Parasitosis intestinal: un tema para tener en cuenta en gastroenterología
..................
Martín Alonso Gómez Zuleta ¹
, Gilberto Jaramillo ²
Resumen
Las parasitosis intestinales se encuentran entre las enfermedades más comunes del mundo y, aunque afecta a los adultos, compromete especialmente a los niños. Generalmente son transmitidas por el consumo de agua o alimentos contaminados con materia fecal, penetración larvaria intradérmica desde el suelo, trasmisión persona a persona o de animales al hombre y constituyen un grave problema de salud pública. Se relaciona con factores sociales como la pobreza, condición geográfica, infraestructura de los servicios sanitarios, educación y estilo de vida, por lo que representa un desafío para la medicina contemporánea y la salud pública. En este artículo se presentan las principales enfermedades parasitarias, así como aspectos relacionados con su diagnóstico y tratamiento
Key words: : Parasitosis; transmisión; contaminación; materia fecal; diagnóstico; tratamiento.
Intestinal parasitosis: a topic to consider in gastroenterology
Abstract
Intestinal parasites are among the most common diseases in the world and although they affect adults, they especially affect children, they are generally transmitted by the consumption of water or food contaminated with fecal matter, intradermal larval penetration from the soil, person-to-person transmission person or from animals to man and constitute a serious public health problem. It is related to social factors such as poverty, geographical condition, infrastructure of health services, education and lifestyle, which is why it represents a challenge for contemporary medicine and public health. This article presents the main parasitic diseases, as well as aspects related to their diagnosis and treatment.
Key words: Parasitosis; transmission; contamination; fecal matter; diagnosis; treatment.
..............
² Internista, gastroenterólogo, Universidad Nacional de Colombia, Hospital San Rafael, Facatativa (Colombia).
Introducción
Los parásitos intestinales son muy frecuentes en los países en vías de desarrollo como el nuestro, produciendo múltiples infecciones en el adulto, pero especialmente en los niños, en quienes puede ser endémica. Como entidades patológicas, estas infecciones se encuentran entre las más comunes; la mayor parte son transmitidas por el consumo de agua o alimentos contaminados con materia fecal, penetración larvaria intradérmica desde el suelo, trasmisión persona a persona o de animales al hombre (1), constituyendo un grave problema de salud pública, tanto por su ocurrencia como por su transmisión y endemicidad. Actualmente los avances en investigación biológica, médica y epidemiológica han permitido el reconocimiento de un amplio espectro de agentes y enfermedades relacionadas, entre ellas giardiasis, oxiuriasis, ascaridiasis. No obstante, hay que añadir a estos hallazgos un incremento en el número de casos y de nuevos tipos de parasitación por patógenos menos frecuentes.Al respecto, además de las condiciones puramente infecciosas de su ámbito etiológico, la literatura actual considera como determinantes aquellos factores sociales que incluyen, entre otros aspectos la pobreza, condición geográfica, infraestructura de los servicios sanitarios, educación y el estilo de vida (2). El desarrollo y empleo de nuevas rutas y procesos de flujo migratorios también ha favorecido el incremento en las cifras de niños procedentes de áreas endémicas. Este escenario representa un desafío para la medicina contemporánea y la salud pública, lo que hace prioritario especialmente en entornos de recursos limitados, avanzar en el conocimiento epidemiológico, microbiológico y clínico adecuado para enfrentar la situación y disponer de las opciones de diagnóstico y terapéutica relevantes para el correcto manejo de estos pacientes.
Este artículo describe los principales diagnósticos y agentes patógenos propios del fenómeno de la parasitosis intestinal y aspectos relevantes de su actualidad epidemiológica y clínica.
Definición y clasificación
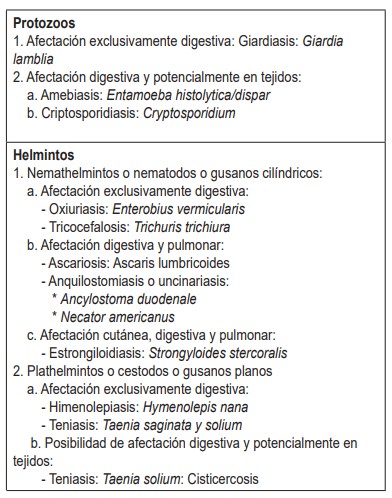
Formalmente, las parasitosis intestinales son infecciones que pueden producirse por la ingestión de quistes de protozoos, huevos o larvas de gusanos o por la penetración de larvas por vía transcutánea desde el suelo (1). Estos agentes realizan una ruta de recorrido específica a través del huésped afectando diferencialmente los órganos por donde pasa. De lo anterior se deduce que a partir del tipo de afectación y el conjunto de sistemas implicados es posible clasificar el origen patológico y tipo de enfermedad derivada según el tipo de parásito y la afectación que provoquen en los distintos órganos y sistemas (tabla 1).Tabla 1. Clasificación de las principales parasitosis intestinales. Fuente: (1).
Giardiasis
Etiopatogenia
Se trata de una de las parasitosis intestinales más comunes a nivel mundial, con distribución alrededor de todo el globo. Tras la ingesta de quistes del protozoo, éstos dan lugar a trofozoítos en el intestino delgado (ID), que permanecen fijados a la mucosa hasta que se produce su bipartición, en la que se forman quistes que caen a la luz intestinal y son eliminados con las heces (3). La capacidad infectiva de los quistes es mayor, así como su viabilidad biológica, por lo que estos, luego de permanecer periodos largos de tiempo en suelos y aguas contaminadas, pueden ser ingeridos de nuevo. Es una patología principalmente frecuente en niños de zonas endémicas y en adultos provenientes o visitantes de dichas zonas (4).Clínica
Cuenta con un amplio conjunto de signos y síntomas entre los que están diferentes manifestaciones de la enfermedad, incluyendo pacientes completamente asintomáticos, siendo este fenómeno más frecuente en niños de áreas endémicas (5). En aquellas personas con manifestaciones perceptibles de enfermedad, es común durante la infección aguda la diarrea acuosa que puede cambiar a esteatorrea con distensión abdominal, dolor y pérdida de peso. En la fase crónica, la sintomatología subaguda se asocia con signos de malabsorción, deshidratación, desnutrición, anemia y, en algunos casos manifestaciones cutáneas (6).Diagnóstico, tratamiento y prevención
El mayor esfuerzo en el área diagnóstica se centra en la identificación de quistes en las heces o de trofozoítos en el cuadro agudo durante el periodo de deposiciones acuosas. Clínicamente es recomendable obtener las muestras en días espaciados o alternos, en tanto que la eliminación es de ritmo irregular por lo que dicho procedimiento puede mejorar la capacidad diagnóstica. Para pacientes con sintomatología persistente, pero resultados negativos en los análisis de materia fecal, el estudio mediante la técnica ELISA es recomendado (7).Puesto que el porcentaje de infecciones resistentes a metronidazol es creciente a nivel global, los esfuerzos para su prevención se concentran en el desarrollo de estrategias que incluyen, entre otras, la advertencia explícita a viajeros a lugares endémicos y el mejoramiento de los sistemas de saneamiento de aguas y de control de producción y comercialización de alimentos.
El tratamiento de elección es con los imidazoles como el metronidazol o el secnidazol (2 g dosis única).
Amebiasis (Entamoeba histolytica/dispar)
Etiopatogenia
Luego de ingerir quistes contenidos en alimentos y
aguas infestadas o debido a deficiencias en la higiene
en manos o en su lavado, los trofozoítos eclosionan en
la luz intestinal y colónica, y pueden permanecer en
ese lugar o invadir la pared intestinal formando nuevos
quistes tras bipartición, mismos que son eliminados al
exterior a través de las heces y logran volver a contaminar agua,
tierra y alimentos (1). Mientras que los parásitos logran invadir la
mucosa y submucosa intestinal,
afectan el tubo intestinal produciendo ulceraciones
que son culpables de la mayor parte de la sintomatología propia de la
enfermedad, así como la posibilidad
de diseminación a distancia y la afectación de otros
órganos, como el absceso hepático (8).
Clínica
Se observan desde pacientes asintomáticos hasta cuadros fulminantes de rápida letalidad. En general su distribución es:- Asintomática: representa el 90 % del total.
- Intestinal invasora aguda o colitis amebiana disentérica: gran
número de deposiciones con contenido mucoso y hemático, tenesmo franco,
con
volumen de la deposición muy abundante en un
principio y casi inexistente posteriormente, dolor
abdominal importante, tipo cólico. En casos de
pacientes desnutridos o inmunodeprimidos pueden presentarse casos de
colitis amebiana fulminante, perforación y formación de amebomas con
cuadros de obstrucción intestinal asociados.
- Amebiasis intestinal invasora crónica.
- Colitis amebiana no disentérica: dolor abdominal
tipo cólico con cambio del ritmo intestinal, intercalando periodos de
estreñimiento con deposiciones diarreicas, tenesmo leve, sensación de
plenitud
posprandial, náuseas, distensión abdominal, meteorismo y borborigmos
(1).
Diagnóstico, tratamiento y prevención
El diagnóstico se hace usualmente mediante la observación de quistes en materia fecal o de trofozoítos en cuadro agudo con deposiciones acuosas. Para diferenciar entre subgéneros del parásito es necesario el uso de técnicas de PCR debido a su sensibilidad y especificidad en el diagnóstico de la infección y por la detección y capacidad para diferenciar las 4 especies: dispar, moshkovskii y acienteí son morfológicamente idénticas a la Entamoeba histolytica que es la única patógena. La aplicación de estas técnicas es factible principalmente en países industrializados, donde la amebiasis afecta especialmente algunos grupos de alto riesgo. En los países con escasos recursos, estas técnicas han sido poco utilizadas por su complejidad, costo y desconocimiento (9). Acerca del tratamiento, el paciente asintomático tiene un papel fundamental en la perpetuación de la endemia; la amebiasis intestinal tiene, además, tendencia familiar y predominio en grupos hacinados, marginados, pobres y de acceso limitado a recursos de saneamiento, por lo que resulta fundamental extremar las medidas de higiene personal y comunitarias, incluyendo planes masivos de educación y cuidado (10).El tratamiento de elección es el metronidazol 500 mg cada 12 horas si es intestinal y cada 8 horas si se trata de un absceso hepático. También se puede usar secnidazol (2 g).
Criptosporidiasis (Cryptosporidium)
Etiopatogenia
Distribuidos de forma generalizada alrededor del mundo, son coccidios protozoarios capaces de infectar animales y personas. La infección se produce por ingesta de oocitos procedentes de alimentos y aguas contaminadas y son comunes en áreas como piscinas, parques acuáticos, lagos y zonas de diversión con agua; también por vía fecal-oral por lo que es considerada una infección común en resguardos infantiles, colegios y zonas de cuidado infantil (11). Luego del consumo de oocitos provenientes de fuentes contaminadas, ocurre la liberación de esporozoítos capaces de unirse a los bordes en cepillo de las células epiteliales intestinales, lugar donde es factible su reproducción asexual o sexual; luego son desechados a través de la materia fecal provocando la perpetuidad del proceso infeccioso en otros huéspedes (12).Clínica
Al igual que otras infecciones propias del tubo intestinal, conlleva desde la presentación de pacientes asintomáticos hasta cuadros intestinales de deposiciones diarreicas acuosas con dolor abdominal, fiebre, náuseas, vómitos y signos de deshidratación. En algunos casos, dependiendo el estado basal del individuo, pérdida de peso. Puede ser más prolongado y grave en pacientes con inmunodepresión. Algunos pacientes experimentan formas extraintestinales de la enfermedad, en particular pacientes con infección por VIH, específicamente afectación de sistema respiratorio, hepatitis, artritis reactivas y afectación ocular (13).Diagnóstico tratamiento y prevención
Su diagnóstico se realiza a través de visualización de oocitos en materia fecal. En zonas donde está disponible, se usan técnicas de EIA en muestra fecal con alta sensibilidad y especificidad.Medidas de soporte: hidratación y reposición de líquidos y electrolitos y, en casos graves, fluidoterapia intravenosa y/o terapias nutricionales. En pacientes inmunodeprimidos se asocia tratamiento antibiótico. En pacientes con SIDA, la terapia antirretroviral consigue mejoría en el estado inmune y acorta la sintomatología (1). Al igual que, en otras condiciones del tubo intestinal, el ejercicio preventivo se basa en la promoción de medidas de higiene para evitar la transmisión fecal-oral. Es fundamental limitar el uso de piscinas en pacientes con diarrea.
Oxiuriasis (Enterobius vermicularis)
Etiopatogenia
La infección ocurre cuando la hembra del parásito se ubica en la zona perianal, especialmente durante la noche. En dicha localización anatómica el agente deposita sus huevos, altamente infecciosos y estos, dada su morfología y particular capacidad de fijación, quedan adheridos a la ropa y piel del huésped. El prurito resultante, debido a los huevos en la piel, hacen que el rascado sea el método de transmisión fecal-oral, en tanto que dichos huevecillos se ubican bajo las uñas (14).Clínica
Al igual que otras parasitosis, la oxiuriasis es más frecuente en niños que en adultos. Aunque en buena parte de los pacientes es asintomática, en quienes se presentan manifestaciones clínicas y subclínicas es debido principalmente a la acción mecánica como prurito o sensación de cuerpo extraño, invasión genital (vulvovaginitis), despertares nocturnos, sobreinfección secundaria a excoriaciones y lesiones cutáneas por el rascado, dolor abdominal que en ocasiones puede ser recurrente, localizarse en FID y suele confundirse con apendicitis aguda. La evidencia es limitada respecto a síntomas como bruxismo, enuresis nocturna o prurito nasal (15).Diagnóstico, tratamiento y prevención
Test de Graham: por medio de cinta adhesiva transparente por la mañana antes de defecación o del duchazo. Funciona a través de la visualización de los huevos depositados por la hembra en zona perianal.Visualización directa del gusano adulto en la exploración anal o vaginal. Particularmente útil en pacientes con pruritos agudos.
En cualquier caso, debe tomarse en cuenta que los huevos son extremadamente resistentes si persiste adecuado nivel de humedad, razón por la que pueden permanecer por largo tiempo en la ropa, siempre que esta no se higienice adecuadamente y se permita su secado completo. En los entornos de pacientes infectados es fundamental extremar las medidas de aseo de retretes, manos y uñas, así como lavar con agua caliente y cloro (lejía) la ropa de cama, pijamas y toallas. Siempre es conveniente el tratamiento de todos los miembros de la familia o personas en contacto con el afectado, ante la posibilidad de perpetuación de la infección (16). Los medicamentos a utilizar son el albendazol o la nitazoxanida.
Tricocefalosis (Trichuris trichiura)
Etiopatogenia
Es una geohelmintiasis transmitida a través de la ingesta de huevos embrionados que provienen de alimentos, objetos, tierra o agua contaminada. Debido a las fases de desarrollo infantil en las que la exploración bucal es frecuente, esta parasitosis es común en niños durante sus primeros años y en algunos casos hasta la adolescencia. Es mucho más común en países en vías de desarrollo. Las larvas del agente usualmente maduran en el ciego y el colon ascendente, donde permanecen aferrados a la mucosa, producen lesión mecánica y traumática con inflamación localizada, y desde allí reproducen con nuevos huevos fértiles que son eliminados por materia fecal, repitiendo el ciclo (17).
Clínica
Correlacionada con el grado de infestación parasitaria. Puede variar desde asintomática, pasando por dolor cólico y deposiciones ocasionales con diarrea, hasta cuadros de disentería con deposiciones de mucosidades y sangre (en particular en pacientes inmunodeprimidos); ocasionalmente, prolapso rectal (18).Diagnóstico, tratamiento y prevención
Usualmente es suficiente con la identificación de huevos en las heces. En algunos casos, en particular aquellos de gravedad, es conveniente el diagnóstico diferencial frente a amebiasis, disentería bacilar y colitis ulcerosa. En todos los casos es necesario extremar medidas de higiene personal. Por tratarse de una enfermedad propia de las personas en condición de hacinamiento y marginalidad, las medidas preventivas son la adecuada eliminación de excretas, utilización de agua potable o purificación de esta mediante métodos convencionales y mejorar las actividades y técnicas para el lavado de alimentos. Lugares como los parques infantiles que incluyen juegos arena, las zonas comunes de infantes (colegios, piscinas, áreas de juego) suelen ser focos de transmisión de niños infectados a niños sanos (19).El tratamiento de elección -al igual que en todos los helmintos- es el albendazol a razón de 200 mg cada 12 horas por 3 días o la nitazoxanida.
Ascaridiasis (Ascaris lumbricoides)
Etiopatogenia
Es la helmintiasis más frecuente y con mayor distribución a nivel mundial. Luego de la ingesta de material contaminado, las larvas salen del huevo en ID, logran cruzar la pared intestinal, se incorporan al sistema portal y llegan nivel pulmonar donde penetran en los alvéolos y escalan consiguiendo ascender a las vías respiratorias altas. Allí, como respuesta a la tos y a la eventual deglución, retornan a ID, teniendo la oportunidad de convertirse en adultos. El ciclo se reinicia a nivel interno y los parásitos producen nuevos huevos, mismos que se eliminan por medio de la materia fecal y quedan disponibles para infectar otros huéspedes (20).Clínica
Dada la posibilidad de afectación multiorgánica, la clínica de la ascariosis es también diversa. A nivel digestivo suele presentarse dolor abdominal debido a la disfunción mecánica y con menor frecuencia meteorismo, vómitos y diarrea. En el ámbito del sistema respiratorio, es frecuente la presentación de cuadros de sintomatología inespecífica hasta síndrome de Löeffler (cuadro respiratorio agudo con fiebre y tos de varios días, expectoración abundante y signos de condensación pulmonar transitoria, consecuencia del paso pulmonar de las larvas y una respuesta de hipersensibilidad asociada) (20). También se han reportado pacientes con anorexia, desnutrición e incluso obstrucción intestinal y absceso hepático (1).Diagnóstico, tratamiento y prevención
Usualmente se realiza a través de la localización de huevos en las heces o bien de larvas en el esputo o material gástrico si es evidente la ocurrencia de fase pulmonar. Las medidas de cuidado y tratamiento coinciden con las usadas para tricocefalosis (20).Anquilostomiasis o uncinariasis (Ancylostoma duodenale y Necator americanus)
Etiopatogenia
Patología causada por infección por nemátodos. Es común y frecuente en las zonas húmedas subtropicales y tropicales, particularmente en América central, Sudamérica y África. En los países en desarrollo, la enfermedad lleva a la muerte de muchos niños al incrementar su riesgo de infecciones, que sus cuerpos normalmente controlarían. Afecta el intestino delgado y los pulmones. Su mecanismo de acción se basa en la eliminación de los huevos del agente por medio de materia fecal; una vez allí, estos eclosionan en un terreno que por sus condiciones de humedad y calor dan lugar a un tipo de larva que precisa una nueva modificación para obtener capacidad infectante mediante penetración por la piel (en A. duodenale también puede provocar infección por ingestión vía oral). Cruzada la barrera cutánea, las larvas se movilizan al sistema venoso o linfático para llegar al sistema cardiaco derecho y de circulación pulmonar, anidando en los alvéolos, madurando en dicha ubicación anatómica y escalando a través de las vías respiratorias altas para ser deglutidas y alcanzar duodeno y yeyuno, donde se fijan y comienzan a producir nuevos huevos fecundados. Al fijarse en ID, los gusanos adultos causan una lesión mecánica que provoca pérdida sanguínea progresiva, grave y crónica (21).Clínica
Sus principales manifestaciones clínicas implican la piel, en la que es común el “síndrome de Larva Migrans Cutánea”: dermatitis pruriginosa, transitoria y reincidente en pies y zonas interdigitales, pues allí se ubican y desplazan las larvas hasta alcanzar el sistema circulatorio. A nivel respiratorio, los pacientes experimentan desde síntomas inespecíficos hasta el síndrome de Löeffler (ver ascaridiasis). Acerca del sistema digestivo, los afectados padecen dolor epigástrico, náuseas, pirosis, diarrea y, además, síndrome anémico (22).Diagnóstico, tratamiento y prevención
El diagnóstico se realiza a través de la identificación de huevos del parásito en materia fecal. A nivel clínico es conveniente conjuntar los factores que, aunados, pueden indicar mayor posibilidad de infección, es decir: origen de un área endémica, síntomas cutáneos y pulmonares, anemia y actividades de contacto con tierra (1). Además del cuidado de la enfermedad en sí misma, los pacientes deben ser tratados para el síndrome anémico en la medida en que dicha condición puede llegar a ser muy severa. Las medidas preventivas son comunes con las usadas para tricocefalosis, aunque en las últimas décadas se ha optado por el desarrollo de iniciativas educativas y preventivas en zonas de alta endemicidad (23).Estrongiloidiasis (Strongyloides
stercoralis)
Etiopatogenia
Esta geohelmintiasis presenta un ciclo vital con distintas posibilidades (1):Ciclo directo: Cuando la larva, que se encuentra en el suelo, se modifica para penetrar cruzando la piel hacia el sistema circulatorio, donde alcanza el sistema cardiaco derecho y circulación pulmonar, asciende por las vías respiratorias hasta ser tragada de nuevo y se dirige a la mucosa del ID. En dicha ubicación anatómica se transforma en hembra infecciosa, pone nuevos huevos que eclosionan y se dirigen a la luz intestinal, desde donde son eliminados al exterior mediante la materia fecal.
Ciclo indirecto: Cuando una o varias generaciones de larvas en vida libre, es decir, sin afectación humana o sin contacto humano efectivo que provoque infección. El ciclo se mantiene hasta que se produce la modificación genética que da lugar a la larva infecciosa para el hombre.
Ciclo de autoinfección: Los cambios de modificación larvaria se originan en la luz intestinal en lugar del exterior; posteriormente ocurre la penetración en el sistema circulatorio repitiendo el recorrido del ciclo directo. Es lo que se denomina síndrome de hiperinfección por S. stercoralis, y es la situación que da lugar a parasitosis persistente sin reinfecciones externas, así como el daño a otros órganos como hígado, pulmón, SNC y sistema ganglionar.
Clínica
A nivel de afectación, su duración y gravedad dependen del estado basal inmunitario del paciente (ver QR). A nivel cutáneo se observa el “síndrome de Larva Currens”: dermatitis pruriginosa por el paso transcutáneo de la larva y el recorrido realizado hasta llegar a la circulación sistémica. En el ámbito respiratorio es frecuente sintomatología como tos y expectoración, aunque se observan con frecuencias cercanas al 10 % de neumonitis y síndrome de Löeffler. Las vías digestivas se afectan de acuerdo con el grado de infestación por la parasitosis, pero es común el dolor epigástrico, los vómitos, la anorexia y los períodos de diarrea que se alternan con estreñimiento. Ante la posibilidad de hiperinfestación (en particular en pacientes VIH+), los síntomas anteriores se expresan con mayor gravedad, al punto de comprometer la vida del sujeto (24).Diagnóstico, tratamiento y prevención
Puede presentarse eosinofilia severa. La identificación del parásito a través de las heces es simple, pero dada la irregularidad de las deposiciones en pacientes infectados, el proceso puede ser impreciso. El sistema de diagnóstico convencional es dependiente del operador y usualmente se logra mediante personal de microbiología experto. La serología mediante EIA confiere una sensibilidad mayor al 90 %, pero es reactiva de forma cruzada con filarias y otros nematodos. Siempre persiste la posibilidad de autoinfección y la curación debe ser verificada. Las medidas preventivas poblacionales son comunes a tricocefalosis (25).Himenolepiasis (Hymenolepis nana)
Etiopatogenia
Dentro de los agentes etiológicos de estas infecciones se encuentran los helmintos, que se clasifican de acuerdo con su forma en planos o cilíndricos. Los planos a su vez se dividen en los que tienen aspecto foliáceo (trematodos) y los que tienen forma de cinta (cestodos). Dentro de los cestodos, las tenias son un grupo frecuente, que a su vez se dividen en gigantes y enanas. En el grupo de las tenias enanas destaca el género Hymenolepis con sus dos especies que pueden afectar al hombre: H. nana y H. diminuta, causando himenolepiosis. La primera es más frecuente y es el cestodo más pequeño que parasita al hombre en diversas áreas de América (26).
El ciclo de vida y transmisión es generalmente monoxénico, con transmisión de hombre a hombre mediante la ingestión de huevos embrionados. Puede haber autoinfección interna o externa. Se ha descrito un ciclo indirecto con la intervención de artrópodos como huéspedes intermediarios, pero este es infrecuente y se considera el ciclo evolutivo más primitivo (27).
Clínica
De índole leve y relacionada con el aparato digestivo, en particular dolor abdominal, meteorismo, diarrea, y bajo peso si la infección se hace crónica (27).Diagnóstico, tratamiento y prevención
Puede cursar la infección sin eosinofilia, pero esta es frecuente. El diagnóstico más eficiente es la observación de huevos en materia fecal, siendo su número indicador directo del grado de infestación. En general, es una tenia más resistente por la presencia de cisticercoides en la mucosa intestinal, por lo que el ciclo de tratamiento debe ser repetido entre 7 y 10 días (1).Teniasis (Taenia saginata y solium)
Etiopatogenia
La teniasis por Taenia solium prevalece en países de África, Asia y América Latina, especialmente en áreas urbanas y rurales que carecen de infraestructura sanitaria adecuada, de medios económicos, de higiene eficiente, y donde los cerdos tienen acceso libre a la materia fecal humana. Su ciclo de vida requiere de un huésped intermediario -el cerdo- para la forma quística o cisticerco y un huésped definitivo -el humano- en su forma adulta. Los porcinos son la fuente para la teniasis humana, enfermedad producida por la ingesta de carne cruda o mal cocida contaminada por cisticercos. El ciclo de vida es mantenido cuando los cerdos tienen acceso a las heces que contienen huevos de Taenia solium, dando origen a la cisticercosis porcina. Los humanos también pueden actuar como huéspedes intermediarios por la ingestión de huevos, ocasionando en ellos la cisticercosis (28).Clínica
Variada y leve. Particularmente de tipo irritación mecánica e inespecífica que incluye meteorismos, náuseas y dolor abdominal. Ocurre la salida frecuente de proglótides a nivel anal con molestia y prurito; así mismo, la observación del deslizamiento de estas por los MMII dejando un líquido lechoso muy pruriginoso y muy rico en huevos (29).Diagnóstico, tratamiento y prevención
Es fundamental la visualización de proglótides en heces. De igual modo, la determinación de coproantígenos por EIA (aunque presenta reactividad cruzada con otros cestodos), útil para la comprobación de la efectividad del tratamiento.La principal forma de prevenir la enfermedad es el tratamiento de las carnes de cerdo desde el proceso de sacrificio y cultivo, hasta la adecuada cocción o congelación prolongada. La adecuada eliminación de las excretas resulta también fundamental. Se usa como criterio de curación el hallazgo del escólex en materia fecal tras el tratamiento. Dicha verificación implica el examen de las heces con resultado negativo, mínimo tres meses siguientes al tratamiento; además, la negativización de coproantígenos (30).
Cisticercosis (Taenia solium)
Etiopatogenia
Es la afectación tisular de la larva de la T. solium. El hombre ingiere huevos de este subtipo de tenia y al llegar al ID, atraviesan la pared intestinal logrando avanzar hasta el sistema circulatorio, pulmones y el corazón izquierdo; desde allí se distribuyen arterialmente a otros lugares del organismo, especialmente SNC, tejido celular subcutáneo, músculos y ojos, en los que consolidan quistes o cisticercos, que pueden permanecer durante años y que al morir producen infecciones severas acompañadas de reacciones inmunitarias graves (30).Clínica
Principalmente neurocisticercosis con epilepsia de aparición tardía, cefalea y signos de HTIC, síndrome psicótico, meningitis aséptica, síndrome de los pares craneales y síndrome medular. A nivel cutáneo se presentan nódulos subcutáneos y musculares blandos y no dolorosos. Adicionalmente, afectación oftálmica con frecuencia única y unilateral. Si la larva muere, puede producir importante reacción inflamatoria y provocar importante reacción uveal, desprendimiento de retina y ceguera (1).Diagnóstico, tratamiento y prevención
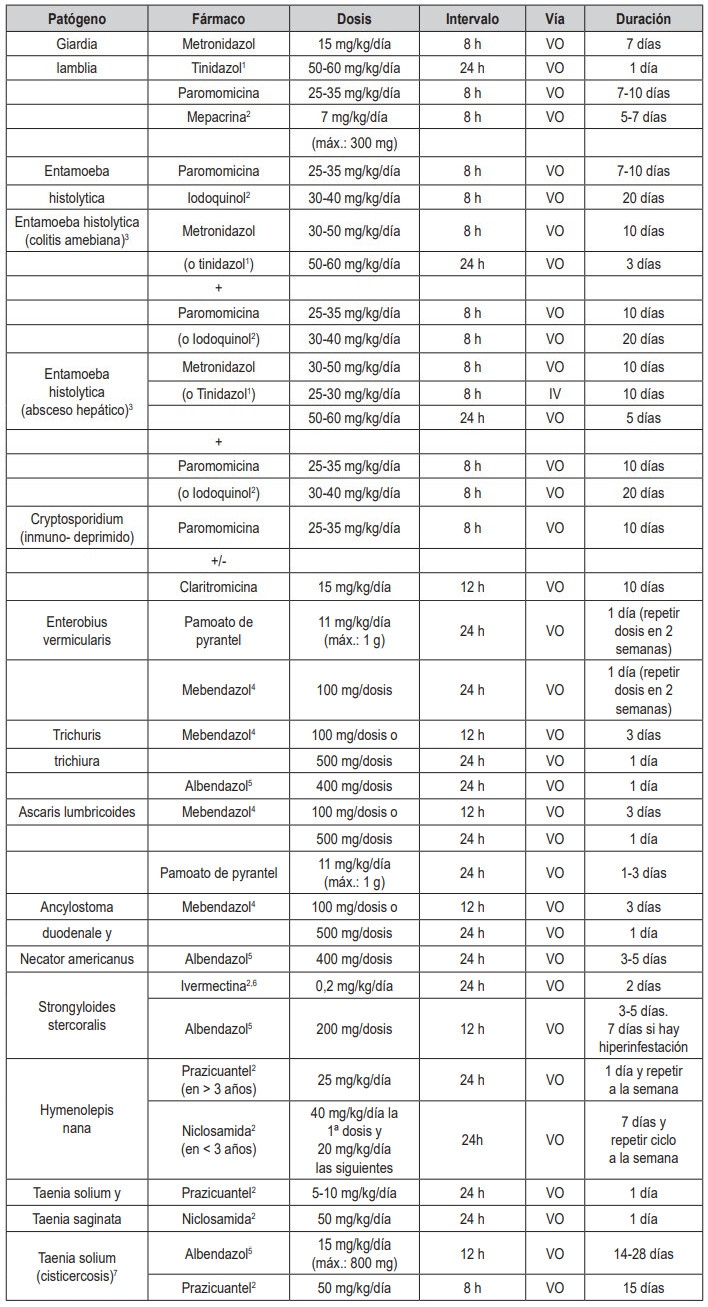
Imagenológica mediante TC cerebral o RNM en paciente originario o visitante de zonas endémicas con sintomatología neurológica. Inmunodiagnóstico con Inmunoblot. Suelen añadirse al tratamiento corticoides, antiepilépticos y cirugía si aparecen signos de HTIC. Los controles son requeridos desde los 3 y hasta los 6 meses (mínimo) después de concluir el tratamiento. La crianza tecnificada e higiénica de los cerdos y la adecuada cocción de los alimentos siguen siendo las principales medidas de prevención contra la enfermedad (31).Tabla 2. Tratamiento de los parásitos intestinales más frecuentes. Fuente: (1)
Referencias
1. Medina
A, Mellado M, García M, Pineiro R, Fontelos P.
Parasitosis intestinales. Protocolos diagnósticos-terapeúticos de la
Asociación Española de Pediatría. Madrid: Asociación española de
pediatría; 2010.
2. Hryhorenko LV, Baibakov VM, Zayats I, Solomenko MV, Romanenko OA. Dynamics of infectious and parasitogenic morbidity at the children population in the rural districts and corelation with water factor. Wiad Lek. 2019;72(5 cz 2):1029-32.
3. Vásquez Tsuji O. Giardiasis. La parasitosis más frecuente a nivel mundial. Rev Centro Investig U La Salle. 2009;8(31):75-90.
4. Giraldo-Gómez J, Lora F, Henao L, Mejia S, Gómez-Marin J. Prevalencia de Giardiasis y Parásitos Intestinales en Preescolares de Hogares atendidos en un programa estatal en Armenia, Colombia . Rev. salud pública. 2005; 7(3):327-38.
5. Huang DB, White AC. An updated review on Cryptosporidium and Giardia. Gastroenterol. Clin. North Am 2006;35(2):291-314.
6. Almannoni S, Martín D, Rodríguez ME, Cordoví R, Domenech I, Rubio MC, Iglesias T, et al. Manifestaciones cutáneas de la giardiasis, sobredimensión de un problema de salud. Rev Cubana Med Trop. 2008;60(3):.
7. Duque S, Nichols RS, Arévalo A, Guerrero R. Serodiagnóstico de giardiosis: identificación de inmunoglobulina G anti-Giardia duodenalis en suero mediante ELISA. Biomédica.2001;. 21(3):228-33. 8.
8. Chacín-Bonilla L. Amebiasis: aspectos clínicos, terapéuticos y de diagnóstico de la infección. Rev. Méd. Chile. 2013;141(5):609-615. 9. Fotedar R, Stark D, Beebe N, Marriott D, Laboratory diagnostic techniques for Entamoeba species. Clin Microbiol Rev. 2007;20(3):511-32.
10. Gómez JC, Cortés JA, Cuervo SI, López MC. Amebiasis intestinal. Infectio. 2007;11(1):36-45.
11. Izvieta DA, Rodríguez Z, Pascual M, Lozada GA, Mustelier HL. Current considerations on the postoperative infections. MEDISAN. 2013;17(4):686-707.
12. Del Coco VF, Códroba M, Basualdo J. Criptosporidiosis: una zoonosis emergente. Rev Argent Microbiol. 2009; 41:185-96.
13. Guerrero-Tinoco G, Villafane-Bermudez D, Velez-Echeverri C. Inmunosupresores y principales complicaciones en el trasplante renal pediátrico. Iatreia. 2017;30(1):56- 66.
14. Báez N, Pereira J, Aliende S, Trapero C. Prueba de Graham y enterobiasis; resultados de 11 años . Rev Pediatr Aten Primaria. 2013;15. e1-3.
15. Del Risco U, Valls M, Sanchén A, Batista F. Enterobiosis en círculos infantiles. Empleo de dos técnicas. Rev Arch Méd Camagüey. 2004; 4(2):.
16. Tapia O, Muñoz C. Oxiuriasis apendicular: estudio de prevalencia y descripción clínico-morfológica. Rev Chilena Cir. 2011; 63(6):599-603.
17. Sapunar J, Gil LC, Gil G. Tricocefalosis masiva en un adulto diagnosticada por colonoscopía.Bol Chil Parasitol. 1999;54(3-4):.
18. Lopez C, Salcedo F. Case report of perineal rectosigmoidectomy (Altemeier’s procedure) for incarcerated rectal prolapse. Rev Col Gastroenterol. 2018; 33(4):454-8.
19. Carmona J, Correa A. Efectos del Albendazol y la Vitamina A periódicos sobre helmintos intestinales y anemia en niños del Urabá Antioqueño (Colombia). Biosalud. 2015;14(1):9-25.
20. Lamberton PH, JOurdan P. Human Ascariasis: Diagnostics Update. Curr Trop Med Rep. 2015; 2(4):189-200.
21. Calvopina M. Anemia crónica grave por Ancylostoma duodenale en Ecuador. Diagnóstico por duodenoscopia. Rev Chilena Infectol. 2017;34(5):499-501.
22. González MV, Flores SA, Cruz-Erazo C, Sánchez DE.Prevalencia de geohelmintos y factores socioambientales en zonas urbanas y rurales, cantón Paquisha, Ecuador. CEDAMAZ. 2014;4(1):4-13.
23. Brentlinger PE., Capps L, Denson M. Anemia e infección por Necator americanus en mujeres en Chiapas, México. Salud Pública Méx. 2003; 45(2):117-9.
24. González MA, Martínez AE, Núñez FA. Estrongiloidiasis crónica y uso prolongado de corticoides. Rev Cubana Med Trop. 2016;68(3):255-61.
25. Cubillana De la Cruz JM. Severe eosinophilia after a travel to the tropic. Strongyloidiasis: a case report .. Sanid. Mil. 2013;69(2):95-7.
26. Devera A, Blanco Y, Del Valle R, Amaya I, Requena C. Infección por Hymenolepis nana en una comunidad indígena del estado Bolívar, Venezuela.. Rev Cubana Med Trop.2016;68(1):70-81.
27. Devera R, Rodríguez D. Himenolepiosis en habitantes de un barrio de Ciudad Bolívar, Venezuela. Saber. 2010;22(1):53-62.
28. Meza-Lucas A, Aguilar F. Teniasis humana por Taenia solium. Rev Mex Patol Clin. 2002; 49(2):92-9.
29. Lightowlers MW, Garcia HH, Gauci CG, Donadeu M, Abela-Ridder B. Monitoring the outcomes of interventions against Taenia solium: options and suggestions. Parasite Immunol. 2016;38(3):158-69.
30. Garcia HH, Rodriguez S, Friedland JS. Immunology of Taenia solium taeniasis and human cysticercosis. Parasite Immunol. 2014;37(8):388-96.
31. Flisser A, Rodríguez-Canul R, Willingham III AL. Control of the taeniosis/cysticercosis complex: Future developments. Vet Parasitol. 2006;139(4):283-92.
Recibido: 06 de Junio de 2022
Aceptado: 06 de Septiembre de 2022
Correspondencia:
Martín Alonso Gómez
martinalonsogomezz@gmail.com
Aceptado: 06 de Septiembre de 2022
Correspondencia:
Martín Alonso Gómez
martinalonsogomezz@gmail.com