Hígado graso: una epidemia silente
..................
Jhon Edison Prieto Ortiz ¹
Resumen
El hígado graso o NAFLD afecta aproximadamente al 25% de la población mundial y es una de las primeras causas de consulta en los servicios de hepatología y de especialistas clínicos, por lo cual el objetivo de esta revisión es dar un enfoque actual, que llegue al mayor número de médicos en nuestro país. La entidad se define como la presencia de esteatosis hepática en una prueba de imagen o una biopsia hepática, más la ausencia de causas secundarias. La génesis del hígado graso es el resultado de la interacción de múltiples factores, entre los que predominan los genéticos, el acúmulo de grasas hepáticas, la resistencia a la insulina y la microbiota intestinal, que llevan a un daño hepatocelular a través de la formación de radicales libres de oxígeno y la posterior activación de la fibrogénesis hepática. El tratamiento se basa fundamentalmente en la pérdida de peso con dieta y ejercicio, continuando con medidas farmacológicas, no farmacológicas y procedimientos quirúrgicos.
Key words: Hígado graso; fisiopatología; tratamiento; enfoque.
Fatty liver: a silent epidemic
Abstract
The fatty liver or NAFLD impacts 25% of the world population approximately and is one of the main causes of hepatology and clinical specialists’ consultation services, so the objective of this review is to give a current approach, that reaches the largest number of doctors in our country. The entity is defined as the presence of liver steatosis in an image test or a liver biopsy, plus the absence of secondary causes. The genesis of fatty liver is the result of the interaction of multiple factors where predominate, genetic ones, the accumulation of liver fats, insulin resistance and intestinal microbiota, which lead to hepatocellular damage through the formation of free oxygen radicals and subsequent activation of liver fibrogenesis. The treatment is based primarily on weight loss with diet and exercise, continuing with pharmacological, non -pharmacological measures and surgical procedures.
Key words: fatty liver; NAFLD; pathophysiology; treatment; approach.
..............
Introducción
El hígado graso o NAFLD (Non-alcoholic fatty liver disease, sigla que traduce enfermedad hepática grasa no alcohólica), fue descrito por primera vez por Zelman en 1952, en pacientes obesos con enfermedad hepática (1). Ludwig en 1980 acuña el término de esteatohepatitis no alcohólica (del inglés NASH, Non Alcoholic Steato-Hepatitis), al observar cambios histológicos similares a los encontrados en hepatitis alcohólica, pero con consumo de alcohol insignificante (2). El hígado graso es una de las primeras causas de consulta en los servicios de hepatología y en consultas de especialistas clínicos, a donde son referidos por hallazgos ocasionales de “un hígado graso” en una imagen (usualmente ecografía) o unas transaminasas elevadas en pacientes asintomáticos. Por ello, el objetivo de esta revisión es dar un enfoque actual, que llegue al mayor número de médicos en nuestro país.Definición y diagnóstico
El hígado graso o NAFLD, se define como la presencia de esteatosis hepática en una prueba de imagen o una biopsia hepática, más la ausencia de causas secundarias: consumo de alcohol mayor a 20 g/día para hombres y 10 g/día para mujeres, ingesta de medicamentos hepatotóxicos en los últimos 6 meses, virus de la hepatitis B y C, hemocromatosis, autoinmunidad y otras causas de hepatopatía crónica. El concepto de hígado graso abarca un espectro que va desde la etapa inicial, la esteatosis simple sin inflamación y fibrosis, pasando por la esteatohepatitis (NASH) con inflamación y fibrosis y culminando en la etapa más avanzada, la cirrosis (3). Recientemente se ha propuesto el término de MAFLD (del inglés, Metabolic-Associated Fatty Liver Disease) para asociar las alteraciones metabólicas asociadas con hígado graso (4), definición que surge por el hecho de que el hígado graso es una enfermedad heterogénea, con múltiples subgrupos, y buscando un mayor entendimiento en su fisiopatología y un mejor acercamiento al tratamiento. Se debe esperar un consenso con respecto a esta nueva definición. El hígado graso se diagnostica ante la presencia de esteatosis hepática en cualquier imagen o en una biopsia hepática en el 5 % o más del tejido examinado (3).Epidemiología
Se calcula una prevalencia mundial global cercana al 25 %, con variaciones según la región del mundo, siendo el medio oriente y Suramérica las regiones con mayor prevalencia, 32 y 31 % respectivamente, norte América 24 %, Europa 23 % y Africa 13 % (5). Otros estudios informan prevalencias de NAFLD en Estados Unidos del 10 al 46 % (6,7) y en Latinoamérica entre 14,3 % y 45 % (8,9). El hígado graso usualmente se diagnostica entre los 40 y 50 años (10), y presenta variaciones según el sexo: en unos estudios predomina en las mujeres (2,11), en otros en los hombres (12-13). Parece haber diferencias étnicas en la prevalencia de NAFLD (12,13), afectando más a la población hispana (12), hecho explicado por mayor prevalencia de obesidad.El hígado graso y principalmente el NASH se asocia con uno o más componentes del síndrome metabólico (SM) (3,14): Obesidad, hipertensión sistémica, dislipidemia y resistencia a la insulina o diabetes manifiesta, con un mayor riesgo de fibrosis grave y de enfermedad cardiovascular en forma independiente (15). Es frecuente en niños y adolescentes obesos, con una prevalencia del hígado graso entre 7,6 % y 34 % (3,16- 17). El hígado graso es la indicación de más rápido crecimiento para el trasplante de hígado por cirrosis descompensada o HCC (18).
Fisiopatología
La génesis del hígado graso es el resultado de la interacción de múltiples factores; predominan los factores genéticos, el acúmulo de grasas hepáticas, la resistencia a la insulina y la microbiota intestinal, que llevan a daño hepatocelular a través de la formación de radicales libres de oxígeno y la posterior activación de la fibrogénesis hepática.Factores genéticos: Se han identificado variantes genéticas relacionadas con el desarrollo y progresión de la fibrosis mediante efectos en la acumulación de grasa hepática, las más importantes son PNPLA3, TM6SF2, MBOAT7 (PRS-HFC), GCKR, HSD17B13 (PRS-5) (3,14,19). La resistencia a la insulina en NASH se ha asociado con polimorfismos en los genes de la apolipoproteína C3, interleucina-6 (IL-6) y adiponutrina (20-22).
Acúmulo excesivo de lípidos en el hígado: Puede ocurrir por depósito excesivo de triglicéridos, ácidos grasos libres (AGL), ceramidas y colesterol libre; también por importación excesiva de AGL del tejido adiposo, disminución de la exportación hepática de AGL o una alteración de la beta-oxidación (23).
Resistencia a la insulina: Se presenta en la mayoría de los pacientes obesos y diabéticos, aunque se puede encontrar también en pacientes delgados no diabéticos (3,24). Desencadena un aumento en la lipólisis periférica y en la síntesis de triglicéridos, mayor captación hepática de AGL y por todo lo anterior acumulación de triglicéridos en los hepatocitos (23-26).
Microbiota intestinal: Se ha asociado con injuria directa e indirecta de la célula hepática mediante varios mecanismos que producen lipotoxicidad, daño oxidativo y fibrosis secundaria, entre ellos: cambios de la microbiota normal con sobrecrecimiento bacteriano en el intestino delgado o en la composición de la microbiota intestinal, aumento de la permeabilidad intestinal, mayor producción de endotoxinas y productos tóxicos como el alcohol y acetaldehído endógenos a nivel colónico por bacterias y levaduras (27-29).
Daño hepatocelular: Se produce por la formación de radicales libres generados por:
- Inducción de lipoxigenasas microsomales del citocromo p-450, a partir de los AGL.
- El cambio a beta-oxidación de los AGL, asociado a defectos preexistentes en la fosforilación oxidativa mitocondrial (3,24).
Estas dos vías llevan conjuntamente a daño hepatocelular y fibrosis mediante activación de múltiples procesos como la activación del factor nuclear kappa-beta, aumento en la producción de citocinas, la activación del factor de necrosis tumoral alfa, el sistema del complemento, la mieloperoxidasa plasmática, y las células asesinas naturales (24,30). La formación de radicales libres de oxígeno y la peroxidación lipídica pueden agotar las enzimas antioxidantes como el glutatión, la vitamina E, el betacaroteno y la vitamina C, tornando al hepatocito más susceptible a la lesión oxidativa (3,31).
Historia natural: Aproximadamente 20 % de los casos de esteatosis simple progresan a NASH y de ellos, otro 20% progresan a cirrosis (3-32). En la actualidad se reconoce que la NASH es la principal causa de cirrosis criptogénica (33). En una revisión sistemática de pacientes con hígado graso, el riesgo de hepatocarcinoma o carcinoma hepatocelular (CHC) en cirróticos osciló entre el 2,4 % en siete años y 12,8 % en tres años. Entre los que no tenían cirrosis, el riesgo de mortalidad por CHC era del 0 al 3 % después de períodos de seguimiento de hasta 20 años (14).
Clinica y laboratorio: Los pacientes son casi siempre asintomáticos como en la mayoría de las enfermedades hepáticas, ocasionalmente refieren astenia, adinamia o dolor en hipocondrio derecho, en etapas avanzadas los signos y síntomas son los de la hipertensión portal o cirrosis (3). Las transaminasas se elevan frecuentemente de forma leve a moderada, sin embargo, resultados normales no excluyen el diagnóstico. Otros hallazgos de laboratorio incluyen la elevación de la fosfatasa alcalina (FA) más de 3 veces su valor normal y la elevación de la ferritina. La albúmina, bilirrubinas y tiempos de coagulación solamente se alteran en la cirrosis avanzada (34-36).
Diagnóstico radiológico
El método más utilizado es la ecografía. La esteatosis se manifiesta como un aumento difuso de ecogenicidad del parénquima hepático (3). Un metaanálisis evidenció una sensibilidad y especificidad de la ecografía del 85 y el 94 % respectivamente, cuando se utilizó la biopsia hepática como estándar de oro (37); sin embargo, la sensibilidad parece estar disminuida en pacientes obesos (38).La tomografía computadorizada (TC) tiene una sensibilidad de 82 % y una especificidad de 100 % para diagnosticar esteatosis hepática cuando el contenido de grasa es ≥ 30 % (39), pero con contenidos menores se reducen respectivamente a 50 % y 83 % (43). La resonancia nuclear magnética (RNM) es más sensible (81 %) y específica (100 %) en el diagnóstico de esteatosis hepática independiente del contenido graso, con buena correlación de los hallazgos histológicos detectando esteatosis con solo 3 % de contenido graso (40).
La resonancia magnética por espectroscopia (RMS) tiene la mayor precisión diagnóstica, alcanzando una exactitud cercana al 100 % (41). Es una prueba cuantitativa que determina la cantidad de grasa hepática y puede ser especialmente útil en pacientes con poca esteatosis (41- 42). Como desventajas se encuentran el elevado costo y la baja disponibilidad de la prueba en muchos sitios.
Biopsia hepática: Es la prueba de oro para el diagnóstico de hígado graso y diferenciar con certeza entre esteatosis simple, esteatohepatitis e incluso cirrosis, con implicaciones pronósticas, de tratamiento y de cambio en el estilo de vida (3,43). La esteatosis se clasifica de acuerdo con el porcentaje de grasa encontrado: leve (5-33 %), moderada (34-66 %) o severa (>66 %) (44). La esteatosis simple se puede distinguir de la NASH según los hallazgos histológicos:
La esteatosis simple puede presentarse aisladamente, con inflamación lobulillar o portal pero sin baloning de los hepatocitos, o con baloning pero sin inflamación.
La esteatohepatitis (NASH) requiere la presencia de esteatosis hepática combinada con baloning de los hepatocitos e inflamación lobulillar hepática (típicamente en la zona acinar 3) (3,43,45), la fibrosis no es una característica de diagnóstico necesaria, pero puede observarse. Cuando la fibrosis progresa a cirrosis, la esteatosis y la inflamación pueden desaparecer dando lugar al diagnóstico de cirrosis “criptogénica” (3,43).
A quienes realizar una biopsia: no existe un consenso claro sobre qué pacientes requieren una biopsia de hígado (46), pero se sugiere en:
- Pacientes mayores de 45 años con obesidad o diabetes asociadas.
- Sospecha de hígado graso no claro después de laboratorio, imágenes o seguimiento prudencial usuales.
- Paciente con mayor riesgo de fibrosis o cirrosis avanzada, obesidad, diabetes, dislipidemia o ferritina sérica >1,5 veces el límite superior de lo normal.
- Sospecha de enfermedad hepática avanzada asociada con hígado graso, estigmas periféricos de cronicidad o cirrosis, esplenomegalia o citopenias.
Determinación no invasiva de la fibrosis hepática
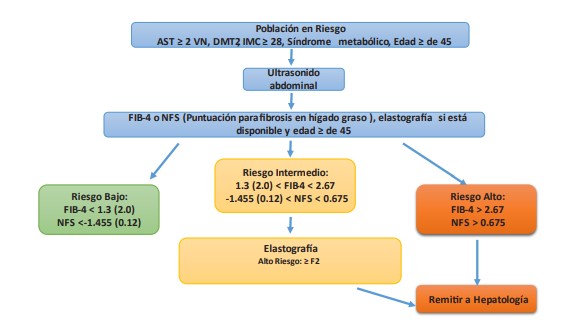
Cualquier lesión hepática crónica puede llevar con el tiempo a fibrosis hepática, a través de un proceso paulatino de colapso de los lobulillos hepáticos, formación de septos fibrosos, regeneración de los hepatocitos y formación de nódulos cirróticos. Las pruebas no invasivas determinan en qué etapa de la fibrogénesis (F0-F4) se encuentra el paciente y son una alternativa a la biopsia hepática. Se considera una fibrosis significativa si la fibrosis es ≥ F2, y avanzada ≥ F3 (3,43).Existen dos categorías de pruebas no invasivas: pruebas serológicas y pruebas basadas en imágenes. La tendencia actual es una combinación de ellas de acuerdo con la disponibilidad local en cada sitio, buscando menos pacientes con una puntuación de fibrosis indeterminada y una mayor especificidad.
Pruebas serológicas: Varios productos comerciales de marcadores séricos han sido validados.
APRI o relación entre AST y plaquetas: Un metaanálisis encontró que para predecir una fibrosis significativa (F2 a F4), un punto de corte APRI de 0,7 tenía una sensibilidad del 77 % y una especificidad del 72 %, y para predecir la cirrosis (F4), un punto de corte APRI de 1,0 tenía una sensibilidad del 76 % y una especificidad del 72 % (47).
El FIB-4 combina el recuento de plaquetas, ALT y AST y la edad es útil para predecir la fibrosis avanzada en pacientes con NAFLD (48).
La puntuación para fibrosis en hígado graso (NFS) tiene en cuenta la edad del paciente, el índice de masa corporal (IMC), los niveles de glucosa en sangre, los niveles de aminotransferasas, el recuento de plaquetas y la albúmina. En un estudio de validación, un valor de corte alto en la NFS > 0,676 se asoció con un valor predictivo positivo para fibrosis avanzada (F3 a F4) del 82 % (sensibilidad 43 %, especificidad 96 %) y un valor de corte bajo < -1,455 se asoció con un valor predictivo negativo del 88 % (77 % de sensibilidad, 71 % de especificidad) (49).
Estas tres pruebas se calculan fácilmente con los datos de las pruebas de laboratorio de rutina y no implican costos, tienen una buena capacidad para diferenciar a los pacientes con fibrosis significativa (F2 a F4) de aquellos sin fibrosis significativa (F0 a F1) (50-51), pero con la desventaja de no poder diferenciar confiablemente entre las diferentes etapas de la fibrosis y con resultados indeterminados hasta en un 65 % (51).
En otras pruebas como FibroTest/FibroSure (disponible en Colombia), Hepascore, FibroSpect, la puntuación ELF (panel del Grupo Europeo de Estudio de Fibrosis Hepática) implica un costo.
Pruebas basadas en imágenes: Determinan la rigidez hepática al aplicar ondas mecánicas y miden la velocidad de propagación a través del tejido mediante imágenes (52,53). Estas pruebas se conocen como elastografía, la mayoría se basan en la ecografía e incluyen la elastografia transitoria (ET) o fibroscan (53,54), la elastografía en tiempo real o de onda bidimensional (2D-SWE) conocida en nuestro medio como Supersonic (53,55-58), la elastografía por impulso de fuerza de radiación acústica (ARFI) (53,59) y elastografía por resonancia magnética (ERM) (53,60); 2D-SWE y ERM combinan la elastografia con imágenes morfológicas hepáticas convencionales en la misma sesión (53,56,61). Las pruebas basadas en ecografía son muy buenas para predecir hígado sano, fibrosis avanzada o cirrosis. En los estadios intermedios deben analizarse con cautela (43,53,61).
Tratamiento
Se sustenta en cuatro etapas progresivas: la primera es fundamental, la pérdida de peso con dieta y ejercicio, continuando con medidas farmacológicas, luego medidas no farmacológicas y terminando con procedimientos quirúrgicos.Pérdida de peso y ejercicio: Es el tratamiento básico y más importante, indicado para todos los pacientes con sobrepeso (índice de masa corporal (IMC) > 25 kg / m2 ) u obesidad (IMC > 30 kg/m2 ), buscando mejoría en las pruebas de función hepática, en la histología, niveles de insulina sérica y en la calidad de vida de los pacientes. Para los pacientes con esteatosis simple se recomienda una pérdida de peso con base en la dieta y el ejercicio, entre 5-7 % del peso corporal, a una tasa ideal de 0,5 a 1,0 kg cada 2 semanas. Para los pacientes con NASH sospechada o comprobada por biopsia, el objetivo de pérdida de peso es mayor, 7 a 10 % del peso corporal. Si una vez logrado el objetivo de pérdida de peso, el nivel sérico de alanino-aminotransferasa (ALT) no se normaliza (ALT < 20 para mujeres y < 30 para hombres), se requiere una pérdida de peso adicional hasta su normalización (3,43,62-63).
Manejo con medicamentos: Está indicado para los pacientes que no logran sus objetivos de pérdida de peso con dieta y ejercicio, y que tienen NASH comprobada por biopsia con fibrosis en estadio ≥2. El enfoque también depende de si el paciente tiene diabetes mellitus o no.
Pacientes con NASH sin diabetes: Vitamina E (dosis de 800 UI/día). Algunos estudios sugieren mejoría en la esteatosis y la inflamación (3,43,64-65). Se cree que el beneficio potencial está relacionado con las propiedades antioxidantes de esta vitamina (3).
Pacientes con NASH y diabetes: Metformina: Es la terapia inicial para la diabetes mellitus tipo 2, sin embargo, no mejora la histología hepática (3,66-67). Las tiazolidinedionas, y específicamente la pioglitazona, mejoran los parámetros bioquímicos e histológicos del hígado en pacientes con NASH (64,69-71).
Agonistas del receptor de GLP-1: Liraglutida y Semaglutida mejoran la histología del NASH al mejorar el metabolismo de la glucosa y los lípidos, reducen el contenido de grasa hepática y mejoran las enzimas hepáticas (72-75).
Procedimientos endoscópicos: Se reservan para los pacientes que no pierden peso con dieta, ejercicio y medicamentos, y además tienen alto riesgo de progresión de la fibrosis. Los procedimientos endoscópicos bariátricos proporcionan porcentajes más altos de pérdida de peso de una manera sostenida. Con regresión de la esteatosis hepática, la esteatohepatitis y la fibrosis en el 30 % de los pacientes (76-77).
Figura 1. Algoritmo de manejo: Modificado de referencia 81
Cirugía bariátrica: Indicada para pacientes con NASH o fibrosis avanzada sin cirrosis descompensada, que no cumplen con sus objetivos de pérdida de peso. Después de un adecuado seguimiento, se ha observado una mejoría histológica posoperatoriamente (78-79). En una revisión sistemática, se informó una mejoría de la esteatosis en 18 estudios, disminución de la inflamación en 11 estudios, mejoría en la puntuación de fibrosis en 6 estudios (80). Sin embargo, cuatro estudios presentaron empeoramiento de la fibrosis, por lo tanto, todos los pacientes deben someterse a un seguimiento posoperatorio adecuado.
Conflictos de interés
El autor declara no tener conflictos de interés con respecto a la publicación de esta revisión.Agradecimientos
El autor expresa agradecimiento a sus pacientes, motivo de actualización permanente.
Referencias
1. Zelman. The liver in obesity. AMA Arch Intern Med. 1952
Aug;90(2):141-56.
2. Ludwig, J.; Viggiano, T.R.; McGill, D.B.; Oh, B.J. Nonalcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin. Proc. 1980;55(7):434-438.
3. Chalasani N, Younossi Z, Lavine JE, Charlton M, Cusi K, Rinella M, et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American Association for the Study of Liver Diseases. Hepatology. 2018;67(1):328-357.
4. Eslam M, Sanyal AJ, George J, Sanyal A, Neuschwander-Tetri B, Tiribelli C, et al. International Consensus Panel. MAFLD: A Consensus-Driven Proposed Nomenclature for Metabolic Associated Fatty Liver Disease. Review Gastroenterology. 2020;158(7):1999-2014.e1. 5. Younossi Z, Anstee QM, Marietti M, Hardy T, Henry L, Eslam M, et al. Global burden of NAFLD and NASH: trends, predictions, risk factors and prevention. Nat Rev Gastroenterol Hepatol. 2017;15(1):11-20.
6. Vernon G, Baranova A, Younossi ZM. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults. Aliment Pharmacol Ther 2011;34(3):274-285.
7. Lazo M, Hernaez R, Eberhardt MS, Bonekamp S, Kamel I, Guallar E, et al. Prevalence of nonalcoholic fatty liver disease in the United States: the Third National Health and Nutrition Examination Survey, 1988-1994. Am J Epidemiol. 2013;178(1):38-45.
8. Lizardi-Cervera J, Laparra IB, Chávez-Tapia NC, Ostos MER, Uribe Esquivel M. Prevalencia de hígado graso no alcohólico y síndrome metabólico en población asintomática. Rev Gastroenterol México 2006;71(4):453-9.
9. Riquelme A, Arrese M, Soza A, Morales A, Baudrand R, Pérez-Ayuso RM, et al. Non-alcoholic fatty liver disease and its association with obesity, insulin resistance and increased serum levels of C-reactive protein in Hispanics. Liver Int. 2009;29(1):82-8.
10. Falck-Ytter Y, Younossi ZM, Marchesini G, McCullough AJ. Clinical features and natural history of nonalcoholic steatosis syndromes. Semin Liver Dis. 2001;21(1):17- 26.
11. Angulo P, Keach JC, Batts KP, Lindor KD. Independent predictors of liver fibrosis in patients with nonalcoholic steatohepatitis. Hepatology. 1999;30:1356.
12. Browning JD, Szczepaniak LS, Dobbins R, et al. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity. Hepatology. 2004;40(6):1387-1395.
13. Weston SR, Leyden W, Murphy R, et al. Racial and ethnic distribution of nonalcoholic fatty liver in persons with newly diagnosed chronic liver disease. Hepatology. 2005;41(2):372-379.
14. Rinella ME. Nonalcoholic fatty liver disease: a systematic review. JAMA 2015;313(22):2263-2273.
15. Stepanova M, Younossi ZM. Independent association between nonalcoholic fatty liver disease and cardiovascular disease in the US population. Clin Gastroenterol Hepatol. 2012; 10(6):646-650.
16. Anderson EL, Howe LD, Jones HE, Higgins JPT, Lawlor DA, Fraser A. The Prevalence of Non-Alcoholic Fatty Liver Disease in Children and Adolescents: A Systematic Review and Meta- Analysis. PLoS ONE 10(10):e0140908.
17. Yu EL, Golshan S, Harlow KE, Angeles JE, Durelle J, Goyal N, et al. Prevalence of Nonalcoholic Fatty Liver Disease in Children with Obesity. J Pediatr. 2019;207:64- 70.
18. Younossi ZM, Marchesini G, Pinto-Cortez H, Petta S. Epidemiology of Nonalcoholic Fatty Liver Disease and Nonalcoholic Steatohepatitis: Implications for Liver Transplantation. Review Transplantation. 2019;103(1):22-27.
19. Dongiovanni P, Romeo S, Valenti L. Genetic Factors in the Pathogenesis of Nonalcoholic Fatty Liver and Steatohepatitis. Biomed Res Int. 2015;2015:460190.
20. Petersen KF, Dufour S, Hariri A, Nelson-Williams C, Foo JN, Zhang XM, et al. Apolipoprotein C3 gene variants in nonalcoholic fatty liver disease. N Engl J Med 2010;362(12):1082-1089.
21. Carulli L, Canedi I, Rondinella S, Lombardini S, Ganazzi D, Fargion S, et al. Genetic polymorphisms in non-alcoholic fatty liver disease: interleukin-6-174G/C polymorphism is associated with non-alcoholic steatohepatitis. Dig Liver Dis. 2009;41(11):823-828.
22. Rotman Y, Koh C, Zmuda JM, Kleiner DE, Liang TJ. The association of genetic variability in patatin-like phospholipase domain-containing protein 3 (PNPLA3) with histological severity of nonalcoholic fatty liver disease. Hepatology. 2010;52(3):894-903.
23. Marra F, Svegliati-Baroni G. Lipotoxicity and the gut-liver axis in NASH pathogenesis. J Hepatol. 2018;68(2):280- 295.
24. Sanyal AJ, Campbell-Sargent C, Mirshahi F, et al. Nonalcoholic steatohepatitis: association of insulin resistance and mitochondrial abnormalities. Gastroenterology. 2001;120(5):1183-1192.
25. Chitturi S, Abeygunasekera S, Farrell GC, HolmesWalker J, Hui JM, Fung C, et al. NASH and insulin resistance: Insulin hypersecretion and specific association with the insulin resistance syndrome. Hepatology. 2002;35(2):373379.
26. Kral JG, Lundholm K, Björntorp P, Sjöström L, Scherstén T. Hepatic lipid metabolism in severe human obesity. Metabolism. 1977;26(9):10251031.
27. Boursier J, Mueller O, Barret M, Machado M, Fizanne L, Araujo-Perez F, et al. The severity of nonalcoholic fatty liver disease is associated with gut dysbiosis and shift in the metabolic function of the gut microbiota. Hepatology. 2016;63(3):764775.
28. Caussy C, Hsu C, Lo MT, Liu A, Bettencuurt R, Ajmera VH, et al. Link between gut-microbiome derived metabolite and shared gene-effects with hepatic steatosis and fibrosis in NAFLD. Hepatology. 2018;68(3):918-932.
29. Loomba R, Seguritan V, Li W, Long T, Klitgord N, Bhatt A, et al. Gut Microbiome-Based Metagenomic Signature for Non-invasive Detection of Advanced Fibrosis in Human Nonalcoholic Fatty Liver Disease. Cell Metab. 2017;25(5):1054-1054.
30. Rensen SS, Slaats Y, Driessen A, Peutz-Kootstra CJ, Nijhuis J, Steffensen R, et al. Activation of the complement system in human nonalcoholic fatty liver disease. Hepatology. 2009;50(6):1809-1817.
31. Baskol G, Baskol M, Kocer D. Oxidative stress and antioxidant defenses in serum of patients with non-alcoholic steatohepatitis. Clin Biochem. 2007;40(11):776-780.
32. Powell EE, Cooksley WG, Hanson R, Searle J, Halliday JW, Powell LW. The natural History of nonalcoholic steatohepatitis: a follow-up study of forty-two patients for up to 21 years. Hepatology. 1990;11(1):74-80
33. Caldwell SH, Crespo DM. The spectrum expanded: cryptogenic cirrhosis and the natural history of non-alcoholic fatty liver disease. J Hepatol. 2004;40(4):578-584.
34. Mofrad P, Contos MJ, Haque M, Sargeant C, Fisher RA, Luketic VA, et al. Clinical and histologic spectrum of nonalcoholic fatty liver disease associated with normal ALT values. Hepatology. 2003;37(6):1286-1292.
35. Charatcharoenwitthaya P, Lindor KD, Angulo P. The spontaneous course of liver enzymes and its correlation in nonalcoholic fatty liver disease. Dig Dis Sci. 2012;57(7):1925-1931.
36. McCullough AJ. The clinical features, diagnosis and natural history of nonalcoholic fatty liver disease. Clin Liver Dis. 2004;8(3):521-533.
37. Hernaez R, Lazo M, Bonekamp S, Kamel I, Brancati FL, Guallar E, et al. Diagnostic accuracy and reliability of ultrasonography for the detection of fatty liver: a metaanalysis. Hepatology. 2011;54(3):1082-1090.
38. De Moura Almeida A, Cotrim HP, Barbosa DB, et al. Fatty liver disease in severe obese patients: diagnostic value of abdominal ultrasound. World J Gastroenterol 2008;14(9):1415.
39. Park SH, Kim PN, Kim KW, Lee SW, Yoon SE, Park SW, et al. Macrovesicular hepatic steatosis in living liver donors: use of CT for quantitative and qualitative assessment. Radiology. 2006;239(1):105-12.
40. Fishbein M, Castro F, Cheruku S, Jain S, Webb B, Gleason T, et al. Hepatic MRI for fat quantitation: its relationship to fat morphology, diagnosis, and ultrasound. J Clin Gastroenterol. 2005;39(7):619-25.
41. Reeder SB, Cruite I, Hamilton G, Sirlin CB. Quantitative assessment of liver fat with magnetic resonance imaging and spectroscopy. J Magn Resonan Imaging. 2011;34(4):729-749.
42. Springer F, Machann J, Claussen CD, et al. Liver fat content determined by magnetic resonance imaging and spectroscopy. World J Gastroenterol. 2010;16(13):1560- 1566.
43. European Association for the Study of the Liver (EASL), European Association for the Study of Diabetes (EASD), European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016;64(6):1388-1402.
44. Neuschwander-Tetri BA, Clark JM, Bass NM, Van Natta ML, Unalp-Arida A, Tonascia J, et al. Clinical, laboratory and histological associations in adults with nonalcoholic fatty liver disease. Hepatology. 2010;52(3):913-924.
45. Brunt EM, Tiniakos DG. Alcoholic and nonalcoholic fatty liver disease. In: Odze RD, Goldblum JR, ed. Surgical pathology of the GI tract, liver, biliary tract and pancreas, 2nd ed., Philadelphia:Elsevier; 2009. p.1007.
46. Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD Single Topic Conference. Hepatology. 2003;37(5):1202-1219.
47. Lin ZH, Xin YN, Dong QJ, Wang Q, Jiang XJ, Zhan SH, et al. Performance of the aspartate aminotransferaseto-platelet ratio index for the staging of hepatitis C-related fibrosis: an updated meta-analysis. Hepatology. 2011;53(3):726-736.
48. Shah AG, Lydecker A, Murray K, Tetri BN, Contos MJ, Sanyal AJ. Comparison of noninvasive markers of fibrosis in patients with nonalcoholic fatty liver disease. Clin Gastroenterol Hepatol. 2009;7(10):1104-1112.
49. Angulo P, Hui JM, Marchesini G, Bugianesi E, George J, Farrell GC, et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology. 2007;45(4):846-854.
50. Chou R, Wasson N. Blood tests to diagnose fibrosis or cirrhosis in patients with chronic hepatitis C virus infection: a systematic review. Ann Intern Med. 2013;158(11):807- 820.
51. Parkes J, Guha IN, Roderick P, Rosenberg W. Performance of serum marker panels for liver fibrosis in chronic hepatitis C. J Hepatol. 2006;44(3):462-474.
52. Ozturk A, Grajo JR, Dhyani M, Anthony BW, Samir AE. Principles of ultrasound elastography. Abdom Radiol (NY). 2018;43(4):773-785.
53. European Association for the Study of the Liver, Asociación Latinoamericana para el Estudio del Hígado. EASLALEH Clinical Practice Guidelines: non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol. 2015;63(1):237-64.
54. Castera L. Transient elastography and other noninvasive tests to assess hepatic fibrosis in patients with viral hepatitis. J Viral Hepat. 2009;16(5):300-314.
55. Prieto Ortiz JE, Sánchez Pardo S, Prieto Ortiz RG, Garzón Orjuela N, Ford JS, Eslava Schmalbach J. Comparison of shear wave elastography (supersonic) with liver biopsy in a cohort of patients from a medium-income country: an observational study. Rev Esp Enferm Dig. 2021;113(5):318-323.
56. Samir AE, Dhyani M, Vij A, et al. Shear-wave elastography for the estimation of liver fibrosis in chronic liver disease: determining accuracy and ideal site for measurement. Radiology. 2015;274(3):888-896.
57. Prieto JE, Garzón-Orjuela N, Sánchez S, Prieto R, Ochoa A, Soto P, Eslava-Schmalbach J. Elastografía en tiempo real (Supersonic), experiencia de un centro en Bogotá. Rev Colomb Gastroenterol. 2021;36(1):58-64.
58. Ferraioli G, Tinelli C, Dal Bello B, et al. Accuracy of real-time shear wave elastography for assessing liver fibrosis in chronic hepatitis C: a pilot study. Hepatology. 2012;56(6):2125-2133.
59. Fierbinteanu-Braticevici C, Andronescu D, Usvat R, et al. Acoustic radiation force imaging sonoelastography for noninvasive staging of liver fibrosis. World J Gastroenterol. 2009;15(44):5525-5532.
60. Yin M, Talwalkar JA, Glaser KJ, Manduca A, Grimm RC, Rossman PJ, et al. Assessment of hepatic fibrosis with magnetic resonance elastography. Clin Gastroenterol Hepatol 2007;5(10):1207-1213.
61. Imajo K, Kessoku T, Honda Y, Tomeno W, Ogawa Y, Mawatari H, et al. Magnetic Resonance Imaging More Accurately Classifies Steatosis and Fibrosis in Patients With Nonalcoholic Fatty Liver Disease Than Transient Elastography. Gastroenterology 2016;150(3):626-637. 62. Vilar-Gomez E, Martinez-Perez Y, Calzadilla-Bertot L, Torres-Gonzalez A, Gra-Oramas B, Gonzalez-Fabian L, et al. Weight Loss Through Lifestyle Modification Significantly Reduces Features of Nonalcoholic Steatohepatitis. Gastroenterology. 2015;149(2):367-378.
63. Kim D, Murag S, Cholankeril G, Cheung A, Harrison S, Younossi ZM, et al. Physical Activity, Measured Objectively, Is Associated With Lower Mortality in Patients With Nonalcoholic Fatty Liver Disease. Clin Gastroenterol Hepatol. 2021;19(6):1240-1247.
64. Sanyal AJ, Chalasani N, Kowdley KV, McCullough A, Diehl AM, BassNM, et al. Pioglitazone, vitamin E, or placebo for nonalcoholic steatohepatitis. N Engl J Med. 2010;362(18):1675-1675.
65. Musso G, Cassader M, Rosina F, Gambino R. Impact of current treatments on liver disease, glucose metabolism and cardiovascular risk in non-alcoholic fatty liver disease (NAFLD): a systematic review and meta-analysis of randomised trials. Diabetologia. 2012;55(4):885-904.
66. Rakoski MO, Singal AG, Rogers MA, Conjeevaram H. Meta-analysis: insulin sensitizers for the treatment of non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2010;32(10):1211-1221.
67. Li Y, Liu L, Wang B, et al. Metformin in non-alcoholic fatty liver disease: A systematic review and meta-analysis. Biomed Rep. 2013;1(1):57-64.
68. Sanyal AJ, Mofrad PS, Contos MJ, et al. A pilot study of vitamin E versus vitamin E and pioglitazone for the treatment of nonalcoholic steatohepatitis. Clin Gastroenterol Hepatol. 2004;2(12):1107-1115.
69. Belfort R, Harrison SA, Brown K, et al. A placebo-controlled trial of pioglitazone in subjects with nonalcoholic steatohepatitis. N Engl J Med. 2006;355(22):2297-2307.
70. Ratziu V, Giral P, Jacqueminet S, Charlotte F, Hartemann-Heurtier A, Serfaty L, et al. Rosiglitazone for nonalcoholic steatohepatitis: one-year results of the randomized placebo-controlled Fatty Liver Improvement with Rosiglitazone Therapy (FLIRT) Trial. Gastroenterology. 2008;135(1):100110.
71. Neuschwander-Tetri BA, Brunt EM, Wehmeier KR, Oliver D, Bacon BR. Improved nonalcoholic steatohepatitis after 48 weeks of treatment with the PPAR-gamma ligand rosiglitazone. Hepatology. 2003;38(4):1008-1017.
72. Armstrong MJ, Gaunt P, Aithal GP, Barton D, Hull D, Parker R, et al. Liraglutide safety and efficacy in patients with non-alcoholic steatohepatitis (LEAN): a multicentre, double-blind, randomised, placebo-controlled phase 2 study. Lancet. 2016;387(10019):679-690.
73. Cusi K. Incretin-Based Therapies for the Management of Nonalcoholic Fatty Liver Disease in Patients With Type 2 Diabetes. Hepatology. 2019;69(6):2318-2322.
74. Newsome PN, Buchholtz K, Cusi K, Linder M, Okanoue T, Ratziu V, et al. A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis. N Engl J Med. 2021;384(12):1113-1124.
75. Armstrong MJ, Hull D, Guo K, Barton D, Hazlehurst JM, Gathercole L, et al. Glucagon-like peptide 1 decreases lipotoxicity in non-alcoholic steatohepatitis. J Hepatol. 2016;64(2):399-408.
76. Pajot G, Calderon G, Acosta A. Endoscopic treatments for obesity. Curr Treat Options Gastroenterol. 2017;15(4):660-675
77. Ali MR, Moustarah F, Kim JJ. American Society for Metabolic and Bariatric Surgery Clinical Issues Committee. American Society for Metabolic and Bariatric Surgery position statement on intragastric balloon therapy endorsed by the Society of American Gastrointestinal and Endoscopic Surgeons. Surg Obes Relat Dis. 2016;12(3):462-467
78. Lassailly G, Caiazzo R, Buob D, Pigeyre M, Verkindt H, Labreuche J, et al. Bariatric Surgery Reduces Features of Nonalcoholic Steatohepatitis in Morbidly Obese Patients. Gastroenterology. 2015;149(2):379-388.
79. Chavez-Tapia NC, Tellez-Avila FI, Barrientos-Gutierrez T, Mendez-sanchez N, Lizardi-Cervera J, Uribe M. Bariatric surgery for non-alcoholic steatohepatitis in obese patients. Cochrane Database Syst Rev. 2010;(1):CD007340.
80. Lee Y, Doumouras AG, Yu J, et al. Complete Resolution of Nonalcoholic Fatty Liver Disease After Bariatric Surgery: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2019;17(6):1040-1060.
81. Dietrich CG, Rau M, Geier A. Screening for nonalcoholic fatty liver disease-when, who and how? World J Gastroenterol. 2021;27(35):5803-5821.
Recibido: 22 de Abril de 2022
Aceptado: 08 de Septiembre de 2022
Correspondencia:
John Edison Prieto Ortiz
jhonprieto@hotmail.com
Aceptado: 08 de Septiembre de 2022
Correspondencia:
John Edison Prieto Ortiz
jhonprieto@hotmail.com