MEJORÍA DE LA VISIÓN EN UNA SERIE DE PACIENTES CON DÉFICIT VISUAL DE ORIGEN NEUROLÓGICO
Juan Camilo Suárez1,Mariana Atehortúa2, Mercedes Molina3, Marta Muñoz4, John Fredy Ochoa5, José Iván Jiménez6
RESUMEN
Antecedentes. Existe una gran frecuencia y prevalencia de lesiones, patologías y trastornos que afectan la función visual, generando frecuentemente, déficit y/o deterioro permanente y discapacidad visual. Entre las causas, las lesiones neurológicas visuales, trascienden la etiología oftalmológica y óptica clásica, y suponen un reto diagnostico, terapéutico y de rehabilitación. Objetivo. Mejorar (rehabilitar) la función visual en personas con déficit de la vía visual por medio de un protocolo original de restricción monocular del mejor ojo y programa intensivo, controlado y estructurado de estimulación visual del ojo con visión más afectada. Método. Investigación cuasi-experimental en 10 pacientes con deterioro visual neurológico secundario a enfermedad vascular, inflamatoria o traumática. Cada paciente posee una evaluación basal de su condición visual, una intervención (restricción visual más programa de estimulación visual), y una evaluación final. La evaluación basal y final tiene medición de agudeza visual (AV), imagen funcional (RMf visual) y perfil de funcionamiento visual. Investigación con aval del Comité de Ética de la Fundación Instituto Neurológico de Colombia. Resultados. Se encontró una mejoría global del 60% de los pacientes en AV cercana y lejana, con un valor p de significancia estadística. La comparación de medias de AV entre los pacientes antes y después de la intervención posee un valor p significativo: AV cercana valor P=0.0171 y AV lejana valor P=0.0099. Se obtuvieron cambios en el patrón de activación por RMf visual. Conclusiones. Hay indicios de mejoría (rehabilitación) de la función visual, mediante cambios en AV y RMf visual, indicando posiblemente un proceso de rehabilitación visual en fase crónica de déficit visual neurológico.
Palabras clave: Personas con Daño Visual, estimulación luminosa (estimulación visual), vías visuales, agudeza visual, rehabilitación, resultado del tratamiento.
VISION IMPROVEMENT IN A SERIES OF PATIENTS WITH NEUROLOGICAL
VISUAL DEFICIT
ABSTRACT
Background. There is a high frequency and prevalence of injuries, diseases and disorders that affect visual function, often generating deficit and / or permanent visual impairment and disability. Among the causes, visual nerve damage goes beyond classical etiology and pose diagnostic, therapeutic and rehabilitation challenges. Objective. To improve (rehabilitate) visual function in people with visual pathway deficit through an original protocol consisting in better eye monocular restriction and an intensive program, with controlled and structured visual stimulation of the affected eye with more vision. Method. Quasi- experimental research in 10 patients with neurological visual impairment secondary to vascular, traumatic or inflammatory disease. All patients have a baseline assessment of their visual condition, an intervention (visual restriction plus visual stimulation program), and a final evaluation. Baseline and final assessments include measurement of visual acuity (VA), functional imaging (visual fMRI) and profile of visual functioning. This research project was underwritten by the Ethics Committee of the Instituto Neurológico de Colombia. Results. Overall improvement in 60% of patients was found in close and far VA, with a p-value of statistical significance. Comparison of means of VA between patients before and after the intervention has a significant p value: VA P value = 0.0171 near and distant VA P value = 0.0099. Changes were obtained in the pattern of fMRI visual activation. Conclusions: There are signs of improvement (rehabilitation) of visual function through changes in VA and visual fMRI, possibly indicating a process of visual rehabilitation in the chronic phase of a visual neurological deficit.
Key words: Visually impaired persons, photic stimulation, visual pathways, visual acuity, rehabilitation, treatment outcome
INTRODUCCIÓN
A nivel mundial se estiman 285 millones de personas con deterioro visual permanente, distribuidas en 246 millones con discapacidad visual, o baja visión, y 39 millones con ceguera 1. La función visual se subdivide en cuatro niveles por agudeza visual (AV): visión normal (AV mejor o igual a 20/60 pies); deterioro visual moderado (AV entre 20/60 a 20/200 pies); deterioro visual severo (AV entre 20/200 a 20/400 pies), y ceguera (AV menor a 20/400 pies hasta no percepción de luz) (1, 2).
El deterioro visual moderado y severo conforman la categoría de discapacidad visual (baja visión), y de manera general la etiología de esta condición clínica se puede agrupar en causas oftalmológicas (propias del globo ocular a nivel de medios de refracción, motilidad, anexos y tracto uveal) y en causas neurológicas que incluyen lesiones de la vía visual como la retina, nervio óptico, quiasma, tractos ópticos, cuerpo geniculado del tálamo visual, radiaciones ópticas, corteza visual primaria y áreas de asociación visual (3).
Al indagar en la etiología mundial de la discapacidad visual y la ceguera, la Organización Mundial de la Salud (OMS) reporta que las principales causas son las ametropias no corregidas, la catarata, retinopatía diabética, retinopatía del prematuro, cicatrices corneales, glaucoma, embolismo o ateromatosis de arterias de la retina y neuro retinitis virales (1). Es así que las principales causas, por su elevada frecuencia son oftalmológicas: ametropías 43%, catarata 33% y glaucoma 2% de distribución mundial (4). Sin embargo, aunque la literatura reconoce que las lesiones neurológicas provocan deterioro de la función visual y discapacidad visual en determinados casos, faltan estadísticas y estudios clínico-epidemiológicos que documenten la verdadera magnitud de la discapacidad visual y ceguera por déficit de etiología neurológica.
No hay reportes concretos en la literatura sobre las causas neurológicas de discapacidad visual y ceguera. Pese a lo anterior, es importante señalar que la enfermedad neurológica en general, explica cerca del 11% de la carga mundial de enfermedad, 6% de los años de vida ajustado en función de discapacidad (AVAD), y hace parte de las principales etiologías del déficit en las personas con alguna discapacidad a nivel mundial (5). Para los autores de este trabajo, la función visual no es ajena de deterioro por déficit neurológico, así no existan datos concretos de dicho fenómeno. Una posible causa que explique el porqué no hay evidencia y/o investigación robusta frente a la temática de discapacidad visual y ceguera neurológica, se resume en la siguiente idea del libro de Bradley (Chapter 14. Bradley's Neurology in Clinical Practice. 2012): “… las causas oftalmológicas de pérdida de la visión a menudo no son evidentes para el neurólogo, mientras que las causas neurológicas de perdida visual a menudo confunden a los oftalmólogos”.
Existen varias enfermedades neurológicas que afectan la función visual, como la neuropatía óptica isquémica, neuritis óptica por esclerosis múltiple y por otras causas, neuropatía óptica traumática, neuropatías compresivas, arteritis temporal y ambliopía por estrabismo(6); todos ellos fenómenos clínicos donde se deterioran aspectos neuronales de la función visual, secundarios a procesos isquémicos, desmielinizantes, tumorales, compresivos, neurodegenerativos y autoinmunes. El ataque cerebro vascular (ACV) puede afectar la vía visual en cualquier lugar de su recorrido, un 30% de los pacientes post ACV poseen perdida de los campos visuales. Cerca del 74% de los pacientes con trauma encefalocraneano (TEC) experimentan dificultades de la visión, y un 38% de estos, quedan con discapacidad visual.
La mayoría de las causas neurológicas dañan neuronas retinales, foto receptores o las vías ópticas, y por tanto se han considerado irreparables debido a la creencia generalizada de que las neuronas cerebrales no se regeneran, y solo se puede ofrecer como tratamiento programas de rehabilitación basados en la visión residual o potencialmente utilizable.
Búsquedas en la literatura médica sobre “rehabilitación de la visión” produce abundantes artículos de métodos de readaptación al déficit o de sustitución para optimizar el remanente visual en discapacidad visual. Dichos métodos se agrupan en dos categorías: entrenamiento en habilidades del procesamiento visual y en entrenamiento de habilidades compensatorias (7). Ninguno de los trabajos relacionados se refiere a rehabilitación en el verdadero sentido de la palabra, que quiere decir recuperación de la función pérdida.
Estudios clínicos en humanos sobre rehabilitación visual son escasos. Uno de ellos consiste en el tratamiento de pacientes adultos con ambliopía mediante estimulación visual (8), en el cual obtienen algún grado de recuperación de la ambliopía en adultos. Otros artículos reportan ampliación de los campos visuales defectuosos por estimulación visual (9), utilizando estimulación visual intermitente y no intensiva. Otro tipo de investigación sobre visión son los trabajos experimentales de lesiones del nervio óptico en ratas, ratones y gatos, en los cuales se han realizado procedimientos de lesión controlada del nervio óptico, para documentar el paso de las fibras a través de la lesión. Los trabajos reportan paso de los axones por unos pocos milímetros del sitio de la cicatriz; se han utilizado múltiples moléculas para facilitar el paso de los axones a través de la cicatriz, como: factor de crecimiento nervioso (NGF, Nerve Growth Factor), factor neurotrópico derivado del cerebro (BDNF, Brain-Derived Neurotrophic Factor), neurotensina (NT, neurotensin), factor de crecimiento del fibroblasto (BFGF, fibroblast growth factor), factor neurotrofico ciliar (CNTF, Ciliary Neurotrophic Factor) y factor de crecimiento asociado a insulina (IGF, insulin-like growth factor) (10). Todos estos trabajos coinciden en que después de la lesión por corte o pinzamiento del nervio óptico, la mayoría de las neuronas de la retina de la rata, mueren en corto tiempo (semanas), quedando solo unas pocas neuronas vivas. El intento de mantener su viabilidad mediante factores de crecimiento y otras moléculas, no ha sido efectivo (10, 11). Estos trabajos no han investigado si ocurren procesos de regeneración neuronal a largo término.
La anterior revisión y la presencia de una problemática médica poco estudiada, comprendida e intervenida como el deterioro y la discapacidad visual neurológica, y la observación anecdótica de un paciente de 80 años de edad quien perdió visión por su ojo derecho a causa de una neuropatía óptica isquémica quedando con visión de cuenta dedos, y 6 años después con un nuevo episodio de neuropatía óptica isquémica en el otro ojo (ojo izquierdo), el cual en pocos meses experimentó recuperación visual en su ojo derecho que permaneció con baja visión, siendo forzado en cierta medida por el compromiso bilateral pero en diferentes momentos de su visión, permitió diseñar una investigación que reproduce lo que ocurrió espontáneamente en dicho paciente.
El objetivo del presente estudio consiste en evaluar la mejoría o rehabilitación de la función visual en diez pacientes con deterioro permanente de la vía visual de origen neurológico, por medio de una técnica original de restricción monocular más un programa intensivo, controlado y estructurado de estimulación visual, denominada Oclusión Óptica Funcional (OOF), a través de un modelo de investigación clínica de tipo cuasi experimental.
- MD. Especialista en Neuro rehabilitación-rehabilitación neuropsicológica, Instituto Neurológico de Colombia. Docente facultad de medicina y psicología Universidad Pontificia Bolivariana, coordinador académico programa Rehabilitación neuropsicológica Universidad CES.
- Psicóloga, especialista en rehabilitación neuropsicológica, Sede Universidad CES Sabaneta.
- MD. Oftalmóloga, retinóloga, Clínica Oftalmológica San Diego.
- MD. Oftalmóloga, neuro oftalmología. Clínica Oftalmológica San Diego.
- Unidad de Neuroimagen funcional. Instituto Neurológico de Colombia
- MD. Neurólogo y Neuro fisiólogo, director científico emérito Instituto Neurológico de Colombia.
MÉTODOS
Estudio cuasi experimental en 10 pacientes con deterioro visual permanente (discapacidad visual) neurológico secundario a enfermedad vascular, inflamatoria o traumática. Como modelo cuasi experimental no se realizó distribución aleatoria de la intervención, sino que cada paciente fue asumido como su propio control mediante análisis y comparación del estado visual pre intervención versus el estado visual pos intervención.
Criterios de inclusión y exclusión
Los pacientes incluidos cumplieron los siguientes criterios de inclusión: paciente de cualquier sexo, mayor a 16 años, con diagnóstico confirmado de neuropatía óptica isquémica (perdida súbita de la visión, disco óptico atrófico), neuropatía óptica traumática (trauma craneano con secuela de pérdida visual), neuropatía óptica por esclerosis múltiple (diagnostico de EM confirmada). Tener al menos un año de evolución, con el deterioro visual estable en los últimos 6 meses, alteración de la AV uni o bilateral (AV menor o igual a 20/60, es decir, en categoría de baja visión) con presencia de un ojo con mejor visión.
Fueron excluidos aquellos pacientes con déficit visual que disminuye la AV de forma bilateral y en igual rango (Ej. AV en ojo derecho 20/200 y en ojo izquierdo 20/200), presencia de un ojo invidente, presencia de implantes metálicos o marcapasos cardiacos que contraindiquen la realización de Resonancia Magnética funcional visual (RMf visual); alteración visual severa por defectos de refracción óptica y baja visión por patología oftálmica propia (glaucoma, opacidades corneales, secuelas de retinopatía de la prematurez, retinopatía hipertensiva, retinopatía diabética, cataratas, retinitis pigmentosa y degeneración macular asociada a la edad), presencia de enfermedad tumoral del nervio óptico, altas dosis de esteroides en los últimos 6 meses, recaída aguda tipo neuritis óptica por esclerosis múltiple en los últimos 6 meses, y falta de capacidad para entender instrucciones y tener adherencia a la intervención propuesta.
Intervención
Se estructuró un programa llamado Oclusión Óptico Funcional (OOF), que consiste en la utilización durante 14 días de un parche ocular de restricción en el ojo con mejor visión y 50 horas de estimulación visual intensiva del ojo con menos visión, supervisada por un profesional en neuro rehabilitación.
- Restricción visual
Restricción visual del ojo funcional (o con mejor visión), durante los 14 días de la terapia OOF, mediante un parche de oclusión ocular. Fue realizado de la siguiente manera: lunes a viernes de 7 a 12 AM en medio de las sesiones de la estimulación visual intensiva aplicada por un profesional en neuro rehabilitación, con un descanso de 15 minutos a mitad de la mañana, y de 1 a 6 PM continuo en el hogar. La oclusión se retiró en horas de la noche, después de las 6:00 pm hasta el día siguiente. Sábados y domingos (tiempo en el que el paciente no asistió a las sesiones de estimulación visual intensiva), se solicitó que utilizara la restricción por 10 horas por día. De esta forma se buscó que cada paciente contara con un tiempo de oclusión de su ojo con mejor visión de 140 horas en 14 días.
- Estimulación visual intensiva
La estimulación visual intensiva consistió en la aplicación de un programa original diseñado por los investigadores, que utiliza un gran volumen de imágenes digitales para proyectar en una pantalla de computador. El programa visual está conformado por varios ejercicios que desglosan la función visual en contraste, color, luminancia, siluetas, lectura de textos en diferentes tamaños de letra y movimiento. Cada ejercicio de estimulación visual posee niveles de dificultad; por ejemplo, a nivel de lectura de textos se estandarizó el número de caracteres y el tamaño de las fuentes ajustadas a los niveles de dificultad. La construcción de dichas imágenes se realizó en el programa Microsoft Office Power Point. Dicho programa se aplicó de lunes a viernes de 7 a 12 AM por un profesional en neuro rehabilitación. La presencia de un profesional médico o psicólogo con especialización en neuro rehabilitación y/o rehabilitación neuropsicológica, durante las 5 horas diarias de estimulación visual intensiva, permitió controlar y guiar al paciente a interpretar y ejecutar cada uno de los ejercicios visuales.
La construcción de cada modulo de imágenes se elaboró a partir de la neurofisiología visual, donde la vía visual posee canales específicos de transmisión de información entre la retina y el tálamo visual, denominados neuronas parvo y magnocelulares ubicadas en las capas celulares del cuerpo geniculado lateral, y cuya existencia crea un conglomerado parvocelular enfocado en agudeza visual y percepción del color y un conglomerado magnocelular especializada en estímulos visuales cambiantes (12).
Se diseñó un conjunto de imágenes originales (inéditas), para la estimulación visual intensiva, con la siguiente organización:
- Modulo de Siluetas: once imágenes con figuras geométricas simples en blanco y negro, y cuarenta y cinco imágenes con siluetas de objetos comunes. Objetivo: estimulación de bastones (visión escotopica, con gran sensibilidad a la luz, monopigmento, acrómatica, baja resolución espacial y gran amplificación de fotones únicos) y vías retinianas convergentes (13); los bastones envían su información a la corteza visual primaria a través de células ganglionares magnocelulares (mayor sensibilidad al contraste).
- Módulo de Color: diez y ocho imágenes con figuras geométricas simples con contraste de color (rojo, azul y verde) y doce imágenes con siluetas de objetos comunes con contraste de color (rojo, azul y verde). Objetivo: estimulación de conos, visión fotópica (menos sensibilidad a la luz, multipigmento, crómatica, gran resolución espacial y mayor sensibilidad a rayos incidentes directos) y vías retinianas dispersas (13); los conos envían su información a la corteza visual primaria a través de células ganglionares parvocelulares (baja sensibilidad al contraste), área de asociación del color (área V4).
- Módulo de Lectura: reconocimiento de letras: veinte y ocho imágenes con letras simples en color negro sobre fondo blanco homogéneo con aumento progresivo del tamaño. Objetivo: estimulación de retinas maculares involucradas en la captación del campo visual central (lectura) y sistema de bastones (visión escotopica). Reconocimiento de palabras: 15 imágenes con palabras, utilizando color y/o blanco/negro con variación del tamaño fuente y contraste.
- Reconocimiento de frases y párrafos: nueve imágenes con párrafos en color negro con fondo blanco, con variación del tamaño de la letra.
- Módulo de Sensibilidad al contraste y sombras: catorce imágenes tipo cuadrícula blanco y negro con cambio gradual de tonalidad. Once imágenes con figuras geométricas tridimensionales, en blanco y negro, con sombra. Seis imágenes con figuras rectangulares verticales y horizontales con degradación de grises. Treinta y siete imágenes para reconocimiento de figura/fondo, con aumento/disminución del contraste. Objetivo: estimulación de bastones, visión escotópica, monocromática.
- Módulo de Percepción de objetos en movimiento: Siete imágenes para localización de puntos en blanco/negro intermitentes, con punto de fijación central de la visión. Una imagen con cuadros de color en movimiento aleatorio. Cinco imágenes con palabras en color y/o blanco/negro en movimiento aleatorio en todos los ejes. Cinco imágenes con círculo en color y/o blanco y negro en movimiento aleatorio en todos los ejes. Cuatro imágenes con fondo negro con líneas blancas y/o de colores en oscilación. Objetivo: estimulación dual de visión fotopica y escotopica, corriente ganglionar parvo y magnocelular y áreas de asociación del color (V4) y del movimiento V5-TM (13).
- Módulo de Reconocimiento de imágenes estáticas de diferentes categorías semánticas: ocho imágenes de fotografías de actividades básicas cotidianas. Quince imágenes de fotografías de lugares comunes de la ciudad. Treinta y cuatro imágenes de situaciones de acción (verbos). Cuarenta imágenes de prendas de vestir. Veintiuna imágenes de utensilios de aseo. Diez y seis imágenes de medios de transporte. Sesenta y nueva imágenes de alimentos. Trece imágenes de deportes. Trece imágenes de partes del cuerpo humano. Diez y seis imágenes de absurdos visuales (imágenes ilógicas). Diez imágenes de rostros (de diferentes sexos, edades y razas). Objetivo: estimular visión fotópica, de gran agudeza y discriminación visual, conglomerado ganglionar parvocelular (13), y áreas corticales de asociación visual.
- Módulo de Percepción visual: veintiséis imágenes de cierre gestáltico en blanco y negro. Objetivo: estimular campo visual central, retina macular, y áreas de asociación visual de alto nivel.
Parámetros a medir
En cada paciente sometido a la terapia OOF, se realizaron los siguientes exámenes antes y después de la intervención: evaluación oftalmológica, resonancia magnética funcional visual (RMf), potenciales evocados visuales y un perfil de funcionamiento visual subjetivo mediante la Clasificación Internacional del Funcionamiento, Discapacidad y Salud (CIF-2011), con la finalidad de detectar cambios no solo en la AV, sino en otros parámetros de la función visual.
- Evaluación oftalmológica
El examen oftalmológico inicial y final fue realizado por diferentes oftalmólogos. La toma de AV se realizó utilizando cartilla de Snellen y cartilla de visión cercana tipo ETDRS. El fraccionario de AV obtenido antes y después en cada paciente, fue transformado a Log MAR para procesamiento estadístico. Bailey y Lovie diseñaron y propusieron una cartilla que estandarizaría las respuestas para cada tamaño de letra en cada una de las líneas, llamada Log MAR. Esto lo lograron al utilizar una progresión logarítmica del tamaño de los optotipos, obteniendo la igualdad en el discernimiento. Propusieron que cada línea de optotipos contenga cinco letras y el espacio entre ellas es exactamente el tamaño de las letras de la misma línea y el espacio entre las líneas es igual al tamaño del optotipo de la línea inferior. De tal manera que con esta cartilla, Bailey y Lovie innovaron el método de evaluar la agudeza visual a través del logaritmo del mínimo ángulo de resolución (logMAR) (14-16).
Este tipo de escala establece:
- Una AV de 20/20 es igual a 0.00 logMAR.
- Una AV de 20/200 representa en logMAR la unidad (1,0).
Por lo tanto, cada sucesivo cambio de línea representa una modificación de 0,10 unidades logarítmicas. En una línea de cinco letras, cada letra tiene un valor de 0,02 unidades logarítmicas; de esta manera se puede anotar objetivamente el valor de la agudeza alcanzada dentro de una línea, con un alto grado de confiabilidad (14-16).
- Resonancia Magnética Funcional Visual (RMf visual)
Se utilizó un equipo Siemens, Magnetom Symphony (Siemens, Erlangen) Maestro Class 1.5T, con el siguiente protocolo: T1 volumétrico axial (MPRAGE): TR = 11 ms., TE = 5.2 ms., FA = 15, Espesor = 1 mm, Matriz = 224 x 256, 176 cortes por volumen. Imágenes funcionales potenciadas en T2 (EPI T2, Grosor de corte: 3 mm, TR: 4000, TE: 50, Espacio entre cortes: 1 mm, FA: 900, 36 cortes). Durante la adquisición de los volúmenes funcionales se realiza tarea de estimulación con luz blanca intermitente y mediante espiral de colores. Ambas tareas son presentadas en paradigmas por bloques (20 segundos de reposo y 20 segundos de estimulación, 6 bloques totales de estimulación) como tareas independientes. La estimulación se realiza de manera independiente en cada ojo con una duración por tarea de 4 minutos.
- Potenciales evocados visuales
Se realizaron en un equipo marca Cadwell de 4 canales siguiendo el protocolo recomendado por la Sociedad de EEG y Clinical Neurophisiology (17).
- Perfil de funcionamiento:
Apreciación subjetiva de la visión, antes y después de la terapia OOF, en cada paciente del estudio a partir de un perfil sobre funcionamiento visual, conformado por 12 ítems, utilizando lenguaje de la Clasificación Internacional del Funcionamiento, Discapacidad y la Salud de la OMS año 2001. Los calificadores de respuesta son: 1 mala, 2 regular, 3 buena y 4 excelente.
Consideraciones éticas
El Comité de Ética de la Fundación Instituto Neurológico de Colombia aprobó la realización de la investigación, advirtiendo el riesgo de inducir ambliopía reversa (a nivel del ojo sano) en los pacientes. Cada paciente dio su consentimiento informado por escrito. Durante la realización de la intervención se revisó diariamente la AV de cada paciente, para suspenderla en caso de mayor deterioro visual o signos de ambliopía reversa. La investigación respeto el método científico, buenas prácticas clínicas y la legislación nacional e internacional de investigación en seres humanos. Se realizó registro en Clinical trial registration number: ISRCTN38035929 (18).
Resultados
Se incluyeron diez pacientes en el periodo junio 2009 a marzo 2012; 70% mujeres, edad promedio 42.3 (DE: ±21.1) años, una mediana de 34.5 (RIC 28-53) años. La causa del deterioro visual fue: tres pacientes con neuropatía óptica por esclerosis múltiple, tres pacientes con neuropatía óptica isquémica y 4 pacientes con neuropatía óptico traumática.
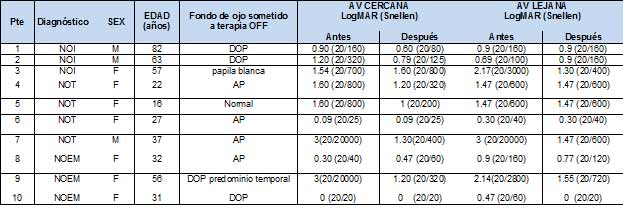
La tabla 1 muestra en cada paciente la patología, edad y sexo, más los hallazgos de fondo de ojo y cambios en la AV cercana y lejana en el ojo sometido a la terapia OOF. La figura 1 y 2 muestra las RMf visuales antes y después de OOF en dos pacientes del estudio (paciente 1 y 9), donde se muestra las diferencias de activación mediante cantidad de voxels activos (lo que representa cantidad de corteza y/o áreas visuales reclutada para ver un estimulo).
Tabla 1. Comparación de Agudeza Visual Cercana y Lejana antes y después de la terapia OOF
AV: Agudeza visual NOI: Neuropatía óptica isquémica, NOT: Neuropatía óptica traumática, NOEM: Neuropatía óptica por esclerosis múltiple. |
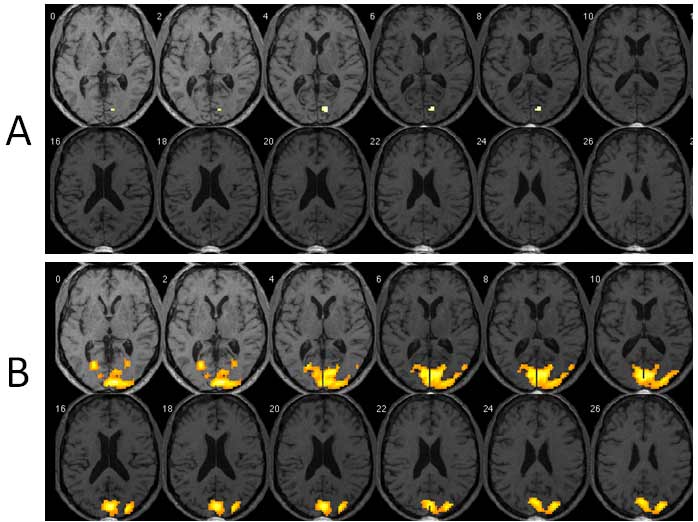
Figura 1. RMf visual antes y después de OOF en el paciente 1. Estimulo: Presentación intermitente de luz blanca mediante un paradigma de bloques. Ojo afectado el cual fue intervenido por OOF: ojo izquierdo. A) serie antes de OOF (fecha 30/ 09/2009). B) serie posterior a OOF (fecha 02/12/2009).
|
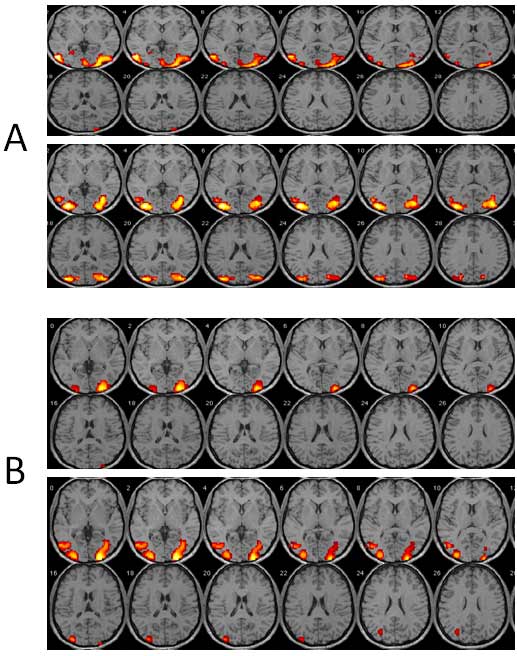
Figura 2. RMf visual antes y después de OOF en el paciente 9. Ojo afectado el cual fue intervenido por OOF: ojo izquierdo. A) Serie con presentación intermitente de luz blanca mediante un paradigma de bloques antes y después OOF. B) Serie con presentación de espiral de colores antes y después de OOF. Fecha realización RMf visual antes de OOF 28/12/2011. Fecha realización RMf visual posterior a OOF 17/01/2012.
|
Análisis AV antes y después de OOF
- AV Cercana: Prueba de comparación de medias de los valores de AV cercana en todos los pacientes antes y después de OOF. Valor P= 0.0171 con un IC al 95.0% (0.111- 0.884).
- AV Lejana: Prueba de comparación de medias de los valores de AV lejana en todos los pacientes antes y después de OOF. Valor P= 0.0099 con un IC al 95.0% (0.103 – 0.572).
En los pacientes con NOI, los pacientes 1 y 2 presentaron una marcada mejoría a nivel de AV cercana en el ojo afectado, aspecto que representa un cambio en la categoría del deterioro visual; el paciente 2 cambió de baja visión severa a baja visión moderada a nivel de visión cercana; el paciente 1 mejoro su visión cercana a niveles próximos de visión cercana a lo normal. La AV lejana en el ojo afectado no se modificó en los pacientes 1 y 2; el paciente 3, mejoró su AV lejana, pasando de ceguera a baja visión severa. El paciente 2 desmejoro en la AV lejana y el paciente 3 desmejoro en la visión cercana, pero dichos cambios no los cambia de categoría de deterioro visual.
En los pacientes con deterioro visual por NOT, mejoraron la AV cercana y lejana los pacientes 4, 5 y 7. La máxima mejoría se encontró en AV cercana. La categoría de deterioro visual cambio drásticamente de ceguera a categoría de baja visión. El paciente 6 no mejoró en ninguna categoría pero tampoco empeoró.
En los pacientes con NOEM, los pacientes 8, 9 y 10 mejoraron la AV lejana en el ojo afectado. La paciente 1 cambio de categoría de baja visión a visión normal. La paciente 9 mejoró su AV cercana, pasando de ceguera a baja visión severa. Solo la paciente 8 disminuyo su AV cercana, pero dicho cambio la deja en la misma categoría de visión cercana a lo normal.
Comportamiento global de la AV cercana
Seis pacientes (60%) mejoraron la cifra de AV cercana a nivel del ojo afectado, posterior a la intervención OOF. Dos pacientes disminuyeron su AV cercana en el ojo afectado. Dos pacientes continuaron con igual nivel de AV cercana, sin experimentar mejoría o desmejora en dicho ítem.
Comportamiento global de la AV lejana
Seis pacientes (60%) mejoraron su cifra de AV lejana a nivel del ojo afectado posterior a la intervención OOF. Dos pacientes disminuyeron su AV lejana en el ojo afectado. Dos pacientes continuaron con igual nivel de AV lejana, sin experimentar mejoría o desmejora en dicho ítem.
Resultado de la RMf visual:
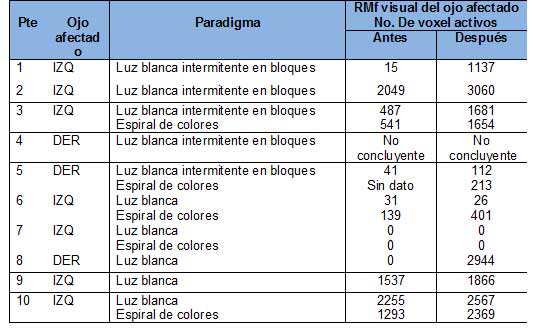
Los resultados de la RMf realizada en todos los pacientes antes y después de la terapia OOF, se detallan en la tabla 2.
Comparación de RMf visual del ojo afectado antes y después de la terapia OOF
Prueba de comparación de medias de número de Voxel activos previo y posterior a la OOF. Valor P= 0.0000 con un IC al 95.0% (727.4- 1016.5).
Potenciales evocados visuales, este examen realizado en todos los pacientes no fue de utilidad, pues los valores no se modificaron apreciablemente con la terapia OOF, en cuanto a la latencia de la onda P100.
Tabla 2. Comparación de RMf visual del ojo afectado antes y después de la terapia OOF
|
Perfil de funcionamiento:
Los resultados detallados de la apreciación subjetiva del estado y nivel de mejoría por parte de los pacientes en estudio, mediante un perfil de funcionamiento de la visión por CIF-2001 antes y después de la terapia OOF. La tabla 3 muestra el detalle de todos los pacientes y la tabla 4 una forma resumida del comportamiento.
Discusión
El presente estudio posee varias limitaciones metodológicas que deben ser tenidas en cuenta a la hora de interpretar los resultados. No se utilizó controles, puesto que una persona sana sin ningún déficit ni condición de discapacidad visual no obtendría ninguna mejoría en su condición visual mediante el protocolo aquí probado. De igual manera la utilización de controles tipo pacientes con discapacidad visual de origen neurológico no poseen un tratamiento estándar ni aceptado de rehabilitación para su condición visual; es por ello que se optó por un modelo cuasi-experimental donde cada paciente fuera su control al poseer deterioro visual permanente y/o discapacidad visual por déficit neurológico, mediante una comparación un antes y un después de la terapia diseñada OOF.
Tabla 3. Mejoría subjetiva antes y después de OOF en cada paciente del estudio 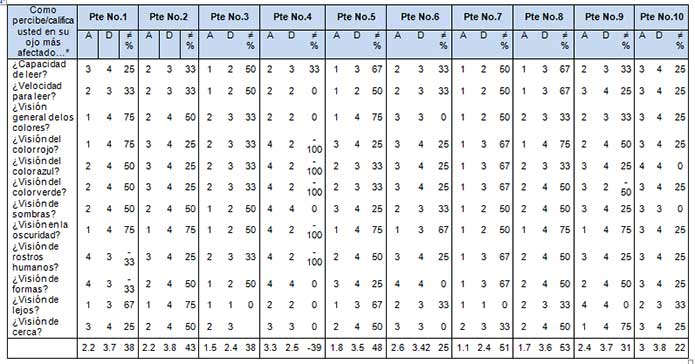 |
Tabla 4. Mejoría subjetiva antes y después de OOF en cada paciente del estudio 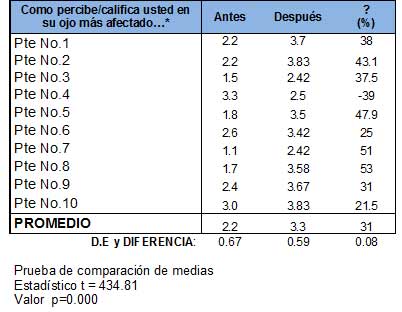 |
La recuperación espontanea es una explicación médica poco estudiada y comprendida, pero una mejoría por dicho proceso se espera que ocurra entre un mes a máximo 6 meses después de la instauración de la lesión o déficit. En este trabajo se trato de controlar la mejoría espontanea, incluyendo pacientes que llevaran al menos un año de evolución, con un deterioro visual estable en los últimos 6 meses. De igual forma se trata de pacientes en categoría de deterioro visual permanente por la presencia de un déficit neurológico ya instaurado y estable, y no en recaída o agudización de síntomas.
Los resultados obtenidos en este proyecto muestran en los pacientes una mejoría global del 60% en la AV cercana y lejana, con un valor de p de significancia estadística. La comparación de medias de las cifras de AV entre los pacientes antes y después de la OOF posee un valor de p significativo: AV cercana valor P= 0.0171 y AV lejana valor P= 0.0099. Datos que respaldan en cierta medida, una mejoría en la función visual medida por AV por el protocolo OOF. La mejoría vista en AV indicaría un proceso de rehabilitación visual. En la literatura se reporta mejoría funcional de los pacientes con déficits visuales y/o discapacidad visual mediante la enseñanza de técnicas compensatorias y uso de ayudas y/o dispositivos de asistencia visual, adaptaciones ambientales, técnicas de entrenamiento en tareas de la vida diaria o mediante la prescripción de lentes, gafas, o de una cirugía refractiva (19-21). La prescripción de lentes permite que el paciente experimente acorde con su situación visual, corrección óptica, donde puede mejorar su AV solo mientras utilice la corrección. Los resultados del presente estudio son alentadores puesto que la mejoría de AV y los cambios en la activación cortical visual observadas se obtienen sin utilizar corrección óptica ni técnicas compensatorias.
La falta de respuesta en algunos pacientes puede tener varias explicaciones: el tiempo del tratamiento de 50 horas de terapia OOF no fue suficiente, la selección de estos pacientes no fue adecuada, la OOF no era adecuada para ellos, falta de colaboración del paciente para cumplir los parámetros de la restricción ocular, o por procesos propios de la misma patología que impide la mejoría visual mediante rehabilitación. Varias hipótesis en medio de una escasez o ausencia de estudios que ofrezcan datos con que contrastar.
Tanto la NOI, NOT y AOEM producen disfunción y/o deterioro del nervio óptico, cuando esto ocurre el paciente experimenta pérdida de la agudeza visual, defecto pupilar aferente, defecto campimétrico, defecto en la visión a color, pérdida de la brillantez a la luz y desaturación del rojo (22-23). Muchos de estos síntomas corresponden a lo referido por los pacientes del estudio registrado en la tabla de apreciación subjetiva previa y posterior a la OOF.
La NOI constituye una injuria isquémica sobre el nervio óptico, donde su forma más común es la isquémica anterior que afecta la cabeza o disco óptico (24-25). Los axones de las neuronas ganglionares que forman el nervio óptico se destruyen al morir el cuerpo de la neurona. Cada nervio óptico contiene cerca de 1 a 1.2 millones de axones de neuronas ganglionares (26). En los tres pacientes con NOI existió algún grado de mejoría mediante la rehabilitación OOF. Dichos pacientes mejoraron algunos parámetros de AV y se visualizó un aumento en la actividad de la corteza visual por RMf.
En los pacientes con NOT las fuerzas de aceleración, desaceleración, compresión y/o elongación sobre la vía visual, afectan la correcta señalización de los impulsos nerviosos a través de dicha estructura. Los pacientes con NOT experimentaron en cierta manera mejoría de AV y cambios en la actividad de la corteza visual por RMf.
En los pacientes con esclerosis múltiple las lesiones desmielinizantes dañan la mielina del nervio óptico y la falta de mielina dificulta el paso de los impulsos nerviosos y por lo tanto hay pérdida de la función visual; estos pacientes pueden desarrollar diferentes grados de atrofia óptica (27). La atrofia óptica indica deficiencia total o parcial en el número de fibras que emergen de la retina (28). En el presente trabajo se tomaron tres pacientes con atrofia óptica por esclerosis múltiple, que llevaban por lo menos 6 meses con un déficit visual estable, sin recaídas ni mejoras; los tres pacientes tuvieron algún grado de mejoría de la AV, correlacionada con mayor activación de la corteza occipital en la RMf.
¿A qué se debe la mejoría visualizada en este grupo de pacientes? los autores del trabajo consideremos las hipótesis de la plasticidad cerebral versus la regeneración neuronal. Donde las conexiones neuronales corticales y de las vías sensoriales, en este caso visuales, pueden ser remodeladas (29) mediante diferentes procesos de plasticidad cerebral, o mediante la formación de neuronas que se diferencian y se dividen a partir de células madres (30) posiblemente presentes o transportadas a la vía visual cuando esta se encuentra lesionada.
Cada teoría del ambiente neuronal que explique el sustrato celular, molecular, genómico y/o proteómico de la recuperación neurológica, y en este caso de mejoría visual neurológica, posee diferentes pros y contras, evidencia comprobada e hipótesis no comprobadas.
Considerar la regeneración de neuronas retinales que dan origen al nervio óptico (decir que las neuronas de la vía óptica se regeneran en una persona adulta), es difícil de entender y tal vez suene más una “herejía neurológica” que a un postulado científicamente aceptable, puesto que la doctrina de la no regeneración neuronal es un dogma aceptado casi universalmente. Para ilustrar este punto basta con lo que dice Stein y colaboradores (31): “Adult brain especially, after a functional area was lost, there was no possibility of recovery regeneration, or repair. Those who did not accept the strict relationship between structure and function in the brain were considered quaint at best or simply out-of-touch with scientific reality”.
El dogma o doctrina de la no regeneración de las neuronas dio origen a la teoría de la plasticidad cerebral, acuñado por Ernesto Lugano en 1906 (32). Esta teoría ha sido durante casi un siglo la base de los programas de rehabilitación de funciones neurológicas pérdidas (33) y se utiliza para explicar cualquier función cerebral no bien entendida: aprendizaje (34), memoria, problemas psiquiátricos, modulación del comportamiento, rehabilitación motora (35), epilepsia refractaria y estimulación cerebral crónica para trastornos del movimiento. La neuroplasticidad es un proceso continuo a corto, mediano y largo plazo de remodelación de mapas neuro sinápticos, que optimiza el funcionamiento de redes cerebrales (36). La plasticidad cerebral se ha convertido en cierta forma en “el comodín” (carta del juego de poker que puede tener cualquier valor), para explicar las funciones cerebrales cuya fisiología no se entiende.
Sin embargo han comenzado a aparecer trabajos de investigación que arrojan serias dudas sobre el dogma de la no regeneración de las neuronas cerebrales bajo el término neurogénesis (37): trabajos en ratas, gatos y monos en los cuales se ha demostrado, la presencia de células madre y factor neurotrópico en el cerebro en áreas sub ventriculares (38), nuevas memorias versus nuevas neuronas en el proceso de aprendizaje y memoria (39), migración de estas células a áreas cerebrales lesionadas, especialmente al hipocampo, formación de nuevas neuronas en el giro dentado del hipocampo para soportar la memoria olfatoria a corto y largo plazo (40), y regeneración neuronal en el cerebro de aves cantoras. En ratas con un stroke provocado por la oclusión de la arteria cerebral media, se ha demostrado un aumento de la proliferación de neuronas progenitoras, no solo en la zona sub ventricular sino también la migración de estas neuronas recientemente generadas al área dañada por el stroke. Por medio de células marcadas con 5 bromo 2 deoxiuridina, se ha demostrado que un stroke conduce a la proliferación de nuevas neuronas que emigran a la zona dañada por la isquemia (41).
En medio de las posibilidades los autores hemos considerado también el escenario donde ciertas fibras del nervio óptico se regeneraron 30 durante el tiempo de evolución de las patologías en estudio, pero no funcionaban hasta que se aplicó un proceso específico e intensivo de estimulación visual, como la que ocurrió aquí mediante el programa OOF.
Postulando que sea cierto la existencia de procesos de neuro plasticidad y/o neuro génesis en la vía visual (reaxonización, regeneración, remielinización, entre otros), producidos a lo largo del tiempo en los pacientes ¿Por qué no se recuperó la función visual hasta que los pacientes fueron sometidos a una estimulación visual intensiva por medio de la terapia OFF?
Para encontrar una explicación al no funcionamiento de las vías visuales, a pesar de que se habían regenerado, en teoría, se ofrece analizar la fisiología de las vías ópticas desde una visión digital.
El ojo humano reproduce, guardando las proporciones, una cámara digital. Tiene 6 millones de pixeles (los conos) y cada uno de ellos envía una señal digital, uno o cero (señales ON/OFF), puesto que las neuronas siguen la ley del todo o nada: el potencial de la acción es producido siempre que se alcanza el umbral de disparo de la neurona y es el máximo posible que se puede producir (13).
Las señales digitales de cada ojo se dirigen por medio del nervio óptico hacia al cuerpo geniculado lateral de ambos lados donde hacen sinapsis con las neuronas de las 6 capas neuronales que contienen los cuerpos geniculados. Los cuerpos geniculados laterales reciben además conexiones sinápticas desde los nervios motores oculares (motor ocular común, motor ocular externo y nervio patético) para coordinar la visión con los movimientos oculares y la contracción del iris (12-13). También desde el sistema nervioso autónomo encargado de los procesos de adaptación a la luz y acomodación de la imagen. En los cuerpos geniculados es posible aceptar o rechazar señales digitales que llegan, y por lo tanto las neuronas de los cuerpos geniculados serían la unidad de procesamiento de las señales digitales ópticas (la cpu del sistema óptico). Cada cuerpo geniculado recibe señales de ambos ojos con capacidad para aceptar o rechazar señales (13).
La propiedad de aceptar o rechazar señales es similar al sistema de dirección de una nave espacial o un misil, controlada por sensores de dirección con dos o más computadores programados para que las señales de los sensores que guían el dispositivo sean iguales, y si una de las señales difiere de las otras, la señal defectuosa o errónea es eliminada. Este es un sistema llamado redundante.
Lo mismo ocurriría con las vías ópticas: los dos cuerpos geniculados laterales con sus 6 capas de neuronas y múltiples conexiones sería un sistema redundante neuronal que elimina las señales defectuosas antes de llegar a la corteza cerebral. En el caso de niños con estrabismo, el ojo desviado envía señales defectuosas y las “CPU” de los cuerpos geniculados eliminan esta señal defectuosa que produce disminución de la agudeza visual y que se conoce con el nombre de ambliopía, palabra que se deriva del griego amblys que quiere decir opaco, obtuso, romo, débil.
La misma explicación es apropiada para explicar porque las neuronas de las vías visuales regeneradas no funcionan; cuando estas neuronas retinales inician el proceso de regeneración, envían señales defectuosas y las CPU de los cuerpos geniculados las eliminan. A medida que el proceso de regeneración avanza y mejoran las señales enviadas por las neuronas, la CPU de los cuerpos geniculados continúa eliminándola y esta eliminación puede persistir por mucho tiempo (como puede ocurrir en los casos de NOI), y solo empiezan a funcionar cuando se les obliga por un estimulo intenso como la terapia OOF que elimina las señales del ojo normal o con mejor visión.
En la ambliopía por estrabismo se dice que toda la vía óptica esta normal y que la señal llega a la corteza visual, pero la corteza la descarta. Resultado de una alteración en las conexiones nerviosas retinales y corticales, por falta de un estímulo visual apropiado durante la fase de maduración del sistema visual; como se visualizó en algunos pacientes del estudio la eliminación de la información visual no ocurre en la corteza visual sino de los cuerpos geniculados, ya que la RMf previo a la terapia OFF tiene nula o poca activación cortical, y después de la terapia OOF, aumenta la activación de la corteza visual.
La sensación visual recibida y transducida por la retina, tiene que escalar varios circuitos de transmisión, modulación, procesamiento, percepción y cognición de naturaleza neuronal (42) donde posiblemente existen varios procesos inducibles de mejoría visual aun por descubrir y comprender.
La mejoría en más de la mitad de los pacientes indica que la terapia OOF puede llegar a conformar un proceso específico de rehabilitación visual a través de la mejoría de parámetros concretos de la función visual (como la AV y la representación cortical de la visión).
La literatura es concreta en afirmar que la rehabilitación visual incluye la optometría, la terapia ocupacional y el trabajo social con el fin de incrementar el nivel de funcionamiento en tareas visuales del paciente (43). Sin embargo este trabajo indaga por la posibilidad de ofrecer un posible manejo complementario centrado en el déficit visual neurológico del paciente, reproducible, especifico e intensivo, en pro del restablecimiento (si tiene cabida dicho termino) de la función visual del paciente.
Agradecimientos
A todos los pacientes que aportando su paciencia, dedicación y convicción permitieron desarrollar este nuevo trabajo, que posee más preguntas que respuestas, en cada uno de ellos en pro de encontrar alguna solución a lo que para muchos es irreversible.
REFERENCIAS
- WHO. Visual impairment and blindness. Fact Sheet N°282, June 2012. http://www.who.int/mediacentre/factsheets/fs282/en/index.html (consultado el: 28/08/2012).
- ICD Update and Revision Platform: Change the Definition of Blindness. In WHO http://www.who.int/blindness/en/index.html (consultado: 12/12/2011)
- Ropper AH, Samuels MA. Chapter 13. Disturbances of Vision. Nonneurologic causes of reduced vision. Neurologic causes or reduced vision. In: Ropper AH, Samuels MA, eds. Adams and Victor's Principles of Neurology. 9th ed. New York: McGraw-Hill; 2009. http://www.accessmedicine.com/content.aspx?aID=3631567. Accessed August 29, 2012
- Pascolini D, Mariotti SP. Global estimates of visual impairment: 2010. Br J Ophthalmol. 2012 May; 96(5):614-8.
- WHO. Neurological Disorders: public health challenges. ISBN: 92 4 156336 2. Geneva: World Health Organization; 2006.
- Taylor Kate, Elliott Sue. Interventions for strabismic amblyopia. Cochrane Database of Systematic Reviews. In: The Cochrane Library, Issue 07, Art. No. CD006461. DOI: 10.1002/14651858.CD006461.pub2.
- Adah C, Richman S. Visual dysfunction: occupational therapy. CINAHL Rehabilitation Guide, April 29, 2011.
- Polat U. Restoration of underdeveloped cortical functions: evidence from treatment of adult amblyopia. Restor Neurol Neurosci. 2008; 26(4-5):413-24.
- Mueller I, Mast H, Sabel BA. Recovery of visual field defects: a large clinical observational study using vision restoration therapy. Restor Neurol Neurosci. 2007; 25(5-6):563-72.
- Chierzi S, Fawcett JW. Regeneration in the mammalian optic nerve. Restor Neurol Neurosci. 2001; 19(1-2):109-18.
- Watanabe M. Regeneration of optic nerve fibers of adult mammals. Dev Growth Differ. 2010 Sep; 52(7):567-76.
- Barrett KE, Barman SM, Boitano S, Brooks HL. Chapter 9. Vision. In: Barrett KE, Barman SM, Boitano S, Brooks HL, eds. Ganong's Review of Medical Physiology. 24th Ed. New York: McGraw-Hill; 2012. http://www.accessmedicine.com/content.aspx?aID=56261417. Accessed August 29, 2012.
- Kandel E, Schwartz JH, Jessell TM. Principles of Neural Science. 4 Ed. Mc-Graw Hill. 2000.
- Veselý P, Synek S. Repeatability and reliability of the visual acuity examination on logMAR ETDRS and Snellen chart. Cesk Slov Oftalmol. 2012 May; 68(2):71-5.
- Rosser DA, Cousens SN, Murdoch IE, Fitzke FW, Laidlaw DA. How sensitive to clinical change are ETDRS logMAR visual acuity measurements? Invest Ophthalmol Vis Sci. 2003 Aug; 44(8):3278-81.
- Kniestedt C, Stamper RL. Visual acuity and its measurement. Ophthalmol Clin North Am. 2003 Jun; 16(2):155-70.
- CNS 2006 Guide Laines, Journal Clinical Neurophysiology, vol 23, No. 21-2006.
- Ashburner J. SPM: a history. Neuroimage. 2012 Ago 15; 62(2):791-800. http://www.controlled-trials.com/
- Nelms AC. New visions: collaboration between OTs and optometrists can make a difference in treating brain injury. OT Pract. 2000; 5(15):14-18.
- McKay DA, Michels D. Facing the challenge of macular degeneration: therapeutic interventions for low vision. OT Pract. 2005; 10(9):10-15.
- Hellerstein LF, Fishman BI. Collaboration between occupational therapists and optometrists. OT Pract. 1999; 4(5):27-30.
- Hauser SL, Harrison TR. Harrison Neurology in clinical medicine. New York: McGraw-Hill, 2006.
- Arango K, Mejia LF, Abad JC. Fundamentos de Cirugía: Oftalmología. 1ª Ed. CIB. 2001.
- U.S. National Library of Medicine and National Institutes of Health. Medical Subject Heading Terms (MeSH) databases. PubMed. In http://www.ncbi.nlm.nih.gov/sites/entrez
- Aminoff M, Greenberg D, Simon R. Neurología Clínica. 6ª ed. Manual Moderno; 2006.
- Ropper AH, Brown RH. Adams and Victor´s. Principles of Neurology. Eighth Edition. New York: Mc Graw-Hill, 2005.
- Arango K, Mejia LF, Abad JC. Fundamentos de Cirugía: Oftalmología. 1ª Ed. CIB. 2001.
- U.S. National Library of Medicine and National Institutes of Health. Medical Subject Heading Terms (MeSH) databases. PubMed. In http://www.ncbi.nlm.nih.gov/sites/entrez
- Hebb D. The effect of early experience on problem solving at maturity. Am Psychol 1947; 2:737-745.
- Mary L. Dombovy. Introduction: the evolving field of Neurorehabilitation. Continuum Lifelong Learning Neurol 2011; 17(3):443-448.
- Stein DG, Hoffman SW. Concepts of CNS plasticity in the context of brain damage and repair. J Head Trauma Rehabil. 2003 Jul-Aug; 18(4):317-41.
- Johansson BB. Brain plasticity in health and disease. Keio J Med. 2004 Dec; 53(4):231-46.
- Dobkin B. The Clinical Science of Neurological Rehabilitation. Oxford University Press, 2003.
- Hebb D. The effect of early experience on problem solving at maturity. Am Psychol 1947; 2:737-745?
- Hlustík P, Mayer M. Paretic hand in stroke: from motor cortical plasticity research to rehabilitation. Cogn Behav Neurol. 2006 Mar; 19(1):34-40.
- Duffau H. Brain plasticity: from pathophysiological mechanisms to therapeutic applications. J Clin Neurosci. 2006 Nov; 13(9):885-97.
- Nakai J, Yoro T, Muto S. Neurogenesis. Tanpakushitsu Kakusan Koso. 1966 Oct; 11(11):1085-7.
- Bath KG, Lee FS. Neurotrophic factor control of adult SVZ neurogenesis. Dev Neurobiol. 2010 Apr; 70(5):339-49.
- Deng W, Aimone JB, Gage FH. New neurons and new memories: how does adult hippocampal neurogenesis affect learning and memory? Nat Rev Neurosci. 2010 May; 11(5):339-50.
- Deng W, Aimone JB, Gage FH. New neurons and new memories: how does adult hippocampal neurogenesis affect learning and memory? Nat Rev Neurosis. 2010 May; 11(5):339-50.
- Greifzu F, Schmidt S, Schmidt KF, Kreikemeier K, Witte OW, Löwel S. Global impairment and therapeutic restoration of visual plasticity mechanisms after a localized cortical stroke. Proc Natl Acad Sci U S A. 2011 Sep 13; 108(37):15450-5.
- Acheson J. Blindness in neurological disease: a short overview of new therapies from translational research. Curr Opin Neurol 2010 Feb; 23(1):1-3.
- McCabe P, Nason F, Demers Turco P, Friedman D, Seddon JM. Evaluating the effectiveness of a vision rehabilitation intervention using an objective and subjective measure of functional performance. Ophthalmic Epidemiol. 2000; 7(4):259-270.
Recibido: Diciembre 15, 2014
Aprobado: Marzo 10, 2014
Direcciones de Correspondencia:
Juan Camilo Suárez, MD. Instituto Neurológico de Colombia.
Calle 55 No.46-36.
Medellín,Colombia.
Página web: www.neurologico.org.co