CARACTERIZACIÓN DE STAPHYLOCOCCUS AUREUS AISLADOS DEL PERSONAL DE SALUD DE UN HOSPITAL DE MEDIANA COMPLEJIDAD DE LA CIUDAD DE CALI EN EL AÑO 2012
Mónica Chávez1, Lida Inés Mancilla2, Armando Lucumí 3
RESUMEN
Introducción. Los estudios de Staphylococcus aureus en personal de salud permiten reducir su diseminación en las infecciones intrahospitalarias y mejorar la calidad de vida de los pacientes. La colonización por S. aureus en personal de salud de un hospital de tercer nivel, se evaluó caracterizándolo fenotípica y molecularmente. Métodos: Una población de 62 trabajadores y 216 estudiantes de medicina, mediante análisis del antibiograma y polimorfismo del gen agr. Resultados: S. aureus colonizó el 30,1% del personal; 17,5% trabajadores, 33,8% estudiantes. El 10,8% fueron meticilino-resistentes, 9 aislados presentaron el gen mecA, ocho resistentes a oxacilina y cefoxitina (88,9% de sensibilidad). La variante II considerada de origen hospitalario, se presentó en el 7,7% de aislados, el agr tipo III de origen comunitario en el 27,6% de aislados meticilino-sensibles. Conclusión. El personal hospitalario presentó colonización por S. aureus de origen hospitalario y comunitario. Es necesario adoptar medidas profilácticas e higiénicas para evitar diseminación y prevenir infecciones.
Palabras Clave. Staphylococcus aureus, antibióticos, portadores asintomáticos, personal de salud, SARM.
ABSTRACT
CHARACTERIZATION OF STAPHYLOCOCCUS AUREUS PRESENT IN HEALTH PERSONNEL OF A MID-COMPLEXITY HOSPITAL OF THE CITY OF CALI, 2012
Introduction. Studies of Staphylococcus aureus in health personnel reduce its spread in nosocomial infections and improve the quality of life of patients. The colonization state by S. aureus in health personnel of a tertiary hospital was performed by phenotypic and molecular characterization. Methods: A population of 62 health workers and 216 medical students were evaluated by analysis of antibiotic susceptibility and polymorphism of agr gene. Results: S. aureus colonized 30.1% of staff individuals, 17.5% of workers, 33.8 % of students. 10.8% were methicillin- resistant, 9 isolated harbored mecA gene, and eight were resistant to oxacillin and cefoxitin (88.9 % sensitivity). The agr II associated with hospital source was in 7.7 % of the isolates and agr type III -associated with a community source- was found in 27.6 % of meticillin-sensitive isolates. Conclusion. Hospital health staff showed colonization by S. aureus of both community and hospital sources. To prevent their spread and infections, prophylactic and hygienic measures are necessary.
Keywords. Staphylococcus aureus, Antibiotics, Asymptomatic carriers, health personnel, MRSA
INTRODUCCIÓN
El S. aureus es un patógeno habitual causante de infecciones nosocomiales, especialmente las cepas SARM (1-5). Estas cepas son resistentes a todos los antibióticos β-lactámicos, lo que limita significativamente las opciones de tratamiento. Las infecciones nosocomiales se asocian con una mayor estancia hospitalaria, la administración prolongada de antibióticos y mayor costo que las infecciones causadas por cepas susceptibles a la meticilina (6-9). En los últimos años se ha reportado también cepas de SARM asociadas a infecciones adquiridas en la comunidad (SARM-AC) con características microbiológicas y clínicas diferentes a las nosocomiales con más posibilidades para establecerse en la comunidad al realizar una diseminación en la comunidad y en el ambiente hospitalario (10). Se detectan principalmente en la población joven sin factores de riesgo y a pesar de desencadenar infecciones graves y más agresivas de la piel y en tejidos blandos, presentan mayor opción farmacológica de erradicación que las nosocomiales (11-14).
Los ambientes hospitalarios con superficies contaminadas por S. aureus, los pacientes y los trabajadores de la salud colonizados por esta bacteria, pueden diseminar el patógeno de ambos orígenes a otros pacientes y trabajadores sanitarios (15-19). El conocimiento del origen de las bacterias presentes en el personal de salud y en el ambiente hospitalario, es entonces una prioridad importante, por las diferencias epidemiológicas, clínicas y farmacológicas que presentan para optimizar así el tratamiento, reduciendo los costos y el tiempo de
hospitalización, al igual que ajustar las medidas de higiene y de contención, que han mostrado su eficacia en la reducción de la transmisión y el control de la propagación (20).
Para determinar el origen y el patrón de diseminación de los aislados bacterianos se han empleado aproximaciones fenotípicas como el patrón de susceptibilidad a los antibióticos (antibiograma), que constituye una herramienta para evaluar el origen de las bacterias que están generando el brote epidémico (21).
Una mayor aproximación del origen de estas cepas, es la caracterización con marcadores moleculares. El polimorfismo en el gen agr, permite determinar la variabilidad y el origen de los aislados. En este sentido se han definido hasta la fecha, cuatro variantes del gen, denominadas como grupos I a IV, de acuerdo a su patrón genético (22). Los estudios epidemiológicos han establecido que los aislados pertenecientes al grupo III se relacionan con infecciones asociadas a la comunidad, mientras que el grupo II se detecta predominantemente en cepas aisladas a nivel intrahospitalario (23, 24).
En el presente estudio se determinó la presencia de aislados de S, aureus en portadores asintomáticos del personal de salud de una institución hospitalaria de Tercer nivel, de la ciudad de Cali en el año 2012, mediante la una caracterización fenotípica, se determinó la prevalencia de los aislados SARM y mediante la Reacción en Cadena de la Polimerasa (PCR) se estimó las variantes genéticas del gen agr.
1.PhD. Profesor Dedicación Exclusiva. Facultad de Salud. Universidad Santiago de Cali, Investigador Grupo de investigación GEFME.
2.PhD. Profesor Dedicación Exclusiva. Facultad de Salud. Universidad Santiago de Cali, Líder Investigador Grupo de investigación GEFME.
MATERIALES Y MÉTODOS
Obtención de las Muestras.
Se realizó un estudio de prevalencia en el personal de salud y en estudiantes expuestos al ambiente hospitalario del hospital San Juan de Dios, una Institución de tercer nivel de la ciudad de Cali. El estudio se desarrolló en la Sala de Recuperación de cirugía (SR) y la Unidad de Cuidados Intermedios (UCIN) que cuenta con 220 camas. La población que ingresa a estas salas corresponde a 496 personas, representadas en 150 profesionales de la salud y 346 estudiantes en prácticas, el tamaño de la población fue calculada para un error de 4%, un nivel de 95% de confianza y un valor crítico o z de 1.96.
La muestra de estudio que comprendió 278 personas, se distribuyó en 62 profesionales de salud de la institución y 216 estudiantes de práctica. El grupo de estudiantes fue discriminado de acuerdo al tiempo de permanencia diaria en el área de práctica: 31 pertenecientes al tercer año (3 horas diarias de prácticas) , 69 correspondientes al cuarto año (5 horas de práctica), 55 del quinto año (8 horas de práctica) y 61 que cursaban el sexto año (12 horas de prácticas). La distribución por género del grupo de estudio fue de 162 mujeres y 116 hombres. En el grupo de estudiantes se evaluaron 122 mujeres y 94 hombres, mientras la distribución en el grupo de profesionales fue 40 mujeres y 22 hombres. Este estudio fue avalado por el comité científico de ética y bioética de la Universidad Santiago de Cali, y realizado teniendo en cuenta las normas técnicas, científicas y éticas establecidas en el decreto 008430 de 1993 del ministerio de Salud y Protección Social de la República de Colombia.
Para el aislamiento de S. aureus se colectaron muestras de secreción nasal mediante la técnica de hisopado, en personas que no habían recibido tratamiento antibiótico en los últimos tres meses y no presentaban enfermedades respiratorias.
Condiciones de Cultivo.
Las muestras se sembraron en agar salino manitol rojo de fenol (Oxoid Ltd., Hampshire, United Kingdom) y se incubaron por 24 a 48 horas a 37oC. La identificación de S. aureus se efectúo por la fermentación del manitol en el agar selectivo (coloración amarilla del medio), la reacción positiva de la prueba de la coagulasa y la observación al microscopio de cocos Gram positivos en racimos a partir de un extendido directo con tinción de Gram, comparando con los valores estandarizados para la cepa control de S. aureus ATCC 25923. El S. aureus se diferenció del estafilococo coagulasa negativo con el empleo de la prueba de la DNasa.
Pruebas de Sensibilidad a los Antibióticos
La prueba de sensibilidad antimicrobiana se realizó empleando el método de difusión en agar según las recomendaciones del Clinical and Laboratory Standards Institute (CLSI) (25). Las colonias confirmadas como S. aureus se suspendieron en caldo de triptona hasta alcanzar la turbidez estandarizada (0.5 D.O. de Mc Farland). La suspensión se inoculó en medio Mueller-Hinton (Scharlau Chemie S.A) y posteriormente se colocaron los sensidiscos, para las pruebas de los antibióticos. Se evaluó la sensibilidad a oxacilina (OXA, 1 μg), cefoxitina (FOX, 30 μg), cefalexina (CEF, 30 µg), gentamicina (GEN, 10 μg), ciprofloxacina (CIP, 5 μg), eritromicina (ERI, 15 μg), clindamicina (CLI, 2 μg), trimetoprim-sulfametoxazol (SXT 1,25/23,75 μg), tetraciclina (TCY, 30 μg), cloranfenicol (CHL, 30 μg), vancomicina (VAN, 30 μg), imipenem (IMP, 10 µg) y penicilina (PEN, 10U) (Oxoid). Los cultivos se realizaron por duplicado a 37oC por 24 horas. Para verificar la acción de los sensidiscos se determinó el diámetro del halo de sensibilidad de acuerdo a los estándares de la CLSI (25). Como control de sensibilidad se empleó la cepa de S. aureus ATCC 25923. La determinación de fenotípica de los aislados SARM se realizó de acuerdo a la resistencia simultánea observada a los antibióticos oxacilina y cefoxitina.
Técnicas Genético-Moleculares.
El ADN de las cepas referencia y de los aislados bacterianos se extrajo empleando el protocolo modificado de Cheng et al, 2006 (26), que se basa en la lisis bacteriana utilizando solución de sacarosa al 25%, 10 mg/ml de lisozima y 1 mg/ml de proteinasa K, a 56oC.
Para establecer a nivel molecular la resistencia a meticilina y vancomicina, se amplificaron los genes mecA y vanA, siguiendo el protocolo reportado por Tokue Y et al (27) y Finks et al (28) respectivamente. Se amplificó una banda 1334 pb del gen mecA empleando los cebadores MR1, 5’ (478)-GTGGAATTGGCCAATACAGG-(497) 3’ y MR2, 5’ (1816)-TGAGTTCTGCAGTACCGGAT-(1797) 3’. Un fragmento de 732 pb del gen vanA se amplificó utilizando los cebadores A1: 5’ (175)-GGGAAAACGACAATTGC-(191) 3’ y A2: 5’ (907)-GTACAATGCGGCCGTTA-(891) 3’.
Para determinar los cuatro grupos agr se amplificaron de manera independiente fragmentos de 440 bp, 572 bp, 406 bp y 588 pb, respectivamente, empleando un juego de cebadores, conformados por el cebador universal en sentido, con la secuencia agr 5'-GTCACAAGTACTATAAGCTGCGAT-3', y uno de los cebadores específicos para cada grupo en anti-sentido: agrI 5'-GTATTACTAATTGAAAAGTG CCATAGC-3', agrII 5'-GTATTACTAATTGAAA AGTGCCATAGC-3, agrIII 5'-CTGTTGAAAAAGTCAACTAAAAGCTC-3' y agrIV 5'-CGATAATGCCGTAATACCCG-3´(22).
Las reacciones de PCR se realizaron en un volumen de 50 μl de una mezcla de reacción compuesta por MgCl2 25 mM, 200 μM de los cuatro dNTP’s, 0,5U de Taq DNA polimerasa (Invitrogen®), 10pmol de cada cebador y 5μl de solución de ADN en un termociclador GeneAmp PCR system 2400®. Los productos de amplificación fueron visualizados después de la separación en el gel de agarosa al 2%, teñido con Bromuro de etídio, bajo luz ultravioleta. Como control positivo de amplificación por PCR de los genes mec y agr se tomó una cantidad de ADN similar de la cepa control de S. aureus y para el gen vanA de una cepa de Enterococos. Como control negativo de las reacciones se tomaron las mezclas de reacción sin ADN y una cantidad de ADN similar de la cepa ATCC 25922 de Eschericchia coli.
Análisis estadísticos.
La unidad de análisis fue el aislado bacteriano obtenido del hisopado nasal, del cual se registró las características microbiológicas y moleculares y se relacionaron con las características sociodemográficas de los portadores como el género y ocupación. En el grupo de estudiantes se registró además el nivel académico (año). Las variables microbiológicas fueron la presencia de S. aureus, Staphylococcus-coagulasa-negativo (SCN) y el grado de sensibilidad o resistencia a cada antibiótico evaluado. Estas últimas variables fueron categorizadas en diferentes grados así: resistencia (1), sensibilidad intermedia (2) y sensibilidad (3), de acuerdo a los estándares para cada antibiótico establecidos para S. aureus. Las variables moleculares fueron presencia de los genes mecA, van A y las variantes del agr. Se construyó una base de datos con las variables de interés, empleando el programa ExcelTM.
Los valores de las variables cuantitativas fueron expresados como porcentaje relativo de la población. La población de estudio se separó en dos grupos de acuerdo a la ocupación: profesionales de la salud y estudiantes. La presencia de S. aureus fue determinada como porcentaje de acuerdo a la ocupación, el tiempo de permanencia en el grupo de estudiantes y el género. En el grupo de colonizados por S. aureus se realizó análisis de asociación entre las distintas variables como el fenotipo de resistencia a los diferentes antibióticos, la presencia del gen mecA y la variante genética de agr, teniendo en cuenta la ocupación. En el grupo de estudiantes se discriminó la multirresistencia de acuerdo al tiempo de permanencia teniendo en cuenta el número de horas diarias de práctica, desde 3 horas para los estudiantes de IV año, 5 horas para V año, 8 horas para VI año. Se determinó la prevalencia de las diferentes variantes de agr en los fenotipos SARM y SASM.
La significancia en las diferencias en la frecuencia de las variables entre los grupos establecidos fue determinada por análisis estadístico, empleando la prueba de chi-cuadrado de Pearson. La significancia estadística fue asignada para valores de p<0,05, considerando un nivel de confianza del 95% (alfa) y un error (beta) de 5%. Los análisis estadísticos se realizaron empleando el paquete estadístico SPSS vs 20.0.
RESULTADOS
El 64% (178/278) del personal de salud se encontró colonizado por Staphylococcus coagulasa negativo. Estos aislados se presentaron en el 70,4% de los estudiantes y en el 41,9% de los profesionales. Esta diferencia fue estadísticamente significativa (p=0,0000). En el caso de los aislados de S. aureus, el 30,1% (65/216) de los participantes mostraron estar colonizados. En los estudiantes se encontró un 33,8% de colonización y un 17,7% en el grupo de profesionales, sin embargo estos valores no representan diferencia estadísticamente significativa (p= 0,0152)
Características Fenotípicas de los Aislados de S. aureus.
El 12,3% (8/65) de los aislados presentaron resistencia a oxacilina (SARO), cinco de estos aislados (62,5%), se encontraron en los estudiantes. Por otra parte, en siete aislados (10,8%) se encontrón características fenotípicas de aislados SARM, el 71,4% (5/7) se aisló de los estudiantes; dos aislados se encontraron en estudiantes que cursaban IV año, dos en estudiantes de V año y un aislado en un estudiante de VI año.
En el grupo de los profesionales se encontró el 18,2% (2 /11) de colonización por SARM, un aislado con resistencia a oxacilina (SARO) y sensibilidad a cefoxitina y otro más con sensibilidad intermedia a oxacilina y resistencia a cefoxitina.
La multirresistencia a los antibióticos en los aislados SARM, incluyó los β-lactámicos, macrólidos, aminoglucósidos y quinolonas.En tres de estos aislados se determinó un halo de sensibilidad disminuida a vancomicina (Tabla.1).
Los aislados sensibles a meticilina (SASM) también presentaron características de multirresistencia a los antibióticos. En este sentido, se detectó resistencia simultánea a cuatro antibióticos en el 21,5% (14/65) de los aislados, a cinco antibióticos en el 16,9% (11/65) y a más de 5 antibióticos en el 35,4% (23/65) de los aislados. En los aislados SASM se encontró una sensibilidad disminuida a vancomicina en el 38,5% (25/65), todos ellos se encontraron en los estudiantes. El menor porcentaje de resistencia en estos aislados se observó para los antibióticos imipenem (22,8%) y ciprofloxacina (19,3%) (Tabla 1).
El mayor número de aislados con resistencia a oxacilina y a ciprofloxacina se registró en el grupo de los trabajadores del hospital con un 27,7% y 45.5%, respectivamente; mientras que los estudiantes que se encontraban en III año y presentan el menor tiempo de permanencia en estas salas (3 horas) no presentaron aislados con resistencia a estos dos antibióticos.
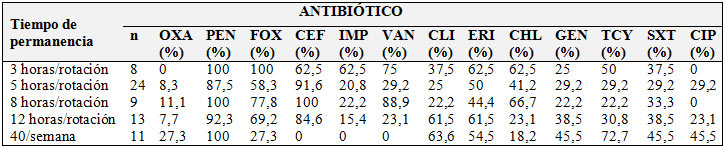
Tabla No. 1. Porcentaje de resistencia a los antibióticos de S. aureus resistente y sensible a meticilina 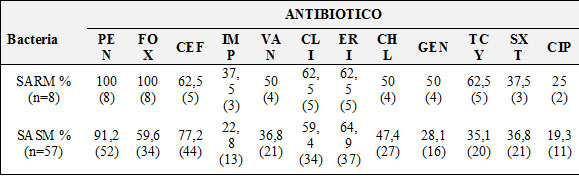 |
Porcentaje de aislados de S. aureus resistente a meticilina (SARM) y S. aureus sensible a meticilina (SASM) con resistencia a los antibióticos evaluados. Los aislados fueron obtenidos de los profesionales de salud (enfermeros, médicos, fonoaudiólogos, terapeutas respiratorios y auxiliares de enfermería). Penicilina(PEN), cefoxitina (FOX), cefalexina (CEF), imipenem (IMP), vancomicina (VAN), clindamicina (CLI), eritromicina (ERI), cloranfenicol (CHL), gentamicina (GEN), tetraciclina (TCY), trimetoprima/sulfametoxazol (SXT), ciprofloxacina (CIP), y Oxacilina (OXA).
La misma tendencia se observó para los aislados con resistencia a clindamicina y gentamicina, el mayor número de estos aislados se detectó en los estudiantes de VI año (62,5% y 25%, respectivamente) y en los trabajadores (18,2% y 45,5%, respectivamente), estos aislados se detectaron en menor porcentaje en los estudiantes de III año (37,5% y 25%, respectivamente). Sin embargo, este grupo de estudiantes presentó el mayor número de aislados con resistencia a imipenem con un 62,5% y ningún aislado se detectó en los trabajadores del hospital (tabla 2). A pesar de estas diferencias, no es posible establecer asociaciones con significancia estadística, debido al pequeño número de muestra y la diferencia entre los grupos, lo que no permite alcanzar un poder estadístico mayor al 80% en la prueba.
Análisis Molecular de los Aislados de S. aureus.
El gen mecA se detectó en sólo en siete aislados SARM (cinco en estudiantes y dos en los profesionales). Este gen también se detectó en dos aislados presentes en los trabajadores, uno de ellos, fue un aislado SARO con sensibilidad a cefoxitina, y el otro aislado con sensibilidad intermedia a oxacilina y resistencia a cefoxitina. Por otra parte, 25 aislados presentaron sensibilidad disminuida a vancomicina; sin embargo, en ninguno de estos se detectó el gen vanA, este gen es el principal determinante que confiere resistencia a este antibiótico.
Tabla No. 2. Distribución de S. aureus con resistencia a los antibióticos de acuerdo al tiempo de permanencia del personal en las salas el Hospital.
|
Porcentaje de aislados de S. aureus con resistencia a los antibióticos en cada grupo de participantes evaluados, con diferente tiempo de permanencia en las salas de recuperación y de la Unidad de Cuidados Intermedios. Los estudiantes de III año (permanecen 3 horas), estudiantes de IV año (5 horas), estudiantes de V año (8 horas), estudiantes de VI año (12 horas) y los profesionales (todos los días por 8 horas)
Distribución de los grupos agr en los aislados de S. aureus.
En el análisis de las variantes del gen agr, 40 aislados (61,5%) amplificaron el agr I, dos de ellos en los aislados SARM (28,6%). Cinco aislados (7,7%) amplificaron para el agr II, todos ellos son SARM y presentan el gen mecA. La diferencia en la prevalencia del agr II entre los aislados SARM y SASM fue estadísticamente significativa (p=0.0000).
El gen agr III se detectó en 16 aislados SASM (27,6%). La prevalencia de este grupo entre los aislados SASM no representó una significancia estadísticamente comparada con los aislados SARM (p= 0,1095) (tabla 3).
El agr IV no se detectó en los aislados y 4 aislados no presentaron amplificación para el gen agr. El agr I se distribuyó en los aislados de todos los grupos de estudio, aunque se presentaron diferencias, no fueron significativas estadísticamente. Los estudiantes de tercer año sólo presentaron este grupo. El agr II se detectó en los aislados de los estudiantes de IV, V y VI año. El agr III se detectó en todos los grupos evaluados con excepción de los estudiantes de III año. El grupo agr I y III s e presentó en los mismos porcentajes en los estudiantes de IV año; en los estudiantes de V, VI año y en los trabajadores del hospital se presentó en mayor porcentaje el agr I (tabla No.4).
Tabla No.3. Grupos agr presentes en los aislados de S. aureus 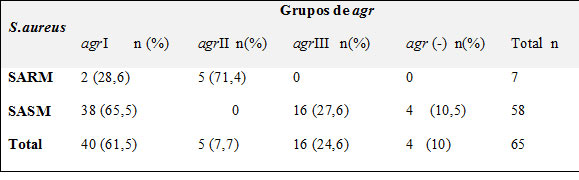 |
Distribución de los grupos agr entre los aislados de S. aureus con resistencia a meticilina (SARM) y S. aureus sensible a meticilina (SASM) en los estudiantes de medicina y trabajadores en el área de la salud del hospital. Se detectaron tres grupos agr (agr I, agr II, agr III). El agr I se encontró en el mayor número de los aislados de S. aureus, detectándose en cepas SARM y SASM (p=0.0577, a 95%). El agr II solo estuvo presente en aislados SARM (p=0.0000, a 95%) y el agr III se determinó sólo en los aislados SASM (p= 0,1095,a 95%).
Tabla No.4. Grupos agr presentes en los Estudiantes de Medicina y los Profesionales de la Salud 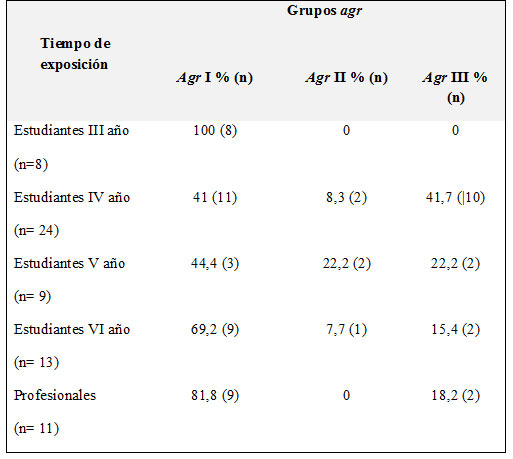 |
Porcentaje de los grupos agr entre los aislados de S. aureus con resistencia a meticilína SARM, de estudiantes de medicina y los profesionales de la salud del hospital. En los estudiantes se hace una discriminación por año académico, que permite determinar tiempo de exposición. P>0,05
DISCUSIÓN
La prevalencia e incidencia de portadores de S. aureus a nivel mundial, varía de acuerdo a la población estudiada. Aproximadamente, el 80% de las personas sanas son portadoras de S. aureus, siendo la mayoría, portadores intermitentes, entre los que se destacan los portadores nasales que hacen parte del personal de la salud (16-18).
En nuestro estudio encontramos que el 30, 1% del personal de salud evaluado estuvo colonizado por S. aureus. La diseminación de esta bacteria a partir del personal de salud, ha sido el enfoque de numerosas investigaciones que buscan mejorar la calidad de vida de los pacientes. (18, 29). En el caso de los trabajadores del hospital, encontramos una colonización del 17,7%, aunque este valor es mayor que el reportado en estudios de Medellín (6,7%) (30) y del Ecuador (12%) (31), resulta ser más bajo que los reportados en un hospital de Santander en el año 2011 con el 72% de personal colonizado (32) y en médicos de los Estados Unidos con un 23,6% de prevalencia (33).
Análisis Fenotípico de los Aislados de S. aureus.
La detección fenotípica de los aislados de SARM se basó en la resistencia simultánea a los antibióticos oxacilina y cefoxitina en las pruebas de sensibilidad a los antibióticos. Datta et al, 2011 (34), evaluaron varios métodos fenotípicos para detectar los SARM y encontraron que la prueba con el disco de cefoxitina tuvo una sensibilidad del 98,5% y una especificidad del 100% comparado con la sensibilidad obtenida con los discos de oxacilina (91,4% y 99,2%, respectivamente). En nuestro estudio, todos los aislados SARM presentaron el gen mecA; sin embargo, en un aislado con resistencia a cefoxitina y sensibilidad intermedia a oxacilina, y en otro, con sensibilidad a cefoxitina y resistencia a oxacilina se detectó este gen, para una sensibilidad a estos dos antibióticos del 88, 9%.
Los datos de sensibilidad intermedia a oxacilina deben tomarse con precaución, porque puede indicar un probable mecanismo de resistencia en desarrollando. Resultados similares fueron reportados por Tokue y col, 1992 (27), quienes encontraron la presencia del gen mecA en seis muestras de S. aureus con sensibilidad intermedia a oxacilina.
En los estudios de prevalencia de los aislados SARM, se estima que el porcentaje de colonización en el personal de salud varía del 1% al 12% (20), con valores considerados bajos como los reportados en hospitales del Ecuador (1%) (31), intermedios como los reportados en los Estados Unidos (6%) (33) y Chile (5.2%) (35) a valores altos como los registrados en la India con un 35% (36).
La prevalencia del 10,8% de SARM en los trabajadores, se ubica en un valor intermedio, con una valor cercano (11,6%) al registrado en el hospital de Santander (32). Además, no encontramos relación con el cargo desempeñado por el profesional de la salud, en concordancia con lo encontrado en otros estudios (32, 33, 37).
Sin embargo, en los estudiantes de medicina, los aislados SARM y SASM se detectaron con un valor alto de colonización (33,8%), esto indica que los estudiantes de medicina deben ser tenidos en cuenta en los programas de control de la infección hospitalaria. Datos muy cercanos de prevalencia en los estudiantes del área de la salud fueron encontrados en otros estudios realizados en Colombia (38, 39), Estados Unidos (33, 37), países de Latinoamérica (40, 41), Europa (42, 43) y Asia (44,45).
Aunque no encontramos relación entre el tiempo que permanecen los estudiantes en prácticas clínicas en las salas del hospital y la colonización por los aislados SARM y SASM, un estudio realizado en España (42) , si encontró un aumento en la colonización por SASM de forma significativa entre los estudiantes de medicina durante su estancia en el hospital. Sería necesario realizar un estudio que involucre a los estudiantes que rotan en otras salas del hospital.
Los siete aislados SARM no sólo presentaron resistencia a los antibióticos β-lactámicos, también se determinó que son resistentes a clindamicina, tetraciclina, ciprofloxacina, gentamicina, trimetroprim-sulfametaxol, incluso, algunos de estos aislados presentaron sensibilidad disminuida a vancomicina. Cinco de estos aislados que se encontraron en el grupo de los estudiantes, presentaron resistencia a todos los antibióticos evaluados, lo cual es compactible con fenotipo nosocomial (SARM-AH) (21). Estos aislados no se detectaron en los estudiantes de tercer año, por lo que la formación sobre higiene de manos debería impartirse antes de que los estudiantes inicien sus prácticas en el hospital.
De otra parte, los aislados SARM presentes en el grupo de trabajadores del hospital presentaron sensibilidad a los antibióticos β-lactámicos cefalexina e imipenem, vancomicina, eritromicina y trimetroprim-sulfametoxazol, pero resistencia a clindamicina, fluoroquinolonas, y tetraciclina, lo que hace compactibles con un fenotipo sugerente de SARM-AC (46). Es importante tener en cuenta, la detección de Staphylococcus coagulasa negativos en nuestro grupo de estudio, porque representa un reservorio para la transferencia horizontal de genes, concretamente el gen mecA, a S. aureus, lo que favorecería el mantenimiento de cepas SARM en el personal colonizado que labora en el hospital.
Los aislados multirresistentes, también se determinó en los SASM que colonizan los profesionales de la salud y los estudiantes en práctica. Varios de estos aislados,pueden estar evolucionado en respuesta a presiones selectivas ejercidas en la microflora residente en los pacientes y en el personal de salud. Estos aislados presentan sensibilidad variable a clindamicina, fluoroquinolonas, trimetroprim-sulfametoazol y aminoglicósidos y resistencia a los antibióticos β-lactámicos principalmente, penicilina, cefalexina y cefoxitina, lo que los hacen compactible con un fenotipo de origen comunitario (13).
Análisis Moleculares de los aislados de S. aureus
Los cinco aislados SARM que se encontraron colonizando a los estudiantes, se ubicaron en el grupo agr II y se consideran compactibles con un origen hospitalario (22, 47, 48). Estos aislados sólo estuvieron presentes en los estudiantes de cuarto año en adelante, lo que refuerza la idea que la higiene de manos y las medidas de contención están fallando en el grupo de estudiantes que encuentran en prácticas clínicas.
Por otra parte, los 16 aislados SASM se ubicaron en el grupo agr III y se relacionan con un origen comunitario. Estos aislados se han encontrado también en aislados SARM-AC y de pacientes con el síndrome del choque tóxico (47).
El mayor número de aislados (65,5%) se ubicaron en el grupo agr I, estos resultados son concordantes con los obtenidos en otros estudios, donde determinan que es el grupo más abundante (22, 47, 48). En estos aislados se encontró dos SARM y dos con el gen MecA, todos presentes en los trabajadores del hospital.
Otro aspecto importante es la prevalencia de cepas SARM con sensibilidad disminuida a vancomicina (h-VISA), la cual varía mucho según las distintas publicaciones, pasando del 0% a más del 50% (5, 28). En nuestro estudio se detectó que un 38,5% de los aislados SARM y SASM eran h-VISA. De acuerdo a los resultados obtenidos por el grupo de Aguilar et al (50), sólo un 10% de los aislados SARM presentan h-VISA. Moise-broder et al (49) mostró que el grupo agr II en los asilados SARM predice el fracaso de la terapia de vancomicina, lo que explicaría al sensibilidad disminuida a vancomicina detectada en nuestros aislados
Sin embrago, la determinación de aislados h-VISA requiere técnicas y condiciones que no se realizan en la práctica diaria de los laboratorios de microbiología. En nuestro caso, la amplificación específica por PCR no detectó el gen vanA, que es el principal marcador que le confiere resistencia a vancomicina en S. aureus. Por lo que la evaluación de sensibilidad a vancomicina por el antibiograma que empleamos no fue el adecuado, en este caso los protocolos recomiendan emplear el método de dilución para determinar el CIM y confirmar la resistencia a nivel fenotípico.
CONCLUSIONES
Se evidenció la colonización en el personal de salud que rota en las salas de recuperación y UCIN con aislados SARM y SASM multirresistente a los antibióticos, principalmente a los β-lactámicos, fluoroquinolonas, aminoglicósidos y macrólidos.
El uso inadecuado de barreras de protección, la asepsia deficiente, por parte del personal e incluso el mal uso de antibióticos en cuanto a dosis o tiempo de duración, hacen que el paciente atendido por personal colonizado tenga un riesgo mayor de sufrir infecciones por el S. aureus asociado a la comunidad o el de origen intrahospitalario.
Se evidenció además que los estudiantes de tercer año, fueron el único grupo que presenta el menor número de aislados resistentes a los antibióticos, carecen de SARM y agr II asociado al hospital. Lo que indica que se debe realizar énfasis en la educación de adopción de medidas preventivas en el primer año, pero continuar reforzando y controlando estas medidas en los años posteriores.
Los estudiantes de IV a VI año presentan aislados con los grupos agr II y III y los trabajadores del hospital con aislados de los grupos agr I y III, lo que indica una falla en la aplicación de las medidas de contención.
Se recomienda realizar actividades de educación a los estudiantes de los primeros años a través de una guía de actuación para medidas de prevención y un protocolo con normas de seguimiento obligatorio para los estudiantes y el personal del hospital.
Agradecimientos.
El grupo de investigación en Genética, Fisiología y Metabolismo (GEFME) agradece el apoyo al cuerpo científico y administrativo del Hospital San Juan de Dios por facilitar realizar el estudio y al director del Programa de Medicina Louis Woolley por el apoyo logístico.
Financiación: El apoyo financiero para la realización de este estudio fue dado por la Dirección General de Investigaciones (DGI) de la Universidad Santiago de Cali.
Conflictos de interés: Ninguno declarado.
REFERENCIAS
- Lorette G, Beaulieu P, Allaert FA, Mahmoudi A, Jarlier V. Superficial community-acquired skin infections: prevalence of bacteria and antibiotic susceptibility in France. J Eur Acad Dermatol Venereol. 2009; 23:1423–1426.
- Wertheim HF, Vos MC, Ott A. Risk and outcome of nosocomial Staphylococcus aureus bacteremia in nasal carriers versus non-carriers. Lancet 2004; 364: 703–05.
- Cabrera CE, Gómez RF, Zuñiga AE, Corral RH, López B, Chavez M. Epidemiology of nosocomial bacteria resistant to antimicrobials. Colomb Med. 2011; 42(2): 117-125.
- Nimmo G, Bell J, Mitchell D, Gosbell I, Pearman J. Antimicrobial resistance in Staphylococcus aureus in Australian teaching hospitals, 1989-1999. Microb Drug Resist 2003; 9: 155-160.
- Arias CA, Reyes J, Zúñiga M, Cortés L, Cruz C, Rico L, et al. Multicentre surveillance of antimicrobial resistance in enterococci and staphylococci from Colombian hospitals, 2001–2002. J Antimicrob Chemothe. 2003; 51: 59–68.
- Cosgrove, SE. Comparison of mortality associated with methicillin-resistant and methicillin-susceptible Staphylococcus aureus bacteremia: a meta-analysis. Clin Infect Dis. 2003; 36: 53–9.
- Assimacopoulos AP, Strandberg KL, Rotschafer JH, P Schlievert M. Extreme pyrexia and rapid death due to Staphylococcus aureus infection: analysis of 2 cases. Clin. Infect Dis. 2009; 48:612–614.
- Febrero-Peray P, Sotto A, Defez C, Cazaban M, Molinari L, Pinède M, et al. Mortality attributable to nosocomial infection: a cohort of patients with and without nosocomial infection in a French university hospital. Infect Control Hosp Epidemiol 2007; 28: 265-72.
- Wakefield DS, Helms CM, Massanari RM, Mori M, Pfaller M. Cost of nosocomial infection: relative contributions of laboratory, antibiotic, and per diem cost in serious Staphylococcus aureus infections. Amer J Infect Control. 1988; 16:185–19.
- Al-Rawahi GN, Reynolds S, Porter SD, Forrester L, Kishi L, Chong T. et al. Community-associated CMRSA-10 (USA300) is the predominant strain among methicillin-resistant Staphylococcus aureus strains causing skin and soft tissue infections in patients presenting to the emergency department of a Canadian tertiary care hospital. J Emerg Med. 2010; 38:6–11.
- Broseta A, Chaves F, Rojo P, Otero J. Emergencia de un clon de Staphylococcus aureus resistente a meticilina de origen comunitario en la población pediátrica del sur de Madrid. Enferm Infecc Microbiol Clin 2006; 24: 31-5
- Kaplan S, Hulten K, Gonzalez B, Hammerman W, Lamberth L, et al. Three year surveillance of community acquired Staphylococcus aureus infections in children. Clin Infect Dis 2005; 40 (12): 1785-1791.
- Martínez-Aguilar G, Avalos-Mishaan A, Hulten K, Hammerman W. Community-acquired, methicillin-resistant and methicillin-susceptible Staphylococcus aureus musculoskeletal infections in children. Pediatr Infect Dis J 2004; 23: 701-6.
- Alvarez CA, Barrientes OJ, Leal AL, Contreras GA, Barrero L, Rincon S, et al. Community associated methicillin-resistant Staphylococcus aureus, Colombia. Emerg Infect Dis. 2006; 12(12):2000-1.
- Harshey RM. Bacterial motility on a surface: many ways to a common goal. Annu Rev Microbiol. 2003; 57:249–273.
- Cosgrove SE, Perl TM. Staphylococcus aureus colonization among healthcare workers at a tertiary care hospital. Infect. Control Hosp. Epidemiol. 2007; 28:1404–1407.
- Kumar P, Shukla I, Varshney S. Nasal screening of healthcare workers for nasal carriage of coagulase positive MRSA and prevalence of nasal colonization with Staphylococcus aureus. Biol Med. 2011; 3(2):182–186.
- Eveillard M, Martin Y. Carriage of methicillin-resistant Staphylococcus aureus among hospital employees: prevalence, duration, and transmission to households. Infect Control Hosp Epidemiol. 2004; 25 (2):114-20.
- Alfaro C, Mascher-Denen M, Fergie J, Purcell K. Prevalence of methicillin-resistant Staphylococcus aureus nasal carriage in patients admitted to Driscoll Children’s Hospital. Pediatr Infect Dis J. 2006; 25:459– 461.
- Charlebois ED, Perdreau-Remington F, Kreiswirth B, Bangsberg DR, Ciccarone D, Diep BA, et al. Origins of community strains of methicillin-resistant Staphylococcus aureus. Clin Infect Dis. 2004; 39:47–54.
- Labarca LJ. Utilización del antibiotipo como marcador epidemiológico en infecciones intrahospitalarias: Comparación con la epidemiología molecular. Rev Chil Infect. 2002; 19 (Supl. 2): S 157-60
- Azimian A, Najar-pirayeh S, Mirab-Samiee S, Naderi M. Occurrence of Methicillin Resistant Staphylococcus Aureus (MRSA) Among Clinical samples In Tehran-Iran And Its Correlation With Polymorphism Of Specific Accessory Gene Regulator (Agr) Groups. Braz J Microbiol. 2012; 43(2):779-785.
- Koreen L, Ramaswamy SV, Graviss E.A, Naidich S, Musser JM, Kreiswirth BN. Spa typing method for discriminating among Staphylococcus aureus isolates: implications for use of a single marker to detect genetic micro- and macrovariation. J Clin Microbiol. 2004; 42:792–799.
- Escobar J, Moreno J, Díaz P, Castro B, Leal A, Vanegas N. Caracterización molecular de Staphylococcus aureus resistente a meticilina adquirido en la comunidad (SARM–AC) en Colombia. Infectio. 2008; 12: 72-74
- Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing: Twenty-third Informational Supplement. 2013; M100-S23. CLSI, Wayne, PA, USA.
- Cheng H R, Jiang N. Extremely rapid extraction of DNA from bacteria and yeasts. Biotech Lett. 2006; 28: 55–59.
- Tokue Y, Shoji S, Satoh K, Watanabe A, Motomiya M. Comparison of a Polymerase Chain Reaction Assay and a Conventional Microbiological Method for Detection of Methicillin-Resistant Staphylococcus aureus. Antimicrob. Agents Chemother, Japan.1992; 36 (1):6-9.
- Finks J, Wells E, Dyke TL, Husain N, Plizga L, Heddurshetti R, et al. Vancomycin-resistant Staphylococcus aureus. Emerg Infect Dis 2009; 15: 943-5.
- Saxena AK, Panhotra BR, Venkateshappa CK, Sundaram DS, Naguib M, Uzzaman W, Al Mulhim K. The impact of nasal carriage of methicillin-resistant and methicillin-susceptible Staphylococcus aureus (MRSA & MSSA) on vascular access-related septicemia among patients with type-II diabetes on dialysis. Ren Fail 2002; 24(6):763-77.
- Londoño J, Ortíz G, Gaviria AM. Prevalencia de Staphylococcus aureus resistente a meticilina en personal de la unidad de terapia intensiva de la clínica universitaria bolivariana, Medellín 2004. Infectio. 2006; 10(3): 160-166.
- Cimera D, Pérez F. Prevalencia de portadores nasales asintomáticos de Staphylococcus aureus meticilino-resistente y su relación con factores de riesgo y protectores en el personal de salud del Hospital General de las Fuerzas Armadas. Rev Mex Patol Clin, 2010; 57 (4): 196-204.
- Espinosa CT, Romero MK, Rincón G, Jácome M, Arámbula de Obregón AL. Portadores nasales de Staphylococcus aureus en personal que labora en un Hospital de Santander. Salud UIS 2011; 43 (2): 111-117
- Cesur S, Cokça F. Nasal carriage of methicillin-resistant Staphylococcus aureus among hospital staff and outpatients. Infect Control Hosp Epidemiol. 2004; 25(2):169-71.
- Datta P, Gulati N, Singla N, Vasdeva HR, Bala K, Chander J. Evaluation of various methods for the detection of meticillin-resistant Staphylococcus aureus strains and susceptibility patterns, J Med Microbiol. 2011; 60:1613–1616.
- Mendoza C, Barrientos C, Panizza V, Concha B, Romero P, Barahona C, etal. Prevención de la infección intrahospitalaria por Staphylococcus aureus resistente a meticilina mediante el manejo de portadores. Rev Chil Infect. 200; 17(2): 129-134
- Mathanraj S, Sujatha S, Sivasangeetha K, Parija SC. Screening for methicillin-resistant Staphylococcus aureus carriers among patients and health care workers of a tertiary care hospital in south india. Ind J Med Microb. 2009; 27(1): 62-4
- Ibarra M, Flatt T, Van Maele D, Ahmed A, Fergie J, Purcell K. Prevalence of methicillin-resistant Staphylococcus aureus nasal carriage in healthcare workers. Pediatr Infect Dis J. 2008; 27(12):1109-11
- Gaona MA. Variación del estado de portador de Staphylococcus aureus en una población de estudiantes de medicina. Rev Cienc Salud. 2009; 7 (1): 37-46.
- Castro OR, et al. Presencia de Staphylococcus aureus resistente a meticilina en fosas nasales en estudiantes de quinto semestre del programa de bacteriología de la Corporación Universitaria Rafael Nuñez. Cienc Sal. 2009; 1 (1): 2-7.
- Ortega C. Estudio de portación nasal de Staphylococcus aureus en estudiantes de medicina de la Universidad de Santiago De Chile. Clín Cienc. 2009; 1(1):10-14
- Requena M, De Passos A, Rondón R, Tedesco A, Padrón D, Pérez y J. Mata. Staphylococcus aureus: Portadores nasales en estudiantes de enfermería. Escuela de Ciencias de la Salud. Universidad de Oriente – Edo. Bolivar. Sociedad Venezolana de Microbiología. Capítulo Sucre XXIX Jornadas Venezolanas de Microbiología "Dr. Vidal Rodríguez Lemoine" Cumaná del 9 al 11 de Noviembre de 2005.
- Rodríguez-Avial C, Álvarez-Novoa, Losaa A, Picazoa J. Aumento significativo de la colonización por Staphylococcus aureus entre los estudiantes de medicina durante la realización de las prácticas en el hospital. Enferm Infecc Microbiol Clin. 2012; 31(8):516-519.
- López-Aguilera S, Goñi-Yestea MM, Barradoa L, González-Rodríguez-Salinas M C, Otero JR, Chaves F. Colonización nasal por Staphylococcus aureus en estudiantes de medicina: importancia en la transmisión hospitalaria. Enferm Infecc Microbiol Clin. 2012; 31(8):500-505
- Vasanthakumari N, Alshrari ASD, Rad EG, Moghaddam HG, Belkum A, Alreshidi MA, et al. Highly dynamic transient colonization by Staphylococcus aureus in healthy Malaysian students. J Med Microb. 2009; 58(11):1531-1532
- Shakya B, Shrestha S, Mitra T. Nasal carriage rate of methicillin resistant Staphylococcus aureus among at National Medical College Teaching Hospital, Birgunj, Nepal. Nepal Med Coll J. 2010;12 (1):26-9
- Monnet DL, MacKenzie FM, Lopez-Lozano JM. Antimicobial drug use and methicillin-resistant Staphylococcus aureus, Aberdeen, 1996–2000. Emerg Infect Dis 2004; 10: 1432–41
- Jarraud S, Mougel C, Thioulous J, Lina G, Meugnier H, Forey F, et al. Relation between Staphylococcus aureus genetic background, virulence factors, agr group (alleles) and human diseases. Infect Immun. 2002; 70:631-641.
- Moise-broder PA, Sakulas J, Eliopoulos GM, Schentag JJ, Forrest A, Moellering RC. Accessory gene regulator group II polymorphism in Methicillin-Resistant Staphylococcus aureus is predictive of failure of vancomycin therapy. Clin Infect Dis. 2004; 38:1700-1705.
- Naimi TS, LeDell KH, Boxrud DM. Epidemiology and clonality of community-acquired methicillin-resistant Staphylococcus aureus in Minnesota, 1996–1998. Clin Infect Dis 2001; 33:990–996.
- Aguilar L, Giménez M, Barberán J. Heterorresistencia y tolerancia a glucopéptidos en aislados grampositivos en el hospital: ¿fenómenos “invisibles” para el clínico con posible traducción clínica?. Rev Esp Quimioter. 2009; 22(4): 173-179.
Recibido: Diciembre 10, 2013
Aceptado: Febrero 20, 2014
Correspondencia: Dra. Mónica Chávez. Facultad de Salud, Universidad Santiago de Cali. Investigador Grupo de investigación GEFME. Dirección. Carrera 47A No.10-65. monikchavez@gmail.com