PERSPECTIVA ONCOLÓGICA DE LA MEDICINA DE PRECISIÓN Y SU IMPLEMENTACIÓN EN PACIENTES PEDIÁTRICOS Y ADULTOS CON GENES DE FUSIÓN NTRK: UNA VISIÓN PARA COLOMBIA
..................
Carlos Vargas ¹⁻³, Carolina Sotelo ¹,³, Diego F. Chamorro ¹,³, Luis Eduardo Pino ⁴
, Pilar Archila ¹,³, Luz Fernanda
Sua ⁵
, Isabel Sarmiento ⁶
, July Rodríguez ¹,³, Alejandro Ruíz-Patiño ¹,³, Leonardo Rojas ²,³,⁷, Hernán Carranza ¹⁻³,
Jorge Otero ¹⁻³, Luisa Ricaurte ⁸
, Juan Esteban García-Robledo ³,⁹, Camila Ordóñez-Reyes ¹,³, Luis Corrales ¹⁰,
Claudio Martín ¹¹, Luis Raez ¹², Christian Rolfo ¹³, Oscar Arrieta ¹⁴, Lucía Zatarain-Barrón ¹⁴, Andrés Felipe
Mosquera-Paternina ¹
, Yency Johana Forero Martinez ¹⁵, Andrés F. Cardona ¹,³,¹⁶
Resumen
La oncología de precisión, definida como la perfilación molecular de los tumores para identificar alteraciones modulables, se ha desarrollado rápidamente para integrarse en la práctica clínica. Las pruebas genómicas involucran diversas partes interesadas que trabajan coordinada y articuladamente para controlar la logística de las muestras de tejido tumoral y desarrollar las pruebas en laboratorios con altos parámetros de calidad, donde el análisis apropiado conduce a resultados reproducibles. Los médicos deben estar familiarizados con las variantes genómicas informadas y con la tecnología utilizada para determinarlas, incluidas las limitaciones de los informes y las metodologías actuales. La interpretación de los hallazgos genómicos se realiza de manera óptima gracias al aporte multidisciplinario, necesario para reducir la incertidumbre de las recomendaciones relacionadas con las variantes documentadas. Los genes 1/2/3 del receptor neurotrópico de la quinasa para la tropomiosina (NTRK) codifican las quinasas del receptor de tropomiosina (TRK) A/B/C, respectivamente. Los reordenamientos cromosómicos que causan fusiones del gen NTRK pueden dar como resultado la activación constitutiva de las proteínas TRK, que actúan como impulsores oncogénicos a través de la activación de diversas vías de crecimiento celular. Las fusiones del gen NTRK ocurren en ~0,3 % de los tumores sólidos, aunque su incidencia varía según el tipo de cáncer. Su prevalencia es >90 % en algunas neoplasias raras como el carcinoma secretor de mama y el carcinoma secretor análogo de la glándula salivar (MASC). Los inhibidores de TRK (larotrectinib, entrectinib y repotrectinib) son activos en los tumores positivos para la fusión de NTRK, y han permitido cambiar el curso natural de múltiples enfermedades. El artítuculo desarrolla una revisión integral sobre la perspectiva de la medicina de precisión y su implementación en pacientes pediátricos y adultos con genes de fusión NTRK en Colombia.
Palabras clave: Medicina de precisión; genómica; terapia dirigida; NTRK; terapia agnóstica.
..............
² - Grupo Oncología Clínica y Traslacional, Clínica del Country, Bogotá, Colombia.
³ - Grupo de Investigación en Oncología Molecular y Sistemas Biológicos (Fox-G), Universidad El Bosque, Bogotá, Colombia.
4 - Departamento Oncología Clínica, Instituto de Cáncer Carlos Ardila Lulle, Fundación Santa Fe de Bogotá, Bogotá, Colombia.
5 - Departamento de Patología y Biología Molecular, Fundación Valle de Lili, Cali, Colombia.
6 - Grupo Oncología Pediatrica, Centro de Cáncer, Clínica del Country, Bogotá, Colombia.
7 - Departamento de Oncología Clínica, Clínica Colsanitas, Bogotá, Colombia.
8 - Departamento de Patología, Clínica Mayo, Rochester, Minnesota, Estados Unidos.
9 - División de Hematología y Oncología, Clínica Mayo, Scottsdale, Estados Unidos.
10 - Grupo Oncología Clínica, Centro de Investigación y Manejo del Cáncer / Hospital Clínica Biblíca, San José, Costa Rica.
11 - División Oncología Torácica, Instituto Alexander Fleming, Buenos Aires, Argentina.
12 - Departamento de Oncología, Instituto de Cáncer Memorial, Miami, Florida, Estados Unidos.
13 - Departamento Oncología Torácica, Centro Oncología Torácica The Tisch Cancer Institute en Mount Sinai Health System, New York, Estados Unidos.
14 - Unidad Oncología Torácica y Laboratorio de Oncología Personalizada, Instituto Nacional de Cancerología – INCan, Ciudad de México, México.
15 - Departamento de Medicina Interna, Clínica Cafam, Bogotá, Colombia.
16 - Dirección de investigación y educación, Centro de Tratamiento e Investigación sobre cáncer Luis Carlos Sarmiento Angulo (CTIC), Bogotá, Colombia.
ONCOLOGICAL PERSPECTIVE OF PRECISION MEDICINE AND ITS IMPLEMENTATION IN PEDIATRIC AND ADULT PATIENTS WITH NTRK FUSION GENES: A VISION FOR COLOMBIA
Abstract
Precision oncology, defined as the molecular profiling of tumors to identify modulable abnormalities, has rapidly developed to integrate into mainstream clinical practice. Genomic testing involves diverse stakeholders working in a coordinated and articulated manner to control the logistics of tumor tissue samples and develop the tests in laboratories with high-quality parameters, where appropriate analysis leads to reproducible results. Clinicians should be familiar with the reported genomic variants and the technology used to determine them, including the limitations of current reporting and methodologies. The interpretation of genomic findings is performed optimally thanks to the multidisciplinary input necessary to reduce the uncertainty of the recommendations related to the documented variants. Neurotropic tropomyosin receptor kinase (NTRK) genes 1/2/3 encode A/B/C tropomyosin receptor kinases (TRK), respectively. Chromosomal rearrangements that cause NTRK gene fusions can result in constitutive activation of TRK proteins, which act as oncogenic drivers through activation of various cell growth pathways. NTRK gene fusions occur in ~ 0.3 % of solid tumors, although their incidence varies by type of cancer. Its prevalence is> 90 % in some rare neoplasms, such as secretory carcinoma of the breast and analogous secretory carcinoma of the salivary gland (MASC). TRK inhibitors (larotrectinib, entrectinib, and repotrectinib) are active in tumors that are positive for NTRK fusion and have changed the natural course of multiple diseases. We developed a comprehensive review on precision medicine and its implementation in pediatric and adult patients with NTRK fusion genes in Colombia.
Key words: Precision medicine; genomics; targeted therapy; NTRK; agnostic therapy
Introducción
Debido los avances en tecnología y con ello en mejoría de la calidad y acceso a la salud, hoy la esperanza de vida de la humanidad se ha incrementado considerablemente. Con una población cada vez más longeva, las enfermedades crónicas no trasmisibles aumentan su prevalencia. Estas enfermedades constituyen la primera causa de muerte a nivel mundial, y entre ellas, el cáncer es la patología situada entre las tres primeras causas de mortalidad antes de los 70 años en la mayoría de países (1). De acuerdo con las estadísticas del Observatorio Global de Cáncer (Global Cancer Observatory- GLOBOCAN), para 2020 en Colombia la incidencia del cáncer fue de 113.221 casos y la prevalencia a 5 años de 293.524. Por otra parte, se reportaron 54.987 muertes por causa del cáncer, siendo esta enfermedad una de las primeras causas de muerte en Colombia según el DANE (2,3).El alto costo para el tratamiento del cáncer, sumado a la aparición de nuevas alternativas terapéuticas, ha incrementado el monto presupuestal dedicado a los pacientes oncológicos (4). No obstante, existe una relación directamente proporcional entre los desenlaces positivos en los pacientes y el costo de los medicamentos (5). Por esa razón, la búsqueda de estrategias o alternativas costo-efectivas para el tratamiento del cáncer es uno de los principales objetivos de la oncología. Entre estas, se encuentra el uso de pruebas moleculares, herramienta que permite enfocar el tratamiento oncológico. A partir de lo anterior surge la oncología de precisión, que centra su objetivo en la caracterización molecular de los tumores para identificar alteraciones que puedan ser dianas de tratamiento, optimizando la eficacia del mismo y reduciendo su costo (6).
Con el crecimiento de la genómica, los estándares terapéuticos en oncología se guían actualmente por caracteres biológicos, más que por criterios clínicos. Adicionalmente, la tecnología permite, no solo el análisis de las variantes germinales y somáticas del ADN, sino también las trasformaciones epigenéticas y en el proteoma resultante de las modificaciones postraduccionales (7,8). En 2011, el Consejo Nacional de Investigación (National Research Council) de los Estados Unidos diseñó los caracteres de la medicina de precisión, refiriéndose a la clasificación de las personas y sus patologías en subpoblaciones específicas, definidas por patrones genéticos comunes que determinan la respuesta a los medicamentos (9). Para una correcta interpretación y uso de esas variables genéticas, el personal médico debe familiarizarse con las variantes genómicas y las instituciones deben establecer protocolos para la aplicación de pruebas moleculares y su optimización en los pacientes (10).
Entre los diferentes patrones genéticos se encuentran las fusiones en el gen del receptor neurotrópico de la quinasa para la tropomiosina (NTRK), que se comportan como inductores oncológicos en ciertos tumores sólidos, en las que ocurren en un 0,3 % de la totalidad de los casos, pero cuya incidencia varía según el tipo de neoplasia. Por ejemplo, Westphalen y colaboradores reportaron una prevalencia de fusiones positivas de NTRK de 0,28 % y 1,34 % en pacientes ≥18 años y <18 años, respectivamente (11). Es fundamental saber que los genes 1/2/3 del NTRK codifican las quinasas del receptor de tropomiosina (TRK) A/B/C, respectivamente (10). Las fusiones en el gen NTRK pueden ocasionar la activación constitutiva de la proteína TRK, que se comporta como un impulsor oncogénico activando vías de crecimiento celular. Es así como los inhibidores de TRK (imatinib, larotrectinib, entrectinib y repotrectinib) tienen efecto en tumores positivos para la fusión de NTRK. En 2001, la FDA aprobó el imatibim para el manejo de este tipo de pacientes y, hoy, diferentes ensayos clínicos exploran más de 100 quinasas como diana para terapia dirigida (12).
A continuación, se desarrolla una revisión integral sobre la perspectiva de la medicina de precisión y su implementación en pacientes pediátricos y adultos con genes de fusión NTRK en Colombia.
Utilidad de la oncología de precisión
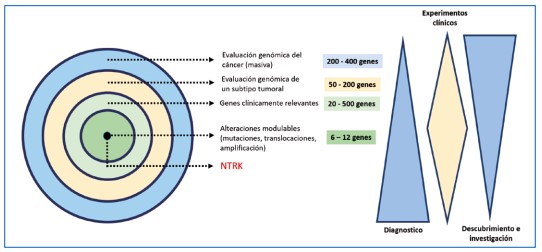
En oncología, la medicina de precisión se refiere al uso de estrategias diagnósticas y terapéuticas combinadas para beneficiar un subconjunto de pacientes cuyas neoplasias presentan eventos genómicos específicos que derivan en alteraciones moleculares que modifican la biología de la célula tumoral desregulando vías de señalización potencialmente modulables (13). Es asi, como nuevas herramientas tecnológicas han permitido la evaluación poligénica mediante perfiles moleculares y con ello la inclusión de biomarcadores predictivos que influencian la visión del cáncer (14) (figura 1). Globalmente, entre 40 y 60 % de los biomarcadores pronósticos en uso tiene relación con el cáncer. Teniendo en cuenta esa cifra, se estima que la oncología de precisión podría impactar entre el 11 y 18 % de la población con diagnóstico de cáncer (15,16). Se calcula que de los 32.6 millones de supervivientes de cáncer en el mundo, el uso de la medicina de precisión podría modificar la sobrevida de 5.5 millones de personas cada año, y para Colombia, con estadísticas del 2018, se estima que 18.340 ciudadanos podrían beneficiarse de la oncología de la precisión (17). De ese número, aproximadamente 500 pacientes serán portadores de translocaciones NTRK-3, y de ellos, 2 de cada 10 serán niños.A pesar del costo para la implementación generalizada de la genómica de profundidad, el uso dirigido de las estrategias terapéuticas de última tecnología ha demostrado un ahorro global del 5,6 % en la población intervenida. Esta estrategia de cuidado basada en el valor podría reducir los costos globales del tratamiento oncológico dirigido después de 18 meses de intervención en más del 7,5 %, evento válido para 1 de 4 pacientes con cáncer avanzado (18).
Puntos clave 1
- La oncología de precisión incluye el uso de estrategias diagnósticas y terapéuticas combinadas para beneficiar un subconjunto de pacientes cuyas neoplasisas presentan eventos genómicos específicos que derivan en alteraciones moleculares susceptibles de manejo con terapias dirigidas.
- Hasta el 18 % de los pacientes con cáncer se benefician de la oncología de precisión.
- Las translocaciones de NTRK 1-3 presentes en diferentes tumores y su tratamiento dirigido constituyen el ejemplo más relevante para demostrar la utilidad del modelo de valor basado en oncología de precisión.
Figura 1. Utilidad de la oncología de precisión para la determinación de genes potencialmente modulables con terapia blanco-dirigida (secuencia desde la exploración génica masiva hasta la identificación de NTRK).
Impacto de la oncología de precisión en los tumores con baja incidencia
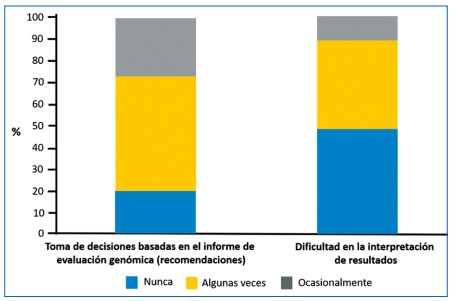
La evidencia ha demostrado la importancia del uso rutinario de la oncología de precisión, incluso en instituciones no consideradas de referencia. Recientemente, Schram y colaboradores mostraron que incluir la secuenciación masiva en la practica clínica modificó un cuarto de las decisiones clínicas. Asimismo, entre los pacientes cuyo tratamiento no fue rectificado, los médicos indicaron la presencia de al menos una alteración genética accionable en el 55 % de los casos; sin embargo, sólo el 45 % de ellos tenía una variante genómica validada por expertos. Con el fin de optimizar las herramientas genómicas de alta precisión, se han diseñado informes genómicos, comités multidisciplinarios de análisis y plataformas de inteligencia artificial que permiten la interpretación de los resultados (19,20). Dentro de estas plataformas se encuentra la aplicación ESCAT (Escala ESMO de accionabilidad clínica para blancos moleculares) que facilita la selección de los pacientes a través de un sistema estandarizado de clasificación basado en la evidencia de alteraciones genómicas con implicaciones clínicas (21).Recientemente, Freedman y colaboradores realizaron la Encuesta Nacional de Medicina de Precisión en el Tratamiento del Cáncer en los Estados Unidos, incluyendo 1.281 oncólogos dispuestos en centros de práctica comunitaria a lo largo del país. De ellos, el 75,6 % informó haber utilizado las pruebas de secuenciación génica masiva para guiar las decisiones de tratamiento (figura 2). Además, el 34,0 % utilizó la plataforma de forma rutinaria para optimizar el manejo de pacientes con enfermedad avanzada refractaria, el 29,1 % la empleó para determinar la elegibilidad de sujetos para experimentos clínicos, y el 17,5 % para decidir sobre el uso no aprobado de medicamentos admitidos por la Administración Federal de Alimentos y Medicamentos (FDA) (22). Los resultados de estas pruebas mostraron recomendaciones útiles para el tratamiento en casi el 27 % de los casos, un porcentaje no despreciable. Cabe anotar que los oncólogos de nuevas generaciones manifiestan tener algún tipo de entrenamiento en genética y prescriben con más frecuencia terapias con dianas moleculares (23).
Figura 2. Utilidad de las pruebas de NGS en los últimos 12 meses entre los oncólogos en los Estados Unidos (9).
Una de las ventajas de la secuenciación masiva es la identificación de blancos genéticos que optimizan intervenciones terapéuticas. Uno de los ejemplos en este ámbito lo representan las translocaciones de NTRK presentes en algunos tumores infrecuentes de población adulta y pediátrica. La identificación de estos blancos moleculares puede realizarse mediante inmunohistoquímica o FISH (fluorescencia por hibridación in situ) previa validación de la información. Un estudio realizado por Gatalica y colaboradores analizó muestras de 11.502 pacientes incluyendo 53 genes de fusión y la secuenciación de 592 genes adicionales en comparación directa con la tipificación por inmunohistoquímica de TrkA/B/C (24) . De la totalidad de la cohorte, el 0,27 % tuvo alteraciones en NTRK, siendo las fusiones más comunes la ETV6:NTRK3 (n=10) y la TPM3:NTRK1 (n=6). Los gliomas presentaron mayor frecuencia en alteraciones del NTRK (1,4 %), con presencia de fusión en el NTRK2. Asimismo, otros 17 casos de tumores no relacionados con el sistema nerviosos central fueron portadores de NTRK, entre ellos carcinomas de pulmón, tiroides, seno, cérvix, colon, cavidad nasal, y diversos sarcomas de tejidos blandos. La expresión uniforme del gen evaluada por inmunohistoquímica encontró 7/8 lesiones NTRK1, 8/9 fusiones NTRK2, y 6/11 NTRK3. Esta información validó la utilidad y simplificación del cribado a través de la inmunohistoquímica (24).
En el mismo orden de ideas, Hechtman y colaboradores evidenciaron que el panel Pan-Trk (rabbit recombinant monoclonal antibody, clone EPR17341, Roche, Cambridge, MA) para detección el gen de fusión por inmunohistoquímica tiene una sensibilidad y especificidad diagnóstica del 95,2 % y 100 %, respectivamente. En este estudio, todos los casos que resultaron positivos por inmunohistoquímica tuvieron una tinción citoplásmica, mientras que se descubrieron patrones específicos de apareamiento para las 5 fusiones LMNA-NTRK1 con acentuación de la membrana nuclear. En contraposición, las 4 fusiones TPM3/4 mostraron acentuación de la membrana celular y la mitad (3/6) de las fusiones NTRK3 mostraron tinción nuclear (25). En conclusión, la tinción Pan-Trk resultó ser una prueba eficiente y ejecutable en el tejido para detección de fusiones de NTRK. Adicionalmente, Hung y col. ahondaron en la utilidad de la inmunohistoquímica como estrategia diagnóstica. Este grupo analizó 210 casos de neoplasias pediátricas (fibrosarcomas, tumores neurales lipofibromatosis like, amartomas, sarcomas mixoides), en estos casos el panel Pan-Trk mostró positividad en 15 fibrosarcomas infantiles (100 %) y en 5 lipofibromatosis/tumores neurales lipofibromatosis like (100 %) (26).
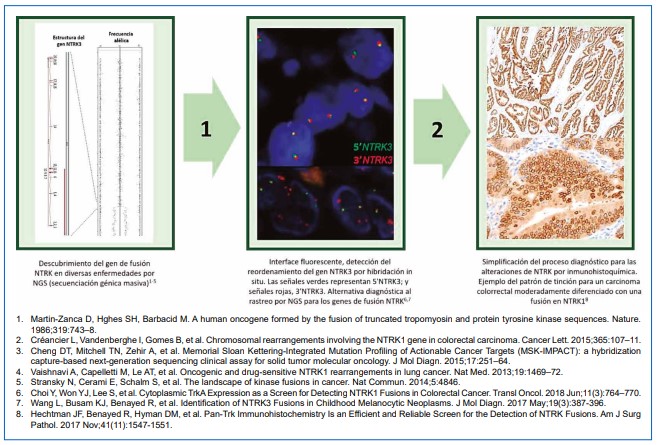
Finalmente, Rudzinski y colaboradores decidieron tipificar la sensibilidad y especificidad del panel PanTrk (EPR17341) y del anticuerpo monoclonal TrkA (EP1058Y) en una población de pacientes NTRK positivos (n=26). Para el panel Pan-Trk (EPR17341) la sensibilidad y especificidad fueron 97 y 98 %, respectivamente, mientras el clono TrkA IHC (EP1058Y) presentó una sensibilidad y especificidad del 100 y 63 % (27). Con esos datos, se soporta la valoración de alteraciones en NTRK a través de inmunohistoquímica, relegando la secuenciación genética a casos más complejos, lo cual permite un acceso más rápido a pruebas de identificación de blancos moleculares y con ello, a un tratamiento oncológico dirigido (28)B and C (TrkA, TrkB and TrkC. En la Figura 3 muestra la evolución y simplificación de las estrategias diagnósticas para diversos tumores portadores de NTRK.
Figura 3. Transición diagnóstica de los genes de fusión NTRK desde su evaluación inicial con técnicas de secuenciación por PCR, hasta la tipificación por secuenciación génica masiva (NGS) (Paso 1), el uso de la hibridación in situ (FISH), y el cribado por inmunohistoquímica (Paso 2).
Puntos clave 2
- La oncología de precisión permitió la identificación de las
trasnlocaciones NTRK 1-3 en diversos tumores; una vez confirmada la
accionabilidad del gen de fusión y la viabilidad del uso del
larotrectnib se introdujo la inmunohistoquímica
(panel Pan-Trk) como estrategias simplificada de
diagnóstico. Esta prueba ha demostrado un alto
rendimiento entre diversas neoplasias de niños y
adultos, presenta una estupenda relación costo/
beneficio y una alta sensibilidad y especificidad,
hallazgos que la hacen fácilmente implementable
en el escenario local.
Importancia de la medicina de precisión en los países con recursos limitados
La oncología de precisión ha demostrado equilibrio a favor del valor económico agregado basado en el costo-efectividad y utilidad del bloqueo específico de blancos moleculares. Dado que el costo neto de los medicamentos oncológicos de última generación representa entre el 12 y 20 % del costo de la atención, la oncología de precisión permite reducir la inversión global al moderar el requerimiento de atención hospitalaria. Por ejemplo, en 2015, el Reino Unido gastó aproximadamente £1.3 mil millones (US $1.830 millones) en servicios hospitalarios para pacientes con cáncer tratados intrainstitucionalmente a lo largo de su último año de vida. De manera similar, Australia y Estados Unidos invirtieron aproximadamente el 79 % (AU $3,6 mil millones, US $2,6 mil millones) y 38 % (US $31,3 mil millones) de su gasto total en cáncer en atención intrainstitucional (29,30). En ese orden de ideas, el uso de biomarcadores como puntos de referencia para la toma de decisiones clínicas, disminuye significativamente los requerimientos de los pacientes en servicios de urgencias o intención intrahospitalaria, y mejora notablemente la calidad de vida del paciente. Aproximación a los tumores NTRK como ejemplo de la práctica basada en oncología de precisión La secuenciación génica masiva permitió la identificación de tres variantes del gen de fusión NTRK en 17 tipos diferentes de tumor. Esta translocación activa de forma constitutiva y dependiente del estímulo proveniente de diferentes ligandos (neurotropinas, factor de crecimiento del nervio periférico - NGF para TrkA, factor de crecimiento derivado del cerebro – BDGF, NT-4/5 para TrkB y NT3 para TrkC) afines con el receptor de la tropomiosina (TRK). El TRK se encuentra relacionado con el crecimiento, diferenciación, maduración y supervivencia de las neuronas (expresión de forma natural el sistema nervioso central). No obstante, las fusiones génicas de NTRK representan un conjunto de rearreglos cromosómicos expresados en el segmento 5’ (más de 60 identificados) en adición a la fracción 3’ que codifica el segmento intracelular tirosin-quinasa (31).La familia de receptores Tropomiosina Receptor Quinasa (TRK, por sus siglas en inglés) comprende 3 proteínas transmembrana denominadas como TrkA, TrkB, TrkC que son codificadas en los genes NTRK1, NTRK2 y NTRK3, localizados en los cromosomas 1q23.1, 9q21.33 y 15q25.3, respectivamente. Estos receptores de TK se expresan en tejido neuronal humano y son importantes en la función del sistema nervioso mediante la activación de neurotrofinas [Factor de crecimiento neuronal (NGF), Factor de crecimiento derivado del cerebro (BDGF), neurotrofina-3 (NTF3)]. Estas actúan como ligandos de esos receptores y favorecen señales de fosforilación sobre residuos de tirosina en el dominio quinasa intracitoplasmático lo cual induce procesos de proliferación y diferenciación del tejido (28).
Las alteraciones en el reordenamiento cromosómico que involucran a NTRK1/2/3 pueden dar como resultado genes de fusión, y con ello producción de proteínas Trk quiméricas con activación constitucional del dominio quinasa intracelular, lo cual perpetúa señales para proliferación y supervivencia celular. La región 3’ del gen NTRK se une con el extremo 5’ de un gen asociado de fusión, ya sea por reordenamiento intracromosómico o intercromosómico. Las alteraciones de NTRK inducen tumorogénesis en cánceres neurogénicos y no neurogénicos y son blancos de agentes terapéuticos, independientemente de la histología del tumor (32,33).
La unión del receptor TrkA por NGF provoca la activación de la vía Ras/Proteína quinasa activada por mitógenos (MAPK), lo cual permite proliferación y crecimiento celular a través de la quinasa regulada por señales extracelulares (ERK). Otras vías como la fosfolipasa C-γ (PLCγ) y dependiente de PI3K también se activan en forma paralela. De igual forma, el acoplamiento de TrkC con NT3 provoca la activación preferencial de la ruta PI3/AKT evadiendo la apoptosis y prolongando la supervivencia celular, mientras que TrkB transduce la señal BDNF a través de Ras-ERK, PI3K y PLCγ, dando como resultado la diferenciación y supervivencia tumoral (27,29,30).
El gen NTRK1 se encuentra en el cromosoma 1q23- q22.4 y sus mutaciones interrumpen la función de la proteína TrkA (Presente en pacientes afectados por insensibilidad congénita al dolor y con síndrome de anhidrosis). El gen NTRK2 fue mapeado en el cromosoma 9q22.17 y contiene 24 exones, 8 codificando una proteína de 822 residuos de aminoácidos (receptor TrkB). El gen NTRK3 se encuentra en el cromosoma 15q25.9 y su producto de transcripción conocido como TrkC está expresado en diversas regiones del sistema nervioso central (31,34,35).
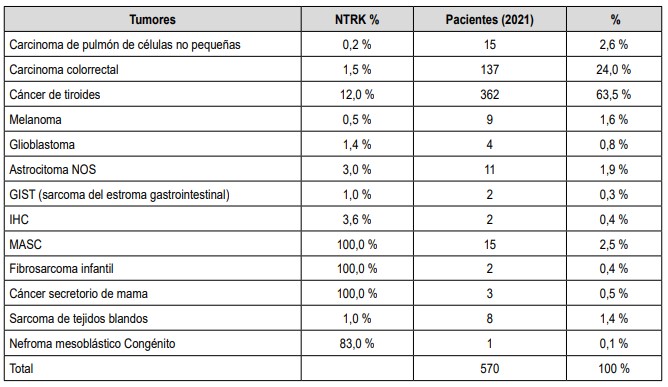
La familia de rearreglos génicos de NTRK está implicada en el desarrollo del 1 % de los tumores sólidos, con una frecuencia incremental (entre el 5 y 75 %) en algunas neoplasias raras propias de la población pediátrica. Entre otros, se encuentra el fibrosarcoma infantil, el nefroma mesoblástico congénito, y diversos gliomas de bajo grado, todos ellos con mínimas alternativas terapéuticas realmente efectivas, hasta el advenimiento de la oncología de precisión que permitió la identificación de NTRK. La transición de la información biológica sobre NTRK entre los adultos permitió documentar las alteraciones en carcinoma secretor de seno, carcinoma papilar de tiroides, adenocarcinoma de vía biliar, cáncer de colon, glioblastoma, glioma pilocítico juvenil, adenocarcinoma de pulmón, carcinoma neuroendocrino de células grandes de pulmón, melanoma Spitzoide, adenocarcinoma del apéndice, carcinoma escamoso de cabeza y cuello, leucemia mieloide aguda, GIST y en carcinomas de glándulas salivares (28). La Figura 4 resume la distribución de los tumores NTRK positivos.
Evaluación clínica politópica y experimentos clínicos novedosos (perspectiva frente a los experimentos convencionales y nuevos medicamentos)
En 2017, la FDA aprobó por primera vez un tratamiento contra el cáncer basado en un biomarcador común en lugar de la localización tradicional de la neoplasia o su arquitectura histológica. Desde entonces, el pembrolizumab está autorizado para tratar cualquier tipo de tumor sólido que expresa inestabilidad microsatélital (36). Con ese hecho, la oncología ha virado desde el uso de medicamentos con efecto citotóxico hacia la medicina de precisión con el uso de compuestos que son específicos de tumores mediante el bloqueo de su fisiopatología molecular. Según datos del 2017, los ensayos clínicos que incluyen biomarcadores como criterio de estratificación en los pacientes con base en la posibilidad de respuesta representaron el 34 % de los estudios en cáncer (37).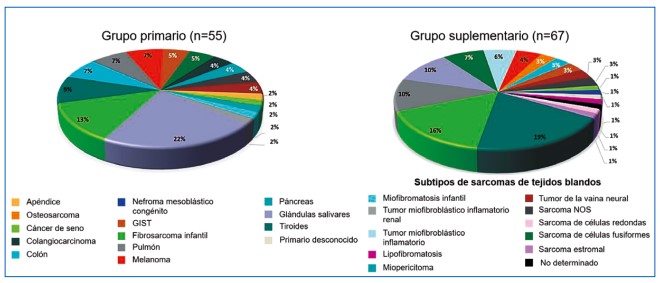
Figura 4. Distribución de los tumores NTRK positivos.
El modelo de estudio canasta (también denominado cubo, agnósticos o pantumor) incluye pacientes con cierta mutación genética común (ej. NTRK), independientemente del sitio u origen de la neoplasia (siempre que incluyan la alteración genómica de interés). En ciertas ocasiones, estos estudios pueden combinar biomarcadores o diseñarse para evaluar varios medicamentos al tiempo en un número seleccionado de alteraciones genéticas (39,40). Estos estudios pueden identificar de manera rápida y con menos costo, la efectividad de un medicamento contra un tumor en particular que comparte una alteración genética con otro. Por ejemplo, el vemurafenib (Zelboraf), un inhibidor de tirosin-quinasa que fue aprobado originalmente por la FDA en 2011 para el tratamiento del melanoma portador de la mutación BRAFⱽ⁶⁰⁰ᴱ, demostró ser eficaz en el tratamiento de una neoplasia hematológica poco frecuente conocida como Enfermedad de Erdheim-Chester (ECD), evento en el que también se presenta la mutación BRAFⱽ⁶⁰⁰ , y que llevó a su aprobación para esta nueva indicación (40).
Desde marzo de 2018, se han encontraron 38 estudios con el modelo canasta en la plataforma ClinicalTrials.gov. Once de estos, están destinados a registrar el uso de un medicamento específico para el tratamiento de diversas neoplasias ante la FDA; el resto (27) se considerarán exploratorios. A partir de 2017, la FDA y la EMA (European Medicines Agency) contemplaron el uso de los estudios canasta como estrategia de registro para patología con una prevalencia mundial inferior a 200.000 pacientes/año o una densidad menor a 1 en 2.000 personas. En total, este tipo de estudios parece ideal para valorar el uso de medicamentos en cerca de 7.000 entidades nosológicas de baja frecuencia (40).
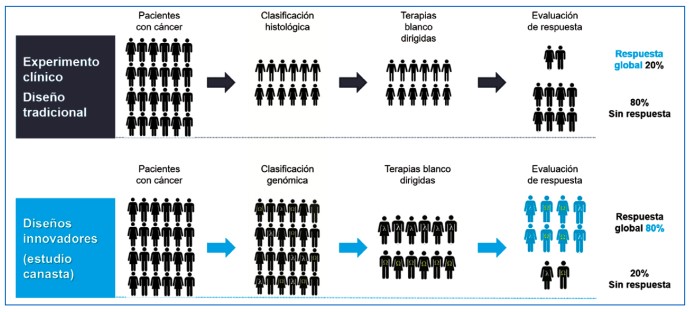
Figura 5. Comparación entre el diseño de los experimentos clínicos tradicionales y los innovadores para evaluación de blancos moleculares específicos en tumores de baja incidencia.
Todos los estudios canasta requieren una capacidad precisa para la predicción de la respuesta con base en la selección de un tumor con características moleculares particulares que favorece el control del blanco bajo el concepto de inhibición biológica efectiva (41). Además, los pacientes incluidos en cada subestudio a menudo se componen de un grupo heterogéneo en términos del subtipo tumoral, histología o características basales de los pacientes, lo que hace difícil valorar los desenlaces temporales (supervivencia libre de progresión y global), que regularmente se homogenizan a la totalidad de la población después de estimar la respuesta. Dada la heterogeneidad de la población, la rareza de los tumores en estudio y la ausencia de un grupo control, el efecto terapéutico suele confirmarse con estudios de la vida real postaprobación (30), evento por el que no se considera la ejecución de estudios fase III. La Figura 6 simplifica gráficamente un estudio canasta, modelos que favorecen inclusión de más pacientes dentro del espectro de quienes podrían acceder a las terapias agnósticas.
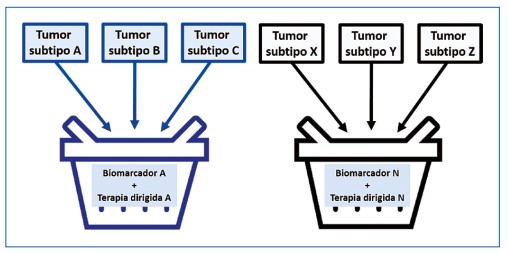
Figura 6. Descripción gráfica de un estudio canasta.
Con base en el desarrollo de estudios casata, se podría proyectar el número de casos NTKR positivos que susceptibles de tratamiento por año (tabla 1). Esa relación conserva las proporciones a las descritas para enfermedades de huérfanas (EHU, definida como aquella entidad que afecta un número absoluto de personas o a una proporción reducida de la población). En Colombia una EHU es aquella crónicamente debilitante y grave, que amenaza la vida, representando una prevalencia menor a 1 por cada 5.000 - 7.000 personas. En 2012 se dictaron las disposiciones para implementar el sistema de información de pacientes con enfermedades huérfanas, y en 2013 se realizó el listado de EHU en Colombia, llevando a cabo un censo por única vez en el año 2013 donde se reportaron 13.218 personas en el país. Dada las condiciones y frecuencia de las alteraciones en NTKR, muchas de estas patologías, por su condición invalidante y altamente lesiva podrían considerarse como EHU.
Tabla 1. Pacientes con diagnóstico potencial de alteraciones NTRK en Colombia considerando el impacto en salud pública (cálculo realizado usando como base la proyección de incidencia de Ferlay J, (2018). Global Cancer Observatory: Cancer Today. Lyon, France: IARC. Available from: https://gco.iarc.fr/today, accessed [13 Feb 2019].
Larotrectinib como ejemplo de la práctica en oncología de precisión
El número creciente de genes de fusión descubiertos durante la última década (>100), incluyendo NTRK, aumentó el interés científico en desarrollar nuevos fármacos con capacidad inhibitoria específica. Bertrand y colaboradores publicaron en 2012 la estructura cristalina en alta resolución de TrkA y TrkB en sus formas Apo, así como la conformación de los inhibidores en fracción nanomolar (42). Al menos 40 de los residuos del dominio quinasa en su conformación Asp-Phe-Gly (DFG) interactúan potencialmente con los ligandos en el sitio de unión del ATP, evento altamente conservado entre las proteínas Trk. Solo 2 de los 40 residuos son diferentes entre TrkA y TrkB, mientras que los sitios de unión ATP de TrkB y TrkC son idénticos. Gracias a estas características, el diseño de pan-inhibidores para las tres isoformas de NTRK (1-3) en lugar de medicamentos específicos se facilitó, logrando actividad antitumoral más amplia (43).El larotrectinib (LOXO-101) en un inhibidor pan-Trk con actividad altamente selectiva contra la súper familia de las quinasas Trk. Su farmacocinética demostró una buena exposición sistémica tras su administración oral, alcanzando aproximadamente el 98 % de la inhibición de TrkA, B y C en concentraciones máximas (44). La actividad clínica del larotrectinib se evidenció en el caso de una mujer de 41 años con un sarcoma, inscrita en el estudio fase I con una adecuada respuesta tumoral tras la exposición al medicamento por menos de 8 semanas (45). Otro pan-inhibidor de Trk con acción paralela sobre ROS1 y ALK es el entrectinib (RXDX-101 y NMS-E628), compuesto en desarrollo y con aprobación preliminar como molécula huérfana en la FDA para pacientes con cáncer de pulmón y de colon portadores de fusiones en NTRK(46). Altiratinib (DCC-2701) y sitravatinib (MGCD516) son inhibidores de múltiples quinasas con actividad in vitro contra TrkA y B(47,48), ambos en desarrollo temprano para pacientes con neoplasias que presentan genes de fusión en Trk. Adicionalmente, varias moléculas más están en curso de investigación preclínica o fase I/II para pacientes oncológicos (49).
La dosis recomendada para el larotrectinib en pacientes adultos y pediátricos depende del área de superficie corporal total. Este medicamento se debe continuar hasta la progresión de la enfermedad o en caso de que se produzca una toxicidad inaceptable. Como se describió, el larotrectinib es un inhibidor altamente selectivo y potente de Trk. La inhibición de Trk evita la activación proteica, lo que resulta en la inducción de la apoptosis y en la inhibición del crecimiento celular. El larotrectinib muestra una farmacocinética proporcional a la dosis en un rango que oscila entre los 100-400 mg. En pacientes adultos las concentraciones plasmáticas máximas se alcanzan en una hora, con niveles plasmáticos en estado estacionario después de 3 días de intervención. En voluntarios sanos, la biodisponibilidad absoluta media de larotrectinib oral fue del 34 % y, después de una dosis intravenosa, el volumen medio de distribución fue de 48 L, y adhesión a proteínas del 70 % (50).
La farmacocinética de larotrectinib no se ve afectada por la edad (rango entre los 28 días y 82 años), sexo, peso corporal o la presencia de insuficiencia renal. Respecto los pacientes con función hepática normal, la exposición a larotrectinib se incrementó en 1.3, 2 y 3.2 veces en pacientes con afectación hepática leve (Child-Pugh A), moderada (Child-Pugh B) y severa (Child-Pugh C), respectivamente. La dosis inicial de larotrectinib debe reducirse en un 50 % en pacientes con insuficiencia hepática moderada a grave. Pueden producirse interacciones farmacológicas clínicamente relevantes cuando el larotrectinib se coadministra con inhibidores potentes del CYP3A4 (itraconazol) o con medicamentos inductores (rifampicina). Si la administración conjunta es inevitable, la dosis del larotrectinib debe reducirse a la mitad con los inhibidores del citocromo y duplicarse con los inductores del mismo (51).
En la figura 7 se discrimina la evolución de los estudios clínicos con larotrectinib en población adulta y pediátrica. En el estudio fase I, el larotrectinib se asoció con una elevada tasa de respuesta global (93 %; 14/15 pacientes) después de una mediana de seguimiento de 5.6 meses en múltiples tumores sólidos (50). La expansión a tres cohortes con carácter multicéntrico incluyó pacientes desde un mes de vida hasta los 21 años. Globalmente, estos sujetos tenían tumores sólidos localmente avanzados o metastásicos, o primarios del sistema nervioso central recurrentes. En todos los casos se había documentado una respuesta inadecuada a las terapias disponibles en ausencia de otras intervenciones sistémicas. En 2016, los criterios de elegibilidad se ampliaron para incluir pacientes con fibrosarcoma infantil localmente avanzado que requeriría una cirugía potencialmente desfigurante para lograr la resección completa del tumor. El tratamiento prequirúrgico con larotrectinib fue una opción viable para los niños (mediana de edad de 2 años) que tenían fibrosarcoma infantil localmente avanzado (n=3) o sarcomas de tejidos blandos (n=6)(52). De estos cinco pacientes, tres tuvieron una respuesta patológica completa o casi completa (>98 %) y continuaron en el seguimiento (7 a 15 meses poscirugía) sin tratamiento con larotrectinib. En los otros dos pacientes que tuvieron tumor viable al momento de la resección, el larotrectinib se continuó hasta o intolerancia o progresión (SCOUT, NCT02637687).
En el análisis con intención de tratar (n=55) la tasa de respuesta global (TRG) evaluada por un comité central independiente fue 75 % (IC 95 % 61-85; desenlace primario para el análisis combinado), mientras la valorada por el investigador fue 80 % (IC 95 % 67-90) (41). Las respuestas ocurrieron independientemente de las características del gen de fusión NTRK, la edad o el tipo de tumor. Por evaluación central, se lograron respuestas completas, respuestas parciales, enfermedad estable y progresión de la enfermedad en 13, 62, 13 y 9 % de los pacientes, respectivamente (el beneficio clínico fue 88 % y solo 5 pacientes progresaron). Dos pacientes incluidos en el análisis se retiraron tempranamente debido al deterioro clínico. La mediana del tiempo a la respuesta fue de 1,8 meses, las medianas de duración de la respuesta (DRO) y de supervivencia libre de progresión (SLP) no se había alcanzado después de un seguimiento de 8,3 y 9,9 meses, respectivamente. Después de un año, las respuestas se mantuvieron en el 71 % de los pacientes y el 55 % permanecieron libres de progresión, manteniendo el beneficio después de 27 meses de tratamiento con larotrectinib (la respuesta se mantuvo al menos 6 meses en el 73 % y 9 meses en el 63 %). La mayoría de los pacientes (86 %) con una respuesta al momento del cierre de los datos continuaron recibiendo larotrectinib o se habían sometido a una cirugía que pretendía ser curativa (53).
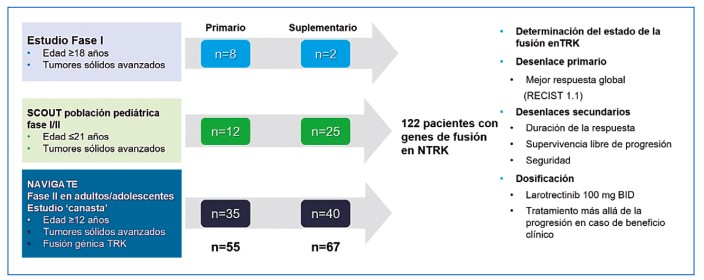
Figura 7. Incluye la secuencia de estudios desarrollados para la evaluación del larotrectinib en múltiples patologías para población pediátrica y adulta.
En el estudio NAVIGATE (NCT02576431) todos los pacientes tenían una fusión documentada del gen NTRK, siendo TRKA, TRKB y TRKC en 45, 2 y 53 % de los pacientes, respectivamente. Todos los casos fueron evaluados por secuenciación (NGS) o hibridación in situ por fluorescencia. Para el corte de datos de julio de 2018, la TRG fuel 81 % (IC 95 % 72-88), con respuestas completas y parciales en 17 y 63 % de los pacientes, respectivamente. Lo anterior para el análisis actualizado de 109 pacientes pediátricos y adultos evaluables después de una mediana de seguimiento de 17,6 meses. En el conjunto de datos primarios (55 pacientes), no se alcanzó la mediana para la duración de la respuesta (54). La figura 8 resume los índices de respuesta en la secuencia de estudios de larotrectinib versus el umbral para otras terapias convencionales antes del advenimiento del inhibidor de tirosin-quinasa. De igual forma, la figura 9 discrimina la distribución individual de la respuesta en el conjunto integrado de pacientes (diversas neoplasias; n=109).
El larotrectinib tiene un perfil de seguridad y tolerabilidad manejable; basado en el análisis conjunto de tres experimentos clínicos, el LOXO-TRK-14001 (n=70), el SCOUT (n=43) y el NAVIGATOR (n=63) se encontró que el 40 % de los pacientes incluidos tenía una exposición al larotrectinib >6 meses y en el 20 % fue >1 año (51). La mediana de edad de los pacientes fue de 51 años (el 25 % tenía una edad ≤18 años) y el 52 % de los pacientes fueron hombres. Los tumores más comunes fueron sarcoma de tejidos blandos (16 %), glándula salivar (11 %), pulmón (10 %), tiroides (9 %), colon (8 %), fibrosarcoma infantil (8 %), primarios del sistema nervioso central (7 %), y melanoma (5 %). La mayoría de los adultos (80 %) recibieron larotrectinib 100 mg dos veces al día (rango de dosis de 50 a 200 mg dos veces al día), mientras el 68 % de los pacientes pediátricos (edad ≤18 años) recibió larotrectinib 100 mg/ m² dos veces al día (dosis máxima de 100 mg dos veces al día; rango de dosis 9,6 -120 mg/m2 dos veces al día) (41). Las reacciones adversas más comunes (frecuencia ≥20 %) de cualquier grado que se produjeron en los pacientes receptores de larotrectinib fueron aumento del nivel de AST (45 %), elevación de la ALT (45 %), anemia (42 %), fatiga (37 %), náuseas (29 %), mareo (28 %), vómito (26 %), tos (26 %), estreñimiento (23 %) y diarrea (22 %). Las reacciones adversas que llevaron a interrupciones temporales o reducción de la dosis fueron el aumento del nivel de ALT (6 %), el de AST (6 %) y el mareo (3 %), la mayoría de los cuales se produjo durante los primeros 3 meses de exposición (51).
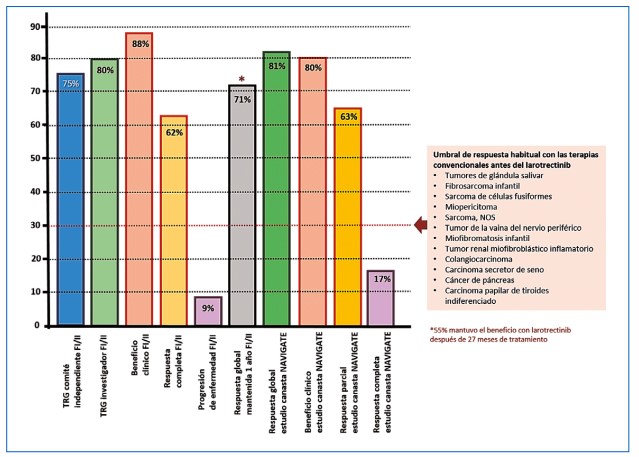
Figura 8. Caracterización de la respuesta con larotrectinib en la secuencia de estudios fase I y II (incluyendo el estudio canasta NAVIGATE) respecto del umbral obtenido con diversas intervenciones convencionales previamente utilizadas.
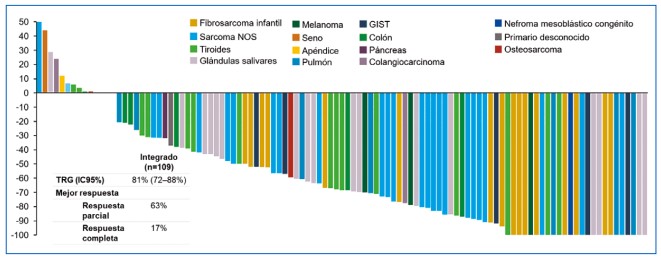
Figura 9. Eficacia del larotrectinib en diversos tumores (conjunto actualizado de datos integrados, 2018). La tasa de respuesta global es 81 % y la respuesta completa 17 %.
Las figuras 10 y 11 incluyen dos casos representativos, el primero, de una mujer de 59 años con un adenocarcinoma de pulmón portador de la fusión TP53-NTRK1 tratada inicialmente con carboplatino/pemetrexed/ pembrolizumab, intervención con la que alcanzó estabilidad.
Posteriormente, y ante la evidencia de extensión visceral y ganglionar (supervivencia libre de progresión de 5,1 meses) recibió larotrectinib (a partir de octubre de 2019) logrando respuesta parcial después de 8 semanas de intervención. El segundo, corresponde a un paciente pediátrico (13 años) con un ganglioglioma anaplásico recurrente y refractario a la quimioradiación con la alteración TPM3-NTRK1 tratado con larotrectinib por 13 meses, intervención con la que se logró respuesta completa.
De esta forma, la terapia agnóstica permite el desarrollo de un abordaje basado no solo en el linaje histológico de la neoplasia, si no también, dirigido hacia las alteraciones genómicas comunes. Esta evolución, ha marcado el desarrollo de la terapia personalizada, permitiendo una selección más depurada de los pacientes y su tratamiento.
Entrectinib y pembrolizumab
El entrectinib fue aprobado el 15 de agosto de 2019 por la FDA, para el tratamiento de pacientes adultos y pediátricos (>12 años) con tumores sólidos portadores de la mutación de fusión NTRK, que se asocien a lesiones metastásicas o aquellos tumores no susceptibles de resección quirúrgica y que han progresado después del tratamiento. La aprobación se basó en la demostración de una tasa de respuesta general duradera del 57 % (95 % de confianza intervalo: 43-71), incluida una tasa de respuesta completa del 7 %, entre 54 pacientes tratados con entrectinib con 10 tipos diferentes de tumores que albergan una fusión NTRK inscritos en uno de los tres grupos clínicos de un solo brazo. La duración de la respuesta varió entre 2,8 y 26 meses. Las reacciones adversas fueron manejables mediante interrupciones de dosis (46 %), reducciones de dosis (29 %), o suspensión de entrectinib (9 %). Esta es la tercera aprobación de un fármaco contra el cáncer para el tratamiento de un tejido agnóstico, definido por biomarcadores tumorales (55).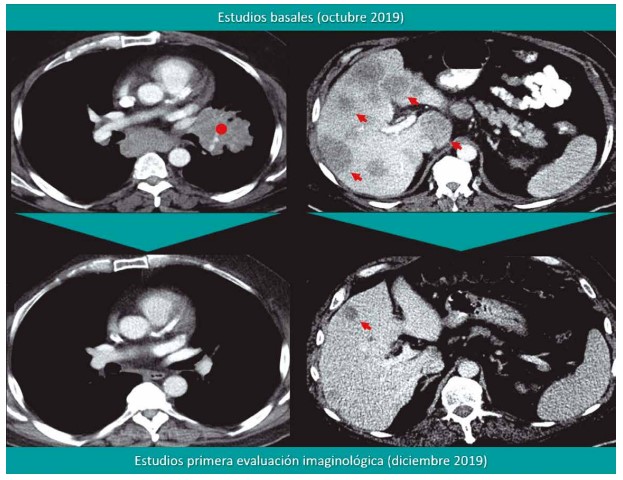
Figura 10. Respuesta parcial tras la administración de larotrectinib en un paciente con adenocarcinoma de pulmón portador de la traslocación TP53-NTRK1.
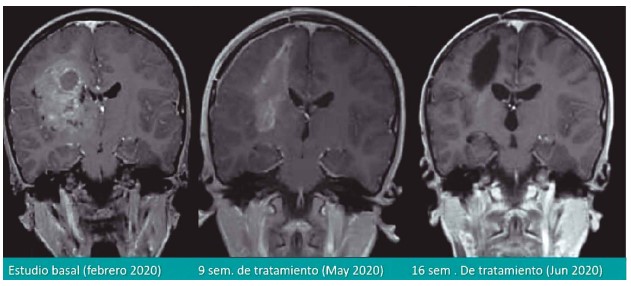
Figura 11. Respuesta de glioma NTRK1 positivo tras el inicio de entrectinib.
La aprobación del entrectinib para tumores sólidos con fusiones de genes de NTRK se basó, en parte, en resultados de tres estudios clínicos pequeños: ALKA-372-001, STARTRK-1 y STARTRK-2. Se realizó un análisis que compiló estos tres estudios encontrando que de 4 de 54 pacientes (7 %) presentaron respuestas completas y 27 (50 %) respuestas parciales. De esta forma se evidenció que entrectinib indujo respuestas duraderas y clínicamente significativas en pacientes con tumores sólidos positivos a la fusión de NTRK y fue bien tolerado. Por otra parte, estos datos destacan la necesidad de realizar pruebas de rutina para las fusiones NTRK para ampliar las opciones terapéuticas disponibles para los pacientes positivos para la fusión NTRK(56).
Antes de la aprobación de entrectinib, pembrolizumab y larotrectinib recibieron la aprobación de la FDA para una indicación basada en biomarcadores independientemente del origen tumoral, siendo aprobado el pembrolizumab para el tratamiento de pacientes adultos y pediátricos con tumores irresecables o metastásicos que presentan inestabilidad de microsatélite alta (MSI-H). La aprobación de la FDA se basó en resultados combinados de cinco estudios clínicos de un solo grupo que evaluó la eficacia de pembrolizumab, que demostraban una tasa de respuesta global (TRG) del 39,6 % (IC 95 %: 31,7- 47,9], incluida una tasa de respuesta completa (RC) del 7 %, en 147 pacientes con varios tumores sólidos MSI-H (57).
En el estudio André y colaboradores, compararon pembrolizumab con la terapia convencional para pacientes con tumores colorrectales con dMMR o con MSI-H. El pembrolizumab produjo una supervivencia libre de progresión significativamente más prolongada que la quimioterapia cuando se recibió como terapia de primera línea para el cáncer colorrectal metastásico MSI-H-dMMR (mediana, 16,5 frente a 8,2 meses; HR, 0,60; IC 95 %, 0,45 – 0,80; P = 0,0002), con menos eventos adversos relacionados con el tratamiento. Los eventos adversos grado 3 o superiores relacionados con el tratamiento ocurrieron en el 22 % de los pacientes en el grupo de pembrolizumab, en comparación con el 66 % en el grupo de quimioterapia (58).
Aunque las respuestas suelen ser duraderas, muchos pacientes desarrollan resistencia a TRKi debido a mutaciones en uno de los genes TRK, o debido a alteraciones genéticas que confieren la activación de vías de señalización oncogénicas alternativas. Por esta razón, se ha desarrollado TRKi de segunda generación, que pueden superar algunas de las mutaciones de resistencia a TRK(59).
Repotrectinib y Selitrectinib
La detección de mecanismos de resistencia, ha dado lugar al desarrollo incluso de una segunda generación de inhibidores NTRK, dentro de los cuales cabe mencionar el papel fundamental de reprotectinib y selitrectinib. El Repotrectinib es un nuevo inhibidor de ALK/ROS1/NTRK de nueva generación diseñado para superar las mutaciones de resistencia a TKI, especialmente la mutación ROS1 G2032R2(60). Los grados de toxicidad encontrados con mayor frecuencia fueron mareos (49 %), disgeusia (48 %), parestesia (28 %) y estreñimiento (20 %). Un total de siete pacientes que fueron positivos para la fusión de NTRK fueron evaluables para la respuesta y dos pacientes que fueron tratados previamente con NTRKi respondieron. En general, uno de los que respondieron tenía carcinoma secretor análogo mamario y mutación G623E en la fusión NTRK3. Los 5 pacientes con NSCLC ROS1+ con G2032R SFM experimentaron regresiones tumorales con una cORR del 40 %. El estudio de fase II de reprotectinib está actualmente en curso (ClinicalTrials. gov identifier: NCT03093116) y confirmará la eficacia clínica y ayudará a dilucidar el mecanismo de resistencia a estos NTRKi de segunda generación (61,62).Por su parte, Selitrectinib está bajo investigación en el ensayo clínico NCT03215511 (estudio de fase 1/2 de LOXO-195 en pacientes con cánceres de fusión NTRK previamente tratados con iTRK) y se realiza para probar la seguridad del medicamento en niños y adultos con cáncer y mutaciones de NTRK (NTRK1, NTRK2 o NTRK3) (63,64).
Este abordaje, sin lugar a duda se ha convertido en el nuevo paradigma de la oncología al disponer de eventos mutagénicos como lo son las fusiones génicas, que se pueden detectar en la biopsia líquida, proporcionando mejores soluciones para los pacientes con cáncer en quienes la terapia agnóstica podría ser la base para mejorar la calidad de vida.
Tabla 2. Enfoque gradual hacia la preparación del sistema de salud en los cinco enfoques
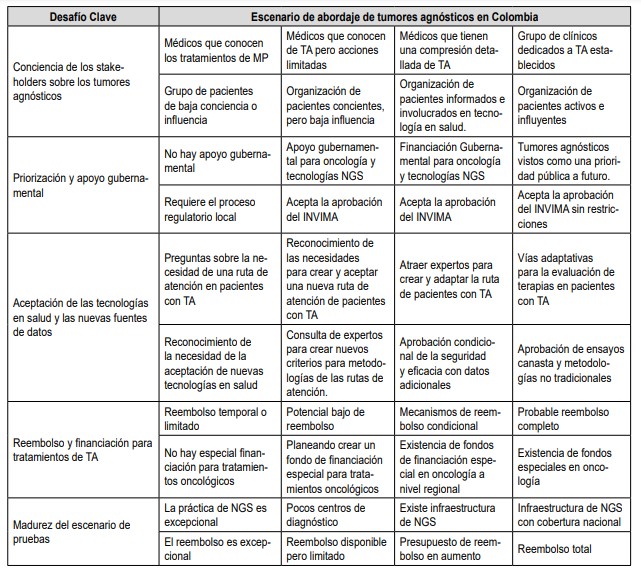
MP: Medicina de Precisión; TA: Tumores Agnósticos.
Desafíos clave para el acceso a terapia personalizada en pacientes con tumores siguiendo una perspectiva agnóstica
Probablemente ningún sistema de un país sea óptimo para permitir el acceso a terapias independientes del tumor; sin embargo, las mejores prácticas, la experiencia y los conocimientos están ampliamente disponibles para mejorar y potencializar el acceso de estas terapias. A continuación, se describen los puntos clave en la habilitación que son necesarios para apoyar el acceso de los pacientes a terapias agnósticas de tumores, y se proporcionan ejemplos a nivel local en los que pagadores, médicos y representantes de los pacientes han comenzado a abordar estos desafíos.Sensibilización de las partes interesadas sobre las terapias de tumores agnósticos
Uno de los aspectos claves en el sistema de salud es generar sensibilización sobre la importancia de la inclusión de nuevas terapias en el abordaje integral de los pacientes con tumores agnósticos. De esta forma, es importante tener una comprensión común y el respaldo de las terapias agnósticas del tumor por parte de los representantes clínicos y de los pacientes. Una barrera significativa en la sensibilización es la baja incidencia de estos tipos de tumores junto con las diferentes nomenclaturas existentes en torno a los tumores agnósticos dentro de las que encontramos: “independientes de histología”, “pan-tumor” y “agnóstico de tejido”; todas refiriendo a un mismo término que dificulta la comprensión.Para estas terapias personalizadas en tumores agnósticos, la FDA otorgó rápidas aprobaciones basadas en la tasa de respuesta global y en la duración de la respuesta, con la información de pocos pacientes (menores a 200 en las terapias agnósticas aprobadas) emitida por estudios clínicos no controlados y de un solo brazo. Sin embargo, existen divergencias en los enfoques adoptados por las autoridades reguladoras nacionales en relación con la evidencia y la definición de resultados. Estos organismos de control utilizan -por lo generaldatos insuficientes generando rechazos que afectan de forma negativa la atención del paciente. Dentro de las causales de estas decisiones negativas se han identificado los siguientes problemas que pueden inferir en su decisión, se incluyen, primero, el desconocimiento respecto al diseño de los nuevos ensayos tipo canasta y segundo, la poca familiarización con el uso de criterios basados en biomarcadores como marcador pronóstico o de respuesta al tratamiento.
Tabla 3. Aspectos para mejorar las barreras identificadas en el acceso a terapias dirigidas.

Preparación del sistema de salud para el acceso de terapias innovadoras
Para conocer los beneficios de estas nuevas terapias y facilitar el acceso de pacientes a las terapias de TA, los responsables políticos, reguladores, contribuyentes y la industria deberán tomar acciones que garanticen la aceptación y fomenten la innovación continua en los cánceres relevantes. En ese orden de ideas, se debería buscar una concertación entre entes reguladores y organizaciones nacionales de tecnología en salud para el diseño de una “vía rápida” que promueva el acceso de los pacientes a tratamientos nuevos; la inversión en nuevos protocolos para la implementación de técnicas moleculares que amplíen su uso en la práctica clínica, y el enriquecimiento de la base científica nacional en cuanto a tumores agnósticos como fuente de información para la toma de decisiones por parte de los entes reguladores en políticas que beneficien a los pacientes que padecen estas enfermedades.
Referencias
1.
Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre
LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of
incidence and mortality worldwide for 36 cancers in 185 countries. CA
Cancer J Clin.
2018;68(6):394–424.
2. World Health Organization. Cancer Today [Internet]. Global Cancer Observatory. 2020 [consultado febrero 15 2021]. Disponible en: https://gco.iarc.fr/
3. DANE. [Internet]. Estadisticas Vitales.. 2021. [consultado febrero 15 2021]. Disponible en: https://www.dane.gov.co/files/investigaciones/poblacion/pre_estadisticasvitales_IVtrim_2020pr.pdf
4. Mitchell AP, Tabatabai SM, Dey P, Ohn JA, Curry MA, Bach PB. Association between clinical value and financial cost of cancer treatments: A cross-sectional analysis. JNCCN J Natl Compr Cancer Netw. 2020;18(10):1349– 53.
5. Howard DH, Bach PB, Berndt ER, Conti RM. Pricing in the Market for Anticancer Drugs. [Internet].Pubs. aeaweb.org. 2022 [consultado febrero 21 2022]. Disponible en: https://pubs.aeaweb.org/doi/pdfplus/10.1257/jep.29.1.1396.
6. Schwartzberg L, Kim ES, Liu D, Schrag D. Precision Oncology: Who, How, What, When, and When Not?.ASCO Edfucational Book.2017;(37):160-169.
7. Gentles AJ, Newman AM, Long Liu C, Bratman S V, Feng W, Kim D, et al. The prognostic landscape of genes and infiltrating immune cells across human cancers HHS Public Access Author manuscript. Nat Med. 2015;21(8):938–45.
8. Newman AM, Liu CL, Green MR, Gentles AJ, Feng W, Xu Y, et al. Robust enumeration of cell subsets from tissue expression profiles. Nat Methods. 2015;12(5):453– 7.
9. Ginsburg GS, Phillips KA. Precision medicine: From science to value. Health Aff. 2018;37(5):694–701.
10. Levy BP, Chioda MD, Herndon D, Longshore JW, Mohamed M, Ou S-HI, et al. Lung Cancer Molecular Testing for Treatment of Metastatic Non-Small Cell Lung Cancer: How to Implement Evidence-Based Recommendations.2022.
11. Westphalen CB, Krebs MG, Le Tourneau C, Sokol ES, Maund SL, Wilson TR, et al. Genomic context of NTRK1/2/3 fusion-positive tumours from a large realworld population. NPJ Precis Oncol. 2021;5(1):69.
12. Attwood MM, Fabbro D, Sokolov A V., Knapp S, Schiöth HB. Trends in kinase drug discovery: targets, indications and inhibitor design. Nat Rev Drug Discov. 2021;20(11):839–61.
13. El Bairi K, Atanasov AG, Amrani M, Afqir S. The arrival of predictive biomarkers for monitoring therapy response to natural compounds in cancer drug discovery. Biomed Pharmacother. 2019;109:2492–8.
14. Yates LR, Seoane J, Le Tourneau C, Siu LL, Marais R, Michiels S, et al. The European Society for Medical Oncology (ESMO) Precision Medicine Glossary. Ann Oncol .2018;29(1):30–5.
15. Marquart J, Chen EY, Prasad V. Estimation of the Percentage of US Patients With Cancer Who Benefit From Genome-Driven Oncology. JAMA Oncol. 2018;4(8):1093.
16. Stransky N, Cerami E, Schalm S, Kim JL, Lengauer C. ARTICLE The landscape of kinase fusions in cancer.Nat Commun. 2014;5:4846.
17. Bravo LE, Muñoz N. Epidemiology of cancer in Colombia. Colomb Med. 2018;49(1):09–12.
18. Pennic F. The State of Value-based Care in 2018: 10 Key Trends to Know [Internet]. Hitconsultant.net. 2022 [consultado febrero 15 2022]..Disponible en: https://hitconsultant.net/2018/06/18/value-based-care-trends/#.YE_IpJ1KiUk 19. Schram AM, Reales D, Galle J, Cambria R, Durany R, Feldman D, et al. Oncologist use and perception of large panel next-generation tumor sequencing.Ann Oncol. 2017;28(9):2298–304.
20. Rolfo C, Manca P, Salgado R, Dam P Van, Dendooven A, Coelho AM, et al. Multidisciplinary molecular tumour board : a tool to improve clinical practice and selection accrual for clinical trials in patients with cancer. ESMO Open. 2018;3(5):e000398.
21. Marrone M, Filipski KK, Gillanders EM, Schully SD, Freedman AN. Multi-marker Solid Tumor Panels Using Next-generation Sequencing to Direct Molecularly Targeted Therapies.[Internet]. PLoS Curr [consultado febrero 12 2022]. 2014;6. Disponible en:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4038678/
22. Freedman AN, Klabunde CN, Wiant K, Enewold L, Gray SW, Filipski KK, et al. Use of Next-Generation Sequencing Tests to Guide Cancer Treatment: Results From a Nationally Representative Survey of Oncologists in the United States. JCO Precis Oncol. 2018;(2):1–13.
23. Mansfield AS, Park BH, Mullane MP. Identification, Priorization, and Treatment of Mutations Identified by Next-Generation Sequencing. . Am Soc Clin Oncol Educ Book. 2018;38:873–880.
24. Gatalica Z, Xiu J, Swensen J, Vranic S. Molecular characterization of cancers with NTRK ene fusions. Mod Pathol. 2019;32(1):147–53.
25. Hechtman JF, Benayed R, Hyman DM, Drilon A, Zehir A, Frosina D, et al. Pan-Trk Immunohistochemistry Is an Efficient and Reliable Screen for the Detection of NTRK Fusions. Am J Surg Pathol. 2017;41(11):1547-1551.
26. Hung Y, Fletcher C, Hornick J. Evaluation of pan-TRK immunohistochemistry in infantile fibrosarcoma, lipofibromatosis-like neural tumour and histological mimics. Histopathology. 2018;73(4):634–44.
27. Rudzinski ER, Lockwood CM, Stohr BA, Vargas SO, Sheridan R, Black JO, et al. Pan-Trk Immunohistochemistry Identifies NTRK Rearrangements in Pediatric Mesenchymal Tumors. Am J Surg Pathol. 2018;42(7):927– 35.
28. Amatu A, Sartore-Bianchi A, Siena S. NTRK gene fusions as novel targets of cancer therapy across multiple tumour types. ESMO Open. 2016;1(2):1–9.
29. Gavan SP, Thompson AJ, Payne K. The economic case for precision medicine. Expert Rev Precis Med Drug Dev. 2018;3(1):1-9.
30. Goldman DP, Gupta C, Vasudeva E, Trakas K, Riley R, Lakdawalla D, et al. The Value of Diagnostic Testing in Personalized Medicine. Forum Heal Econ Policy. 2013;16(2):S87–99.
31. Vaishnavi A, Le AT, Doebele RC. TRKing Down an Old Oncogene in a New Era of Targeted Therapy. [Internet]. Aacrjournals.iorg. 2022. Disponible en: http://aacrjournals.org/cancerdiscovery/article-pdf/5/1/25/1821210/25.pdf
32. Amatu A, Sartore-Bianchi A, Bencardino K, Pizzutilo EG, Tosi F, Siena S. Tropomyosin receptor kinase (TRK) biology and the role of NTRK gene fusions in cancer. Ann Oncol. 2019;30(Supplement 8):VIII5–15.
33. Farago AF, Taylor MS, Doebele RC, Zhu VW, Kummar S, Spira AI, et al.. Clinicopathologic Features of NonSmall-Cell Lung Cancer Harboring an NTRK Gene Fusion.JCO Precis Oncol. 2018;2018:PO18.00037.
34. Vaishnavi A, Capelletti M, Le AT, Kako S, Butaney M, Ercan D, et al. Oncogenic and drug sensitive NTRK1 rearrangements in lung cancer. Nat Med . 2013;19(11):1469–72.
35. Milione M, Ardini E, Christiansen J, Valtorta E, Veronese S, Bosotti R, et al. Identification and characterization of a novel SCYL3-NTRK1 rearrangement in a colorectal cancer patient. Oncotarget. 2017;8(33):55353-55360.
36. Heymach J, Krilov L, Alberg A, Baxter N, Chang SM, Corcoran R, et al. Clinical cancer advances 2018: Annual report on progress against cancer from the American Society of Clinical Oncology. J Clin Oncol. 2018;36(10):1020–44.
37. Chen HZ, Bonneville R, Roychowdhury S. Implementing precision cancer medicine in the genomic era. Semin Cancer Biol. 2019;55:16–27.
38. Roychowdhury S, Chinnaiyan AM. Translating Cancer Genomes and Transcriptomes for Precision Oncology. CA Cancer J Clin. 2016;66:75–88.
39. Hirakawa A, Asano J, Sato H, Teramukai S. Master protocol trials in oncology: Review and new trial designs. Contemp Clin Trials Commun. 2018;12:1–8.
40. Tao JJ, Schram AM, Hyman DM. Basket Studies: Redefining Clinical Trials in the Era of Genome-Driven Oncology. Annu Rev Med. 2018;69:319-331.
41. Cunanan KM, Gonen M, Shen R, Hyman DM, Riely GJ, Begg CB, et al. Basket Trials in Oncology: A TradeOff Between Complexity and Efficiency. J Clin Oncol. 2017;35(3):271-273.
42. Bertrand T, Kothe M, Liu J, Dupuy A, Rak A, Berne PF, et al. The crystal structures of TrkA and TrkB suggest key regions for achieving selective inhibition. J Mol Biol. 2012;423(3):439–53.
43. Raeppel SL, Gaudette F, Nguyen H, Beaulieu N, Wang J, Maroun C, et al. Identification of a Novel Series of Potent TrkA Receptor Tyrosine Kinase Inhibitors. Int J Med Chem. 2012;2012:412614.
44. Burris H, Shaw A, Bauer T. Farago A, Doebele R, Smith S et al. Abstract 4529: Pharmacokinetics (PK) of LOXO101 during the first-in-human Phase I study in patients with advanced solid tumors: Interim update. Cancer Research and Treatment. 2015.
45. Doebele RC, Davis LE, Vaishnavi A, Le AT, Estrada-Bernal1 A, Keysar S, et al. An oncogenic NTRK fusion in a soft tissue sarcoma patient with response to the tropomyosin-related kinase (TRK) inhibitor LOXO-101. Cancer Discov. 2015;5(10):1049–57.
46. Drilon A, Siena S, Ignatius Ou S-H, Patel M, Ju Ahn M, Lee J, et al. Safety and Antitumor Activity of the Multitargeted Pan-TRK, ROS1 , and ALK Inhibitor Entrectinib: Combined Results from Two Phase I Trials (ALKA372-001 and STARTRK-1) investigators.[Internet]. Aacrjournals.org. 2022 [consultado febrero 15 de 2022] Disponible en: http://aacrjournals.org/cancerdiscovery/article-pdf/7/4/400/1839104/400.pdf
47. Patwardhan PP, Ivy KS, Musi E, De Stanchina E, Schwartz GK. Significant blockade of multiple receptor tyrosine kinases by MGCD516 (Sitravatinib), a novel small molecule inhibitor, shows potent anti-tumor activity in preclinical models of sarcoma. Oncotarget. 2016;7(4):4093-4109.
48. Smith BD, Kaufman MD, Leary CB, Turner BA, Wise SC, Ahn YM, et al. Altiratinib Inhibits Tumor Growth, Invasion, Angiogenesis, and Microenvironment-Mediated Drug Resistance via Balanced Inhibition of MET, TIE2, and VEGFR2. Mol Cancer Ther . 2015;14(9):2023-2034
49. Abrams J, Conley B, Mooney M, Zwiebel J, Chen A, Welch JJ, et al. National Cancer Institute’s Precision Medicine Initiatives for the New National Clinical Trials Network. Am Soc Clin Oncol Educ B. 2014;(34):71–6.
50. Laetsch TW, Dubois SG, Mascarenhas L, Federman N, Albert CM, Davis JL, et al. Larotrectinib for paediatric solid tumours harbouring NTRK gene fusions: a multicentre, open-label, phase 1 study. Lancet Oncol. 2018;19(5):705–14.
51. Patwardhan P, Ivy K, Musi E, de Stanchina E, Schwartz G. Significant blockade of multiple receptor tyrosine kinases by MGCD516 (Sitravatinib), a novel small molecule inhibitor, shows potent anti-tumor activity in preclinical models of sarcoma. Oncotarget. 2015;7(4):4093-4109.
52. Dubois SG, Laetsch TW, Federman N, Turpin BK, Albert CM, Nagasubramanian R, et al. The Use of Neoadjuvant Larotrectinib in the Management of Children With Locally Advanced TRK Fusion Sarcomas. Clinical Trial. 2018;4241–7.
53. Drilon A, Laetsch TW, Kummar S, Dubois SG, Lassen UN, Demetri GD, et al. Efficacy of Larotrectinib in TRK Fusion–Positive Cancers in Adults and Children. N Engl J Med. 2018;378(8):731–9.
54. Lassen UN, Albert CM, Kummar S, van Tilburg CM, Dubois SG, Geoerger B, et al. Larotrectinib efficacy and safety in TRK fusion cancer: An expanded clinical dataset showing consistency in an age and tumor agnostic approach. Ann Oncol. 2018;29:viii133.
55. Marcus L, Donoghue M, Aungst S, Myers CE, Helms WS, Shen G, et al. FDA Approval Summary : Entrectinib for the Treatment of NTRK gene Fusion Solid Tumors. Clin Cancer Res. 2021;928–32.
56. Doebele RC, Drilon A, Paz-ares L, Siena S, Shaw AT, Farago F, et al. Entrectinib in patients with advanced or metastatic NTRK fusion_positive solid tumours: integrated analysis of three phase 1–2 trials. Lancet Oncol. 2020;21(2):271–82.
57. Le DT, Uram JN, Wang H, Bartlett BR, Kemberling H, Eyring AD, et al. PD-1 Blockade in Tumors with MismatchRepair Deficiency. N Engl J Med. 2016;372(26):2509– 20.
58. André T, Shiu K-K, Kim TW, Jensen B V., Jensen, L. H., Punt C, Diaz LA. Pembrolizumab in Microsatellite-Instability–High Advanced Colorectal Cancer. N Engl J Med. 2020;383(23):2207–18.
59. Rohrberg KS, Lassen U. Detecting and Targeting NTRK Fusions in Cancer in the Era of Tumor Agnostic Oncology. Drugs. 2021;81(4):445–52.
60. Lin JJ, Hubbeling HG, Ferris LA, Iafrate AJ. Patterns of Metastatic Spread and Mechanisms of Resistance to Crizotinib in ROS1 -Positive Non – Small-Cell Lung Cancer. JCO Precis Oncol. 2017;1001:1–13.
61. Cho BC, Drilon A, Doebele RC, Kim D, Lin JJ, Lee J, et al. Safety and Preliminary Clinical Activity of Repotrectinib in Patients with Advanced ROS1 Fusion-Positive Non-Small Cell Lung Cancer ( TRIDENT-1 STUDY ) . J Clin Oncol. 2019;37(15 supl.):9011–9011.
62. Chu QS. Targeting non-small cell lung cancer : driver mutation beyond epidermal growth factor mutation and anaplastic lymphoma kinase fusion. Ther Adv Med Oncol. 2020;1–27.
63. A Study to Test the Safety of the Investigational Drug Selitrectinib in Children and Adults That May Treat Cancer [Internet]. Clinicaltrrials.gov. 2017 [consultado febrero 15 2022]. Disponible en: https://clinicaltrials.gov/ct2/show/NCT03215511
64. Sparidans RW, Li W, Schinkel AH, Beijnen JH. Bioanalytical assay for the novel TRK inhibitor selitrectinib in mouse plasma and tissue homogenates using liquid chromatography-tandem mass spectrometry. J Chromatogr B . 2019;1122–1123:78–82.
Aceptado: 15 de marzo de 2022
Correspondencia:
Andrés F. Cardona
acardona@fctic.org