DEL COVID-19 AL POSCOVID-19: LECCIONES Y DESAFÍOS
..................
Yeny
Acosta-Ampudia ¹
, Carolina Ramírez-Santana ¹
, Diana M. Monsalve ¹
, Manuel Rojas¹
Resumen
La enfermedad por el coronavirus (COVID-19) es causada por el nuevo coronavirus de tipo 2 del síndrome respiratorio agudo severo (SARS-CoV-2). Esta enfermedad es asintomática o leve en aproximadamente el 80 % de los casos, y severa o crítica en el 20 % restante. La COVID-19 fue considerada inicialmente una enfermedad pulmonar, pero ahora se reconoce como una enfermedad multiorgánica con un amplio espectro de manifestaciones clínicas. Algunos pacientes que sufren una infección aguda por SARS-CoV-2 desarrollan una amplia variedad de síntomas persistentes que no se resuelven en el transcurso de muchos meses. Esta condición es conocida como síndrome post-covid-19 (SPC). La respuesta inflamatoria persistente, la desregulación de la respuesta inmune innata y adaptativa, la presencia de autoinmunidad latente y autoinmunidad manifiesta y los reservorios persistentes de SARS-CoV-2 en ciertos tejidos pueden ser responsables de la severidad de la enfermedad en la infección aguda y de las secuelas del SPC. En este artículo presentamos la interacción del SARS-CoV-2 con el sistema inmune y la posterior contribución de las respuestas inmunes disfuncionales en la progresión de la enfermedad. Finalmente, destacamos las implicaciones de las intervenciones terapéuticas dirigidas para controlar la infección viral y regular la respuesta inmune.
Palabras clave: SARS-CoV-2; COVID-19; Síndrome poscovid; autoinmunidad; inflamación.
..............
FROM COVID-19 TO POSTCOVID-19: LESSONS AND CHALLENGES
Abstract
Coronavirus disease (COVID-19)
is caused by the novel severe acute respiratory syndrome
coronavirus type 2 (SARS-CoV-2). This disease is asymptomatic or mild
in approximately 80%
of cases, and severe or critical in the remaining 20%. COVID-19 was
initially considered a pulmonary disease; however, it is now recognized
as a multi-organ disease with a wide spectrum
of manifestations.
Some patients with acute SARS-CoV-2 infection develop a wide variety of
persistent symptoms that do not resolve over months. This condition is
known as post-COVID syndrome
(PCS). The persistent inflammatory response, the dysregulation of the
innate and adaptive immune response, the presence of latent and overt
autoimmunity, and SARS-CoV-2 reservoirs
in certain tissues may be responsible for the severity of acute
infection and sequelae of SPC.
In this review, we present the interaction of SARS-CoV-2 with the immune system and the subsequent contribution of dysfunctional immune responses to disease progression. Finally, we highlight the implications of targeted therapeutic interventions to control viral infection and regulate the immune response.
Key words: SARS-CoV-2; COVID-19; Post-covid syndrome; autoimmunity; inflammation.
Introducción
La infección por SARS-CoV-2, agente causal de la enfermedad por el coronavirus (COVID-19), se ha propagado causando una alta mortalidad y morbilidad. El origen de la pandemia se remonta a un grupo de casos de neumonía viral relacionados epidemiológicamente con un mercado de mariscos en la ciudad de Wuhan en China (1,2). El 30 de enero, la Organización Mundial de la Salud (OMS) declaró el nuevo brote de COVID-19 como una emergencia de salud pública de importancia internacional (3). La COVID-19 se ha categorizado por una evolución de fases superpuestas. Primero, hay una fase viral que bien puede ser asintomática o leve en aproximadamente en el 80 % de los pacientes. En el 20 % restante, la enfermedad puede ser grave o crítica. En la mayoría de los pacientes críticos, existe una fase caracterizada por la hiperreactividad del sistema inmune que desencadena un estado de hipercoagulabilidad y finalmente, una lesión y falla orgánica (4). El SARS-CoV-2 comparte alrededor del 89 % de identidad de secuencia con otros coronavirus (5) y en menor proporción con el genoma del SARS-CoV (79 %) y con MERS-CoV (50 %) (6). El genoma del SARS-CoV-2 está compuesto por seis marcos de lectura abiertos: replicasa (ORF1a/ORF1b), espiga (S), envoltura, membrana y nucleocápside. El gen replicasa codifica una poliproteína que se escinde proteolíticamente en 16 proteínas no estructurales involucradas en la transcripción y replicación del virus (7,8).En esta revisión describimos el papel de la respuesta inmune y sus aproximaciones terapéuticas en la fase aguda de la infección por SARS-CoV-2 y en el SPC.
COVID-19 agudo
Mecanismo de invasión del SARS-CoV-2
El SARS-CoV-2 infecta a las células humanas al unirse a la enzima convertidora de angiotensina-2 (ACE-2) a través del dominio de unión al receptor de su proteína S (9). Esta enzima se expresa en células del epitelio ciliado de la nasofaringe y el tracto respiratorio superior, epitelio bronquial, neumocitos tipo II, además de macrófagos o monocitos, mastocitos y células endoteliales vasculares (10). Una vez se da el acople, la proteína S unida a ACE-2 sufre una escisión proteolítica catalizada por la proteasa transmembrana de serina 2 (TMPRSS2) para mediar la fusión con la membrana celular. Después de este proceso, las partículas virales internalizadas liberan el ARN para el comienzo de la replicación de nuevos viriones (11) (figura 1). ACE-2 soluble ha sido relacionada con severidad en pacientes con COVID-19 agudo (12). Sin embargo, otros estudios, incluyendo el nuestro, no observaron correlación significativa de los niveles de ACE-2 soluble y los parámetros clínicos en pacientes con COVID-19 (13,14). Adicional a ACE-2, se ha demostrado la participación de otras proteínas como la furina y la neuropilina en el proceso de infección (15). La proteína S es escindida en S1 y S2 por TMPRSS2 para permitir la fusión de las membranas viral y celular (16).Inmunidad innata y adaptativa
La inmunidad innata es la primera línea de defensa frente al virus, la cual incluye macrófagos, monocitos, células dendríticas, neutrófilos y células asesinas naturales armadas con receptores de reconocimiento de patrones (RRP) como los receptores Toll-like (TLR). Estos receptores ayudan a la activación del factor nuclear κB, las proteínas quinasas activadas por mitógeno y los factores reguladores del interferón (IFN) que conllevan a: 1) la producción de citoquinas proinflamatorias, incluyendo el factor de necrosis tumoral (TNF), interleuquina (IL)-6 e IL-1, 2) la producción de quimioquinas que ayudan al reclutamiento de otras células, y 3) la transcripción de genes que codifican otros sensores innatos, como NLRP3 e IFN de tipo I y II, y los genes estimulados por IFN (17) (figura 1). Varios estudios han demostrado que el TLR2 juega un papel importante en la activación de la inflamación tras la infección por SARS-CoV-2 (18). Estudios in silico sugieren que la proteína S del SARS-CoV-2 puede unirse a TLR1, TLR4 y TLR6, teniendo mayor afinidad por TLR4 (19). La activación de los RRP por el SARS-CoV-2 puede inducir la liberación desregulada de IL-1β, IL-6, TNF, IL-12, IFN-β, IFN-γ, IL-17, entre otras, que contribuyen a la tormenta de citoquinas y a la mortalidad en COVID-19 (20).La activación de la respuesta inmune innata y la evasión del SARS-CoV-2 a esta respuesta conlleva a la activación de la respuesta inmune adaptativa (21). Las células B de los centros germinales pueden proliferar y diferenciarse en células plasmáticas, produciendo y secretando anticuerpos específicos para controlar la replicación del SARS-CoV-2. La mayoría de los estudios serológicos sugieren que los anticuerpos antiSARS-CoV-2 IgM aparecen entre los 8 y 12 días después del inicio de los síntomas y perduran por algunos meses. Mientras, los anticuerpos IgG aparecen en un promedio de 14 días permaneciendo por más tiempo. La durabilidad de estos anticuerpos parece estar directamente relacionada con la severidad de la COVID-19 (22–24) (figura 1). Todavía no es claro el grado y la duración de la protección conferida tras la infección por este virus, no obstante, estudios han mostrado que la inmunidad humoral contra el SARS-CoV-2 puede no ser duradera en pacientes con COVID-19 leve (25,26) (figura 2). Además, la potencia de unión y neutralización de los anticuerpos generados tras una primera infección puede ser significativamente reducida tras la aparición de nuevas variantes (27). Por otro lado, SARS-CoV-2 provoca respuestas de células T de memoria altamente funcionales. Los individuos que se recuperaron de COVID-19 severo presentan respuestas más fuertes; una respuesta menos intensa en pacientes con enfermedad leve, incluso en ausencia de anticuerpos anti-SARS-CoV-2 ha sido descrita. La respuesta celular en la fase aguda muestra un fenotipo citotóxico activado, mientras que en la fase convaleciente un fenotipo de memoria (28).
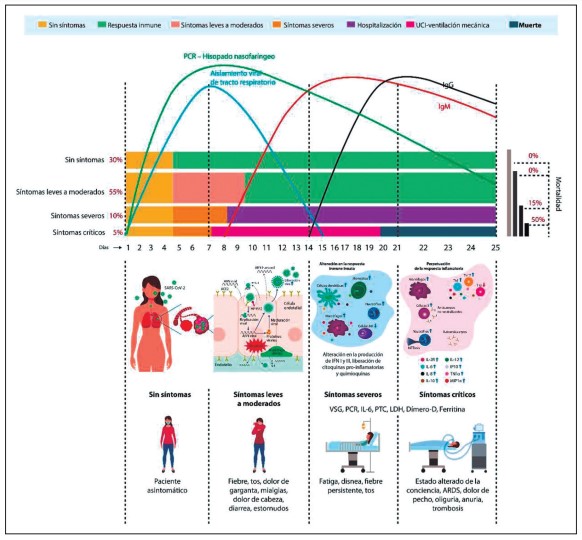
Figura 1. Resumen traslacional de la COVID-19. Se muestra la
cinética de seroconversión de los anticuerpos IgM e
IgG. La positividad de la PCR para SARS-CoV-2 podría durar más de 25
días después del inicio de la enfermedad.
Alrededor del 80 % de los pacientes no desarrollan síntomas o presentan
una enfermedad leve a moderada. La
infección de SARS-CoV-2 a través del receptor ACE-2 conduce a una
alteración de la respuesta inmune que puede
conllevar a la perpetuación de la respuesta inflamatoria representada
principalmente por migración de células
inmunes y liberación de citoquinas proinflamatorias y quimioquinas. La
presencia de autoanticuerpos puede estar
relacionada con la severidad de la enfermedad y el posible desarrollo
de un fenómeno autoinmune. *Todos estos
marcadores son factores de riesgo asociados a la progresión de la
enfermedad. Adaptado de (4).
Abreviaturas: ACE-2: enzima convertidora de angiotensina-2; ARDS: síndrome de dificultad respiratoria aguda; ARN: ácido ribonucleico; CXCL: ligando de quimioquina; Ig: inmunoglobulina; IFN: interferón; IL: interleuquina; IP-10: proteína 10 inducida por interferón-γ; LDH: lactato deshidrogenasa; MIP1α: proteína inflamatoria de macrófagos1α; NK: células asesinas naturales; PCR: reacción en cadena de la polimerasa; PCR: proteína C reactiva; PCT: procalcitonina; SARS-CoV-2: coronavirus de tipo 2 causante del síndrome respiratorio agudo severo; Th: linfocito T ayudador; TMPRSS2: proteasa transmembrana de serina 2; TNF: factor de necrosis tumoral; UCI: unidad de cuidados intensivos; VSG: velocidad de sedimentación globular.
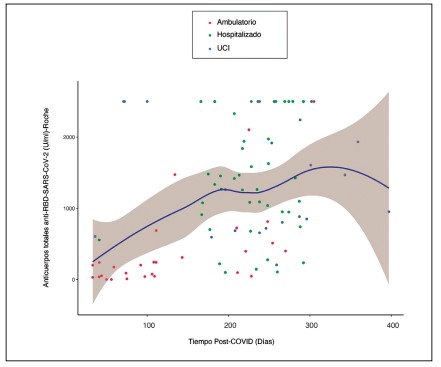
Figura 2. Anticuerpos anti-SARS-CoV-2 totales y tiempo post-COVID. La línea representa el gráfico de dispersión estimado con intervalos de confianza del 95 %. Tomado de (29). Abreviaturas: RBD: dominio de unión al receptor; SARS-CoV-2: coronavirus de tipo 2 causante del síndrome respiratorio agudo severo; UCI: unidad de cuidados intensivos.
Autoinmunidad en COVID-19
Varios estudios han demostrado que el SARS-CoV-2
puede actuar como desencadenante de una desregulación autoinmune y/o
autoinflamatoria. La producción de un amplio espectro de
autoanticuerpos puede
contribuir a la fisiopatología de la COVID-19 (30,31).
Wang y colaboradores (32) mostraron una alta prevalencia de
autoanticuerpos contra citoquinas, quimioquinas, componentes del
complemento y proteínas
de superficie celular en pacientes hospitalizados con
COVID-19; otro estudio evidenció la presencia de autoinmunidad latente
reumática, tiroidea y fosfolipídica
en pacientes con COVID-19. Los pacientes con alta
frecuencia de factor reumatoide, anticuerpos IgM antiβ2-glicoproteína I
y anticuerpos antinucleares (ANAs)
tenían una estancia hospitalaria prolongada, requerían
más vasopresores durante la hospitalización y tenían
más probabilidades de desarrollar una enfermedad crítica, indicando que
esta autoinmunidad latente influye
en la gravedad de la COVID-19 (33). Pascolini y colaboradores (34)
también demostraron la positividad de
autoanticuerpos incluyendo ANAs en el 45 % de los
pacientes con COVID-19. En otro estudio se evidenció que
aproximadamente el 10 % de los pacientes con
COVID-19 severo potencialmente mortal tienen anticuerpos neutralizantes
contra los IFN de tipo-I (35).
Además, se observó que estos autoanticuerpos tienen
una mayor prevalencia después de los 60 años (36).
Por tanto, la presencia de estos autoanticuerpos incrementa el riesgo
de muerte por COVID-19 de manera
dependiente de la edad (37). También se ha demostrado la relación de
una alta mortalidad con niveles
altos de anticuerpos antianexina A2 en pacientes con
COVID-19 (38) y adicionalmente, el diagnóstico de diversas enfermedades
autoinmunes cómo el síndrome
de Guillain-barré (39), enfermedad de Kawasaki (4),
lupus eritematoso sistémico (40), artritis reumatoide
(41), enfermedad autoinmune tiroidea (42,43), síndrome
antifosfolípidico (44) y púrpura trombocitopénica (45) en un subgrupo
de pacientes infectados con
SARS-CoV-2, lo cual indica el efecto crítico y fundamental de
SARS-CoV-2 sobre la inmunidad y su capacidad para desencadenar
trastornos autoinmunes en
sujetos genéticamente predispuestos.
Síndrome poscovid-19
Concepto y características clínicas
Aunque la mayoría de los pacientes con COVID-19
se recuperan completamente, muchos experimentan
síntomas de COVID-19 después de la recuperación de
la infección y otros incluso pueden desarrollar nuevos
síntomas (46). Este espectro clínico que ocurre después de una
infección aguda se denomina SPC, COVID-19 persistente o COVID-19
prologando (47). En
octubre de 2021, la OMS publicó una definición clínica del SPC:
“Enfermedad que ocurre en personas que
tienen antecedentes de infección probable o confirmada por SARS-CoV-2;
generalmente dentro de los tres
meses desde el inicio de COVID-19, con síntomas y
efectos que duran al menos dos meses” (48). Una amplia variedad de
síntomas crónicos/tardíos después de
la infección por SARS-CoV-2 han sido descritos: pulmonares (disnea,
tos, fibrosis pulmonar), cardiovasculares (dolor torácico,
palpitaciones, miocardiopatía
por estrés, miocarditis), hematológicos (eventos tromboembólicos),
neuropsiquiátricos (dolor de cabeza,
dolor crónico, fatiga, depresión, ansiedad, trastornos
del sueño, desequilibrio cognitivo, anosmia, paranestesia), renales
(insuficiencia renal), dermatológicas y
endocrinas (cetoacidosis diabética, tiroiditis de Hashimoto, enfermedad
de Graves) (49).
En nuestro grupo evaluamos sistemáticamente 100 pacientes con infección previa por SARS-CoV-2 (29). Los síntomas musculoesqueléticos, digestivos y neurológicos, incluida la depresión, fueron los más frecuentes en los pacientes con SPC. Un tercio de los pacientes presentaron al menos un síntoma musculoesquelético, respiratorio, gastrointestinal y neurológico simultáneamente. La artralgia y la diarrea persistieron en más del 40 % de los pacientes con el síndrome. Es importante resaltar que una hospitalización durante la fase aguda no se asoció con ninguna manifestación clínica del SPC. Además, una revisión sistemática de la literatura y un metanálisis demostró que más del 20 % de los pacientes tienen fatiga/ debilidad muscular, disnea, dolor y malestar, ansiedad/ depresión y problemas de concentración (figura 3).
Mecanismos inmunopatológicos del síndrome poscovid
Las vías inmunopatológicas que permiten el desarrollo del SPC no son del todo conocidas. Sin embargo, diferentes mecanismos han sido propuestos (figura 4): i) daño tisular a largo plazo, ii) persistencia viral, iii) autoinmunidad, iv) inflamación patológica, y v) desregulación celular.Anomalías radiológicas pulmonares y deficiencias funcionales han sido observadas en el SPC tres meses después del alta hospitalaria, independientemente de la gravedad inicial de la enfermedad (50). Incluso seis meses después del inicio de los síntomas, las anomalías radiológicas pulmonares persisten en la mitad de los sobrevivientes de COVID-19 (51). También existe evidencia de lesión cardíaca en COVID prolongado. Tres meses después del alta hospitalaria, las anomalías radiológicas del remodelado ventricular son evidentes en el 29 % de supervivientes de COVID-19 (52).
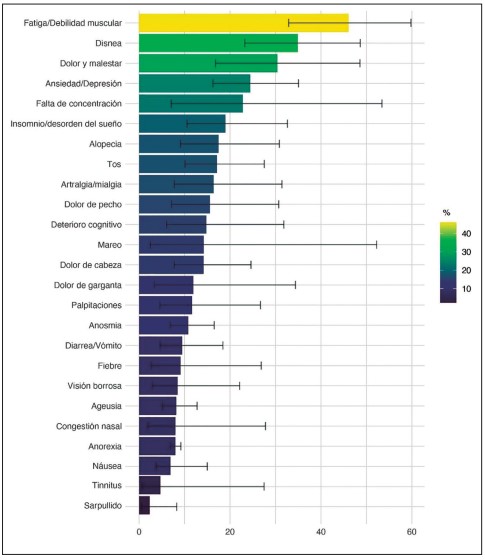
Figura 3. Manifestaciones clínicas del SPC. La barra de error representa el intervalo de confianza del 95 % estimado. Adaptado de (29).
Una infección viral persistente por SARS-CoV-2 implicaría una exposición persistente al superantígeno en el huésped. El superantígeno del virus podría sobreestimular las respuestas inmunitarias e inducir bucles de retroalimentación negativa que permitan la persistencia viral (53). Vibholm y Col. (54) encontraron que el 5,3 % de los individuos seguían siendo positivos para el SARS-CoV-2 incluso 90 días después de la infección. Gaebler y colaboradores (55) detectaron ARN viral en biopsias intestinales de pacientes asintomáticos 4 meses después de la infección aguda. Adicionalmente, ARN y antígenos virales han sido detectados en muestras de la mucosa olfativa de pacientes con pérdida continua del olfato entre 110 y 196 días después de la enfermedad aguda (56).
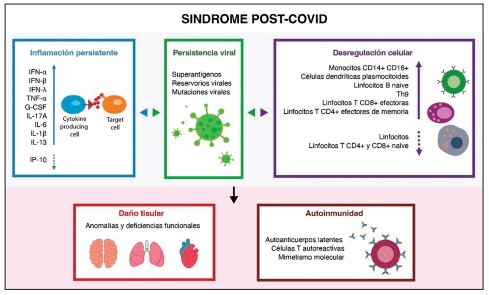
Figura 4. Mecanismos descritos en el SPC. La inflamación
persistente, la persistencia viral y la desregulación
inmune inducen daño tisular y autoinmunidad después de la infección por
SARS-CoV-2.
Abreviaturas: CD: cluster de diferenciación; IL: interleucina; IP-10: proteína 10 inducida por interferón-γ; IFN: interferón; G-CSF: factor estimulante de colonias de granulocitos; Th: linfocito T ayudador; TNF: factor de necrosis tumoral.
En nuestro estudio el análisis de componentes principales de citoquinas y linfocitos mostró que los pacientes con SPC fueron segregados de manera independiente de los controles prepandémicos y los pacientes con COVID-19 agudo (figura 5B). El SPC se definió como un estado proinflamatorio caracterizado por un aumento de IFN-α, TNF-α, G-CSF, IL-17A, IL-6, IL1β e IL-13 y una disminución de IP-10. Con respecto a los linfocitos, las células T CD8+ efectoras, células T CD4+ efectoras de memoria, Th9 y células B naive aumentaron en el SPC, mientras que las células T CD4+ y CD8+ naive y los linfocitos totales disminuyeron (58). Phetsouphanh y Col. (59) demostraron que pacientes con SPC tienen un aumento persistente en la frecuencia de monocitos CD14+ CD16+ y células dendríticas plasmocitoides, así como una elevación persistente en los niveles de interferón tipo I (IFN-β) y tipo III (IFN-λ) 8meses después de la infección.
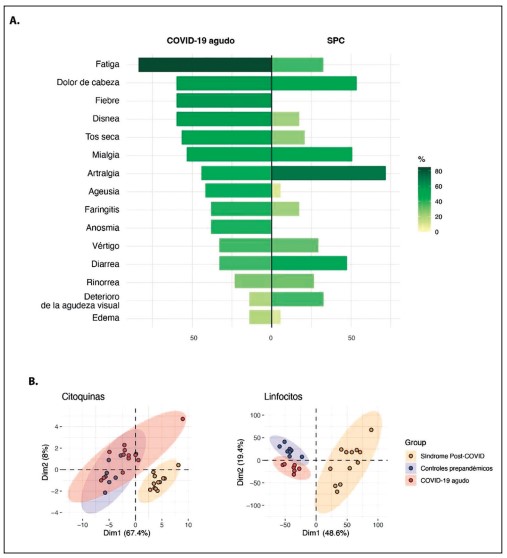
Figura 5. Características clínicas y perfil inmune del SPC. A. Síntomas del COVID-19 agudo y síndrome poscovid (SPC). B. Análisis de componentes principales de citoquinas y poblaciones celulares en controles prepandémicos, COVID-19 agudo y SPC. Tomado de (58).
La elevación persistente de citoquinas proinflamatorias puede tener efectos sistémicos y específicos de órganos asociados con manifestaciones del SPC. Estos incluyen remodelación cardíaca alterada, arritmias cardíacas, neuroinflamación, neurodegeneración, lesión renal, resistencia periférica a la insulina y reabsorción ósea (60).
Visvabharathy y colaboradores (61) demostraron que la gravedad de los déficits cognitivos o los marcadores de calidad de vida en pacientes con Neuro-SPC están asociados con una expresión reducida de moléculas efectoras en las células T de memoria. Otros estudios han revelado diferencias significativas en múltiples poblaciones celulares de la inmunidad innata (células NK, neutrófilos y monocitos CXCR3+) y adaptativa (células T foliculares y reguladoras), perturbaciones significativas en la expresión génica y en el transcriptoma de pacientes con SPC (62).
Tratamiento de COVID-19
Desde la aparición de los primeros casos de infección por SARS-CoV-2 en Wuhan, se inició una carrera para desarrollar tratamientos contra la COVID-19. Existen múltiples factores que determinan la selección de tratamientos para la COVID-19 como: tiempo de inicio de síntomas, manifestaciones clínicas, comorbilidades, eficacia clínica del tratamiento, disponibilidad de la opción de tratamiento, factibilidad de administrar medicamentos parenterales y prevalencia regional de las variantes de SARS-CoV-2 (63).La COVID-19 se ha asociado con inflamación y un estado protrombótico acompañado de incremento en los valores de fibrinógeno y Dímero D (64). Los pacientes hospitalizados con COVID-19 tienen un alto riesgo de tromboembolismo (65), por lo que deben recibir tratamiento profiláctico de anticoagulantes, como heparina de bajo peso molecular o heparina no fraccionada durante todo el tiempo de hospitalización (66).
En el primer año de la pandemia, en ausencia de otras opciones terapéuticas, el plasma de convaleciente (PC) se utilizó ampliamente. La transferencia de plasma de un paciente que se recuperó y está convaleciente de COVID-19 a una persona que actualmente padece la enfermedad tiene como objetivo crear inmunidad pasiva transitoria para combatir la infección activa (67).
La transfusión de PC proporciona actividad antiviral a través de la transferencia de anticuerpos neutralizantes y de otros componentes inmunes tales como citoquinas (68). El PC disminuye la IL-6 y aumenta el IFN-γ y la IL-10, y aumenta las células T CD4+ de memoria central, que pueden localizarse en los tejidos linfoides secundarios, para ser reactivadas por la exposición al antígeno. El PC también aumenta las células B de memoria, que pueden diferenciarse en células plasmáticas de larga vida para mantener la producción de anticuerpos a largo plazo (69) (figura 6). Las primeras experiencias de estudios observacionales no controlados sugirieron eficacia del PC, determinada por mayor supervivencia, disminución de la carga viral y mejoría radiológica (70,71). La plausibilidad de la eficacia clínica del PC estuvo dada en gran parte por la relación dosis-respuesta en un estudio de gran tamaño, con una reducción de la mortalidad a los 30 días entre los pacientes que recibieron PC con altos títulos IgG anti-SSARS-CoV-2 en comparación con aquellos que recibieron PC con títulos más bajos (72). Por el contrario, el ensayo RECOVERY, un ensayo clínico aleatorizado con criterios de valoración clínicos, se detuvo prematuramente porque los títulos altos de PC no mejoraron la supervivencia en pacientes hospitalizados con COVID-19 en el Reino Unido (73).
Aunque la vacunación sigue siendo la forma más efectiva de prevenir la infección por SARS-CoV-2, y debe considerarse como la primera línea de prevención, ensayos clínicos controlados aleatorizados (por ejemplo con anticuerpos monoclonales como tixagevimab y cilgavimab) siguen siendo autorizados por la FDA como profilaxis previa a la exposición a SARS-CoV-2 en personas con alto riesgo (74). Una modificación en la región cristalizable de estos anticuerpos proporciona una protección potencial contra la infección por SARSCoV-2 de hasta 6 meses. Esta combinación de anticuerpos monoclonales parece tener actividad contra la variante B.1.617.2 (Delta). Aunque los datos preliminares in vitro sugieren que la variante B.1.1.529 (Omicron) sigue siendo susceptible a esta combinación, se necesitan más datos para evaluar completamente la actividad y la eficacia de estos tratamientos (75).
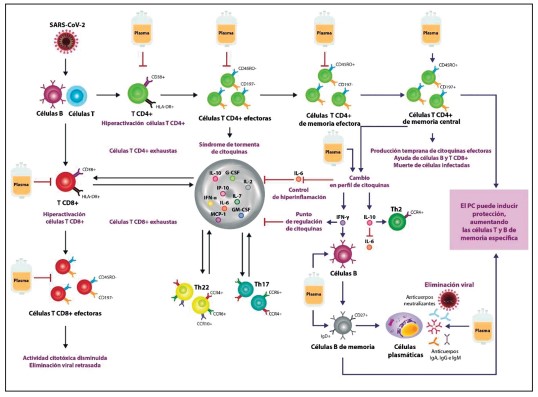
Figura 6. Posible mecanismo de acción del plasma convaleciente en pacientes con COVID-19 severo. Tomado de (69). Abreviaturas: CCR: receptor de quimiocinas C–C; CD: cluster de diferenciación; PC: plasma de convaleciente; HLA: antígeno leucocitario humano, Ig: inmunoglobulina; IL: interleucina; IP-10: proteína 10 inducida por interferón-γ; IFN: interferón; G-CSF: factor estimulante de colonias de granulocitos; GM-CSF: factor estimulante de colonias de granulocitos y macrófagos; MCP-1: proteína quimiotáctica de monocitos-1; Th: Th: linfocito T ayudador.
Las terapias dirigidas al huésped que incluyen dexametasona (76), tocilizumab (77) y baricitinib (78) y el cóctel de anticuerpos monoclonales casirivimab/ imdevimab (79) y anakinra (80) están asociadas con supervivencia. Remdesivir, un agente antiviral, tiene un impacto modesto en la reducción del tiempo de recuperación (81). De estos, solo la dexametasona está ampliamente disponible en entornos de recursos limitados y existe una necesidad urgente de opciones terapéuticas accesibles para la COVID-19. Hay múltiples agentes terapéuticos ahora disponibles para pacientes no hospitalizados con COVID-19 leve a moderado que tienen un alto riesgo de progresión de la enfermedad. Se aconseja el uso de ritonavir potenciado con nirmatrelvir en la mayoría de los pacientes no hospitalizados de alto riesgo con COVID-19 leve a moderado (63).
Tras sufrir una infección de COVID-19 muchas personas presentan secuelas importantes después de tres semanas del inicio de los síntomas hasta más allá de las 12 semanas. Los tratamientos varían de acuerdo con las afecciones, ya sea a nivel físico, cognitivo o neurológico. Se ha descrito el uso de oxígeno, AINES, antibióticos para la infección secundaria, entre otros (82).
Conclusiones
La respuesta inmune innata y adaptativa del huésped es un factor crítico en la conducción de la COVID-19. Los cambios en el sistema inmune podrían tener implicaciones en la recuperación a la infección por SARSCoV-2, en la respuesta a otras infecciones y en la exacerbación de otras afecciones crónicas. Estrategias inmunoterapéuticas dirigidas tanto al virus como al control de la respuesta inmune disfuncional serán de gran utilidad para el manejo de la enfermedad aguda y del SPC.Financiación
Este trabajado fue financiado por la Universidad del Rosario (ABN011).Agradecimientos
Los autores agradecen a todos los miembros del CREA por sus contribuciones y fructíferos debates durante la preparación del manuscrito.
Referencias
1.Wu JT, Leung K, Leung GM. Nowcasting and forecasting the
potential domestic and international spread of
the 2019-nCoV outbreak originating in Wuhan, China: a
modelling study. Lancet. 2020;395(10225):689–97.
2. Hui DS, I Azhar E, Madani TA, Ntoumi F, Kock R, Dar O, et al. The continuing 2019-nCoV epidemic threat of novel coronaviruses to global health - The latest 2019 novel coronavirus outbreak in Wuhan, China. International journal of infectious diseases . 2020;91: 264–6.
3. Team EE. Note from the editors: World Health Organization declares novel coronavirus (2019-CoV) sixth public health emergency of international concern. Euro Surveill . 2020;25(5):200131e.
4. Rodríguez Y, Novelli L, Rojas M, De Santis M, AcostaAmpudia Y, Monsalve DM, et al. Autoinflammatory and autoimmune conditions at the crossroad of COVID-19. J Autoimmun. 2020 ;114:102506.
5. Naqvi AAT, Fatima K, Mohammad T, Fatima U, Singh IK, Singh A, et al. Insights into SARS-CoV-2 genome, structure, evolution, pathogenesis and therapies: Structural genomics approach. Biochim Biophys Acta Mol Basis Dis. 2020;1866(10):165878.
6. Lu R, Zhao X, Li J, Niu P, Yang B, Wu H, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet. 2020;395(10224):565–74.
7. Chan JF-W, Kok K-H, Zhu Z, Chu H, To KK-W, Yuan S, et al. Genomic characterization of the 2019 novel human-pathogenic coronavirus isolated from a patient with atypical pneumonia after visiting Wuhan. Emerg Microbes Infect. 2020;9(1):221–36.
8. Hu B, Guo H, Zhou P, Shi Z-L. Characteristics of SARS-CoV-2 and COVID-19. Nat Rev Microbiol. 2021;19(3):141–54.
9. Lan J, Ge J, Yu J, Shan S, Zhou H, Fan S, et al. Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor. Nature. 2020;581(7807):215–20.
10. Li M-Y, Li L, Zhang Y, Wang X-S. Expression of the SARS-CoV-2 cell receptor gene ACE2 in a wide variety of human tissues. Infect Dis poverty. 2020;9(1):45.
11. Vaduganathan M, Vardeny O, Michel T, McMurray JJ V, Pfeffer MA, Solomon SD. Renin-Angiotensin-Aldosterone System Inhibitors in Patients with Covid-19. N Engl J Med. 2020;382(17):1653–9.
12. van Lier D, Kox M, Santos K, van der Hoeven H, Pillay J, Pickkers P. Increased blood angiotensin converting enzyme 2 activity in critically ill COVID-19 patients. ERJ open Res. 2021;7(1):00848-2020.
13. Rojas M, Acosta-Ampudia Y, Monsalve DM, Ramírez-Santana C, Anaya J-M. How Important Is the Assessment of Soluble ACE-2 in COVID-19? Am J Hypertens. 2021;34(3):296–7.
14. Rieder M, Wirth L, Pollmeier L, Jeserich M, Goller I, Baldus N, et al. Serum ACE2, Angiotensin II, and Aldosterone Levels Are Unchanged in Patients With COVID-19. Am J Hypertens. 2021;34(3):278–81.
15. Kyrou I, Randeva HS, Spandidos DA, Karteris E. Not only ACE2-the quest for additional host cell mediators of SARS-CoV-2 infection: Neuropilin-1 (NRP1) as a novel SARS-CoV-2 host cell entry mediator implicated in COVID-19. Signal Transduct Target Ther. 2021;6(1):21.
16. Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020;181(2):271- 280.e8.
17. Diamond MS, Kanneganti T-D. Innate immunity: the first line of defense against SARS-CoV-2. Nat Immunol. 2022;23(2):165–76.
18. Zheng M, Karki R, Williams EP, Yang D, Fitzpatrick E, Vogel P, et al. TLR2 senses the SARS-CoV-2 envelope protein to produce inflammatory cytokines. Nat Immunol. 2021;22(7):829–38.
19. Choudhury A, Mukherjee S. In silico studies on the comparative characterization of the interactions of SARSCoV-2 spike glycoprotein with ACE-2 receptor homologs and human TLRs. J Med Virol. 2020;92(10):2105–13.
20. Karki R, Sharma BR, Tuladhar S, Williams EP, Zalduondo L, Samir P, et al. Synergism of TNF-α and IFN-γ Triggers Inflammatory Cell Death, Tissue Damage, and Mortality in SARS-CoV-2 Infection and Cytokine Shock Syndromes. Cell. 2021;184(1):149-168.e17.
21. Sette A, Crotty S. Adaptive immunity to SARS-CoV-2 and COVID-19. Cell. 2021;184(4):861–80.
22. Zhao J, Yuan Q, Wang H, Liu W, Liao X, Su Y, et al. Antibody Responses to SARS-CoV-2 in Patients With Novel Coronavirus Disease 2019. Clin Infect Dis . 2020;71(16):2027–34.
23. Guo L, Ren L, Yang S, Xiao M, Chang D, Yang F, et al. Profiling Early Humoral Response to Diagnose Novel Coronavirus Disease (COVID-19). Clin Infect Dis . 2020;71(15):778–85.
24. Yan X, Chen G, Jin Z, Zhang Z, Zhang B, He J, et al. Anti-SARS-CoV-2 IgG levels in relation to disease severity of COVID-19. J Med Virol. 2022;94(1):380–3.
25. Ibarrondo FJ, Fulcher JA, Goodman-Meza D, Elliott J, Hofmann C, Hausner MA, et al. Rapid Decay of AntiSARS-CoV-2 Antibodies in Persons with Mild Covid-19. N Engl J Med. 2020;383(11):1085–7.
26. Long Q-X, Tang X-J, Shi Q-L, Li Q, Deng H-J, Yuan J, et al. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nat Med. 2020;26(8):1200–4.
27. Tea F, Ospina Stella A, Aggarwal A, Ross Darley D, Pilli D, Vitale D, et al. SARS-CoV-2 neutralizing antibodies: Longevity, breadth, and evasion by emerging viral variants. PLoS Med. 2021;18(7):e1003656.
28. Sekine T, Perez-Potti A, Rivera-Ballesteros O, Strålin K, Gorin J-B, Olsson A, et al. Robust T Cell Immunity in Convalescent Individuals with Asymptomatic or Mild COVID-19. Cell. 2020;183(1):158-168.e14.
29. Anaya J-M, Rojas M, Salinas ML, Rodríguez Y, Roa G, Lozano M, et al. Post-COVID syndrome. A case series and comprehensive review. Autoimmun Rev. 2021;20(11):102947.
30. Halpert G, Shoenfeld Y. SARS-CoV-2, the autoimmune virus. Autoimmun Rev . 2020;19(12):102695.
31. Trahtemberg U, Fritzler MJ. COVID-19-associated autoimmunity as a feature of acute respiratory failure. Intensive Care Med. 2021;47(7):801–4.
32. Wang EY, Mao T, Klein J, Dai Y, Huck JD, Jaycox JR, et al. Diverse functional autoantibodies in patients with COVID-19. Nature. 2021;595(7866):283–8.
33. Anaya J-M, Monsalve DM, Rojas M, Rodríguez Y, Montoya-García N, Mancera- Navarro LM, et al. Latent rheumatic, thyroid and phospholipid autoimmunity in hospitalized patients with COVID-19. J Transl Autoimmun. 2021;4:100091.
34. Pascolini S, Vannini A, Deleonardi G, Ciordinik M, Sensoli A, Carletti I, et al. COVID-19 and Immunological Dysregulation: Can Autoantibodies be Useful? Clin Transl Sci. 2021;14(2):502–8.
35. Bastard P, Rosen LB, Zhang Q, Michailidis E, Hoffmann H-H, Zhang Y, et al. Autoantibodies against type I IFNs in patients with life-threatening COVID-19. Science. 2020;370(6515):abd4585.
36. Bastard P, Gervais A, Le Voyer T, Rosain J, Philippot Q, Manry J, et al. Autoantibodies neutralizing type I IFNs are present in ~4% of uninfected individuals over 70 years old and account for ~20% of COVID-19 deaths. Sci Immunol. 2021;6(62):eabl4340.
37. Manry J, Bastard P, Gervais A, Voyer T Le, Rosain J, Philippot Q, et al. The risk of COVID-19 death is much greater and age-dependent with type I IFN autoantibodies. Research Square. 2022;rs.3rs-122906.
38. Zuniga M, Gomes C, Carsons SE, Bender MT, Cotzia P, Miao QR, et al. Autoimmunity to annexin A2 predicts mortality among hospitalised COVID-19 patients. Eur Respir J. 2021;58(4):2100918.
39. Sansone P, Giaccari LG, Aurilio C, Coppolino F, Esposito V, Fiore M, et al. Post-Infectious Guillain-Barré Syndrome Related to SARS-CoV-2 Infection: A Systematic Review. Life . 2021;11(2):167.
40. Zacharias H, Dubey S, Koduri G, D’Cruz D. Rheumatological complications of Covid 19. Autoimmun Rev. 2021;20(9):102883.
41. Baimukhamedov C, Barskova T, Matucci-Cerinic M. Arthritis after SARS-CoV-2 infection. Lancet Rheumatol. 2021;3(5):e324–5.
42. Lui DTW, Lee CH, Chow WS, Lee ACH, Tam AR, Fong CHY, et al. Thyroid Dysfunction in Relation to Immune Profile, Disease Status, and Outcome in 191 Patients with COVID-19. J Clin Endocrinol Metab. 2021;106(2):e926–35.
43. Duntas LH, Jonklaas J. COVID-19 and Thyroid Diseases: A Bidirectional Impact. J Endocr Soc. 2021;5(8):bvab076.
44. Tang K-T, Hsu B-C, Chen D-Y. Autoimmune and Rheumatic Manifestations Associated With COVID-19 in Adults: An Updated Systematic Review. Front Immunol. 2021;12:645013.
45. Zulfiqar A-A, Lorenzo-Villalba N, Hassler P, Andrès E. Immune Thrombocytopenic Purpura in a Patient with Covid-19. N Engl J Med. 2020;382(18):e43.
46. Sudre CH, Murray B, Varsavsky T, Graham MS, Penfold RS, Bowyer RC, et al. Attributes and predictors of long COVID. Nat Med. 2021;27(4):626–31.
47. Garrigues E, Janvier P, Kherabi Y, Le Bot A, Hamon A, Gouze H, et al. Post-discharge persistent symptoms and health-related quality of life after hospitalization for COVID-19. J Infect. 2020;81(6):e4–e6.
48. Flatby AV, Himmels JPW, Brurberg KG, Gravningen KM. COVID-19: Post COVID-19 condition.[Internet]. Oslo: Noruega: Institute of Public Health; 2022 [consultado 2 febrero 2022]. Disponible en:
https://www.fhi.no/globalassets/dokumenterfiler/rapporter/2022/covid-19-postcovid-19-condition-rapid-review-report-2022.pdf
49. Lopez-Leon S, Wegman-Ostrosky T, Perelman C, Sepulveda R, Rebolledo PA, Cuapio A, et al. More than 50 long-term effects of COVID-19: a systematic review and meta-analysis. Sci Rep. 2021;11(1):16144.
50. Zhao Y-M, Shang Y-M, Song W-B, Li Q-Q, Xie H, Xu Q-F, et al. Follow-up study of the pulmonary function and related physiological characteristics of COVID-19 survivors three months after recovery. EClinicalMedicine. 2020;25:100463.
51. Huang C, Huang L, Wang Y, Li X, Ren L, Gu X, et al. 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet . 2021;397(10270):220–32.
52. Moody WE, Liu B, Mahmoud-Elsayed HM, Senior J, Lalla SS, Khan-Kheil AM, et al. Persisting Adverse Ventricular Remodeling in COVID-19 Survivors: A Longitudinal Echocardiographic Study. J Am Soc Echocardiogr. 2021;34(5):562–6.
53. Jacobs JJL. Persistent SARS-2 infections contribute to long COVID-19. Med Hypotheses . 2021;149:110538. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33621843
54. Vibholm LK, Nielsen SSF, Pahus MH, Frattari GS, Olesen R, Andersen R, et al. SARS-CoV-2 persistence is associated with antigen-specific CD8 T-cell responses. EBioMedicine. 2021;64:103230.
55. Gaebler C, Wang Z, Lorenzi JCC, Muecksch F, Finkin S, Tokuyama M, et al.Evolution of antibody immunity to SARS-CoV-2. Nature.2021;591(7851):639–44.
56. de Melo GD, Lazarini F, Levallois S, Hautefort C, Michel V, Larrous F, et al. COVID-19-related anosmia is associated with viral persistence and inflammation in human olfactory epithelium and brain infection in hamsters. Sci Transl Med. 2021;13(596).
57. Dotan A, Muller S, Kanduc D, David P, Halpert G, Shoenfeld Y. The SARS-CoV-2 as an instrumental trigger of autoimmunity. Autoimmun Rev. 202120(4):102792.
58. Acosta-Ampudia Y, Monsalve DM, Rojas M, Rodríguez Y, Zapata E, Ramírez- Santana C, et al. Persistent Autoimmune Activation and Proinflammatory State in PostCOVID Syndrome. J Infect Dis. 2022;jiac017.
59. Phetsouphanh C, Darley DR, Wilson DB, Howe A, Munier CML, Patel SK, et al. Immunological dysfunction persists for 8 months following initial mild-to-moderate SARS-CoV-2 infection. Nat Immunol. 2022;23(2):210–6.
60. Mehandru S, Merad M. Pathological sequelae of longhaul COVID. Nat Immunol. 2022;23(2):194–202.
61. Visvabharathy L, Hanson B, Orban Z, Lim PH, Palacio NM, Jain R, et al. Neuro-COVID long-haulers exhibit broad dysfunction in T cell memory generation and responses to vaccination. medRxiv.. 2021;2021.08.08.21261763.
62. Ryan FJ, Hope CM, Masavuli MG, Lynn MA, Mekonnen ZA, Yeow AEL, et al. Long-term perturbation of the peripheral immune system months after SARS-CoV-2 infection. BMC Med . 2022;20(1):26.
63. Coronavirus Disease 2019(COVID-19) Treatment Guidelines [Internet] . Natl Institutes Health. 2020 [consultado 6 febrero 2022]: Disponible en: https://www.covid19treatmentguidelines.nih.gov/
64. Han H, Yang L, Liu R, Liu F, Wu K-L, Li J, et al. Prominent changes in blood coagulation of patients with SARSCoV-2 infection. Clin Chem Lab Med. 2020;58(7):1116– 20.
65. Nopp S, Moik F, Jilma B, Pabinger I, Ay C. Risk of venous thromboembolism in patients with COVID-19: A systematic review and meta-analysis. Res Pract Thromb Haemost. 2020;4(7):1178–91.
66. Sholzberg M, Tang GH, Rahhal H, AlHamzah M, Kreuziger LB, Áinle FN, et al. Effectiveness of therapeutic heparin versus prophylactic heparin on death, mechanical ventilation, or intensive care unit admission in moderately ill patients with covid-19 admitted to hospital: RAPID randomised clinical trial. BMJ. 2021;375:n2400.
67. Axfors C, Janiaud P, Schmitt AM, Van’t Hooft J, Smith ER, Haber NA, et al. Association between convalescent plasma treatment and mortality in COVID-19: a collaborative systematic review and meta-analysis of randomized clinical trials. BMC Infect Dis. 2021;21(1):1170.
68. Rojas M, Rodríguez Y, Monsalve DM, Acosta-Ampudia Y, Camacho B, Gallo JE, et al. Convalescent plasma in Covid-19: Possible mechanisms of action. Autoimmun Rev. 2020l;19(7):102554.
69. Acosta-Ampudia Y, Monsalve DM, Rojas M, Rodríguez Y, Gallo JE, Salazar-Uribe JC, et al. COVID-19 convalescent plasma composition and immunological effects in severe patients. J Autoimmun. 2021;118:102598.
70. Duan K, Liu B, Li C, Zhang H, Yu T, Qu J, et al. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc Natl Acad Sci U S A. 2020;117(17):9490–6.
71. Shen C, Wang Z, Zhao F, Yang Y, Li J, Yuan J, et al. Treatment of 5 Critically Ill Patients With COVID-19 With Convalescent Plasma. JAMA. 2020;323(16):1582–9.
72. Joyner MJ, Carter RE, Senefeld JW, Klassen SA, Mills JR, Johnson PW, et al. Convalescent Plasma Antibody Levels and the Risk of Death from Covid-19. N Engl J Med. 2021;384(11):1015–27.
73. Convalescent plasma in patients admitted to hospital with COVID-19 (RECOVERY): a randomised controlled, open-label, platform trial. Lancet . 2021;397(10289):2049–59.
74. Administration USF and D. Fact sheet for healthcare providers: Emergency Use Authorization for Evusheld [Internet]. U.S.Food and Drug Administration. 2022 [consultado 6 febrero 2022]. Disponible en:
https://www.fda.gov/media/156674/download
75. VanBlargan LA, Errico JM, Halfmann PJ, Zost SJ, Crowe JEJ, Purcell LA, et al. An infectious SARS-CoV-2 B.1.1.529 Omicron virus escapes neutralization by therapeutic monoclonal antibodies. Nat Med. 2022;1–6.
76. Horby P, Lim WS, Emberson JR, Mafham M, Bell JL, Linsell L, et al. Dexamethasone in Hospitalized Patients with Covid-19. N Engl J Med. 2021;384(8):693–704.
77. Tocilizumab in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, openlabel, platform trial. Lancet. 2021;397(10285):1637–45.
78. Marconi VC, Ramanan A V, de Bono S, Kartman CE, Krishnan V, Liao R, et al. Efficacy and safety of baricitinib for the treatment of hospitalised adults with COVID-19 (COV-BARRIER): a randomised, double-blind, parallelgroup, placebo-controlled phase 3 trial. Lancet Respir Med. 2021;9(12):1407–18.
79. Casirivimab and imdevimab in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial. Lancet. 2022;399(10325):665–76.
80. Kyriazopoulou E, Poulakou G, Milionis H, Metallidis S, Adamis G, Tsiakos K, et al. Early treatment of COVID-19 with anakinra guided by soluble urokinase plasminogen receptor plasma levels: a double-blind, randomized controlled phase 3 trial. Nat Med. 2021;27(10):1752–60.
81. Beigel JH, Tomashek KM, Dodd LE. Remdesivir for the Treatment of Covid-19 -Preliminary Report. Reply. N Engl J Med. 2020;383(10): 994. 82. Greenhalgh T, Knight M, A’Court C, Buxton M, Husain L. Management of post-acute covid-19 in primary care. BMJ. 2020;370:m3026..
Aceptado: 9 de marzo de 2022
Correspondencia:
Yeny Acosta-Ampudia.
yeny.acosta@urosario.edu.co