INTELIGENCIA ARTIFICIAL EN NEUMOLOGÍA
..................
Leslie Vargas-Ramírez ¹, Rafael Brango Ayazo ²
Resumen
Palabras clave: Inteligencia artificial; Deep Learning; Machine Learning; Neumología; Enfermedad Pulmonar obstructiva crónica; Asma; Hipertensión pulmonar; Enfermedad pulmonar intersticial; Apnea del sueño.
..............
² MD. Gerencia y Auditoría de la Calidad en Salud, Asmetsalud, Bogotá, Colombia.
ARTIFICIAL INTELLIGENCE IN PULMONOLOGY
Abstract
Every day we find more often the term artificial intelligence in all scenarios of medicine including pulmonology, being a necessity the knowledge in the subject and the approach of the health professional to the use of these tools. The applicability of artificial intelligence in pulmonology had its beginnings in the interpretation of pulmonary function tests and in diagnostic settings, however, we quickly see the importance of its use in decision support, checking and surveillance of outcomes in daily practice and in the field of research, clinical prediction models, just to name a few. In this article we make a narrative review of the role of artificial intelligence in some of the pathologies most often seen in our daily practice. The use of artificial intelligence is described in the clinical, functional, and imaging diagnosis of COPD and asthma as well as in the remote monitoring of patients, advances in the interpretation of images and pathology of interstitial diseases with the use of machine learning and deep learning, the application in pulmonary hypertension screening from tests other than right heart catheterization and finally the wide range of applications in sleep medicine where progress is amazing.Keywords: Artificial Intelligence; Deep Learning; Machine Learning; Pulmonary Medicine; Pulmonary Disease Chronic Obstructive; Asthma; Hypertension Pulmonary; Lung Diseases Interstitial; Sleep Apnea Syndromes.
Introducción
Para citar a Herman Kesten, los progresos de la medicina son gigantescos. La inteligencia artificial (IA) es entendida en términos generales como cualquier tipo de sistema computacional artificial que muestra un comportamiento inteligente, es decir, un comportamiento complejo que conduce a alcanzar objetivos. Se ha venido presentando en los últimos años como el verdadero impulsor de un cambio o transformación, que aunque se mostraba como inaudito, ha mejorado nuestro presente y futuro (1).El sector de la salud está respondiendo a un consumismo creciente, influido por las diferentes experiencias que la sociedad tiene frente a bienes y servicios en otros sectores que de la mano de las nuevas tecnologías se reinventan poniendo en el centro al consumidor, usuario, ciudadano que en nuestro caso sería el paciente, haciéndole más participativo y promoviendo los mejores resultados en salud. Aunque la IA ya se está utilizando en el entorno de los sistemas sanitarios, su uso será cada vez más imprescindible en la atención médica, ya que permite mejorar la productividad, la calidad de la atención, la participación del paciente en su manejo y seguimiento, el acceso a los servicios, ganando en proximidad y humanización de los procesos al permitir dedicar más tiempo y de mayor calidad a la relación médico-paciente.
La IA es en este momento una prioridad de la sociedad y así lo están entendiendo los responsables de la toma de decisiones en materia de salud, gobiernos de todo el mundo, empresas, inversores, innovadores y emprendedores entre otros.
Las enfermedades respiratorias son responsables de una alta carga de morbilidad y mortalidad a nivel mundial. Su prevención, diagnóstico temprano y tratamiento adecuado permitirán aliviar esta carga en gran medida.
La IA presagia oportunidades emocionantes en la optimización de la atención médica y significa un sinfín de posibilidades para personalizar la atención en salud, brindando una herramienta a los neumólogos que les permita interpretar los síntomas respiratorios con precisión y hacer un diagnóstico correcto. A continuación, hacemos una revisión narrativa del papel de la IA en algunas de las patologías respiratorias, siendo imposible abarcar en este espacio todo el espectro en el que se está utilizando actualmente.
IA en fisiología pulmonar
Las pruebas de función pulmonar (PFP) son la principal herramienta para la valoración del sistema respiratorio. Su interpretación requiere de un neumólogo que, basado en guías internacionales, puede clasificarlas como normales, obstructivas, restrictivas o mixtas. Aunque es un proceso estandarizado, la precisión diagnóstica dependerá de la experticia de quien las interpreta, lo cual dificulta la generalización, siendo la IA una herramienta que podría ayudar en este fin (2).En un trabajo realizado con 120 neumólogos de 16 hospitales europeos que evaluaron 50 casos con PFP, se encontró que el reconocimiento de los patrones coincidió con las guías internacionales en el 74,4% (± 5,9) de los casos (kappa 0,67), mientras el diagnóstico correcto fue realizado por 44,6% de los neumólogos (kappa 0,35). En comparación, un software que utilizó datos de las PFP combinados con características del paciente (edad, sexo, Índice de Masa Corporal (IMC) y el índice paquete año de consumo de tabaco) logró hacer una interpretación correcta de los patrones en el 100% de los casos y un diagnóstico correcto en el 82% (3). El uso de un marco de aprendizaje automático, integrando la función pulmonar con las variables clínicas, puede proporcionar árboles de decisión alternativos que permiten un diagnóstico más preciso (4).
IA en enfermedad pulmonar obstructiva crónica (EPOC)
La enfermedad pulmonar obstructiva crónica (EPOC) tiene una prevalencia alta y se considera que en el 2030 será la tercera causa de muerte en el mundo. El diagnóstico se realiza por espirometría, pero sigue siendo una enfermedad infradiagnosticada por lo que se ha propuesto la IA como herramienta para el diagnóstico a través de múltiples aplicaciones (5).El uso de DL para evaluación de imágenes se ha usado con un buen rendimiento diagnóstico (6). Basados en un marco de diagnóstico asistido por computadora es posible hacer el abordaje y clasificación de los subtipos de enfisema en la TAC, así como la evaluación de la gravedad y extensión del mismo (7) permitiendo una aproximación más precisa a la enfermedad.
Se pueden identificar regiones portadoras de patología en una imagen a través de características del contenido de la imagen como color, forma, textura y longitud de ejecución. La selección de características es la base de la precisión de estos marcos de diagnóstico asistidos por computadora. Este proceso consiste en encontrar el subconjunto óptimo de características extraídas para que pueda hacerse una correcta y precisa clasificación. Existen cuatro enfoques del proceso: el de filtro, que selecciona características clasificándolas con una puntuación de relevancia y descarta las de baja calificación tomando un umbral de referencia que puede ser el índice Gini, chi cuadrado, ganancia de información o el coeficiente de Pearson; el enfoque de envoltura, que identifica un subconjunto de características en función del rendimiento predictivo; el enfoque integrado, semejante al de envoltura y, finalmente, el enfoque híbrido, que realiza la clasificación de características similar al filtro y los resultados filtrados se ajustan usando el enfoque de envoltura (8).
La segmentación es el proceso de dividir los tejidos pulmonares de un corte de tomografía axial computarizada (TAC) pulmonar eliminando su fondo, lo cual requiere de gran precisión para establecer límites en tejidos o lesiones pulmonares. Para esto se pueden utilizar clústeres o conglomerados, abordando el problema de la incertidumbre, es decir, la variabilidad de la intensidad de los pixeles vecinos en la imagen.
Un análisis basado en AP de TAC no solamente puede clasificar fumadores con o sin EPOC, sino que puede predecir desenlaces como exacerbaciones y mortalidad. Esta evaluación por AP puede ser desarrollada en una cohorte y aplicada a otra sin requerimiento de un entrenamiento adicional, a partir de la identificación de clústeres o subgrupos que comparten imágenes y características clínicas únicas (9).
En los últimos años se ha observado un aumento del uso de algoritmos de AA para clasificar con mayor precisión los fenotipos de la enfermedad a través de clústeres que permiten integrar información de los pacientes y encontrar estructuras en los datos que sean similares entre sí (10). En este ámbito de investigación también se han establecido puntos de buenas prácticas como son el uso de datos longitudinales prospectivos, cohortes que incluyan diferentes poblaciones y escenarios, inclusión de información genética como la disponible en las bases de datos de COPDgene y la garantía de claridad en la selección de las variables que se usen para identificar los fenotipos (10).
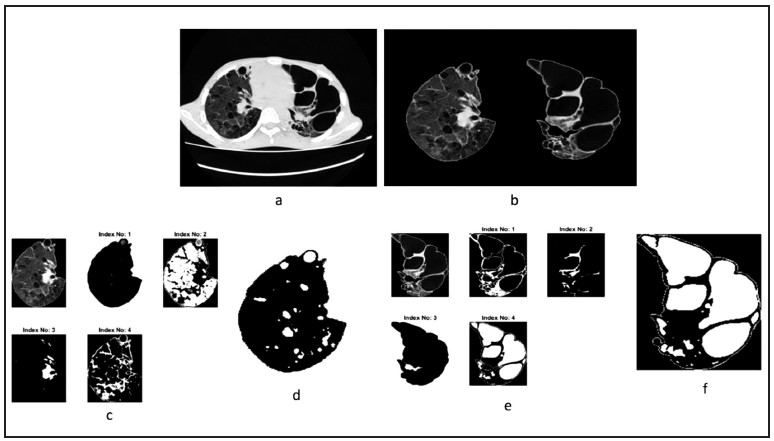
Figura 1. (a) Corte de TC de pulmón de entrada, (b) Tejidos pulmonares segmentados, (c) Pulmón derecho que representa cuatro grupos, (d) Regiones de interés extraídas del pulmón derecho (enfisema), (e) Pulmón izquierdo que representa cuatro grupos, (f) Regiones de interés extraídas del pulmón izquierdo (bulas subpleurales). Figura modificada con autorización de Isaac A, Nehemiah H, Isaac A, Kannan A. Computer- Aided Diagnosis system for diagnosis of pulmonary emphysema using bio-inspired algorithms. Comput Biol Med. 2020;124:103940.
La IA también permite evaluar progresión de la EPOC (11). Un buen ejemplo es SuStain (Subtype and Stage Inference), una herramienta de AA capaz de definir subtipos de la enfermedad, estadios y progresión en tiempo a partir de datos transversales de TAC y función respiratoria. Los hallazgos fueron validados en un corte transversal en la cohorte ECLIPSE (12) y de forma longitudinal en la cohorte COPDGene con datos de cinco años de seguimiento (13).
Así mismo, se han podido crear modelos a través de AA para establecer predictores de exacerbación a través de datos obtenidos de forma automática de historias clínicas electrónicas (14). En nuevos modelos de predicción de mortalidad usando AA se han incluido de forma novedosa mediciones de imágenes, incluyendo datos de la pared cardiaca, pared de la vía aérea y del parénquima; siendo interesante que se continúa encontrando la distancia de la caminata de seis minutos, el Volumen Espiratorio Forzado en 1 segundo (VEF1), la disnea y el IMC como predictores de mortalidad en EPOC, acompañados de la relación arteria pulmonar/ aorta (15,16). El monitoreo remoto del paciente con EPOC ha permitido que el equipo tratante tenga la certeza de que está haciendo el seguimiento adecuado, y que el paciente gane confianza en el personal que le hace el seguimiento y en sí mismo.
Un claro ejemplo es el uso de acelerómetros que permiten el monitoreo de la actividad física, con el que se procesan y clasifican los tipos de actividades que hace el paciente e incluso permiten darle indicaciones de lo que debe hacer, a través de algoritmos de AA que ajustan las recomendaciones a las necesidades del paciente. También están disponibles sistemas de monitoreo remoto para detección de tos y control de frecuencia de esta, los cuales usan un micrófono y análisis del audio basados en IA, evaluando también las sibilancias a través de algoritmos de AA con muy buena sensibilidad y precisión (17).
IA en asma
El diagnóstico de asma requiere un abordaje inicial que se basa en la historia clínica y se soporta en gran medida con la detección de sibilancias en la auscultación; sin embargo, la detección de estos ruidos respiratorios necesita entrenamiento, por lo que pueden ser pasadas por alto por personal inexperto. Existen dispositivos portátiles que registran las señales de los ruidos respiratorios y permiten identificar sibilancias con una sensibilidad del 89,3% y una especificidad de 96,2%; las señales son posteriormente transferidas a teléfonos inteligentes, que a través de un algoritmo que usa un modelo de Markov profundo, identifican las frecuencia correctas (18).Un algoritmo de procesamiento de lenguaje natural (NPL) se desarrolló a partir de un proceso automático de extracción de datos de registros médicos electrónicos (historia clínica, laboratorio y antecedentes especialmente) logrando el diagnóstico de asma en una cohorte de niños con una sensibilidad del 86%, especificidad 98%, valor predictivo positivo del 98% y valor predictivo negativo del 98% (19).
Algoritmos de AA también han sido utilizados en el ámbito de la interpretación de pruebas de función pulmonar en asma. En un estudio se utilizaron diferentes técnicas (K-Nearest Neighbors, Random forest (RF), AdaBoost con árboles de decisión y clasificación basada en disimilitud) para aumentar la precisión del diagnóstico de asma a través de oscilometría forzada. Los autores demostraron que estas herramientas lograban el objetivo propuesto, siendo la mejor área bajo la curva 0,91 (20). Integrar un mayor número de variables que representen el componente multidimensional de la enfermedad: clínica, genotipo, RNA de células mononucleares en sangre periférica, citometría de flujo, citoquinas, RT-qPCR, podría establecer fenotipos más precisos en términos de clasificación a través de ML (Figura 2) (21).
En el contexto del tratamiento, determinar las variables que predicen la respuesta a esteroides nos permitiría mayor precisión en el manejo de los pacientes. Para este fin, en un trabajo con 346 adultos con asma se utilizó un modelo de aprendizaje no supervisado de múltiples vistas, con lo cual se identificaron 4 clústeres (22). Los grupos 1 y 2 estuvieron compuestos por pacientes jóvenes con asma alérgica, función pulmonar normal, que respondían a esteroide y que se diferenciaban por las características del esputo; un tercer grupo de mayor edad con asma de inicio tardío, eosinofilia y compromiso de la función pulmonar que respondían a esteroide, y un cuarto grupo de pacientes de sexo femenino, con obesidad, alteración obstructiva severa, poca eosinofilia y pobre respuesta a los esteroides. A partir de este análisis se reconocieron 12 variables predictivas de esta respuesta, lo que permitiría hacer realmente una medicina de precisión.
El tratamiento de los pacientes con asma tiene por objetivo lograr el adecuado control de los síntomas, seguimiento que habitualmente se realiza a través de cuestionarios. La introducción de otras características como la fracción de óxido nítrico exhalado (FeNO), compuestos orgánicos volátiles exhalados (VOCs) y citocinas para determinar control, ha sido evaluada usando RF, demostrando que adicionar VOCs podría discriminar niños con asma persistente controlada y no controlada con un área bajo la curva de 86%, y que añadir el FeNO y los otros marcadores no mejora la precisión en esta clasificación (23).
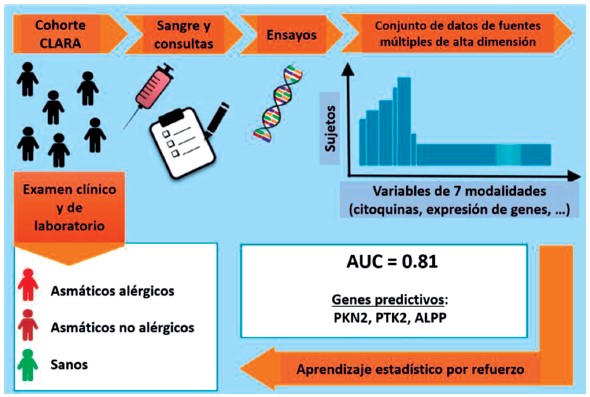
Figura 2. El aprendizaje estadístico sobre datos inmunológicos, genéticos y ambientales clasifica bien el asma. La estimación del riesgo es más precisa cuando se incorporan todos los datos con una estrategia multimodal. Los mejores predictores son tres genes diana. ALPP: fosfatasa alcalina placentaria, PKN2: proteína quinasa N2, PTK2: proteína tirosina quinasa 2. AUC: área bajo la curva de características operativas del receptor (adaptado con autorización de Krautenbacher N, Flach N, Böck A, Laubhahn K, Laimighofer M, Theis FJ, et al. A strategy for high-dimensional multivariable analysis classifies childhood asthma phenotypes from genetic, immunological, and environmental factors. Allergy. 2019 Jul;74(7):1364-1373. doi: 10.1111/all.13745. Epub 2019 Mar 31.).
La predicción de crisis se ha abordado a través de modelos avanzados de AP, que toman variables clínicas de registros médicos electrónicos. Xiant Y. y colaboradores (25) propusieron una red neuronal sensible al tiempo para predecir exacerbaciones en una población de más de 30.000 pacientes, usando el mecanismo de atención, específicamente diseñado para redes neuronales profundas, actuando como filtro de información y asignando un peso a cada concepto clínico. Con todos estos datos se logró definir factores de riesgo personalizados y, a nivel de cohorte se logró una muy buena precisión.
En pacientes con asma también se han usado dispositivos para monitoreo remoto. Un sensor basado en acelerómetro se usó para recopilar datos durante el sueño de pacientes pediátricos asmáticos, registrando frecuencia cardiaca, frecuencia respiratoria, aceleración de pulso y movimientos, logrando correlacionar estos cambios fisiológicos con los síntomas y predecir exacerbaciones (26).
IA en enfermedad pulmonar intersticial
El abordaje de las enfermedades pulmonares intersticiales requiere una historia clínica detallada, examen físico completo con énfasis en la auscultación pulmonar y una correcta evaluación tomográfica. Con las guías actuales y la discusión en grupos multidisciplinares se tiene una mejor probabilidad de hacer un diagnóstico preciso. Sin embargo, el acceso a estos grupos es limitado y las habilidades en detectar estertores finos en la auscultación pulmonar, así como la interpretación de las imágenes, requieren experticia.La cuantificación de los sonidos respiratorios -incluyendo los estertores finos a través de algoritmos basados en AApuede predecir los hallazgos de fibrosis pulmonar en la tomografía, dando apoyo al diagnóstico temprano de esta patología. Los ruidos respiratorios son registrados a través de fonendoscopios electrónicos y transferidos a computadores que identifican el tipo de sonido según el algoritmo (27).
Desde hace varios años se ha utilizado el análisis asistido por computadora y la identificación y clasificación automatizada basados en TAC a través de características de textura como matrices de coocurrencia de nivel de gris, matrices de longitud de ejecución, análisis fractal y medidas basadas en histograma, proponiéndose más recientemente el uso de características aprendidas directamente de los datos (28).
Algunos de estos métodos se basan en algoritmos de aprendizaje no supervisado como la máquina de Boltzmann (29), una red neuronal capaz de capturar y reproducir la estructura estadística de un conjunto de datos dado o K-SVD (30) para construir conjuntos de características aprendidas. La cuantificación de las anormalidades tomográficas permite caracterizar subgrupos de esta enfermedad. Para este fin han usado redes neuronales convolucionales (CNN) a partir de patrones tomográficos específicos extraídos de regiones de interés como se observan en la figura 3, a los cuales se les incorporan redes 2D, 2.5D y 3D.
Cada red individual es entrenada en la base de datos y luego los resultados de las redes se resumen y combinan a la salida del conjunto, lo cual mostró un rendimiento superior comparado con los modelos individuales (31).
La evaluación de TAC mediante un algoritmo de DL puede proporcionar una clasificación casi inmediata de las enfermedades pulmonares intersticiales con un alto nivel de precisión, convirtiéndose en una herramienta útil en centros donde no se tiene experiencia en la interpretación de imágenes torácicas (32). En ocasiones, es necesario el análisis de tejido pulmonar obtenido por biopsia transbronquial, biopsia abierta o crio biopsia para establecer el diagnóstico definitivo, requiriendo de la participación de un patólogo entrenado en pulmón.
Pankratz y colaboradores (33), desarrollaron un clasificador genómico de tejido obtenido por biopsia transbronquial que diferencia la neumonía intersticial usual (NIU) de la no NIU, tomando como referencia al patólogo experto. Se utilizó AA para entrenar un algoritmo altamente específico, demostrando que se mejora la utilidad de este tipo de muestras, siendo necesario a futuro la realización de validaciones y análisis con especímenes obtenidos a través de otros procedimientos (34).
IA en hipertensión arterial pulmonar
El diagnóstico de la hipertensión arterial pulmonar (HAP) a menudo se retrasa por la falta de sospecha clínica y por la necesidad de realización de cateterismo cardíaco derecho, procedimiento que no es de fácil acceso, pero que es indispensable para confirmar, cuantificar, clasificar y determinar el tratamiento. El uso de pruebas más sencillas podría permitir una aproximación temprana a la enfermedad. La radiografía de tórax es de fácil acceso, bajo costo y se puede convertir -a través de la aplicación de AP- en una herramienta para el diagnóstico de HAP (35), con la posibilidad incluso de estratificar el riesgo de hospitalización por insuficiencia cardiaca (36). El electrocardiograma (ECG) también puede ayudar en la tamización y detección temprana de HAP. Un algoritmo de IA fue desarrollado usando una red neural profunda, una red neural convolucional y un método de ensamble para integrar las dos redes a partir de la señal del ECG de 12 derivaciones y datos demográficos de una cohorte histórica multicéntrica de más de 20.000 pacientes para diagnosticar HAP, alcanzando un área bajo la curva de 0,85 en la validación interna y 0,90 en la validación externa (37).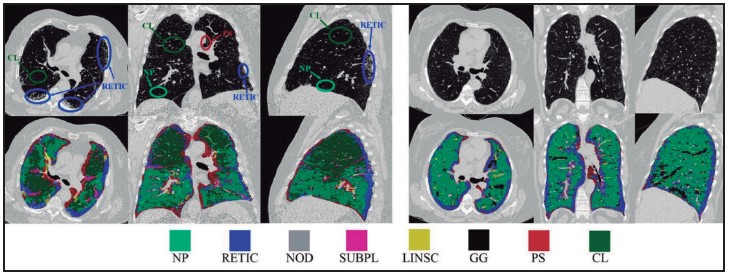
Figura 3. Resultados de la clasificación automática en dos tomografías con diferentes subtipos de anormalidad intersticial. NP (parénquima normal), RETIC (reticular), Nod (Nodular), SUBPL (Línea Subpleural), LINSC (Cicatriz Lineal), GC (Vidrio Esmerilado), PS (Enfisema Paraseptal), CL (Enfisema Centrilobulillar) (modificada con autorización de Bermejo-Peláez D, Ash SY, Washko GR, San José Estépar R, Ledesma-Carbayo MJ. Classification of Interstitial Lung Abnormality Patterns with an Ensemble of Deep Convolutional Neural Networks. Sci Rep. 2020 Jan 15;10(1):338. doi: 10.1038/s41598-019-56989-5).
También se ha utilizado AA en la identificación de fenotipos basados en el análisis no supervisado de perfiles proteómicos. En un estudio observacional prospectivo con pacientes con HAP del grupo 1 evaluados en las universidades de Stanford y Sheffield, se midió un panel de 48 citoquinas, quimioquinas y factores de crecimiento, con lo cual se descubrieron y validaron cuatro clústeres con distintos perfiles inmunológicos que podrían predecir riesgos clínicos, pronóstico a largo plazo y constituir blancos terapéuticos para terapias emergentes (41). Los métodos de AA de última generación superan los enfoques basados en reglas de decisión simple, usadas comúnmente para identificación de personas con hipertensión pulmonar en bases de registros médicos electrónicos, lo cual es aplicable en metodología a la selección de cohortes para investigación con mayor sensibilidad y especificidad (42).
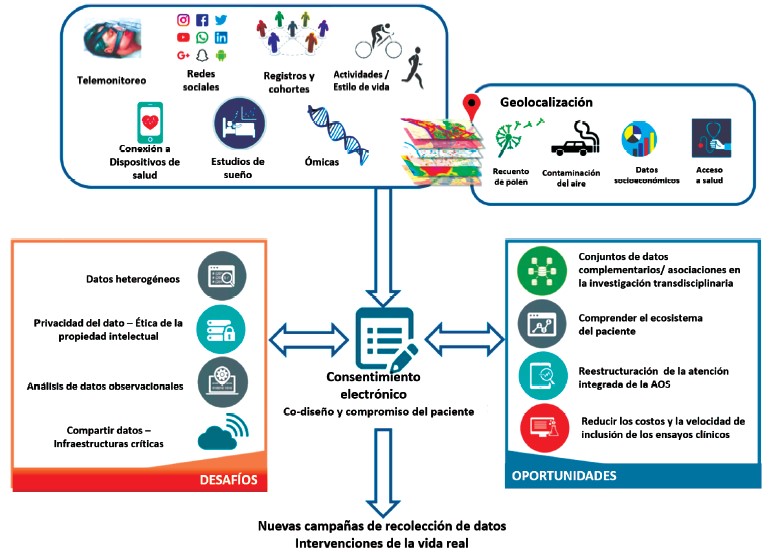
Figura 4. Fuentes de Big Data: datos recopilados a diario provenientes de diferentes fuentes pueden ser complementados con geolocalización que permita evaluar el entorno del paciente. Se generan nuevas oportunidades, pero también desafíos (figura modificada con autorización de Pépin JL, Bailly S, Tamisier R. Big Data in sleep apnoea: Opportunities and challenges. Respirology. 2020 May;25(5):486-494. doi: 10.1111/resp.13669. Epub 2019 Aug 14).
IA en medicina del sueño
En 2020 la Academia Americana de Medicina del Sueño (AASM) publicó una breve revisión acerca de las actuales aplicaciones de la IA en medicina del sueño, ventajas, desventajas y su potencial uso. Este documento permitió poner en la mesa la necesidad de generalizar su conocimiento (43). Una de las primeras aplicaciones ha sido en la estadificación de las etapas de sueño en la polisomnografía. Esta actividad requiere la marcación de la etapa de sueño en épocas de 30 segundos de registro electroencefalográfico, actividad que demanda gran cantidad de tiempo. La aplicación de AA en este proceso ha demostrado buena precisión en la estadificación con kappas de 0,8 similares a las reportadas en comparaciones interevaluador (0,68- 0,76) (44).A través de AP basado en redes neuronales convolucionales es posible detectar los eventos respiratorios (apneas e hipopneas) en la polisomnografía, siendo capaz de lidiar con diferentes características de las señales como las formas de la onda y las demás señales fisiológicas para una correcta identificación (45,46).
Con respecto a las aplicaciones descritas, la AASM adopta como posición la aceptación del análisis mediante IA de los datos electrofisiológicos adquiridos a partir de polisomnografía. Se espera que las aplicaciones de la IA en la estadificación de las etapas del sueño y marcación de los eventos respiratorios mejoren la eficiencia de los laboratorios de sueño sin reemplazar la evaluación por el experto (47). En la parte clínica ha sido muy importante el uso de BigData en la caracterización de los diferentes fenotipos de la enfermedad, así como en la construcción de modelos predictivos y de subgrupos según la respuesta al manejo con CPAP, permitiendo realizar una verdadera medicina personalizada y de precisión (48). Las fuentes de datos son múltiples y es de resaltar que la recolección de estos requiere el consentimiento electrónico del paciente (Figura 4).
Referencias
1.
Sánchez-Caro J, Sánchez FA. Inteligencia artificial en el campo de la
salud. Un nuevo paradigma: aspectos clínicos, éticos y legales. 1ª ed.
Fundación Merck Salud; 2021.2. Delclaux C. No need for pulmonologists to interpret pulmonary function tests. Eur Respir J. 2019;54(1):1900829.
3. Topalovic M, Das N, Burgel PR, Daenen M, Derom E, Haenebalcke C, et al. Artificial intelligence outperforms pulmonologists in the interpretation of pulmonary function tests. Eur Respir J. 2019;53(4):1801660.
4. Topalovic M, Laval S, Aerts JM, Troosters T, Decramer M, Janssens W. Automated Interpretation of Pulmonary Function Tests in Adults with Respiratory Complaints. Respiration. 2017;93(3):170–8.
5. Das N, Topalovic M, Janssens W. Artificial intelligence in diagnosis of obstructive lung disease: Current status and future potential. Curr Opin Pulm Med. 2018;24(2):117–23.
6. Bibault JE, Xing L. Screening for chronic obstructive pulmonary disease with artificial intelligence. Lancet Digit Heal. 2020;2(5):e216–7.
7. Tang LYW, Coxson HO, Lam S, Leipsic J, Tam RC, Sin DD. Towards large-scale case-finding: training and validation of residual networks for detection of chronic obstructive pulmonary disease using low-dose CT. Lancet Digit Heal. 2020;2(5):e259–67.
8. Isaac A, Nehemiah H, Isaac A, Kannan A. ComputerAided Diagnosis system for diagnosis of pulmonary emphysema using bio-inspired algorithms. Comput Biol Med. 2020;124:103940.
9. González G, Ash SY, Vegas-Sánchez-Ferrero G, Onieva Onieva J, Rahaghi FN, Ross JC, et al. Disease Staging and Prognosis in Smokers Using Deep Learning in Chest Computed Tomography. Am J Respir Crit Care Med. 2018;197(2):193-203
10. Nikolaou V, Massaro S, Fakhimi M, Stergioulas L, Price D. COPD phenotypes and machine learning cluster analysis: A systematic review and future research agenda. Respir Med. 2020;171:106093.
11. Agusti A, Faner R. When Harry Met Sally, or when machine learning met chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2020;201(3):263–75.
12. Agusti A, Calverley PM, Celli B, Coxson HO, Edwards LD, Lomas DA, et al. Characterisation of COPD heterogeneity in the ECLIPSE cohort. Respir Res. 2010;11(1):122. 13. Young AL, Bragman FJS, Rangelov B, Han MK, Galbán CJ, Galbán G, Lynch D, et al. Disease Progression Modeling in Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med. 2020;201:294–302.
13. Ställberg B, Lisspers K, Larsson K, Janson C, Müller M, Łuczko M, et al. Predicting hospitalization due to copd exacerbations in swedish primary care patients using machine learning – based on the arctic study. Int J Chron Obstruct Pulmon Dis. 2021;16:677–88.
14. Moll M, Qiao D, Regan EA, Hunninghake GM, Make BJ, Tal-Singer R, et al. Machine Learning and Prediction of All-Cause Mortality in COPD. Chest. 2020;158(3):952– 64.
15. Matheson AM, Parraga G. Machine Learning Predictions of COPD Mortality: Computational Hide and Seek. Chest. 2020;158(3):846–7.
16. Li X, Zhou HP, Zhou ZJ, Du N, Zhong EH, Zhai K, et al. Artificial intelligence-powered remote monitoring of patients with chronic obstructive pulmonary disease. Chin Med J (Engl). 2021;134(13):1546–8.
17. Oletic D, Bilas V. Asthmatic Wheeze Detection from Compressively Sensed Respiratory Sound Spectra. IEEE J Biomed Health Inform. 2018;22(5):1406-1414.
18. Kaur H, Sohn S, Wi C-Il, Ryu E, Park MA, Bachman K, et al. Automated chart review utilizing natural language processing algorithm for asthma predictive index. BMC Pulm Med. 2018;18(1):1–9.
19. Amaral JLM, Lopes AJ, Veiga J, Faria ACD, Melo PL. High-accuracy detection of airway obstruction in asthma using machine learning algorithms and forced oscillation measurements. Comput Methods Programs Biomed. 2017;144:113–25.
20. Krautenbacher N, Flach N, Böck A, Laubhahn K, Laimighofer M, Theis FJ, Ankerst DP, Fuchs C, Schaub B. A strategy for high-dimensional multivariable analysis classifies childhood asthma phenotypes from genetic, immunological, and environmental factors. Allergy. 2019 Jul;74(7):1364-1373.
21. Wu W, Bang S, Bleecker ER, Castro M, Denlinger L, Erzurum SC, et al. Multiview cluster analysis identifies variable corticosteroid response phenotypes in severe asthma. Am J Respir Crit Care Med. 2019;199(11):1358–67.
22. Van Vliet D, Smolinska A, Jöbsis Q, Rosias PPR, Muris JWM, Dallinga JW, et al. Association between exhaled inflammatory markers and asthma control in children. J Breath Res. 2016;10(1):016014.
23. Khasha R, Sepehri MM, Mahdaviani SA. An ensemble learning method for asthma control level detection with leveraging medical knowledge-based classifier and supervised learning. J Med Syst. 2019;43(6):158.
24. Xiang Y, Ji H, Zhou Y, Li F, Du J, Rasmy L, et al. Asthma Exacerbation Prediction and Risk Factor Analysis Based on a Time-Sensitive, Attentive Neural Network: Retrospective Cohort Study. J Med Internet Res. 2020;22(7):e16981.
25. Huffaker MF, Carchia M, Harris BU, Kethman WC, Murphy TE, Sakarovitch CCD, et al. Passive nocturnal physiologic monitoring enables early detection of exacerbations in children with asthma a proof-of-concept study. Am J Respir Crit Care Med. 2018;198(3):320–8.
26. Horimasu Y, Ohshimo S, Yamaguchi K, Sakamoto S, Masuda T, Nakashima T, et al. A machine-learning based approach to quantify fine crackles in the diagnosis of interstitial pneumonia: A proof-of-concept study. Medicine. 2021;100(7):e24738.
27. Ohno Y, Aoyagi K, Takenaka D, Yoshikawa T, Ikezaki A, Fujisawa Y, Murayama K, Hattori H, Toyama H. Machine learning for lung CT texture analysis: Improvement of inter-observer agreement for radiological finding classification in patients with pulmonary diseases. Eur J Radiol. 2021;134:109410.
28. Li Q, Cai W, Feng DD. Lung image patch classification with automatic feature learning. Proc Annu Int Conf IEEE Eng Med Biol Soc. 2013;6079–82.
29. Zhao W, Xu R, Hirano Y, Tachibana R, Kido S. A sparse representation based method to classify pulmonary patterns of diffuse lung diseases. Comput Math Methods Med. 2015;2015:567932.
30. Bermejo-Peláez D, Ash SY, Washko GR, San José Estépar R, Ledesma-Carbayo MJ. Classification of Interstitial Lung Abnormality Patterns with an Ensemble of Deep Convolutional Neural Networks. Sci Rep. 2020;10(1):1–15.
31. Walsh SLF, Calandriello L, Silva M, Sverzellati N. Deep learning for classifying fibrotic lung disease on highresolution computed tomography: a case-cohort study. Lancet Respir Med. 2018;6(11):837–45.
32. Pankratz DG, Choi Y, Imtiaz U, Fedorowicz GM, Anderson JD, Colby T V., et al. Usual interstitial pneumonia can be detected in transbronchial biopsies using machine learning. Ann Am Thorac Soc. 2017;14(11):1646–54.
33. Wells AU, Antoniou KM. The genomic detection of usual interstitial pneumonia from transbronchial biopsy tissue: A dress rehearsal for the future? Ann Am Thorac Soc. 2017;14(11):1632–3.
34. Zou XL, Ren Y, Feng DY, He XQ, Guo YF, Yang HL, Li X, Fang J, Li Q, Ye JJ, Han LQ, Zhang TT. A promising approach for screening pulmonary hypertension based on frontal chest radiographs using deep learning: A retrospective study. PLoS One. 2020;15(7):e0236378.
35. Kusunose K, Hirata Y, Tsuji T, Kotoku J, Sata M. Deep learning to predict elevated pulmonary artery pressure in patients with suspected pulmonary hypertension using standard chest X ray. Sci Rep. 2020;10(1):1–8.
36. Kwon J myoung, Kim KH, Medina-Inojosa J, Jeon KH, Park J, Oh BH. Artificial intelligence for early prediction of pulmonary hypertension using electrocardiography. J Hear Lung Transplant. 2020;39(8):805–14.
37. Leha A, Hellenkamp K, Unsöld B, Mushemi-Blake S, Shah AM, Hasenfuß G, et al. A machine learning approach for the prediction of pulmonary hypertension. PLoS One. 2019;14(10):1–16.
38. Leopold JA, Maron BA. Precision Medicine in Pulmonary Arterial Hypertension. Circ Res. 2019;124(6):832-833.
39. Zhang J, Gajjala S, Agrawal P, Tison GH, Hallock LA, Beussink-Nelson L, et al. Fully automated echocardiogram interpretation in clinical practice: Feasibility and diagnostic accuracy. Circulation. 2018;138(16):1623– 35.
40. Sweatt AJ, Hedlin HK, Balasubramanian V, Hsis A, Blum LK, Robinson WH, et al. Discovery of Distinct Immune Phenotypes Using Machine Learning in Pulmonary Arterial Hypertension HHS Public Access. Circ Res. 2019;124(6):904–19.
41. Ong MS, Klann JG, Lin KJ, Maron BA, Murphy SN, Natter MD, et al. Claims-based algorithms for identifying patients with pulmonary hypertension: A comparison of decision rules and machine-learning approaches. J Am Heart Assoc. 2020;9(19):e016648.
42. Goldstein CA, Berry RB, Kent DT, Kristo DA, Seixas AA, Redline S, et al. Artificial intelligence in sleep medicine: Background and implications for clinicians. J Clin Sleep Med. 2020;16(4):609–18.
43. Biswal S, Sun H, Goparaju B, Brandon-Westover M, Sun J, Bianchi MT. Expert-level sleep scoring with deep neural networks. J Am Med Informatics Assoc. 2018;25(12):1643–50.
44. Bernardini A, Brunello A, Gigli GL, Montanari A, Saccomanno N. AIOSA: An approach to the automatic identification of obstructive sleep apnea events based on deep learning. Artif Intell Med. 2021;118:102133.
45. Mostafa SS, Mendonça F, Ravelo-García AG, MorgadoDias F. A systematic review of detecting sleep apnea using deep learning. Sensors. 2019;19(22):1–26.
46. Goldstein CA, Berry RB, Kent DT, Kristo DA, Seixas AA, Redline S, et al. Artificial intelligence in sleep medicine: An American Academy of Sleep Medicine position statement. J Clin Sleep Med. 2020;16(4):605–7.
47. Pépin JL, Bailly S, Tamisier R. Big Data in sleep apnoea: Opportunities and challenges. Respirology. 2020;25(5):486–94.
Recibido: 12 de Noviembre, 2021
Aceptado: 22 de Noviembre, 2021
Correspondencia:
Leslie Vargas-Ramírez