Resúmen
Propósito de la revisión: La
terapia médica nutricional con dieta cetogénica se ha empleado para el
tratamiento de la epilepsia por casi un siglo. En la actualidad,
resurge para la reducción rápida de peso
y su empleo en atletas; también se ha estudiado en enfermedades como
las neurológicas, el cáncer, la
obesidad y la diabetes de tipo II. En esta revisión se definen los
diferentes tipos de dietas cetogénicas,
se explican los fundamentos metabólicos, se exploran nuevos
conocimientos sobre los mecanismos
relacionados en las diferentes enfermedades, y se alerta sobre sus
riesgos y consecuencias.
Hallazgos
recientes:
Se ha sugerido que las dietas cetogénicas no solo mejoran el control de
las convulsiones,
sino que también causan un impacto en diferentes afecciones
neurológicas, pueden controlar el crecimiento tumoral y contribuyen al
control de la obesidad; además, se han observado resultados diversos
cuando se usan para mejorar el rendimiento en atletas y en voluntarios
sanos. Discusión: Se han
encontrado resultados positivos con el empleo de las dietas cetogénicas
en diferentes enfermedades.
Existen dificultades en la estandarización de los datos, debido a la
inexactitud de la información con
respecto al consumo de alimentos y al cumplimiento de la dieta a largo
plazo. El número limitado de
pacientes y su deserción hacen difícil la reproducción y generalización
de los resultados de este tratamiento nutricional.
Conclusiones: La dieta cetogénica no
es inocua. Se necesita que su indicación,
implementación y seguimiento estén a cargo de profesionales de la salud
idóneos, quienes pueden
prever los riesgos y los beneficios que se pueden obtener en cada una
de las indicaciones.
Palabras clave: dieta
cetogénica; dieta de Atkins; glioblastoma; cáncer; Alzheimer;
Parkinson; epilepsia; esclerosis múltiple; enfermedades neurológicas;
obesidad.

¹ ND, MBA. Miembro Asociado Academia Nacional de Medicina.
Directora del Centro Latinoamericano de Nutrición.
Ketogenic diets and their role in clinical nutrition
Abstract
Purpose of the review: Ketogenic
diet as a medical nutritional therapy has been used to treat
epilepsy for almost a century. Nowadays, ketogenic diets are
re-emerging as ways to reduce
weight rapidly and for performance improvement in athletes. The impact
of ketogenic diets in
diseases such as cancer, obesity, type II diabetes, and neurological
diseases has also been
studied. This review lists the definition and classification of the
different types of ketogenic
diets and the explanation of their respective metabolic fundamentals.
Also reviewed, is the
new research regarding the risks and related effects in various
diseases when following this
type of diet.
Recent findings: It
has been suggested that ketogenic diets not only improve
seizure control, but also positively impact neurological conditions,
may help control tumor
growth, and contribute to obesity management. In addition, various
positive results have been
observed when used to improve performance in athletes and healthy
volunteers. Discussion:
Positive results have been found with the use of ketogenic diets in
different diseases. There
are difficulties in standardizing the data, due to the inaccuracy of
the information regarding
food consumption and long-term diet compliance. The limited number of
patients and their
desertion make it difficult to reproduce and generalize the results of
this nutritional treatment.
Conclusions: The ketogenic diet
is not safe. It is necessary that its indication, implementation, and
follow-up, be carried out by qualified health professionals, who can
understand the
risks/benefit tradeoff of ketogenic diets.
Keywords: ketogenic
diet; Atkins diet; glioblastoma; cancer; Alzheimer’s; Parkinson’s;
epilepsy; multiple sclerosis; neurological diseases; obesity.
Introducción
La dieta cetogénica se ha empleado desde la época de
Hipócrates, en la cual los periodos de ayuno mostraban ser beneficiosos
para el manejo de la epilepsia.
Se caracteriza por ser rica en grasa y baja en carbohidratos. Su
objetivo es imitar el estado de ayuno con el
propósito de favorecer la producción de cuerpos cetónicos, mediante el
cambio de la principal fuente energética, de la grasa por los
carbohidratos (1).
Existe evidencia reciente que sugiere la importancia
que las dietas cetogénicas pueden tener en diferentes enfermedades,
además del conocido papel que
desempeñan en el manejo de las convulsiones en
los pacientes con epilepsia, pues contribuyen a tratar la
sintomatología presente en la enfermedad de
Parkinson, la de Alzheimer, la esclerosis múltiple,
el cáncer, la diabetes tipo 2 y la obesidad, y en el
deportista con el objeto de optimizar su desempeño.
(1-14).
En los estudios clínicos recientes de estas dietas en
adultos, se destaca la importancia de establecer sus características,
las tasas de deserción de los estudios, los
métodos para evaluar el cumplimiento de la alimentación prescrita y los
reportes de los efectos secundarios
relacionados con la terapia médica nutricional. Esto,
con el objetivo de permitir la reproductibilidad y la generalización de
los resultados en las diferentes situaciones clínicas.
Existen cuatro tipos de dietas cetogénicas (11): la clásica, la de
triglicéridos de cadena media, la de Atkins
modificada y la de bajo índice glucémico. Las proporciones de los
nutrientes varían entre ellas. Para mayor
claridad, se explican a continuación.
• Clásica
o tradicional. Esta no es una dieta balanceada. Contiene una
proporción fija entre
gramos de grasa y gramos de carbohidratos y
proteínas. Las relaciones más usadas son de 4:1 y
de 3:1. Una dieta cetogénica con relación de 4:1
significa que, para un total de 5 gramos, 4 son de
grasa y el gramo restante puede ser de proteína o
carbohidrato o de su combinación. Por lo tanto,
en una dieta cetogénica de 4:1, el 90% de las calorías provienen de la
grasa. Cuando la relación
es de 3:1, el aporte calórico de la grasa es del 87%
y el 13% restante le corresponde a las proteínas y
carbohidratos.
• Triglicéridos de cadena media.
Este tipo de grasa contiene ácidos octanoicos y decanoicos, los
cuales producen mayor cantidad de cetonas por
unidad de energía que los triglicéridos de cadena
larga, que son utilizados con mayor frecuencia en
la alimentación normal. Se emplea aceite de triglicéridos de cadena
media para proporcionar alrededor de la mitad del aporte calórico,
razón por
la cual se requiere una menor cantidad de grasa en
la dieta, lo cual permite mayor aporte de proteína
y carbohidratos y, por ende, una mayor variedad
de alimentos.
En 1970, Peter Huttenlocher desarrolló la dieta
cetogénica, en la cual el 60% de las calorías las
aportaban los triglicéridos de cadena media (12).
En algunos pacientes, esta cantidad producía intolerancia
gastrointestinal, manifestada por dolor de
tipo cólico, diarrea y vómito. Por esta razón, se ha
sugerido que una dieta en la que estos triglicéridos
aportan el 45% de las calorías, tiene los mismos
beneficios, con menos efectos gastrointestinales
secundarios. Aunque esta dieta tiene varias ventajas, su utilización
depende del costo de los triglicéridos de cadena media pues, en algunos
países, es
alto y no es subsidiado por los sistemas de salud.
• Atkins modificada. Esta
dieta permite administrar
entre 10 y 20 gramos diarios de carbohidratos, se estimula el consumo
de grasa (11). Es más fácil de implementar y preparar en casa, puesto
que no requiere pesar todos los alimentos que se van a consumir
y aporta mayores cantidades de proteína. Al igual
que la dieta cetogénica clásica, no es balanceada y
requiere suplemento de vitaminas y minerales.
• Bajo índice glucémico. Esta
dieta también es baja
en carbohidratos, los cuales están restringidos a un
aporte de 40 a 60 gramos diarios, e incluye la selección de alimentos
con un índice glucémico menor de 50 (11). Al igual que la dieta
modificada de
Atkins, es fácil de implementar, no requiere pesar
los alimentos ni supervisión nutricional continua,
y no es necesario iniciarla con periodos de ayuno,
ni que el individuo se hospitalice para iniciar su
tratamiento.
Aspectos bioquímicos de la dieta
cetogénica
El objetivo de esta dieta es generar un estado cetogénico, el cual se
puede lograr después de algunos días
de ayuno o por la reducción del consumo de carbohidratos.
Las dos fuentes primarias de los cuerpos cetónicos son
los ácidos grasos y el metabolismo de los aminoácidos
leucina, isoleucina, lisina, fenilalanina, tirosina y triptófano. La
oxidación del alcohol también puede resultar en la formación de cuerpos
cetónicos.
Aunque los cuerpos cetónicos se producen en cantidades limitadas en el
hígado, no se emplean como fuente
de energía en este órgano, sino en otros tejidos como
los del corazón, el sistema musculoesquelético y los
riñones. El cerebro puede llegar a requerir entre 140
y 150 gramos diarios de glucosa; cuando el ayuno es
prolongado, se adapta para utilizar los cuerpos cetónicos como fuente
energética, los cuales pueden llegar a
suplir hasta el 50%, lo reduce el catabolismo proteico
necesario para la gluconeogénesis (15).
Estado cetogénico
En la mayoría de los pacientes, la homeostasis de la
glucosa se mantiene por las acciones reguladoras contrarias de la
insulina y el glucagón en el metabolismo
de la glucosa y la grasa. En condiciones normales de
alimentación, la glucosa es la fuente primaria de energía empleada por
los diferentes tejidos. El incremento posprandial de la glucosa
estimula las células β del
páncreas a secretar insulina, la cual interviene en la
captación celular de glucosa. Esto permite normalizar
los niveles de glucemia y que la glucosa se convierta en
energía celular. Una vez en la célula, se puede producir
la glucólisis para generar piruvato y adenosín trifosfato
(ATP). El piruvato –en presencia del oxígeno– se transporta a la
mitocondria y se convierte en acetil CoA, el
cual puede participar en el ciclo del ácido tricarboxílico para la
fosforilación oxidativa y la generación de
ATP mediante la cadena de transporte de electrones.
En periodos cortos de ayuno, de uno a tres días, los
niveles de glucemia se mantienen mediante el estímulo
del glucagón sobre la glucogenólisis y por la gluconeogénesis de
novo.
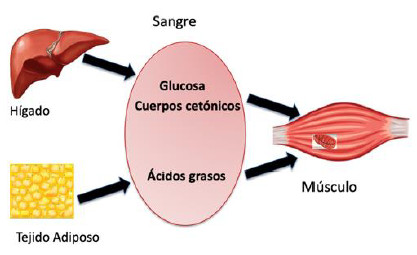
En casos de inanición prolongada, o sea con una duración mayor de tres
días, la lipoproteína lipasa estimula las acciones reguladoras
contrarias del glucagón,
la epinefrina y el cortisol, y genera la movilización de
ácidos grasos libres que se encuentran en los triglicéridos y están
almacenados en el tejido adiposo. Los
ácidos grasos libres que son secretados hacia la circulación pasan al
hígado para la β-oxidación con el objeto
de producir acetil-coenzima A (acetil-CoA), que es capaz de entrar al
ciclo de los ácidos tricarboxílicos (ciclo
de Krebs) para completar la fosforilación oxidativa.
La producción de ATP se genera a partir de fragmentos
de dos carbonos que se secretan como acetil-CoA desde la cadena de
ácidos grasos durante la β-oxidación.
Por lo tanto, en los periodos de ayuno, cuando la gluconeogénesis se
incrementa, el ácido oxalacético se
emplea como precursor de la glucosa, lo cual disminuye su
disponibilidad para condensarse con el acetilCoA para formar citrato,
lo que incrementa el flujo de
acetil-CoA mediante la acetoacetil-CoA tiocinasa en
dirección a la cetogénesis. La acetoacetil-CoA tiocinasa condensa dos
moléculas de acetil-CoA para formar
acetoacetil-CoA. A su vez, el acetoacetil-CoA se une a
una tercera molécula de acetil-CoA que, por la vía de la
HMG sintetasa, genera el hidroxi-3-metilglutaril-CoA
(HMG-CoA), la cual se fracciona para formar ácido
acetoacético y acetil-CoA. El ácido acetoacético puede
ser reducido por la NADH para formar ácido B-hidroxibutírico. La
acetona, a su vez, puede formarse por la
descarboxilación no enzimática del ácido acetoacético.
La producción de acetona es relativamente poca y la
que se produce se excreta por los pulmones (
figura 1).
En condiciones de ayuno o cuando la ingestión de
carbohidratos es muy baja, como en el caso de la dieta cetogénica, el
organismo agota las reservas de glucosa y comienza a utilizar las
reservas grasas mediante la oxidación de los ácidos grasos, la cual
genera los
cuerpos cetónicos que se emplean como una fuente
energética alterna para la producción de ATP. Por lo
tanto, la cetosis se produce por la generación y acumulación de cetonas
como resultado de la utilización
en exceso de grasas debido al déficit de carbohidratos
(
figura 2).
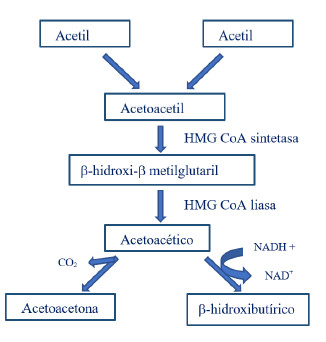
Tabla 1: Seguimiento medidas de control.
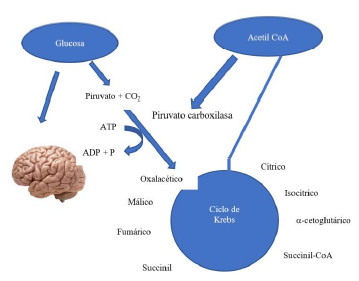
Figura 2. Interacción de la glucosa y la acetil-CoA, y
ciclo de Krebs. La glucosa es necesaria para suplir
la energía al sistema nerviosos central y para la
producción de piruvato que puede ser transformado a
ácido oxalacético con la unión de la acetil-CoA.
Traducido con permiso de referencia (14).
El ácido oxalacético se produce por medio del ciclo
anapletórico que lo sintetiza a partir de la glucosa,
mediante la carboxilación del ácido pirúvico por la
carboxilasa, la cual es dependiente del ATP. Cuando
el aporte de glucosa es deficiente, tanto para la oxidación de grasa
como para el suministro de la glucosa
requerida para el funcionamiento del sistema nervioso
central, el cuerpo emplea los cuerpos cetónicos como
fuente alterna para producir ATP, debido a que no
existe el ácido oxalacético necesario para entrar al ciclo de Krebs.
Este ciclo es una secuencia de reacciones
químicas que convierten glucosa, proteínas y grasas en
energía. La desviación del ácido oxalacético detiene el
ciclo de Krebs, reduce su eficiencia y evita el procesamiento de
acetil-CoA adicional (13,14). En condiciones normales, la oxidación de
la grasa genera grandes
cantidades de acetil-CoA, las cuales son procesadas en
el ciclo de Krebs.
Los cuerpos cetónicos son el ácido acetoacético, la
acetona y el ácido ß-hidroxibutírico, los cuales pueden
pasar por la barrera hematoencefálica y son fuentes alternativas de
combustible para el cerebro y otros tejidos.
En el cerebro, las mitocondrias ocupan los cuerpos
cetónicos y usan múltiples procesos enzimáticos para
convertirlos de nuevo en acetil-CoA y generar ATP.
Este proceso ocurre de manera similar en las mitocondrias de los
tejidos extrahepáticos, por lo que la cetogénesis aumenta la
concentración de cuerpos cetónicos
en la sangre y en la orina.
Mediante tiras reactivas se pueden detectar cuerpos cetónicos en la
orina para verificar si se produce cetosis,
las cuales indican valores de pH de 0 a 4+, que se correlacionan con
las concentraciones de cetonas entre 0
y más de 16 mmol/L.
La cetosis por dieta, a diferencia de la cetoacidosis
diabética, es un proceso gradual y, por lo tanto, más
seguro. Los niveles sanguíneos de cuerpos cetónicos alcanzan un nivel
máximo de 7 a 8 mmol/L y generan
menos alteraciones del pH.
Una característica clínica común de la diabetes y una dieta cetogénica
es el aliento con olor a “fruta madura”, el
cual se produce por la volatilidad de la acetona (13,14).
En las personas con una dieta cetogénica, se emplean
los cuerpos cetónicos como la principal fuente energética; sin embargo,
los niveles de glucemia permanecen
normales. Esto se debe al proceso de gluconeogénesis
a partir de proteínas y a la liberación de glicerol por
la oxidación de las grasas. De esta manera, los tejidos
que son absolutamente dependientes de la glucosa,
como los eritrocitos, pueden suplir sus demandas metabólicas (13,14).
En la
figura 3, se presenta un
esquema de la formación,
utilización y excreción de los cuerpos cetónicos (16).
Beneficios en las enfermedades
neurológicas
Las dietas cetogénicas se emplean con frecuencia en
los pacientes con alteraciones neurológicas, principalmente con
epilepsia, aunque se está considerando su
empleo en la enfermedad de Alzheimer, la de Parkinson, la esclerosis
lateral amiotrófica, la esclerosis múltiple y el síndrome de
deficiencia de GLUT1.
Existen varios estudios preclínicos que apoyan el uso
de las dietas cetogénicas, los cuerpos cetónicos o ambos, para impedir
o mejorar los cambios bioquímicos
e histológicos que conducen a la disfunción neurológica. Se han
postulado diferentes hipótesis o pruebas
de mecanismos que demuestran que las terapias cetogénicas influyen en
la regulación metabólica, la modulación de neurotransmisión, la
reducción del estrés oxidativo y los efectos antiinflamatorios y
genómicos
(17) (
tabla 1).
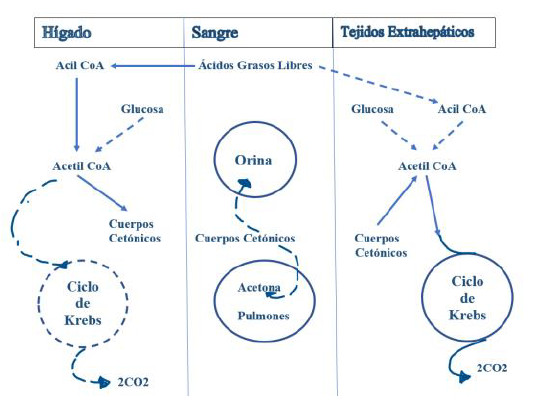
Figura 3. Formación, utilización y excreción de cuerpos cetónicos.
Las líneas punteadas muestran vías secundarias y las continuas son vías
principales.
Adaptado de referencia (16).
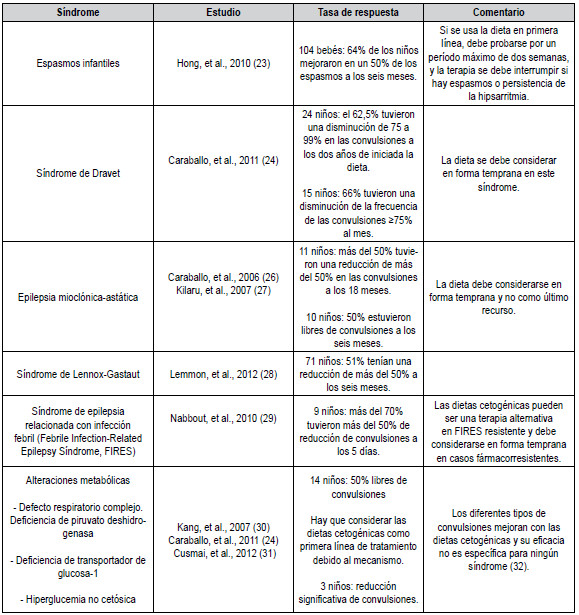
Epilepsia
La dieta cetogénica data de tiempos históricos, cuando se prescribían
cambios en la alimentación para el
manejo de diferentes enfermedades, entre ellas, la epilepsia. En su
tratado sobre
La enfermedad sagrada
(400
a. de C.), Hipócrates trató de eliminar la creencia de
que la epilepsia tenía un origen divino, por lo que era
necesario buscar la causa orgánica (18).
En 1911, los médicos franceses Guelpap y Marie trataron 20 niños y
adultos con epilepsia, empleando una
dieta vegetariana hipocalórica combinada con periodos de inanición y
purgado, y reportaron una disminución en las convulsiones (19). En los
Estados Unidos, y por la misma época, Bernarr Macfadden, un
fisicoculturista de la época, popularizó el ayuno para restaurar
la salud. H. Conklin (20), un estudiante de Macfadden
comenzó a tratar los pacientes epilépticos con ayuno.
Tuvo éxito en el 20% de pacientes, quienes no presentaron convulsión
alguna, y alguna mejoría en el 50%
de ellos (11).
Tabla 1. Mecanismos hipotéticos mediante los cuales las terapias
cetogénicas influyen en las enfermedades neurológicas
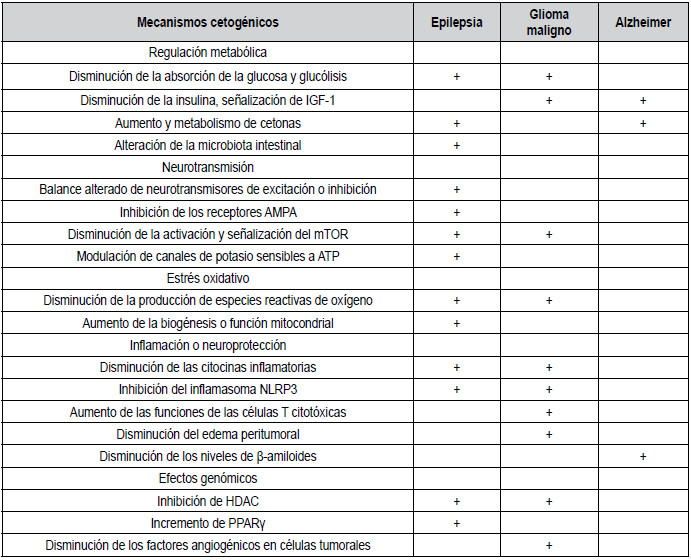
AMPA: ácido amino-3-hidroxil-5-metil-4-isoxazolepropiónico; IGF:
factor de crecimiento similar a la insulina 1; HDAC: histonas
deacetilasas; mTOR: objetivo mamífero de rapamicina; NLRP3: proteína
receptora similar a NOD 3; PPAR: peroxisoma receptor activado por
proliferador. Adaptado con permiso de: referencia (17)
En 1921, Wilder de la Clínica Mayo, propuso la dieta
cetogénica como alternativa al ayuno, la cual tenía por
objeto imitar metabólicamente la inanición y, por otro
lado, proporcionar suficientes cantidades de proteínas
y calorías para permitir un crecimiento adecuado (21).
A medida que estuvieron disponibles los anticonvulsionantes, la dieta
cetogénica se utilizó con menor frecuencia, aunque se considera una
opción en los casos
de epilepsia resistente cuando la cirugía no es viable y
en las encefalopatías epilépticas (11,22). Según la experiencia de
Dhamija, et al.(11), todos los tipos de convulsiones mejoran con este
tipo de tratamiento nutricional, pero los enfermos con epilepsia focal,
aunque
mejoran, no alcanzan a estar libres de los episodios
convulsivos. La eficacia de la dieta cetogénica no es específica para
ningún síndrome, aunque se emplea con
mayor frecuencia en las encefalopatías epilépticas de
la infancia (23–32) (
tabla 2).
En adultos, la evidencia sobre los efectos de la dieta
cetogénica en la epilepsia es menos contundente que
en los niños y, además, se emplea con menor frecuencia (33). Un estudio
de Cochrane (22) muestra que
son pocas las investigaciones en adultos, las muestras
son pequeñas y heterogéneas, y aunque los resultados
son positivos, se deben interpretar con cautela, pues
es evidente que se requiere más investigación al respecto (34,35). Aun
así, las dietas cetogénicas se deben
considerar como una opción en adultos con epilepsia
intratable con medicamentos. La posibilidad de dietas
más agradables, como la dieta modificada de Atkins
o la de bajo índice glucémico, mejora las opciones de
cumplimiento en los adultos, y reduce la sintomatología y los efectos
secundarios.
Enfermedad de Alzheimer
La enfermedad de Alzheimer es la forma más común
de demencia progresiva. Se caracteriza por la pérdida
de la memoria reciente y el déficit cognitivo asociado
con el depósito extracelular de péptido amiloide, ovillos
neurofibrilares de proteína tau intracelular y muerte neuronal en el
hipocampo.
Las teorías varían con respecto a la etiología del proceso general de
la enfermedad, pero la disfunción
mitocondrial y el hipometabolismo de la glucosa son
características bioquímicas reconocidas (36). El procesamiento de la
proteína precursora amiloide, los
defectos en la función mitocondrial y la disminución
en la función de la cadena respiratoria, se alteran para
favorecer la producción del fragmento amiloide patógeno. La reducción
de la absorción y el metabolismo
de la glucosa se relaciona con la degeneración cognitiva progresiva,
debido a que las neuronas mueren de
hambre debido a una glucólisis ineficiente (37).
Se ha demostrado la asociación entre una dieta con un
alto índice glucémico y una mayor carga cerebral de
amiloide en humanos (38); además, el aumento de la
resistencia a la insulina contribuye al desarrollo de la
enfermedad de Alzheimer (39–41). Esto sugiere que es
posible modificar la alimentación para prevenir la acumulación de
amiloide en el cerebro y reducir el riesgo
de enfermedad de Alzheimer.
Las dietas cetogénicas se consideran de utilidad en los
pacientes con enfermedad de Alzheimer. En esta enfermedad parece
existir una disminución patológica de
la habilidad del cerebro para utilizar la glucosa, que es
el principal sustrato energético del cerebro. Hay datos
neurobiológicos que sugieren que los cuerpos cetónicos son una fuente
alterna de energía, efectiva para el cerebro. La administración de
triglicéridos de cadena
media puede elevar la concentración de cuerpos cetónicos y mejorar la
función cognitiva en adultos mayores con alteraciones de la memoria
(42).
Tabla 2. Hallazgos en síndromes electroclínicos específicos
FIRES: Febrile Infection-Related Epilepsy Syndrome. Modificado con
Permiso Referencia (11)
Reger,
et al. (43), llevaron
a
cabo el primer estudio clínico doble ciego, controlado y con placebo,
de 20 pacientes con enfermedad de Alzheimer o con defecto
cognitivo leve. Se les suministró una bebida en emulsión con
triglicéridos de cadena media o con placebo.
La elevación de los cuerpos cetónicos (ácido ß-hidroxibutírico) ocurrió
únicamente en los pacientes que no
tenían el genotipo de la apolipoproteína E (APOE).
En ellos, se encontró un rendimiento cognitivo mejorado a corto plazo,
medido con una herramienta sencilla de evaluación que mide dominios
cognitivos que
incluyen atención, memoria, lenguaje y práctica.
Henderson,
et al. (44),
también compararon la influencia de los triglicéridos de cadena media
en la memoria
y en la cognición, en un estudio doble ciego controlado
con placebo. Al igual que Reger, demostraron que la
elevación de la concentración sérica del ácido ß-hidroxibutírico
mejoraba la memoria y la función cognitiva.
Taylor,
et al. (45),
llevaron
a cabo una prueba piloto
de un solo grupo de 15 pacientes con enfermedad de
Alzheimer, leve y moderada. Este era un estudio de
retención y viabilidad de la dieta cetogénica, en el cual
se empleó una alimentación con suplemento de triglicéridos de cadena
media durante tres meses, una relación de dieta cetogénica ≤1:1 y con
complemento de
triglicéridos de cadena media (70% de energía como
grasa). Se demostró que en 9 de cada 10 pacientes con
enfermedad de Alzheimer que completaron el estudio
y lograron la cetosis, había una mejoría en el puntaje
de la escala cognitiva de evaluación de la enfermedad,
que se correlacionó con la elevación de los niveles séricos de ácido
ß-hidroxibutírico.
Krikorian,
et al. (46),
compararon una dieta baja en
carbohidratos con una alta, en 23 pacientes adultos
con déficit cognitivo leve tratados por más de seis semanas. Con la
dieta baja en carbohidratos se demostró un mejor rendimiento de la
memoria verbal y una
correlación positiva con la concentración de cuerpos
cetónicos, pero no hubo diferencia significativa en la
función cognitiva entre los dos grupos.
Otros estudios demostraron efectos positivos con las
dietas cetógénicas, tanto en la enfermedad de Alzheimer como en el
déficit cognitivo leve (9,47-51) (
tabla
3).
Enfermedad de Parkinson
La patogénesis de la enfermedad esporádica de Parkinson no se conoce
aún. Se ha propuesto que el deterioro de la función mitocondrial que
compromete
la sustancia
nigra, juega un
papel importante en el comienzo y en la progresión de la enfermedad
(14). Kashiwaya,
et al. (52),
usaron un análogo de la heroína, el
1-metil-4-fenilpiridinio (MPP+), que produce la muerte de las células
de la sustancia nigra dopaminérgica,
mediante la inhibición del complejo multienzimático
mitocondrial de la NADH deshidrogenasa. Este análogo produce cambios en
las neuronas mesencefálicas
cultivadas, similares a los observados en la enfermedad de Parkinson.
El ácido ß-hidroxibutírico protegió
a estas neuronas de la neurodegeneración tóxica por el
1-metil-4-fenilpiridinio (+) (52).
En un estudio pequeño y no controlado de siete pacientes, se evaluó la
mejoría mediante la escala unificada
de calificación de la enfermedad de Parkinson (
Unified
Parkinson’s Disease Rating Scale, UPDRS), después de
que los pacientes se sometieron a una dieta cetogénica
durante 28 días; cinco de ellos la implementaron con
éxito y mejoraron su puntaje en la escala (53).
Phillips,
et al. (5),
adelantaron un estudio piloto, aleatorizado y controlado de 44
pacientes, a quienes se
les asignó en forma aleatoria una dieta baja en grasa
o una dieta cetogénica. Treinta y ocho pacientes terminaron el estudio
y, los que tenían dieta cetogénica
mantuvieron niveles fisiológicos de cetosis. Los autores concluyeron
que ambos grupos mejoraron en forma significativa de los síntomas
motores y no motores;
sin embargo, el grupo con la dieta cetogénica tuvo mayor mejoría de los
síntomas no motores.
Tabla 3. Otros estudios clínicos sobre dietas cetogénicas en el
tratamiento de la enfermedad de Alzheimer
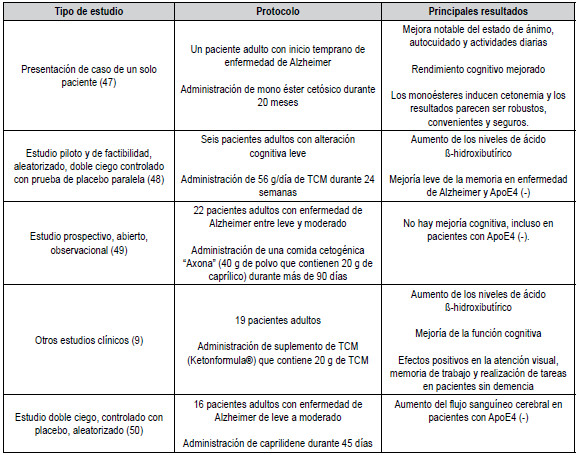
TCM: triglicéridos de cadena media. Modificado con autorización de
referencia
No obstante, se requieren más estudios para poder decir que la dieta
cetogénica tiene un valor contundente
en el manejo de la enfermedad de Parkinson.
Esclerosis múltiple
La esclerosis múltiple es una enfermedad neurodegenerativa de
naturaleza autoinmunitaria que produce
inflamación y destrucción de la vaina de mielina de
las neuronas, lo que altera la actividad energética en
las mitocondrias. Esto lleva a un proceso degenerativo
debido a la falta del soporte trófico proporcionado por
la mielina. Algunas de las consecuencias físicas incluyen pérdidas o
cambios musculares que implican un deterioro que disminuye hasta en 40%
la capacidad
mitocondrial muscular, lo que conlleva un empeoramiento de la función
física y disminución de la masa
muscular.
En el estudio de Benlloch,
et al. (54),
de 27 pacientes
con esclerosis múltiple, el empleo de una dieta isocalórica,
mediterránea y cetogénica durante cuatro meses,
logró mejorar la masa muscular magra, disminuir la
inflamación y el estado oxidativo como consecuencia
de un incremento en la saciedad y en la disminución
del apetito.
En el estudio piloto de Brenton,
et
al. (6), de 20 pacientes con esclerosis múltiple recurrente, se
les indicó una
dieta cetogénica durante seis meses. Se obtuvo reducción del índice de
masa corporal y de la masa grasa
total (p<0,0001), reducción de la fatiga (p=0,002), mejoría en los
puntajes de depresión (p=0,0003) y reducción significativa de la
leptina (p<0,0001).
La dieta cetogénica parece ser una opción en el manejo de la esclerosis
múltiple. Brinda beneficios clínicos,
aunque se requiere un mayor número de estudios confirmatorios.
Cáncer
En las células cancerosas, la mayor parte de la energía
proviene de la glucosa, incluso en presencia de oxígeno. Con el objeto
de entender este proceso es necesario
revisar sus diferentes etapas. El primer paso de la respiración se
llama glucólisis, proceso en el cual la glucosa
se rompe en dos moléculas más pequeñas llamadas
piruvato y se forman 2 ATP. La mayoría de las células
sanas continúan con un segundo proceso de oxidación
del piruvato en el ciclo de Krebs, del cual se obtienen
36 ATP (
figura 4).
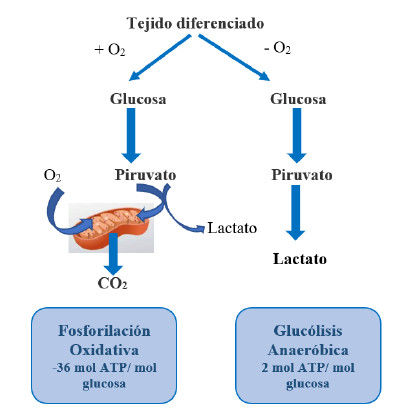
Figura 4. Producción energética en la glucólisis aeróbica y la
anaeróbica. Autoría Propia.
La situación interna de las células tumorales es estresante. Los vasos
sanguíneos del tumor se alteran y, con frecuencia, tienen aspecto
anormal y contorneado.
Esta estructura defectuosa conduce a una pobre capacidad de entregar
oxígeno y da como resultado un estado de acidosis. Otra consecuencia de
la distribución
anormal de los vasos es que algunas partes del tumor
están lejos de los vasos sanguíneos y no reciben suficientes nutrientes
y oxígeno. A medida que los tumores crecen, el suministro de sangre se
hace insuficiente,
lo cual provoca que el área dentro del tumor se torne
hipóxica.
Las células que solo usan glucólisis no dependen del
oxígeno para sobrevivir. Esto puede beneficiar a las
células cancerosas que se encuentran en ambientes bajos de oxígeno.
Como reacción a la hipoxia, se activa
una proteína llamada HIF1-α (
Hypoxia
Inducible Factor 1-Subunit Alpha). Esta proteína aumenta la
tasa de
glucólisis y disminuye la conversión de glucosa a los
productos que se ven en las células normales. La hipoxia y la
activación de la HIF1-α ayudan a promover
tanto el movimiento celular como la metástasis, al incrementar la
producción de TWIST, una proteína que
juega un papel esencial en las metástasis. La TWIST
hace que las células cancerosas cedan el control sobre
su entorno, lo que les permite moverse e invadir tejidos
cercanos. El proceso por el cual las células epiteliales
cambian a un tipo de célula que puede moverse más
fácilmente, se conoce como la transición epitelialmesenquimal. Junto
con la capacidad de moverse, la
transición epitelial-mesenquimal brinda a las células
capacidades “primitivas” que ayudan a proteger las células cancerosas y
facilitan la propagación del cáncer
(4,6,11,17,55-57).
Las células cancerosas generan un gran desperdicio de
energía debido a que solo hacen el primer paso de la
glucólisis, produciendo solo 2 ATP. Con frecuencia, no
completan la fosforilación oxidativa, que es el segundo
paso y en el cual está la mayor producción energética.
Como resultado, necesitan usar muchas más moléculas de glucosa para
obtener suficiente energía para sobrevivir. Este mecanismo se conoce
como el “efecto
Warburg” debido a que fue Otto Warburg, un científico alemán, Premio
Nobel de Medicina en 1931, el primero en describir este comportamiento
(11) (
figura 4).
Es posible que algunas células cancerosas no puedan
completar todo el proceso de respiración debido a las
mutaciones en el ADN, aunque los cambios metabólicos que se generan por
usar solo la glucólisis les proporciona algunas ventajas como, por
ejemplo, generar
ácido láctico y bicarbonato, que pueden usarse como
sustratos que les ayudan a sobrevivir y crecer; evitar
ser reconocidas y destruidas por las células del sistema
inmunológico; atraer células que pueden ayudar al crecimiento de las
células tumorales, y activar oncogenes
que les permiten evitar su destrucción.
La dieta cetogénica probablemente crea un entorno
metabólico desfavorable para las células cancerosas y,
por lo tanto, puede considerarse como un adyuvante
prometedor y como una terapia multifactorial específica del paciente.
La mayoría de los estudios preclínicos
y varios estudios clínicos abogan por el uso de la dieta
cetogénica en combinación con tratamientos estándar,
con base en su potencial para mejorar los efectos antitumorales de la
quimioterapia y la radioterapia clásicas. Este tipo de dieta se
considera segura y tolerable,
y mejora la calidad de vida (56,57).
Weber,
et al. (57), evaluaron
de forma crítica la evidencia preclínica y clínica de las dietas
cetogénicas en el
contexto de la terapia del cáncer en un trabajo publicado en línea en
el 2019, en el que resaltan los mecanismos que podrían explicar los
efectos antitumorales de
la dieta cetogénica. La revisión incluyó 87 estudios, de
los cuales 30 eran clínicos y 57 preclínicos.
Los estudios preclínicos argumentaron que la dieta cetogénica había
disminuido el crecimiento tumoral en
el 60%, mientras que en el 17% no se detectó ninguna
influencia en el crecimiento tumoral. También, afirmaban que prolongaba
la tasa de supervivencia, retrasaba la iniciación del tumor y reversaba
el proceso de
caquexia inducida por el cáncer.
Aunque, en su mayoría, los estudios clínicos eran resúmenes, estudios
de casos y estudios pilotos y de factibilidad, enfocados en la
tolerancia y la seguridad de
la dieta cetogénica, encontraron que el tratamiento de
referencia es la combinación de cirugía, radioterapia y
quimioterapia. Hasta esta publicación de Weber, existen dos estudios y
solo uno de ellos controlado aleatorizado en mujeres con cáncer de
ovario o de endometrio, de Cohen, et al. (58,59), que presentaron
mejoría
de la función física, mayor energía y disminución de
los deseos de picar alimentos.
Nebeling,
et al. (60),
reportaron una reacción terapéutica excelente con la dieta cetogénica
en dos pacientes
pediátricos con astrocitoma maligno en estado avanzado. Después de ocho
semanas con dieta cetogénica,
en la tomografía por emisión de positrones, en ambos
niños se observó una disminución promedio del 21,8%
de la absorción de glucosa en el sitio del tumor. Uno de
ellos presentó una mejoría significativa del estado de
ánimo y el aprendizaje de habilidades, y continuó con
esta dieta durante doce meses, permaneciendo libre de
progresión de la enfermedad. Después del diagnóstico,
ambos pacientes permanecieron en remisión, uno de
ellos durante cinco años y el otro por cuatro, ambos
con buena calidad de vida.
En general, cuando los pacientes observaron la dieta
cetogénica, se produjo pérdida de peso con reducción
de la grasa total, con preservación de la masa magra.
En los pacientes caquécticos, la dieta cetogénica produjo ganancia de
peso y mantuvo un balance positivo
de nitrógeno (60).
La razón por la que algunas investigaciones no pudieron llegar a una
conclusión con respecto a la eficacia
de la dieta cetogénica en pacientes con cáncer, fue la
falta de poder del estudio o a la falta de observancia de
la dieta de los pacientes con cáncer.
Sin embargo, para dilucidar aún más los mecanismos
de la dieta cetogénica como terapia y evaluar su aplicación en la
práctica clínica, se necesitan más estudios
moleculares, así como estudios clínicos controlados
uniformes (56).
Glioblastoma multiforme
El glioblastoma multiforme es el tumor cerebral maligno primario más
común y letal. El 34,6% de los pacientes tienen un pronóstico de vida
de un año y menos del 5% presenta supervivencia a cinco años (61).
Se ha demostrado una relación adversa entre la esperanza de vida y los
episodios hiperglucémicos en los
pacientes con glioblastoma multiforme que se encuentran en tratamiento.
A la luz de los estudios e hipótesis
con respecto a la utilización de la glucosa en las células
malignas, se considera el empleo de dietas cetogénicas
y con restricción calórica como terapia adyuvante.
Paradójicamente, los tratamientos destinados a curar
el glioblastoma, como son la cirugía, la radiación y
la quimioterapia, causan directamente inflamación y
conducen a un aumento de los niveles de cortisol y de
sustancias necesarias para alimentar las células malignas, como son la
glucosa y el glutamato (neurotransmisor excitador) que luego se
convierte a glutamina, lo
cual contribuye directamente a la hiperglucemia (62).
Mayer,
et al. (63) llevaron a
cabo un estudio retrospectivo para evaluar el impacto de la
hiperglucemia en 106
pacientes que se sometieron al tratamiento estándar
para glioblastoma multiforme. La conclusión fue que
los que experimentaron episodios hiperglucémicos
durante el tratamiento tuvieron un pronóstico significativamente peor,
con una mediana de supervivencia
de 8,8 meses en aquellos con reportes de uno o más episodios de
hiperglucemia. La mediana de supervivencia fue 16,7 meses para los
pacientes que no informaron episodios de hiperglucemia, lo que implica
que este es un factor de riesgo potencial para un mal
pronóstico. Con base en la hipótesis del aumento de
la glucólisis en el glioblastoma multiforme y el valor
predictivo pronóstico de hiperglucemia, la restricción
de carbohidratos y las dietas cetogénicas se estudian
como terapia coadyuvante para este tumor. Infortunadamente, la
información que corrobora esta hipótesis
es limitada.
Varios estudios clínicos en pacientes con glioblastoma
han reportado resultados variables (63–69), algunos
son estudios de casos y otros tienen un mayor número
de pacientes, pero, en general, son grupos pequeños.
Uno de los casos fue el de una mujer de 65 años de
edad quien, después de una resección tumoral, recibió una dieta
cetogénica durante dos meses y medio,
y presentó regresión del glioblastoma multiforme (63).
Los dos estudios que incluyeron el mayor número de
pacientes fueron el de Champ y el de Rieger (64,68).
Champ,
et al. (64),
estudiaron en forma retrospectiva
53 pacientes, seis de los cuales tuvieron dieta cetogénica durante su
tratamiento. Cuatro de los pacientes
estaban vivos, con una mediana de seguimiento de 14
meses. Las cifras de glucemia de los pacientes con la
dieta estándar eran de 122 versus 84 mg/dl para los de
la dieta cetogénica. La restricción de carbohidratos
contribuyó a reducir de manera significativa los niveles
de glucemia, a pesar de estar recibiendo corticoides.
Rieger,
et al. (68),
evaluaron la restricción de carbohidratos y una dieta cetogénica en 20
pacientes con glioblastoma multiforme recurrente. Los pacientes
recibieron una alimentación sin restricción calórica, pero
con limitación de los carbohidratos, con un aporte de
menos de 60 gramos diarios. Para lograrlo, se les suministró yogur
fermentado con alto contenido de grasa
(500 ml/día) y suplementos a base de aceites vegetales.
Posteriormente, recibieron educación personalizada y
material impreso sobre las dietas cetogénicas, junto
con recetas e instrucciones para cumplir con la dieta
cetogénica durante la alimentación en casa. El efecto
de la dieta cetogénica se trató de evaluar verificando
las cetonas en orina dos o tres veces por semana, pero
su seguimiento fue poco eficaz. El rango de supervivencia libre de
progresión fue de 3 a 13 semanas, con
una media de tan solo 5 semanas. La mediana global
de supervivencia fue de 32 semanas.
Las células cerebrales normales pasan fácilmente al
metabolismo de las cetonas durante el ayuno terapéutico o la
restricción calórica. Las anormalidades estructurales y funcionales
presentes en la mitocondria
de los tumores cerebrales, por el contrario, restringen
el empleo de los cuerpos cetónicos como fuente energética por parte de
las células tumorales y dan como
resultado una dependencia del metabolismo de la glucosa por parte de
estas células malignas (70).
Infortunadamente, la terapia médica nutricional no es
parte de la práctica médica actual en el campo del cáncer cerebral. Sin
embargo, puede ser que, más pronto
que tarde, los médicos y los pacientes lleguen a apreciar el valor del
manejo nutricional en los tumores cerebrales malignos, en cuyo caso la
dieta cetogénica se
enfoca en el metabolismo de la energía tumoral y en
reducir su crecimiento mediante mecanismos integrados, como la acción
antiinflamatoria, la antiangiogénica y la proapoptótica (70).
Obesidad y diabetes de tipo 2
La obesidad se encuentra asociada con múltiples comorbilidades, afecta
en forma negativa el pronóstico
de otras enfermedades y resulta en un incremento sustancial de los
gastos en salud.
La patogénesis de la obesidad es multifactorial; incluye
causas genéticas, ambientales y del estilo de vida, que contribuyen al
desarrollo de alteraciones neuroendocrinas. Cuando se acumula grasa en
el tejido adiposo por
un balance energético positivo durante un tiempo prolongado, se puede
producir un estado fisiológico proinflamatorio que afecta las señales a
la insulina y crea resistencia a esta hormona. Con el tiempo, la
resistencia a
la insulina genera cambios metabólicos, como elevación
de la concentración de ácidos grasos libres, de los triglicéridos
plasmáticos y de las citocinas inflamatorias,
y de la dislipidemia aterogénica, lo cual incrementa el
riesgo de enfermedad cardiovascular (71).
La obesidad requiere un manejo multidisciplinario
para lograr una pérdida de peso exitosa. Existen opciones diferentes
para hacerlo, como regímenes alimentarios, intervenciones cognitivas
conductuales,
tratamientos farmacológicos, y procedimientos endoscópicos y
quirúrgicos. Aunque existan todas estas
iniciativas, menos del 20% de las personas logran el
objetivo de reducir peso, solo el 10% lo mantiene durante un año y la
mayoría vuelve a ganar peso en un
lapso de tres a cinco años (72).
Unas de las estrategias para reducir de peso son las
dietas cetogénicas, que se emplearon tiempo atrás y
que vuelven a considerarse debido a su rápido efecto
inicial y su potencial teórico que mejora la resistencia
a la insulina y la salud metabólica (71). Esta dieta se
empleó desde 1921 para la obesidad y para la diabetes
mellitus (73,74), pero el descubrimiento de la insulina
redujo la necesidad de prescribir alimentación baja en
carbohidratos. Después, a partir de la década de los
60, las dietas cetogénicas muy bajas en carbohidratos
se reconocieron con mayor frecuencia como métodos
para tratar la obesidad.
Dieta de Atkins
En 1972, Robert C. Atkins (75,76) popularizó la dieta
cetogénica y describió una alimentación muy baja en
carbohidratos para lograr la pérdida de peso, basada en
el principio de promover la cetogénesis. Las cetonas,
predominantemente el ácido acetoacético y el ácido ßhidroxibutírico, se
generan como reacción a la oxidación
de grasas y pueden utilizarse como fuente primaria de
combustible en lugar de la glucosa. La dieta cetogénica
de Atkins puede ser baja o muy baja en carbohidratos.
Muy baja en carbohidratos: se
recomiendan entre 20 y 50
gramos diarios de carbohidratos o 10% de una dieta
de 2.000 kcal/día para alcanzar un estado cetogénico.
Baja en carbohidratos: se
caracteriza por aportar menos
de 130 gramos diarios de carbohidratos. Este aporte es
un punto intermedio entre el 45 y el 65% de calorías
totales recomendadas en la población general.
Consiste en cuatro fases, las cuales tienen como objetivo producir una
pérdida de peso significativa y mantener el peso corporal ideal a largo
plazo (75). Estas
fases son: inducción, pérdida continua de peso, premantenimiento y
mantenimiento (75) ver tabla 4. La
dieta cetogénica parece ser efectiva para obtener una
disminución rápida de peso, principalmente a expensas de la pérdida de
grasa, aunque también se pierde
masa libre de grasa. La disminución de peso se relaciona especialmente
con la restricción calórica por
saciedad temprana y por la limitación en el consumo
de calorías provenientes de carbohidratos. El estado
cetogénico se asocia con la disminución de la resistencia a la insulina
y con una mejoría en el perfil de los
lípidos, ambos relacionados con la disminución de la
grasa corporal (77). La mayoría de los estudios indican
que la dieta cetogénica no reduce la capacidad de la
actividad física, a pesar de que existen algunos informes de
disminución del rendimiento en los ejercicios
de resistencia (77–79).
Deportes y dietas cetogénicas
El ejercicio y la nutrición son dos intervenciones que
influyen en las tasas de síntesis y degradación de la proteína muscular
y, por lo tanto, en su balance. El 80%
de la síntesis proteica proviene del reciclaje de aminoácidos, mientras
que solo el 20% se genera a partir de
la ingestión proteica (80). Los estímulos anabólicos,
como son el consumo de aminoácidos o el ejercicio,
pueden aumentar la síntesis proteica muscular, al mejorar la eficacia
del reciclaje de aminoácidos esenciales
provenientes de la degradación proteica muscular.
Tabla 4. Característica de la intervención con la dieta de Atkins
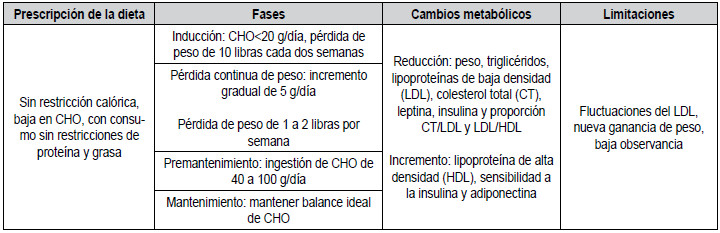
CHO: carbohidratos. Modificado con permiso de: referencia (75)
En los humanos, la gluconeogénesis se deriva generalmente del aporte de
un esqueleto de carbón proveniente de los pocos aminoácidos con
propiedades
gluconeogénicas (alanina, glutamina y glicina). En
las personas con sobrepeso y obesidad, el glicerol derivado de los
triglicéridos es una fuente importante
de glucosa. Estas dos fuentes mantienen un índice de
glucemia estable y evitan la hipoglucemia durante el
ayuno o en quienes ingieren una dieta cetogénica. Los
cuerpos cetónicos son capturados después por los tejidos extrahepáticos
de la circulación y utilizados como
fuente de energía (81) (
figura 5).
Efectos en el ejercicio aeróbico
La contribución de los ácidos grasos al metabolismo
oxidativo varía con la intensidad y la duración del
ejercicio. Durante el de intensidad baja a moderada,
la oxidación de ácidos grasos exógenos es una fuente importante de
energía. Cuando la intensidad es
moderada y tiene mayor duración, la contribución
de los ácidos grasos al metabolismo oxidativo aumenta. Por lo tanto,
las estrategias que promueven
la disponibilidad de ácidos grasos pueden ser críticas
para optimizar el ejercicio de resistencia. Además, las
dietas cetogénicas pueden ser útiles en el ejercicio de
resistencia aeróbica, debido a que promueven el uso
de las grasas como combustible, en lugar de los carbohidratos. La grasa
derivada del tejido adiposo es
un suministro constante de energía, mientras que las
reservas de carbohidratos endógenos del glucógeno
que se encuentran en el sistema musculoesquelético
y en el hígado son finitas. El aumento de los cuerpos cetónicos, como
resultado de la dieta cetogénica,
puede proporcionar una fuente de combustible alterna o suplementaria
para mantener el ejercicio de resistencia (82).
El efecto benéfico de la dieta cetogénica y baja en carbohidratos en el
ejercicio aeróbico, está relacionado
con la reducción de la masa corporal total y la grasa
corporal, una mayor tasa de oxidación de las grasas,
una menor oxidación de la glucosa y una reducción en la tasa de
utilización de glucógeno muscular durante
el esfuerzo físico.
Figura 5. Suministro exógeno de substratos en el organismo. Durante
el ejercicio, el sistema musculoesquelético
requiere una administración continua de sustratos exógenos para proveer
energía para la contracción muscular. El
hígado suministra glucosa y cuerpos cetónicos mediante las vías
gluconeogénicas y cetogénicas. La lipólisis del
tejido adiposo mantiene las concentraciones de ácidos grasos. Adaptado
de Referencia (84).
Es posible que la dieta cetogénica genere algunos
mecanismos fisiológicos que pueden limitar el rendimiento debido a
fatiga central, que se puede relacionar
con una mayor circulación de ácidos grasos no esterificados que
aumentan la competencia entre ellos y el
triptófano por la captación de albúmina. El resultado
es un aumento del triptófano libre que, a su vez, provoca una mayor
absorción por parte del cerebro y un
aumento subsecuente de la síntesis de serotonina. El
triptófano es un neurotransmisor relacionado con la
sensación de letargo y cansancio que puede contribuir
a la pérdida de la señal nerviosa a nivel central y a una
disminución en la motivación.
También, se pueden oxidar más aminoácidos, lo que
aumenta la concentración de amoníaco y contribuye a
la fatiga central (83,84).
Aunque hay poca información sobre la combinación
de las dietas cetogénicas con los ejercicios de resistencia para lograr
hipertrofia muscular, a continuación, se
mencionan algunos datos disponibles.
En el estudio de Vargas,
et al.
(10), se evaluó la eficacia de la dieta cetogénica combinada con un
programa
rendimiento deportivo. Esta mezcla mostró una alternativa de
alimentación con enfoque en la disminución
de la masa grasa y del tejido adiposo visceral, sin reducir la masa
corporal magra. Sin embargo, este estudio
que consiste en un protocolo de rendimiento deportivo
centrado en la tensión mecánica durante ocho semanas, no mostró ser una
estrategia óptima para desarrollar la masa muscular en hombres
entrenados.
En el estudio de Paoli,
et al.
(85), los cambios metabólicos similares al ayuno, que generan
resultados equivalentes a la autofagia, no parecen ser beneficiosos
para
la formación de masa muscular.
Otros autores consideran que las dietas bajas en carbohidratos o
cetogénicas no parecen ser superiores ni
ofrecen ventajas para el ejercicio de resistencia, en comparación con
las dietas ricas en carbohidratos (86,87).
Efectos en el ejercicio anaeróbico
El ejercicio anaeróbico es aquel de alta intensidad y
baja duración (menos de dos minutos). En esta situación, las demandas
de energía se suplen mediante el
sistema de provisión de fósforo y ácido láctico, los
cuales dependen en gran medida del glucógeno que se
encuentra en el sistema musculoesquelético. Durante
el ejercicio anaeróbico, las fuerzas de contracción dentro del músculo
son fuertes y las fibras musculares se
lesionan. En el periodo de recuperación, además de
reponer los carbohidratos, es necesario suplir los aminoácidos
esenciales para apoyar la síntesis de proteínas necesarias para reparar
y reconstruir el músculo.
En general, las dietas cetogénicas contienen cantidades suficientes de
proteínas (alrededor del 15% del valor calórico total); sin embargo, la
baja ingestión de
carbohidratos puede afectar de forma adversa el rendimiento anaeróbico,
debido a que incrementa la dependencia de aminoácidos gluconeogénicos y
disminuye
la reposición de glucógeno (83).
Varios estudios demuestran que, en combinación con
los ejercicios anaeróbicos, las dietas cetogénicas y
bajas en carbohidratos no se pueden considerar una
estrategia efectiva para incrementar el rendimiento
anaeróbico ni la masa corporal (10,85-87); inclusive,
la hipertrofia muscular del entrenamiento puede verse afectada con este
tipo de alimentación (83). En el
cuadro 1 (86) se resumen los efectos de las dietas cetogénicas en los
diferentes deportes y sus posibles mecanismos fisiológicos (80,88–90).
En conclusión, tal como dice Paoli (85), la dieta cetogénica en el
deporte sigue siendo una zona de penumbra “el punto medio entre la luz
y la sombra, entre la
ciencia y la superstición”. Se puede decir que varios
estudios respaldan su empleo en atletas de resistencia
como una estrategia efectiva para reducir el peso corporal y la masa
grasa, particularmente en el período de
las 3 a las 12 semanas.
Las investigaciones que demuestran una mejoría significativa en el
rendimiento del ejercicio de intensidad
moderada son limitadas; sin embargo, el rendimiento
del ejercicio de intensidad más alta puede verse afectado. Su empleo
por periodos cortos no afecta los parámetros de rendimiento, pero puede
conducir a una
disminución indeseada de la masa corporal magra o bloquear la
hipertrofia muscular. Por lo tanto, no se
respalda el uso de las dietas cetogénicas como una
estrategia alimentaria efectiva para aumentar el rendimiento deportivo
(83).
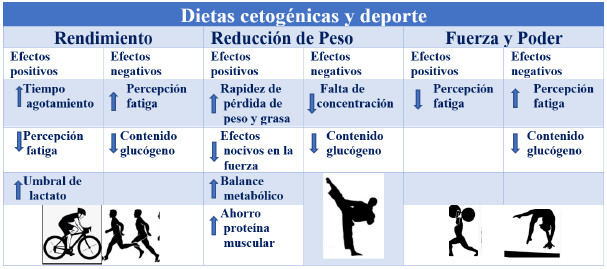
Cuadro 1. Efectos de las dietas cetogénicas en los diferentes
deportes y sus posibles mecanismos fisiológicos.
Adoptado y Traducido de referencia (86).
Efectos secundarios
El efecto adverso que se reporta con mayor frecuencia
con este tipo de alimentación es la falta de observancia del
tratamiento debido a las limitadas opciones de
alimentos y a otros efectos predecibles, como hipoglucemia,
deshidratación y letargia.
Las características de la alimentación también conducen a efectos
gastrointestinales, pérdida de peso e
hiperlipidemia transitoria. Entre los efectos gastrointestinales, los
más frecuentes son náuseas, vómito, estreñimiento y disminución del
apetito. Estos se pueden
manejar con ajustes en la alimentación por parte de un
profesional en nutrición y dietética.
En los pacientes con sobrepeso u obesidad, la pérdida
de peso puede ser un efecto benéfico, pero en aquellos desnutridos,
como los enfermos con gliomas, obviamente no lo son. Por lo tanto, se
requieren ajustes
calóricos para evitar la pérdida de peso (50,55,91).
Los cambios en el perfil de los lípidos, como la elevación en ayunas de
los valores del colesterol sérico,
los triglicéridos y las lipoproteínas de baja densidad
(LDL) y la disminución de las lipoproteínas de alta
densidad (HDL), se presentan durante el primer año
de tratamiento, pero tienden a normalizarse después
de este tiempo.
Otros efectos adversos que se han visto con la dieta
cetogénica son hepatitis, pancreatitis, hiperuricemia,
hipertransaminemia, hipomagnesemia e hiponatremia
(33,50,91)substrate utilization; body composition and
quality of life (QOL.
La restricción estricta de carbohidratos puede generar
deficiencias de vitaminas y minerales, y propiciar la
osteopenia y la osteoporosis. Esto hace necesario emplear suplementos
para alcanzar las cantidades requeridas (50,55,91).
El empleo por tiempos prolongados de la dieta cetogénica puede causar
también aterosclerosis, cardiomiopatía, nefrolitiasis, neuropatía del
nervio óptico y anemia. En el metabolismo, puede alterar el catabolismo
y reducir la síntesis de proteínas funcionales. Además,
el poder cumplir con las necesidades calóricas se dificulta debido a la
pérdida de apetito y a la disminución
de atractivo organoléptico de los alimentos (50,91)
(
cuadro 2).
Contraindicaciones y seguimiento
Las dietas cetogénicas están contraindicadas en forma absoluta cuando
existen alteraciones metabólicas
incluidas la deficiencia de piruvato carboxilasa o de
carnitina, y los defectos en la oxidación de los ácidos
grasos, como aquellos en el transportador de carnitina
y porfiria (11).
Algunas de las contraindicaciones relativas son las
hiperlipidemias y la litiasis renal. Por esta razón, antes de comenzar
este tipo de régimen alimentario, se
sugiere solicitar exámenes de sangre y orina. En sangre, se deben
determinar la acil-carnitina, el lactato y
el perfil de lípidos. En la orina, se deben evaluar los
ácidos orgánicos, la relación entre calcio y creatinina,
y practicar el uroanálisis.
Durante el seguimiento y, por lo menos, cada tres
meses, se deben practicar exámenes de sangre, como
hemograma completo, glucemia, electrolitos que incluyan calcio,
magnesio y fósforo, albúmina, lipasa,
selenio, fosfatasa alcalina, 25-hidroxivitamina D, perfil lipídico en
ayunas, carnitina (si está en tratamiento con valproato) y niveles de
beta-hidroxibutirato; y en
la orina, uroanálisis y la relación entre calcio y creatinina.
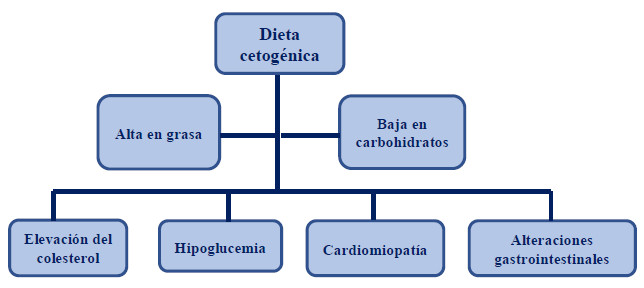
Cuadro 2. Esquema de los efectos adversos de las dietas
cetogénicas. Elaboración propia.
Efectos secundarios
La dieta cetogénica tradicional, es decir, la más estricta, genera
problemas de observancia y tolerancia. Las
versiones modificadas, que son menos estrictas, son
más llevaderas.
Algunos de los efectos secundarios agudos que pueden
presentarse en el inicio la dieta, son náuseas, vómito, hipoglucemia y
cetosis excesiva que conduce a letargia (11).
Los efectos secundarios crónicos pueden ser:
• Gastrointestinales: estreñimiento,
pérdida de
peso, deficiencia de vitaminas y minerales (selenio, vitamina D y
calcio) y pancreatitis
• Renal: cálculos
• Cardiaco: intervalo QT prolongado, miocardiopatía
• Crecimiento y desarrollo: baja talla, osteopenia
• Exámenes de laboratorio: baja albúmina, baja carnitina, perfil
anormal de lípidos.
Conclusión
Las dietas cetogénicas se han empleado desde hace
muchos años, principalmente en los pacientes con epilepsia, y su empleo
se ha extendido a otras enfermedades como el cáncer, las enfermedades
neurológicas,
la obesidad y la resistencia a la insulina. Aunque se
han obtenido buenos resultados, existe dificultad para
estandarizar los datos debido a la inexactitud de la información sobre
la ingestión de alimentos y el cumplimiento de la dieta a largo plazo,
y el número limitado
de pacientes y su deserción, lo cual hace difícil reproducir y
generalizar los resultados de los estudios con
este tratamiento nutricional.
La dieta cetogénica no es inocua; es necesario que
su indicación, implementación y seguimiento estén a
cargo de profesionales de la salud idóneos en el tema,
quienes pueden establecer los riesgos y beneficios que
se pueden obtener en cada una de las indicaciones.
Conflicto de interés
Asesor científico de Boydorr Nutrition.
Referencias
1. McDonald TJW, Cervenka MC. Lessons
learned from
recent clinical trials of ketogenic diet therapies in adults.
Curr Opin Clin Nutr Metab Care. 2019;22(6):418–24.
2. Kverneland M, Molteberg E, Iversen
PO, Veierød MB,
Taubøll E, Selmer K, et al. Effect of modified Atkins diet
in adults with drug-resistant focal epilepsy: A randomized clinical
trial. Epilepsia. 2018;59(8):1567–76.
3. Sremanakova J, Sowerbutts AM,
Burden S. A systematic review of the use of ketogenic diets in adult
patients
with cancer. J Hum Nutr Diet. 2018;31(6):793–802.
4. Klement RJ. The emerging role of
ketogenic diets in
cancer treatment. Curr Opin Clin Nutr Metab Care.
2019;22(2):129–34.
5. Phillips MCL, Murtagh DKJ,
Gilbertson LJ, Asztely FJS,
Lynch CDP. Low-fat versus ketogenic diet in Parkinson’s
disease: A pilot randomized controlled trial. Mov Disord.
2018;33(8):1306–14.
6. Brenton JN, Banwell B, Bergqvist
AGC, Lehner-Gulotta
D, Gampper L, LeythamE, et al. Pilot study of a ketogenic diet in
relapsing-remitting MS. Neurol Neuroimmunol
Neuroinflamm. 2019;6(4):e565.
7. Evcili G, Utku U, Öğün MN, Özdemir
G. Early and long
period follow-up results of low glycemic index diet for migraine
prophylaxis. Agri. 2018;30(1):8–11.
8. Hallberg SJ, McKenzie AL, Williams
PT, Bhanpuri NH,
Peters AL, Campbell W, et al. Effectiveness and Safety
of a Novel Care Model for the Management of Type 2
Diabetes at 1 Year: An Open-Label, Non-Randomized,
Controlled Study. Diabetes Ther. 2018;9(2):583–612.
9. Ota M, Matsuo J, Ishida I, Takano
H, Yokoi Y, HoriH,
et al. Effects of a medium-chain triglyceride-based ketogenic formula
on cognitive function in patients with
mild-to-moderate Alzheimer’s disease. Neurosci Lett.
2019;690:232–6.
10. Vargas S, Romance R, Petro JL,
Bonilla DA, Galancho
I, Espinar S, et al. Efficacy of ketogenic diet on body
composition during resistance training in trained men:
a randomized controlled trial. J Int Soc Sports Nutr.
2018;15(1):31. Dhamija R, Eckert S, Wirrell E. Ketogenic diet. Can J
Neurol Sci. 2013;40(2):158–67.
11. Huttenlocher PR, Wilbourn AJ,
Signore JM. Mediumchain triglycerides as a therapy for intractable
childhood
epilepsy. Neurology. 1971;21(11):1097–103.
12. Walczyk T, Wick JY. The Ketogenic
Diet: Making a Comeback. Consult Pharm. 2017;32(7):388–96.
13. Paoli A, Bianco A, Damiani E,
Bosco G. Ketogenic diet
in neuromuscular and neurodegenerative diseases. Biomed Res Int.
2014;2014:474296.
14. Medeiros D, Wildman R, editores.
Lipids: fatty acids,
triglycerides, phospholipids, and sterols. En: Advanced
Human NutritionthCuarta edición. Jones & Barlett Learning; 2019. p.
111-146.
15. Mayes P. Metabolismo de lípidos. En: Harper H, editor.
Manual de química fisiológica. Cuarta edición. México:
Litografía Maico; 1973. p. 297–343.
16. McDonald TJW, Cervenka MC. The Expanding Role of
Ketogenic Diets in Adult Neurological Disorders. Brain
Sci. 2018;8(8).
17. Hipócrates. The genuine work of Hippocrates. Baltimore: Williams
and Wilkins; 193p.
18. Guelpa G, Marie A. La lutte
contre l’épilepsie par la désintoxication et par la rééducation
alimentaire. Rev Ther
Medico-Chirurgicale. 1911;78:8–13.
19. Conklin HW. Cause and treatment
of epilepsy. J Am Osteopathic Assoc. 1922;26:11–4.
20. Wilder HH. Anthropometric
measurements. Science.
1921;53(1358):20.
21. Martin-McGill KJ, Jackson CF, Bresnahan R, Levy RG,
Cooper PN. Ketogenic diets for drug-resistant epilepsy.
Cochrane Database Syst Rev. 2018;11:CD001903.
22. Hong AM, Turner Z, Hamdy RF,
Kossoff EH. Infantile spasms treated with the ketogenic diet:
prospective
single-center experience in 104 consecutive infants. Epilepsia.
2010;51(8):1403–7.
23. Caraballo RH. Nonpharmacologic
treatments of Dravet syndrome: focus on the ketogenic diet. Epilepsia.
2011;52(Suppl 2):79–82.
24. Nabbout R, Copioli C, Chipaux M,
Chemaly N, Desguerre I, Dulac O, et al. Ketogenic diet also benefits
Dravet
syndrome patients receiving stiripentol: a prospective
pilot study. Epilepsia. 2011;52(7):e54-57.
25. Caraballo RH, Cersósimo RO, Sakr
D, Cresta A, Escobal
N, Fejerman N. Ketogenic diet in patients with myoclonic-astatic
epilepsy. Epileptic Disord. 2006;8(2):151–5.
26. Kilaru S, Bergqvist AGC. Current
treatment of myoclonic astatic epilepsy: clinical experience at the
Children’s
Hospital of Philadelphia. Epilepsia. 2007;48(9):1703–7.
27. Lemmon ME, Terao NN, Ng Y-T,
Reisig W, Rubenstein
JE, Kossoff EH. Efficacy of the ketogenic diet in Lennox-Gastaut
syndrome: a retrospective review of one
institution’s experience and summary of the literature.
Dev Med Child Neurol. 2012;54(5):464–8.
28. Nabbout R, Mazzuca M, Hubert P,
Peudennier S, Allaire C, FlurinV, et al. Efficacy of ketogenic diet in
severe
refractory status epilepticus initiating fever induced refractory
epileptic encephalopathy in school age children
(FIRES). Epilepsia. 2010;51(10):2033–7.
29. Kang H-C, Lee YJ, Lee JS, Lee EJ,
Eom S, You SJ, et al.
Comparison of short- versus long-term ketogenic diet for
intractable infantile spasms. Epilepsia. 2011;52(4):781–7.
30. Cusmai R, Martinelli D, Moavero
R, Dionisi Vici C, Vigevano F, Castana C, et al. Ketogenic diet in
early myoclonic encephalopathy due to non ketotic hyperglycinemia.
Eur J Paediatr Neurol. 2012;16(5):509–13.
31. Nangia S, Caraballo RH, Kang H-C,
Nordli DR, Scheffer
IE. Is the ketogenic diet effective in specific epilepsy syndromes?
Epilepsy Res. 2012;100(3):252–7.
32. Mosek A, Natour H, Neufeld MY,
Shiff Y, Vaisman N. Ketogenic diet treatment in adults with refractory
epilepsy:
a prospective pilot study. Seizure. 2009;18(1):30–3.
33. Klein P, Janousek J, Barber A,
Weissberger R. Ketogenic diet treatment in adults with refractory
epilepsy. Epilepsy Behav. 2010;19(4):575–9.
34. Kossoff EH, Rowley H, Sinha SR,
Vining EPG. A prospective study of the modified Atkins diet for
intractable
epilepsy in adults. Epilepsia. 2008;49(2):316–9.
35. Swerdlow RH. Brain aging,
Alzheimer’s disease, and mitochondria. Biochim Biophys Acta.
2011;1812(12):1630–
9.
36. Wilkins HM, Swerdlow RH. Amyloid
precursor protein processing and bioenergetics. Brain Res Bull.
2017;133:71–9.
37. Castellano C-A, Nugent S, Paquet
N, Tremblay S, Bocti
C, LacombeG, et al. Lower brain 18F-fluorodeoxyglucose uptake but
normal 11C-acetoacetate metabolism in
mild Alzheimer’s disease dementia. J Alzheimers Dis.
2015;43(4):1343–53.
38. aylor MK, Sullivan DK, Swerdlow
RH, Vidoni ED, Morris
JK, Mahnken D, et al. A high-glycemic diet is associated
with cerebral amyloid burden in cognitively normal older
adults. Am J Clin Nutr. 2017;106(6):1463–70.
39. de la Monte SM. Insulin
Resistance and Neurodegeneration: Progress Towards the Development of
New Therapeutics for Alzheimer’s Disease. Drugs. 2017;77(1):47–
65.
40. Gaspar JM, Baptista FI, Macedo
MP, Ambrósio AF.
Inside the Diabetic Brain: Role of Different Players Involved in
Cognitive Decline. ACS Chem Neurosci.
2016;7(2):131–42.
41. Nafar F, Clarke JP, Mearow KM.
Coconut oil protects
cortical neurons from amyloid beta toxicity by enhancing signaling of
cell survival pathways. Neurochem Int.
2017;105:64–79.
42. Reger MA, Henderson ST, Hale C,
Cholerton B, Baker
LD, Watson S, et al. Effects of beta-hydroxybutyrate on
cognition in memory-impaired adults. Neurobiol Aging.
2004;25(3):311–4.
43. Henderson ST, Vogel JL, Barr LJ,
Garvin F, Jones JJ,
Costantini LC. Study of the ketogenic agent AC-1202 in
mild to moderate Alzheimer’s disease: a randomized,
double-blind, placebo-controlled, multicenter trial. Nutr
Metab (Lond). 2009;6:31.
44. Taylor MK, Sullivan DK, Mahnken
JD, Burns JM, Swerdlow RH. Feasibility and efficacy data from a
ketogenic
diet intervention in Alzheimer’s disease. Alzheimers Dement (N Y).
2018;4:28–36.
45. Krikorian R, Shidler MD, Dangelo
K, Couch SC, Benoit
SC, Clegg DJ. Dietary ketosis enhances memory in mild
cognitive impairment. Neurobiol Aging. 2012;33(2):425.
e19-27.
46. Newport MT, VanItallie TB,
Kashiwaya Y, King MT, Veech
RL. A new way to produce hyperketonemia: use of ketone ester in a case
of Alzheimer’s disease. Alzheimers
Dement. 2015;11(1):99–103.
47. Rebello CJ, Keller JN, Liu AG,
Johnson WD, Greenway FL. Pilot feasibility and safety study examining
the
effect of medium chain triglyceride supplementation in
subjects with mild cognitive impairment: A randomized
controlled trial. BBA Clin. 2015;3:123–5.
48. Ohnuma T, Toda A, Kimoto A,
Takebayashi Y, Higashiyama R, Tagata Y, et al. Benefits of use, and
tolerance
of, medium-chain triglyceride medical food in the management of
Japanese patients with Alzheimer’s disease:
a prospective, open-label pilot study. Clin Interv Aging.
2016;11:29–36.
49. George AJ, Holsinger RMD, McLean
CA, Laughton KM,
Beyreuther K, Evin G, et al. APP intracellular domain is
increased and soluble Abeta is reduced with diet-induced
hypercholesterolemia in a transgenic mouse model of
Alzheimer disease. Neurobiol Dis. 2004;16(1):124–32.
50. Rusek M, Pluta R, Ułamek-Kozioł
M, Czuczwar SJ.
Ketogenic Diet in Alzheimer’s Disease. Int J Mol Sci.
2019;20(16).
51. Kashiwaya Y, Takeshima T, Mori N,
Nakashima K, Clarke K, Veech RL. D-beta-hydroxybutyrate protects
neurons in models of Alzheimer’s and Parkinson’s disease.
Proc Natl Acad Sci USA. 2000;97(10):5440–4.
52. Vanitallie TB, Nonas C, Di Rocco
A, Boyar K, Hyams
K, Heymsfield SB. Treatment of Parkinson disease with
diet-induced hyperketonemia: a feasibility study. Neurology.
2005;64(4):728–30.
53. Benlloch M, López-Rodríguez MM,
Cuerda-Ballester M,
Drehmer E, Carrera S, Ceron JJ, et al. Reply to “When
Is a Ketogenic Diet Ketogenic? Comment on Satiating
Effect of a Ketogenic Diet and Its Impact on Muscle Improvement and
Oxidation State in Multiple Sclerosis Patients. Nutrients 2019, 11,
1156”. Nutrients. 2019;11(8).
54. Branco AF, Ferreira A, Simões RF,
Magalhães-Novais S,
Zehowski C, Cope E, et al. Ketogenic diets: from cancer
to mitochondrial diseases and beyond. Eur J Clin Invest.
2016;46(3):285–98.
55. Bozzetti F, Zupec-Kania B. Toward
a cancer-specific
diet. Clin Nutr. 2016;35(5):1188–95.
56. Weber DD, Aminzadeh-Gohari S,
Tulipan J, Catalano L, Feichtinger RG, Kofler B. Ketogenic diet in the
treatment of cancer - Where do we stand? Mol Metab. 2020;33:102–21.
57. Cohen CW, Fontaine KR, Arend RC,
Soleymani T,
Gower BA. Favorable Effects of a Ketogenic Diet on
Physical Function, Perceived Energy, and Food Cravings in Women with
Ovarian or Endometrial Cancer: A
Randomized, Controlled Trial. Nutrients. 2018;10(9).
58. Allen BG, Bhatia SK, Anderson CM,
Eichenberger-Gilmore JM, Sibenaller ZA, Mapuskar KA, et al. Ketogenic
diets as an adjuvant cancer therapy: History and potential mechanism.
Redox Biol. 2014;2:963–70.
59. Nebeling LC, Miraldi F, Shurin
SB, Lerner E. Effects of a
ketogenic diet on tumor metabolism and nutritional status in pediatric
oncology patients: two case reports. J
Am Coll Nutr. 1995;14(2):202–8.
60. Fearon KC, Borland W, Preston T,
Tisdale MJ, Shenkin
A, Calman KC. Cancer cachexia: influence of systemic
ketosis on substrate levels and nitrogen metabolism. Am
J Clin Nutr. 1988;47(1):42–8.
61. Weeks HD, Weidman-Evans E.
Adjuvant metabolic therapy for glioblastoma multiform. Clinical
Nutrition ESPEN. 2017;19:70–2.
62. Mayer A, Vaupel P, Struss H-G,
Giese A, Stockinger
M, Schmidberger H. Strong adverse prognostic impact
of hyperglycemic episodes during adjuvant chemoradiotherapy of
glioblastoma multiforme. Strahlenther
Onkol. 2014;190(10):933–8.
63. Champ CE, Palmer JD, Volek JS,
Werner-Wasik M, Andrews DW, Evans J, et al. Targeting metabolism with a
ketogenic diet during the treatment of glioblastoma multiforme. J
Neurooncol. 2014;117(1):125–31.
64. Schwartz K, Chang HT, Nikolai M,
Pernicone J, Rhee
S, OlsonK, et al. Treatment of glioma patients with ketogenic diets:
report of two cases treated with an IRBapproved energy-restricted
ketogenic diet protocol and
review of the literature. Cancer Metab. 2015;3:3.
65. Elsakka AMA, Bary MA, Abdelzaher
E, Elnaggar M, Kalamian M, MukherjeeP, et al. Management of
Glioblastoma Multiforme in a Patient Treated With Ketogenic
Metabolic Therapy and Modified Standard of Care: A
24-Month Follow-Up. Front Nutr. 2018;5:20.
66. Artzi M, Liberman G, Vaisman N,
Bokstein F, Vitinshtein
F, AizensteinO, et al. Changes in cerebral metabolism during ketogenic
diet in patients with primary brain tumors:
1H-MRS study. J Neurooncol. 2017;132(2):267–75.
67. Rieger J, Bähr O, Maurer GD,
Hattingen E, Franz K, BruckerD, et al. ERGO: a pilot study of ketogenic
diet in recurrent glioblastoma. Int J Oncol. 2014;44(6):1843–52.
68. Zuccoli G, Marcello N, Pisanello
A, Servadei F, Vaccaro
S, MukherjeeP, et al. Metabolic management of glioblastoma multiforme
using standard therapy together with
a restricted ketogenic diet: Case Report. Nutr Metab
(Lond). 2010;7:33.
69. Santos JG, Da Cruz WMS, Schönthal
AH, Salazar MD,
Fontes CAP, Quirico-SantosT, et al. Efficacy of a ketogenic diet with
concomitant intranasal perillyl alcohol as a
novel strategy for the therapy of recurrent glioblastoma.
Oncol Lett. 2018;15(1):1263–70.
70. Seyfried TN, Kiebish M, Mukherjee
P, Marsh J. Targeting energy metabolism in brain cancer with
calorically
restricted ketogenic diets. Epilepsia. 2008;49 Suppl
8:114–6.
71. Kuchkuntla AR, Shah M, Velapati
S, Gershuni VM, Rajjo T, NandaS, et al. Ketogenic Diet: an
Endocrinologist
Perspective. Curr Nutr Rep. 2019;8(4):402–10.
72. Velapati SR, Shah M, Kuchkuntla
AR, Abu-Dayyeh B,
Grothe K, Hurt T, et al. Weight Regain After Bariatric
Surgery: Prevalence, Etiology, and Treatment. Curr Nutr
Rep. 2018;7(4):329–34.
73. Wheless JW. History of the
ketogenic diet. Epilepsia.
2008;49 Suppl 8:3–5.
74. Atkins RC. Dr. Atkins’ New Diet
Revolution. New York:
HarpPeren; 1998p.
75. MD Atkins, Robert. Dr. Atkins’
New Diet Revolution. Government Institutes; 200p.
76. Kuchkuntla AR, Limketkai B, Nanda
S, Hurt RT, Mundi MS. Fad Diets: Hype or Hope? Curr Nutr Rep.
2018;7(4):310–23.
77. Murphy EA, Jenkins TJ. A
ketogenic diet for reducing obesity and maintaining capacity for
physical activity: hype or hope? Curr Opin Clin Nutr Metab Care.
2019;22(4):314–9.
78. Cox PJ, Kirk T, Ashmore T,
Willerton K, Evans R, Smith
A, et al. Nutritional Ketosis Alters Fuel Preference and
Thereby Endurance Performance in Athletes. Cell Metab.
2016;24(2):256–68.
79. Wilson JM, Lowery RP, Roberts MD,
Sharp MH, Joy
JM, Shields A, et al. The Effects of Ketogenic Dieting
on Body Composition, Strength, Power, and Hormonal
Profiles in Resistance Training Males. J Strength Cond
Res. 2017;.
80. Wolfe RR. Branched-chain amino
acids and muscle
protein synthesis in humans: myth or reality? J Int Soc
Sports Nutr. 2017;14:30.
81. Paoli A, Cancellara P, Pompei P,
Moro T. Ketogenic Diet
and Skeletal Muscle Hypertrophy: A Frenemy Relationship? J Hum Kinet.
2019;68:233–47.
82. Harvey KL, Holcomb LE, Kolwicz
SC. Ketogenic Diets
and Exercise Performance. Nutrients. 2019;11(10).
83. Chang C-K, Borer K, Lin P-J.
Low-Carbohydrate-HighFat Diet: Can it Help Exercise Performance? J Hum
Kinet. 2017;56:81–92.
84. Paoli A, Bianco A, Grimaldi KA.
The Ketogenic Diet
and Sport: A Possible Marriage? Exerc Sport Sci Rev.
2015;43(3):153–62.
85. Burke LM, Ross ML, Garvican-Lewis
LA, Welvaert M, Heikura IA, Forbes G, et al. Low carbohydrate, high fat
diet impairs exercise economy and negates the performance benefit from
intensified training in elite race
walkers. J Physiol (Lond). 2017;595(9):2785–807.
86. Burke LM. Re-Examining High-Fat
Diets for Sports Performance: Did We Call the “Nail in the Coffin” Too
Soon?
Sports Med. 2015;45 Suppl 1:S33-49.
87. McSwiney FT, Wardrop B, Hyde PN,
Lafountain RA, Volek JS, Doyle L. Keto-adaptation enhances exercise
performance and body composition responses to training
in endurance athletes. Metab Clin Exp. 2018;81:25–34.
88. Paoli A, Grimaldi K, D’Agostino
D, Cenci L, Moro T, BiancoA, et al. Ketogenic diet does not affect
strength performance in elite artistic gymnasts. J Int Soc Sports Nutr.
2012;9(1):34.
89. Greene DA, Varley BJ, Hartwig TB,
Chapman P, Rigney
M. A Low-Carbohydrate Ketogenic Diet Reduces Body
Mass Without Compromising Performance in Powerlifting and Olympic
Weightlifting Athletes. J Strength Cond
Res. 2018;32(12):3373–82.
90. Benlloch M, López-Rodríguez MM,
Cuerda-Ballester M,
Drehmer E, Carrera S, Ceron J, et al. Satiating Effect of
a Ketogenic Diet and Its Impact on Muscle Improvement
and Oxidation State in Multiple Sclerosis Patients. Nutrients.
2019;11(5).
Recibido:
Febrero 5, 2020
Aprobado: Mayo 21, 2020
Correspondencia:
Patricia Savino
patricia.savino@gmail.com













