Resúmen
El cáncer de cabeza y cuello es una entidad cada vez más frecuente,
caracterizada por relacionarse
con desfiguración facial y generar en los pacientes que lo padecen, no
sólo una alta tasa de morbilidad
somática sino también psiquiátrica. La historia de este tipo de tumores
data de algunos años antes de
la era común (también conocida como antes de Cristo) y se extiende, con
una evolución progresiva
hasta nuestros días, con una aceleración mayor en las últimas 4
décadas. La historia nos muestra
como el empirismo, el pensamiento crítico y la lógica de ensayo y error
fueron fundamentales en los
avances iniciales hacia el diagnóstico y tratamiento del cáncer de
cabeza y cuello, en épocas en las
que los conocimientos de biología fundamental no eran sino esbozos, y
donde incluso algunas teorías
espirituales servían como explicación.
Palabras clave: Cáncer de cabeza y cuello; historia del
cáncer; inmunoterapia; terapia dirigida.

¹ M.D. Centro de Investigaciones Clínicas, Fundación Valle del
Lili, Cali, Colombia.
HEAD AND NECK CANCER: A HISTORICAL PERSPECTIVE
Abstract
Head and Neck cancer is characterized for facial disfi guration and its
related not only with
high levels of somatic morbidity and mortality, but also with severe
mental health disturbances.
The history of this kind of tumors remotes to the time before the
common era (also known as
Before Christ) and extends to our times, with a special acceleration in
the development of new
technologies in the last 4-5 decades. History shows us how empiricism,
critical thinking and
the logic of trial and error were fundamental for the initial
advancements towards diagnosis
and treatment of head and neck cancer in time when fundamental biology
knowledge was just
initiating and when even spiritual theories served as explanations.
Keywords: Head and neck cancer; history of cancer;
immunotherapy; targeted therapy.
Introducción
El cáncer de cabeza y cuello (CCyC) corresponde a
un grupo de neoplasias heterogéneas principalmente
epiteliales que se desarrollan en diferentes regiones
anatómicas que corresponden a la cabeza y el cuello.
Típicamente este tipo de tumores se originan a partir
de las mucosas que recubren los labios, la cavidad
oral, la lengua, la cavidad nasal, los senos paranasales, la faringe,
la laringe, la tráquea, además del tejido parenquimatoso que conforma
órganos como las
glándulas salivales mayores y menores (1).
De acuerdo con el observatorio global del cáncer
(GLOBOCAN), en 2018 a nivel mundial se diagnosticaron 887.359 nuevos
casos de CCyC, correspondiendo al 4,9% de todos los casos de cáncer
durante ese año, siendo la séptima causa más común
de cáncer y provocando un total de 453.307 muertes
que conformaban el 4,7% de todas las muertes por
cáncer (2). En Colombia, para ese mismo año se
diagnosticaron 2.962 casos de CCyC, siendo la décima causa de cáncer y
provocando aproximadamente
1.146 muertes que correspondieron al 2,5% de todas
las muertes por cáncer en Colombia.
Evidencia del cáncer en la literatura
antigua
Erwin H. Ackerknecht M.D deja claro en su escrito
(1958) que, para la época, resultaba complicado realizar una evaluación
histórica completamente detallada de la historia del cáncer, pues no
existían registros epidemiológicos de estos, tampoco se entendía
completamente la fisiopatología de la oncogénesis, y
la historia disponible se limitaba a ciertas menciones
de estos fenómenos en escritos antiguos de personajes famosos como
Hipócrates (3). Así como la mayoría de las nociones iniciales que se
desarrollaron
con respecto a diferentes condiciones patológicas,
las primeras nociones del cáncer se registran en los
escritos Hipocráticos (400 a. C.), donde se mencionaba la existencia de
tumoraciones no inflamatorias
y ulcerosas en órganos como la piel, la mama y los
genitales, que comúnmente tendían a la recidiva y
que en la mayoría de los casos resultaban fatales.
Hipócrates los domino como
karkinos
o
karkinoma,
palabras que más tarde se traducirían al latín como
cáncer.
Con respecto al CCyC, existen algunos ejemplares
de cráneos humanos encontrados en Egipto que
datan del 3.400 a. C. que mostraban lesiones indicativas de tumores
nasofaríngeos (3). Moodie et al
encontraron también evidencia de la presencia de
tumores de la mandíbula y el cráneo en restos de
peruanos de la época precolombina (4). En 2006
Bernal
et al publicaron un
análisis interesante de los
restos arqueológicos de alfarería que se encontraban
en diferentes museos en Colombia y Ecuador, provenientes de la región
Tumaco-La Tolita, una de estas
figuras presentaba una gran masa facial con bordes
que simulaban estar ulcerados, además de la presencia de desviación de
la comisura labial que suponía
compromiso del nervio facial, y sospechándose que
se trataba de una representación de un tumor del
seno maxilar (5).
Antes de Galeno, era común que el tratamiento de
diferentes tumores se hiciera de forma local, es decir, utilizando
métodos de resección de los tejidos,
sin embargo, Galeno en el año 150 d. C. formuló la
teoría de que el cáncer era el resultado de una perturbación en uno de
los cuatro “
humores”, que se
consideraban como los pilares fundamentales de la teoría
de los humores (humorismo o teoría humoral), la
cuál se deriva de la medicina hipocrática (6). Galeno
creía que alteraciones de la “
bilis
negra” o “
melancolía”
eran el origen del cáncer y que, por ende, el enfoque de tratamiento
debía sistémico y no solamente
local (7,8).
Cientos de años después, con el descubrimiento del
sistema linfático, el famoso filósofo René Descartes
describió una teoría más avanzada del origen del cáncer, señalando al
sistema linfático como una pieza clave (9) en el desarrollo tumoral y
llevando al inicio de
la resección linfática además del tumor (procedimiento que resulta
clave incluso en la actualidad) (10).
Etiología del cáncer de cabeza y
cuello de acuerdo con la historia
Con el paso del tiempo, nuevas teorías cada vez más
fundamentadas en la biología, empezaron a tratar de
explicar las causas del CCyC. Inicialmente, la infección por sífilis se
supuso como una importante causa
de CCyC, debido a que esta era muy frecuente (aproximadamente un tercio
de los pacientes admitidos a
los hospitales de Londres durante el siglo 19 tenían
sífilis), sin embargo, Henry T. Butlin (11) (1845-
1912) (cirujano de Cabeza y Cuello) reportó que de
sus pacientes con cáncer de lengua muy pocos resultaron positivos para
sífilis (12). Channing Simmons
reportó además que que de sus pacientes con cáncer
oral, solamente el 14% fueron positivos para sífilis
basado en el test de Wassermann (13).
Otro de los factores de riesgo para el CCyC que
se sospechó siglos atrás fue el uso de tabaco, que
para 1562 ya se utilizaba ampliamente en la corte
de Francia (14). A pesar de que se pusieron muchos
obstáculos gubernamentales al consumo del tabaco, para el año 1614 ya
habían 7000 tiendas de tabaco distribuidas por Londres (15). El primer
caso
reportado que relacionaba el tabaco con cáncer fue
publicado en el New England Journal of Medicina en 1761 (15), seguido
por diferentes análisis
epidemiológicos en varias regiones de Europa que
encontraban siempre relación entre el CCyC y el
consumo de tabaco, principalmente por medio del
uso de pipas (16,17).
Evolución del tratamiento del cáncer
de cabeza y cuello
Era premoderna (1500-1900)
Es de esperarse que durante la época pre-moderna
no existiera conocimiento alguno de los mecanismos biológicos del
cáncer, y más aún de la farmacología que hoy en día conocemos con
funciones
antineoplásicas. Es lógico entonces que el control
local de la enfermedad fuera prácticamente la única
alternativa terapéutica, sin embargo, muchas limitaciones se
presentaban a la hora de realizar estos
procedimientos. Uno de los obstáculos más grandes
correspondía claramente a la inexistencia de la anestesia, haciendo que
los procedimientos fueran realmente una tortura para los pacientes,
otro obstáculo
mucho más importante desde el punto de vista de
la letalidad correspondía al sangrado intraoperatorio
(3). En la primera mitad de los 1700s, el doctor Marchetti, quien era
profesor de cirugía de la universidad
de Padua, Italia, realizó una de las primeras resecciones de cáncer de
lengua utilizando un cauterio
(18). Con respecto al sangrado, diferentes técnicas
fueron utilizadas incluyendo al ligadura de los vasos,
empaquetamiento con compresas, utilización de instrumentos de hierro a
altas temperaturas, sustancias
cáusticas y tintura de hierro (3). Louis introdujo en
1759 la costumbre de ligar el vaso que alimentaba
el tumor antes de iniciar la resección de este (19).
Diferentes técnicas para evitar el sangrado fueron
desarrollándose, y en 1805, Home introdujo una técnica de
estrangulamiento del tumor utilizando suturas, que luego evolucionarían
al uso del écraseur,
introducido por Bell hacia los 1850, un instrumento
quirúrgico mecánico que permitía la estrangulación
de un tejido (20) (
Figura 1).
Posteriormente en 1854,
Middledorpf introdujo la posibilidad de adicionar
una corriente galvánica al loop de metal del écraseur, haciendo que
este aumentara su temperatura,
brindándole características de un cauterio (21).

Figure 1. Écraseur clásico utilizado
en la época premoderna
Las cirugías, que inicialmente se hacían por una vía
intraoral, fueron evolucionando rápidamente hacia abordajes externos
debido a que el espacio para
maniobrar era reducido. Regnoli utilizó un enfoque
submental en el piso de la lengua (3), Jaeger realizó
realizó disección de una maxila para facilitar el espacio quirúgico
(13), y Maisoneuve incluso decidió
disecar ambas maxilas (22). Un paso más allá fue
dado por Billroth, quien apreciaba el buen acceso al
tumor, llegando al punto de realizar la resección de
una porción de la mandíbula y reconectando el hueso al finalizar el
procedimiento (23).
Resulta impresionante no sólo el avance en las técnicas quirúrgicas de
la época teniendo en cuenta todas
las limitaciones, sino también, las situaciones tan
dolorosas por las que pasaban los pacientes. Es importante mencionar
que este tipo de procedimientos
no eran comunes y eran practicados sólo por algunos
cirujanos con experiencia.
El éter y el cloroformo como anestésicos fueron introducidos en 1847 y
1849 respectivamente. A pesar
de esto, en muchos casos de cirugía oral o maxilofacial se prefería no
utilizar anestesia, pues resultaba
complicado tanto para el encargado de la anestesia
como para el cirujano compartir el espacio alrededor
de la vía aérea (24). Con la llegada de la traqueostomía y el uso de la
cánula de Trendelenburg, el acceso
a la vía aérea para el anestesista se hacía mucho más
simple, y la restricción del tiempo operatorio para el
cirujano también fue disminuyendo (13).
Con respecto a los tumores de la laringe, la situación
era aún más complicada pues los reflejos laríngeos
llevan al laringoespasmo, que hacen casi completamente imposible la
evaluación laríngea, de esta
forma, los tumores laríngeos mantuvieron considerablemente
subdiagnosticados durante varios siglos.
Leveret fue el primero en lograr una evaluación decente de la laringe
utilizando un espejo curvo acompañado de un lazo para pólipos.
Posteriormente,
para 1855, el músico y cantante Manuel García comunicó a la Real
Sociedad de ciencia de Francia que
había logrado realizar una evaluación de su laringe
y sus cuerdas vocales utilizando un espejo dental y
un espejo de mano (25). Diferentes cambios y mejoras fueron adaptados a
esta técnica, conocida como
laringoscopia indirecta, para hacerla más efectiva en
la práctica quirúrgica.
El origen de la laringología en Europa derivó en parte gracias al
doctor Morrel MacKenzie quién aprendió la técnica de laringoscopia
indirecta en Vienna
y la introdujo como una especialidad en Londres,
fundando un hospital dedicado a esto (The Throat
Hospital), poco tiempo después la cantidad de casos
de tumores de la laringe identificados aumentaron
considerablemente (26).
Diferentes técnicas quirúrgicas fueron desarrolladas
durante el siglo 19. Una de ellas, la fisura laríngea,
creada en 1810 durante las guerras napoleónicas
para la extracción de cuerpos extraños27 fue utilizada posteriormente
por Gordon Buck en 1851 en un
hospital de Nueva York, USA para el tratamiento de
tumores laríngeos (28,29). A pesar de esto, los resultados clínicos
obtenidos con la fisura laríngea fueron
pobres, pero fue un paso importante en la laringología pues gracias a
este procedimiento se desarrolló la
laringectomía, siendo Theodor Billroth (
Figura
2) el
primer cirujano en usarla efectivamente para el tratamiento del cáncer
de laringe (30).

Figure 2. Theodor Billroth (1829-1894), Austrian
surgeon.
Era moderna (1900-1990)
Entrando al siglo 20, diferentes descubrimientos
científicos en los campos de la física y la química
marcaron los fundamentos de la radioterapia. El 30
de noviembre de 1895 Roentgen descubrió los rayos
X (31,32), y Becquerel describió el fenómeno de
radiactividad atómica (33), seguidos por los Curies
quienes descubrieron el radio en 1898.
El desarrollo de la radioterapia cursó cuatro fases,
la primera de estas evaluaba la dosis de radiación
de acuerdo al eritema cutáneo, la segunda fase se concentró en el uso
local, con un intento de preservación del tejido sano e introduciendo
los términos
de tiempo, tamaño del tumor y longitud de onda
(dirigido por la escuela Francesa), La tercera fase,
dirigida por la escuela inglesa se enfocó en la adecuada planeación de
los campos anatómicas que se
irradiarían y la dosimetría (34), y la cuarta fase es en
cierto modo el tipo de radioterapia que se ofrece en
la actualidad (13).
La forma de proveer de radioterapia en el CCyC fue
empírica con respecto a número de dosis, duración y
fraccionamiento, persistiendo este enfoque por aproximadamente 3
décadas hasta que Coutard desarrolló un plan más uniforme de
tratamiento basado en
el tamaño del tumor (35). Los tumores pequeños se
trataban por 15 días, los de tamaño intermedio por
20-25 días y los tumores de grandes dimensiones durante 35-40 días.
En los inicios del siglo 20 también se promovió el
uso de la terapia de radio o terapia Curie donde se
utilizaba bromuro de radio tópico, aplicado comúnmente por
dermatólogos, encontrando poco o ningún beneficio y procediéndose al
desarrollo de nuevas alternativas para proveer los radiofármacos (que
para la época no eran más que sales de elementos
radiactivos) (36,37).
Lo siguientes avances en la terapia del CCyC se basaron en la terapia
concurrente de cirugía y radioterapia, al mismo tiempo que ambas
disciplinas iban
avanzando. En siglo XX, uno de los principales exponentes en cirugía de
cabeza y cuello del cáncer fue
Henry Butlin (
Figura 3), cuyos
aportes a la práctica
quirúrgica lo llevaron a ser nombrado caballero de
Inglaterra. En sus manos, la sobrevida de los pacientes con diferentes
tipos de CCyC llegó a alcanzar
cifras tan altas como 28%, teniendo en cuenta que
décadas atrás sólo se alcanzaba un 5% de tasa de curación (38).

Figure 2. Theodor Billroth (1829-1894), Austrian
surgeon.
Fue también uno de los primeros en notar que de
sus pacientes que lograban una curación “total”, 30-
40% recaían a nivel nodal, proponiendo entonces la
disección del triángulo anterior de ganglios linfáticos
del cuello en todas sus cirugías (39).
Los pasos dados por Butlin fueron continuados en
Estados Unidos por George Crile quién se encargó
de promover en su entorno académico la realización
de disección nodal, siendo uno de los principales
promotores de esta técnica en el área de cabeza y
cuello (40), y también cofundador de la famosa Cleveland Clinic
(anteriormente ya se había propuesto
la disección ganglionar en tumores de mama).
Quimioterapia en el tratamiento del
cáncer de cabeza y cuello
Durante gran parte del siglo 20, la cirugía y la radioterapia eran
considerados los pilares del tratamiento
del CCyC, siendo la quimioterapia una opción utilizado sólo en
escenarios paliativos en tumores avanzados. La quimioterapia sólo
empezó a utilizarse
formalmente en este tipo de tumores hacia los años
70s. Un artículo de la revista Cancer publicado en
1984 resume claramente que tipo de quimioterapias
se solían utilizar y en qué escenarios clínicos (41).
Para esa época, el metotrexate era el fármaco más estudiado, utilizado
principalmente en CCyC de tipo
escamoso recurrente (42). Se utilizaba a dosis de 40-
60 mg/m² de superficie de área corporal, intravenoso, semanal
(diferentes esquemas con dosis mucho
más altas fueron también estudiados pero no se encontró mayor
efectividad pero si una mayor toxicidad) (43). Otros medicamentos
también utilizados
en el siglo pasado eran la bleomicina, el cisplatino, la
ciclofosfamida y la hidroxiurea. También para esta
época se introducía el concepto de quimioterapia de
inducción o quimioterapia neoadyuvante previa al
tratamiento quirúrgico (44). Además de la terapia
neoadyuvante, la quimioterapia adyuvante también
fue estudiada en diferentes escenarios, algunas veces
precedida de radioterapia, pero sin encontrar ningún
beneficio en cuanto a desenlaces de sobrevida (45).
Hasta este punto de la historia, parecía que el uso
de quimioterapia no tuviera un rol significativo en el
tratamiento del CCyC, pues los resultados de su uso
en los escenarios pre y posquirúrgicos no mostraban
beneficios mejores que aquellos proporcionados por
la radioterapia. Con el aumento del conocimiento
en la biología tumoral, y extrapolando de hallazgos
encontrados en el tratamiento de otros tumores, en
los 90s diferentes estudios evaluaron el rol de la quimioradioterapia
concurrente, pues ya se sabía que
algunos agentes quimioterapéuticos permitían una
radiosensibilización de las células tumorales (46).
De acuerdo con lo anterior, y posterior a la realización de diversos
ensayos clínicos, varios meta-análisis fueron publicados, en los cuales
se encontró un
beneficio estadísticamente significativo del uso de
quimioradioterapia concurrente sobre el uso de radioterapia sola,
principalmente en los escenarios de enfermedad locoregional resecable,
pero también en
otros estadios de la enfermedad (47,48).
Nacimiento de la terapia dirigida en
el cáncer de cabeza y cuello
En diferentes cánceres de origen epitelial, las mutaciones driver en el
gen del receptor del factor de crecimiento epidérmico han mostrado ser
críticas en el
desarrollo de la malignidad, además de muchas veces asociarse con una
enfermedad más agresiva y de
peor pronóstico. Esto se ha evidenciado no sólo en
el CCyC, sino también en tumores como el cáncer
de colon y recto y el cáncer de pulmón de célula no
pequeña (49,50). Mendelsohn et al fueron pioneros
en considerar el bloqueo de este receptor como una
posible alternativa terapéutica. Hasta la fecha, cetuximab, un
anticuerpo monoclonal tipo IgG1 quimérico dirigido contra EGFR es el
único agente que ha
demostrado una mejor sobrevida en pacientes con
CCyC de tipo escamocelular, en combinación con
radioterapia vs radioterapia sola (51) y combinación
con quimioterapia a base de platinos (52). Panitumumab, un anticuerpo
monoclonal totalmente humano dirigido contra EGFR no demostró mejoría
en la sobrevida de los pacientes con CCyC, al igual
que otros agentes dirigidos como los inhibidores de
tirosina quinasa gefitinib, erlotinib y afatinib (53).
A pesar de los resultados positivos con cetuximab,
la tasa de respuesta total en el escenario clínico de
CCyC resistente o metastásico es de solo el 13% con
una mediana de sobrevida libre de progresión (PFS)
de 2,3 meses como agente único, y de 2,8 meses en
combinación con quimioterapia (52,54). Diferentes
estrategias se han utilizado para estudiar la presencia
de biomarcadores genéticos y moleculares que pudieran predecir la
respuesta a cetuximab, o marcadores de resistencia que de ser
bloqueados mejoraran
los resultados con este medicamento. Algunas de las
mutaciones susceptibles de inhibición del EGFR en
tumores como el cáncer de pulmón de célula no pequeña han sido
evaluados también en el CCyC, sin
embargo, este tipo de alteraciones no fueron encontradas (55).
Diferentes estrategias se encuentran en
estudio actualmente para evaluar agentes que puedan generar un bypass
de los mecanismos de resistencia existentes, sin embargo, a la fecha
ninguno ha
demostrado algún tipo de beneficio (56).
Gracias al proyecto del “
The Cancer
Genome Atlas”55,
múltiples vías de señalización alteradas se pudieron
evidenciar en las muestras de pacientes con CCyC.
Estas alteraciones obedecen a 6 principales vías de
señalización: 1. Vías mediadas por receptores de tirosina quinasa, 2.
Vía de las MAPK, 3. Vía PI3K/
AKT/mTOR, 4. Vía del ciclo celular, 5. Vía de la reparación del DNA y
6. Vías epigenéticas (56). Dentro de estas alteraciones se encuentran
genes como:
FGF1-3, HER2, IGF-1R, HRAS, PIK3CA, PTEN,
CDKN2A, CCND1, CDK6, PARP, ATR, KMT2C,
KMT2D, ARID1A y NSD1.
Inhibición del checkpoint
inmunológico en el cáncer de cabeza
y cuello
El premio Nobel del 2018 fue otorgado a los doctores
Jim Alisson y Tasuku Honjo por sus descubrimientos relacionados con el
checkpoint inmunológico y
su papel en la evasión al sistema inmune mediada
por algunos tumores. CTLA-4 y PD1 son receptores
en los linfocitos T que cuando son estimulados inducen una inactivación
de estos. Basado en lo anterior,
aquellos tumores con altos niveles de expresión de
las moléculas PD-L1 (ligando para PD1) y B7-1/
B7-2 (ligando para CTLA4) parecieran depender de
la evasión tumoral como principal hallmark en su
proceso de oncogénesis, lo que hipotéticamente los
haría más susceptibles a la inhibición de esta vía. Un
esquema de la vía de señalización de la interacción
PD1/PD-L1 se detalla en la
figura 4.
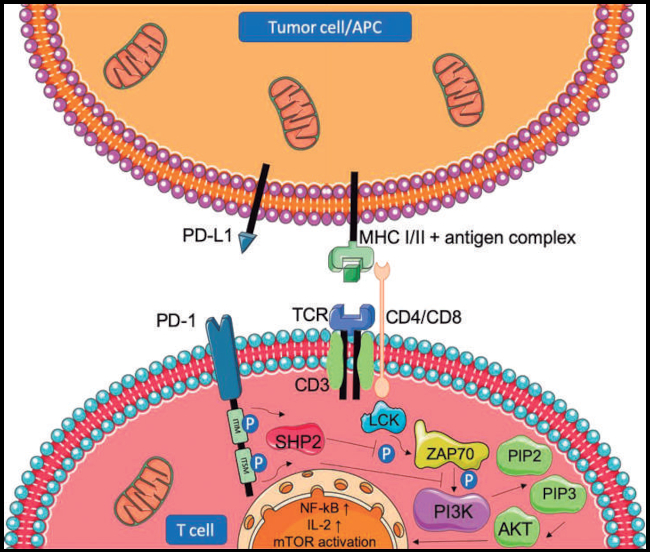
Figura 4. Ilustración que retrata la vía de señalización asociada a
la interacción
entre PD-1 en el linfocito T y PD-L1 en la célula tumoral.
Esta hipótesis fue rápidamente confirmada en múltiples estudios
realizados en diversos tumores incluyendo cáncer de pulmón, el melanoma
y el cáncer
de células renales (57). Un meta-análisis publicado
en la revista Oral Oncology, evaluó la eficacia de la
inhibición del checkpoint inmunológico en el tratamiento del CCyC de
tipo escamoso. Los autores
encontraron 8 estudios diferentes, de los cuales dos
correspondían a ensayos clínicos aleatorizados, en
los cuales se demostró que el uso de nivolumab (antiPD1) y
pembrolizumab (anti-PD1) mostró una diferencia estadísticamente
significativa en la sobrevida
con respecto a la terapia estándar en los pacientes
con enfermedad avanzada (58).
El estudio KEYNOTE-048, un ensayo clínico de fase
III que evaluó la eficacia del uso de pembrolizumab
como monoterapia vs pembrolizumab + quimioterapia vs quimioterapia +
cetuximab en el escenario
de CCyC escamocelular recurrente o metastásico. El
brazo de pacientes que recibieron pembrolizumab
en monoterapia, tuvo una mediana de sobrevida de
14,9 meses vs 10,7 meses de los pacientes que recibieron quimioterapia
+ cetuximab (p = 0.0007) (59).
El estudio CheckMate 141 encontró también beneficios con el uso de
Nivolumab en el escenario de
enfermedad resistente a primera línea de quimioterapia basada en
platinos. Los autores compararon la
sobrevida global de pacientes con CCyC que recibieron nivolumab como
monoterapia vs pacientes que
recibieron una de las siguientes: metotrexate, docetaxel o cetuximab.
La mediana de sobrevida en el
grupo de Nivolumab fue de 7,5 meses, mientras que la de los grupos que
recibieron terapia estándar fue
de 5,1 meses (p = 0,01) (60).
El estudio KEYNOTE-040 que evaluó la eficacia del
uso de pembrolizumab como monoterapia vs uno de
los siguientes: metotrexate, docetaxel y cetuximab,
en el escenario de enfermedad resistente o metastásica. Los
investigadores encontraron una mediana de
sobrevida en el grupo de pembrolizumab de 8,4 meses, y de 6,9 meses en
el grupo de cuidado estándar
(p = 0,0161) (61).
Nuevas terapias en desarrollo
En las últimas tres décadas, la biología molecular ha
avanzado a pasos agigantados, logrando el desarrollo de herramientas
tales como CRISPR/Cas9 (62),
la reprogramación celular y la modificación genética de células
autólogas de pacientes con cáncer para
usarse como terapia celular, además de otros enfoques terapéuticos del
cáncer como la nanomedicina
y las “vacunas” del cáncer. En el caso de CRISPR/
Cas y otros mecanismos de edición genética (terapia
génica), diferentes estudios
in vitro
y ensayos clínicos en fases iniciales se han realizado para evaluar
la restauración de genes supresores tumorales (63)
(principalmente TP53) que se encuentren truncados
o que hayan sufrido deleción durante la oncogénesis
(64,65).
El uso de células T con receptor quimérico para el
antígeno (células CAR-T) fue un descubrimiento
revolucionario para el tratamiento de malignidades
hematológicas refractarias a varias líneas de tratamiento, incluyendo
el trasplante de progenitores
hematopoyéticos, en el manejo de linfoma difuso
de células B grandes y de la leucemia linfoblástica
aguda. Sus resultados demostraron indiscutiblemente su efectividad en
el tratamiento de estos pacientes
(66,67). Las células CAR-T tienen la capacidad de
dirigir toda una respuesta inmune adaptativa celular tanto de
linfocitos T CD8+ como de linfocitos T
CD4+, dirigida contra aquellas células que expresen
en su membrana alguna molécula particular, en el
caso de los linfomas y las leucemias, es CD19, antígeno exclusivo de
los linfocitos B. Este enfoque
en los tumores sólidos es mucho más complejo de
aplicar, pues muchas veces no existen antígenos restringidos al tumor,
o cuando estos existen suelen ser
intracelular y no expresados en la membrana de la
célula. Algunos antígenos candidatos a este tipo de
terapia son: MUC1 y ligandos promiscuos del tipo
ErbB (68-70).
Conclusión
La historia del CCyC resulta fascinante, al igual que
la de los diferentes tipos de tumores. Es de resaltar
la persistencia a lo largo de miles de años, en que los
académicos han permanecido curiosos e inquietos
por entender mejor estas enfermedades y encontrar
una solución. La mayoría de los avances históricos
en el tratamiento del CCyC se realizaron en los últimos trecientos
años, pero los incrementos más sustanciales en la sobrevida de los
pacientes sin duda se
han logrado tan sólo en las últimas 4-5 décadas, todo
gracias a los avances en biología molecular, al descubrimiento de la
estructura del DNA, al proyecta genoma humano y por supuesto al Atlas
del Genoma
del Cáncer (TCGA). En los años por venir se esperan muchos avances,
cada vez más fundamentados
en terapias moleculares, que se caracterizan por ser
más específicas, más efectivas y con menos eventos
adversos.
Agradecimientos
Quisiera agradecer especialmente a los doctores
Henry Idrobo y Andrés Felipe Cardona, quienes,
desde su experiencia en la oncología y la investigación, han servido
como guías y mentores, aportando
significativamente al futuro talento humano en oncología del país,
dejando un legado en todos los que
hemos tenido la oportunidad de aprender de ellos.
Referencias
1. Chow LQM. Head and Neck Cancer. N
Engl J Med
2020; 382:60–72.
2. Bray F, Ferlay J, Soerjomataram I,
Siegel RL, Torre
LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of
incidence and mortality worldwide
for 36 cancers in 185 countries. CA Cancer J Clin.
2018;68:394–424.
3. ACKERKNECHT EH. Historical notes
on cancer. Med
Hist. 1958;2:114–119.
4. Moodie RL. Tumors of the head
among the pre-Columbian Peruvians. Ann Med Hist. 1926;8:394–412.
5. Bernal JE, Briceno I. Genetic and
other diseases in
the pottery of Tumaco-La Tolita culture in ColombiaEcuador. Clin Genet.
2006;70:188–191.
6. Bhikha R, Glynn J. The theory of
humours revisited.
Int J Dev Res. 2017;7:15029–15034.
7. Hajdu SI. A note from history:
Landmarks in history of
cancer, part 1. Cancer. 2011;117:1097–1102.
8. di Lonardo A, Nasi S, Pulciani S.
Cancer: We should
not forget the past. J. Cancer. 2015;6:29–39.
9. Lukong KE. Understanding breast
cancer – The long
and winding road. BBA Clin. 2017;7:64–77.
10. Natale G, Bocci G, Ribatti D.
Scholars and scientists in the history of the lymphatic system. J.
Anat.
2017;231:417–429.
11. Shedd DP. The Work of Henry T.
Butlin, an Early Head
and Neck Surgeon. Am J Surg. 1997;173:234–236.
12. Inchingolo F, Santacroce L,
Ballini A, Topi S, Dipalma
G, Haxhirexha K et al. Oral Cancer: A Historical Review. Int J Environ
Res Public Health. 2020;17:3168.
13. McGurk M, Goodger NM. Head and
neck cancer and
its treatment: historical review. Br J Oral Maxillofac
Surg . 2000;38:209–220.
14. Martin HE. The history of lingual
cancer. Am J Surg.
1940;48:703–716.
15. Redmond DE. Tobacco and Cancer:
The First Clinical
Report, 1761. N Engl J Med. 1970;282:18–23.
16. von Soemmerring ST. De Morbis
vasorum absorbentium corporis humani... Varrentrapp et Wenneri, 1795.
17. Pott P. The chirurgical works of
Percivall Pott, F.R.S.,
surgeon to St. Bartholomew’s Hospital, a new edition,
with his last corrections. 1808. Clin Orthop Relat Res.
2002;:4–10.
18. Marchetti P. Observationum
medico-chirurgicarum rariorum sylloge. Cadorinis, 1737.
19. Louis A. Memoire physiologique et
pathologique sur
la langue. 1770.
20. Absolon KB, Rogers W, Aust JB.
Some historical developments of the surgical therapy of tongue cancer
from the seventeenth to the nineteenth century. Am J
Surg. 1962;104:686–691.
21. Middeldorpf AT. Die Galvano
caustik ein Beitrag zur
operativen Medicin. Josef Max & Comp., 1854.
22. Maisoneuve M. Sur un cas
d’extirpation presque totale de la langue au moyen de la cauterisation
en flesches. J Compt Rend Acad Sc. 1863;57: 831.
23. Billroth T. Osteoplastiche
Resectionen des Unterkiefers nach Eigener Methode. Arch Klin Chri .
1862;2:651–657.
24. Stell PM. History of surgery of
the upper jaw. Tumours
Up jaw Edinburgh Ed Churchill Livingstone 1993;:1–15.
25. Garcia M. IV. Observations on the
human voice. Proc
R Soc London 1856;:399–410.
26. Sir Morell Mackenzie (1837–1892).
Nature.
1937;140:16.
27. Stevenson RS, Guthrie D. A
history of oto-laryngology.
E. & S. Livingstone, 1949.
28. Thomson SC. Cancer of the Larynx.
Laryngoscope.
1921;31:522–527.
29. Thomson S. The history of cancer
of the larynx. J
Laryngol Otol . 1939;54:61–87.
30. Stell PM. The first laryngectomy.
J Laryngol Otol .
1975;89:353–358.
31. Röntgen WC. Über eine neue Art
von Strahlen. Sitzungsberichte der Physik.-Med. Gesellschaft zu
Würzbg . 1895;137:132–141.
32. Dunn PM. Wilhelm Conrad Röentgen
(1845-1923),
the discovery of x rays and perinatal diagnosis. Arch.
Dis. Child. Fetal Neonatal Ed. 2001;84(2):F138-9.
33. Radvanyi P, Villain J. La
découverte de la radioactivité. Comptes Rendus Phys. 2017;18:544–550.
34. Paterson R, Parker HM. A Dosage
System for Gamma
Ray Therapy. Br J Radiol 1934;7:592–632.
35. Coutard H. Roentgentherapie des
epitheliomas de la
region amygdalienne, de l’hypopharynx et du larynx
au cours des annees 1920 a 1926. Radiophys et radiothérapie .
1932;2:11–27.
36. Duane W. Methods of preparing and
using radioactive substances in the treatment of malignant disease,
and of estimating suitable dosages. Bost Med Surg J.
1917;177:787–799.
37. Dominici H. Du traitement des
tumeurs malignes par
le rayonnement ultrapénétrant du radium. Bull Cancer.
1908;1:124–156.
38. Butlin HT. The hunterian lecture
on what operation can
do for cancer of the tongue. Br Med J. 1898;1:541–
544.
39. Butlin HT. On the Early Diagnosis
of Cancer of the
Tongue, and on the Results of Operations in Such Cases. Br Med J.
1909;1:462–463.
40. Crile G. Excision of cancer of
the head and neck: With
special reference to the plan of dissection based on
one hundred and thirty-two operations. J Am Med Assoc
.1906;XLVII:1780–1786.
41. Watne AL. Treatment alternatives:
Head and neck
cancers. Cancer . 1984;54:2673–2681.
42. Hong WK, Bromer R. Chemotherapy
in Head and
Neck Cancer. N Engl J Med. 1983;308:75–79.
43. Levitt M, Mosher MB, DeConti RC,
Farber LR, Skeel RT, Marsh JC et al. Improved therapeutic index of
methotrexate with ‘leucovorin rescue’. Cancer Res.
1973;33:1729–1734.
44. Baker SR, Makuch RW, Wolf GT.
Preoperative Cisplatin and Bleomycin Therapy in Head and Neck Squamous
Carcinoma: Prognostic Factors for Tumor Response. Arch Otolaryngol .
1981;107:683–689.
45. Laramore GE, Scott CB, Al-Sarraf
M, Haselow RE,
Ervin TJ, Wheeler R et al. Adjuvant chemotherapy for
resectable squamous cell carcinomas of the head and
neck: Report of intergroup study 0034. Int J Radiat
Oncol Biol Phys . 1992;23:705–713.
46. Cognetti DM, Weber RS, Lai SY.
Head and neck
Cancer an evolving treatment paradigm. Cancer.
2008;113:1911–1932.
47. Pignon JP, Bourhis J, Domenge C,
Designé L. Chemotherapy added to locoregional treatment for head
and neck squamous-cell carcinoma: three metaanalyses of updated
individual data. MACH-NC Collaborative Group. Meta-Analysis of
Chemotherapy on
Head and Neck Cancer. Lancet. 2000;355:949–955.
48. Baujat B, Audry H, Bourhis J,
Chan ATC, Onat H,
Chua DTT et al. Chemotherapy in locally advanced
nasopharyngeal carcinoma: an individual patient data
meta-analysis of eight randomized trials and 1753 patients. Int J
Radiat Oncol Biol Phys. 2006;64:47–56.
49. Krasinskas AM. EGFR Signaling in
Colorectal Carcinoma. Patholog Res Int . 2011;2011:1–6.
50. Fernández-Trujillo L,
Garcia-Robledo JE, ZúñigaRestrepo V, Sua LF. Clinical characteristics
and PDL1 expression in primary lung squamous cell carcinoma: A case
series. Respir Med Case Reports .
2020;30:101114.
51. Bonner JA, Harari PM, Giralt J,
Azarnia N, Shin DM,
Cohen RB et al. Radiotherapy plus cetuximab for
squamous-cell carcinoma of the head and neck. N
Engl J Med. 2006;354:567–78.
52. Vermorken JB, Mesia R, Rivera F,
Remenar E, Kawecki A, Rottey S et al. Platinum-Based Chemotherapy
plus Cetuximab in Head and Neck Cancer. N Engl J
Med. 2008;359:1116–1127.
53. Soulieres D, Senzer NN, Vokes EE,
Hidalgo M, Agarvala SS, Siu LL. Multicenter phase II study of
erlotinib,
an oral epidermal growth factor receptor tyrosine kinase inhibitor, in
patients with recurrent or metastatic
squamous cell cancer of the head and neck. J Clin
Oncol. 2004;22:77–85.
54. Vermorken JB, Trigo J, Hitt R,
Koralewski P, DiazRubio E, Rolland F et al. Open-label, uncontrolled,
multicenter phase II study to evaluate the efficacy
and toxicity of cetuximab as a single agent in patients
with recurrent and/or metastatic squamous cell carcinoma of the head
and neck who failed to respond to
platinum-based therapy. J Clin Oncol. 2007;25:2171–
2177.
55. Lawrence MS, Sougnez C,
Lichtenstein L, Cibulskis
K, Lander E, Gabriel SB et al. Comprehensive genomic characterization
of head and neck squamous cell
carcinomas. Nature. 2015;517:576–582.
56. Gougis P, Bachelard CM, Kamal M,
Gan HK, Borcoman E, Torossian N et al. Clinical development of
molecular targeted therapy in head and neck squamous
cell carcinoma. JNCI Cancer Spectr. 2019;3(4):pkz055
57. Beltran E, Garcia-Robledo JE,
Rodríguez-Rojas LX,
Rengifo M, Perez B, Pachajoa H et al. Clear cell renal
carcinoma synchronous with dedifferentiated liposarcoma: a case report
and review of the literature. J Med
Case Rep. 2020;14(1):4.
58. Ghanizada M, Jakobsen KK, Grønhøj
C, von Buchwald C. The effects of checkpoint inhibition on head
and neck squamous cell carcinoma: A systematic review. Oral Oncol.
2019;90:67–73.
59. Burtness B, Harrington KJ, Greil
R, Soulières D, Tahara M, de Castro G et al. Pembrolizumab alone or
with chemotherapy vs. cetuximab with chemotherapy
for recurrent or metastatic squamous cell carcinoma
of the head and neck (KEYNOTE-048): a randomised,
open-label, phase 3 study. Lancet .2019;394:1915–
1928.
60. Ferris RL, Blumenschein G,
Fayette J, Guigay J, Colevas AD, Licitra L et al. Nivolumab for
Recurrent Squamous-Cell Carcinoma of the Head and Neck. N Engl J
Med. 2016;375:1856–1867.
61. Cohen EEW, Soulières D, Le
Tourneau C, Dinis J, Licitra L, Ahn MJ et al. Pembrolizumab vs.
methotrexate, docetaxel, or cetuximab for recurrent or metastatic
head-and-neck squamous cell carcinoma (KEYNOTE-040): a randomised,
open-label, phase 3 study.
Lancet. 2019;393:156–167.
62. Garcia-Robledo JE, Barrera MC,
Tobón GJ. CRISPR/
Cas: from adaptive immune system in prokaryotes to
therapeutic weapon against immune-related diseases. Int Rev Immunol .
2020;39:11–20.
63. Birkeland A, Ludwig ML, Spector
ME, Brenner JC. The
potential for tumor suppressor gene therapy in head
and neck cancer. Discov Med 2016;21:41.
64. Liu S, Chen P, Hu M, Tao Y, Chen
L, Liu H et al. Randomized, controlled phase II study of post-surgery
radiotherapy combined with recombinant adenoviral
human p53 gene therapy in treatment of oral cancer.
Cancer Gene Ther. 2013;20:375–378.
65. Yoo GH, Moon J, LeBlanc M,
Lonardo F, Urba S, Kim
H et al. A phase 2 trial of surgery with perioperative
INGN 201 (Ad5CMV-p53) gene therapy followed by
chemoradiotherapy for advanced, resectable squamous cell carcinoma of
the oral cavity, oropharynx,
hypopharynx, and larynx: Report of the southwest
oncology group. Arch Otolaryngol - Head Neck Surg.
2009;135:869–874.
66. Anagnostou T, Riaz IB, Hashmi SK,
Murad MH, Kenderian SS. Anti-CD19 chimeric antigen receptor T-cell
therapy in acute lymphocytic leukaemia: a systematic review and
meta-analysis. Lancet Haematol .
2020;7:e816–e826.
67. Neelapu SS, Locke FL, Bartlett
NL, Lekakis LJ, Miklos
DB, Jacobson CA et al. Axicabtagene Ciloleucel CAR
T-Cell Therapy in Refractory Large B-Cell Lymphoma.
N Engl J Med. 2017;377:2531–2544.
68. Mei Z, Zhang K, Lam AKY, Huang J,
Qiu F, Qiao B
et al. MUC1 as a target for CAR-T therapy in head
and neck squamous cell carinoma. Cancer Med.
69. Wang S, Zhu Z. Enhanced chimeric
antigen receptor
T-cell therapy: A novel approach for head and neck
cancers. Oral Dis. 2019;25:355–356.
70. Papa S, Adami A, Metoudi M,
Achkova D, van
Schalkwyk M, Parente Pereira A et al. A phase I trial of
T4 CAR T-cell immunotherapy in head and neck squamous cancer (HNSCC). J
Clin Oncol . 2018;36:3046–
3046.
Recibido:
Noviembre 10, 2020
Aprobado: Diciembre 02, 2020
Correspondencia:
Juan Esteban Garcia-Robledo
juanesmd23@gmail.com






