Resumen
El uso de agentes químicos para tratar enfermedades se remonta a
los primeros asentamientos humanos. Sin embargo, el desarrollo de
terapias químicas como tal, se le atribuye al médico Paul Ehrlich
con el desarrollo de su “bala de plata” para tratar la sífilis con
arsenicales. La quimioterapia en cáncer
surgió a partir del uso de armas biológicas en la Primera Guerra
Mundial y el desarrollo del gas mostaza en 1917. Sus propiedades
mielotóxicas y vesicantes fueron reconocidas en 1946 por Goodman y
colaboradores y posteriormente utilizadas en pacientes con leucemia y
linfomas. Después de 30 años
de investigación, desarrollo de nuevos agentes e identificación de
mecanismos diversos, se creó la
oncología médica como subespecialidad de Medicina Interna en EEUU a
fines de 1973. Los mayores
avances oncológicos ocurrieron en estas tres últimas décadas como
resultado de grandes descubrimientos tecnológicos en el área de
biología molecular y genómica, que a su vez generaron un enorme
avance en la investigación en cáncer. El acelerado desarrollo
terapéutico oncológico ha impactado: a)
el número anual de agentes aprobados por la FDA, b) la agilidad de los
procesos de aprobación, c) el
diseño de estudios clínicos y d) renovado el optimismo con el que
pacientes y profesionales de la salud
enfrentan el cáncer. Además, nuevas disciplinas nacieron (p.e.,
inmuno-oncología, cardio-oncología),
y aquellas ya establecidas se sofisticaron aún más (radioterapia,
medicina paliativa, etc). Este artículo
revisa aspectos históricos relacionados con el desarrollo de la
quimioterapia, los principios básicos
para su aplicación y la combinación con otros agentes citotóxicos,
terapias diana, e inmuno-oncología.
Palabras clave: Quimioterapia; agentes oncológicos; drogas
citotóxicas; cáncer; Historia.
BIRTH OF CHEMOTHERAPY
Abstract
The use of chemicals to treat human disease dates back to ancient
human settlements. However, the use of chemical agents is attributed to
Paul Ehrlich, a german jewish physician who
urged the need to develop “silver bullets” against pathogens and
subsequently developed the
first standard treatment for syphilis. The history of chemotherapy in
cancer is closely linked to
the use of biological weapons during world war I, specifically the
mustard gas in 1917. Goodman, and others from Yale described the
myelotoxic and vesicant properties of this agent in
1946 and later used to treat patients with leukemia and lymphoma. After
30 years of research
and development of novel agents and mechanisms of action, medical
oncology became a
subspecialty of Internal Medicine in 1973. The greatest advances in
oncology have taken
place during the past 3 decades (1995-2020) as a result of great
technological discoveries
applied to the fields of molecular biology and genomics. The large
development of new anticancer agents has resulted in a) greater number
of annually approved drugs by the FDA.
b) much faster drug approval processes. c) new designs of clinical
trials d) a renewed enthusiasm and optimism for patients and health
care providers facing cancer. Moreover, new
disciplines have emerged (immune-Oncology, Cardio-Oncology, etc), and
those previously
established experienced renovation (radiation therapy, palliative
medicine, etc). This article
reviews historical aspects associated with the development of
chemotherapy, the basic principles for its administration, and the
combination with other cytotoxic agents, targeted agents,
and immune modulators.
Keywords: Chemotherapy;
Oncology drugs; cytotoxic agents; cancer; anticancer agents; History.

¹ MD, MPH. Center for Oncology and Blood Disorders. Houston,
United States of America
Aspectos históricos del desarrollo de
la quimioterapia
El uso de agentes para tratar enfermedades es casi tan
antiguo como la especie humana. Es de conocimiento
popular que, a través de la historia, diferentes culturas
utilizaron agentes como el oro, el mercurio y el antimonio para tratar
cáncer, infecciones, y múltiples enfermedades crónicas(1).
El desarrollo de la quimioterapia se le atribuye al médico judío Alemán
Paul Ehrlich, quien nació un 14 de
marzo de 1854 en Strehlen - en la alta Silesia de Alemania y completó
sus estudios de medicina en 1878.
Ehrlich consiguió un trabajo como profesor asistente
en la clínica médica de Berlín y posteriormente fue
nombrado director del Instituto Real de Terapia Experimental en 1899
donde formó un equipo de distinguidos investigadores, alcanzando la
cima de su carrera.
Ehrlich publicó la metodología de tinciones para el
bacilo que Koch había descubierto y ese método fue
la base para modificaciones futuras desarrolladas por
Ziehl y Neelson (2). De este trabajo también se desarrolló la tinción
de Gram ampliamente utilizada en
bacteriología. Su trabajo en el área de quimioterapia
comenzó en 1902. Ehrlich comenzó a estudiar el uso
de coloraciones para tratar animales infectados con el
parásito de la enfermedad del sueño Africano. Ehrlich
descubrió que algunos colorantes (especialmente su
favorito – rojo de triptano) prevenían o curaban a los
animales infectados por un tipo específico de parásito,
más no por otros. El también describió como en ciertas condiciones, los
animales infectados desarrollaban
una alta resistencia a determinados colorantes, demostrando por primera
vez la resistencia a drogas (1).
Ehrlich también investigó el arsénico extensamente.
En su época se descubrió que un grupo de microorganismos con forma de
sacacorchos era sensible a los
arsenicales. Para la época, dos científicos alemanes
habían demostrado que una especie de este grupo de
organismos era el responsable de la sífilis. Ehrlich estaba dispuesto a
encontrar lo que el denominó “la bala
de plata” contra la espiroqueta de la sífilis y sintetizó
un compuesto arsenical conocido como salvarsán, que
en 1910 se convirtió casi inmediatamente en el tratamiento de elección
para la sífilis hasta que la penicilina
lo desplazó al demostrar su poder curativo a finales de
los años 1940 (1, 3). Ehrlich recibió múltiples honores
incluyendo el Premio Nobel de Medicina y Fisiología
en 1908. Falleció el 20 de agosto de 1915 a causa de un
accidente cerebrovascular, tan solo 5 años después de
comenzar el uso de quimioterapia (3).
Quimioterapia en cáncer
La guerra química moderna comenzó en 1915 cuando Alemania utilizó cloro
en gran escala para atacar a
los aliados durante la Primera Guerra Mundial. Esta
ofensiva provocó una gran actividad de operaciones
encaminadas al desarrollo de agentes biológicos para
la defensa de los aliados y la creación de nuevos y más
letales químicos en ambos lados del conflicto. En Julio
de 1917, en un campo en las afueras de Ypres en Bélgica, se probó por
primera vez un agente ampollante llamado gas mostaza por su olor a ajo
y mostaza. Aquel
agente fue responsable de más de 400.000 muertes durante la guerra. Su
eficacia le convirtió en el agente
biológico de elección desde 1917 hasta nuestros días,
tal como lo evidencian reportes de su uso por Iraq en
contra de Irán en 1987. Al entrar a la Segunda Guerra
Mundial, EEUU dedicó especial interés a investigaciones para
contrarrestar los efectos tóxicos de la mostaza
nitrogenada y desarrollar productos aun más letales.
Los programas de evaluación se llevaron a cabo en
cerca de 60.000 militares, de los cuales, 4.000 a 5.000
participaron en investigaciones llevadas a cabo en cámaras de gases
(4).
En diciembre 2 de 1943, un bombardeo aéreo sobre buques de los Aliados
en Bari, Italia, hizo estallar el SS John Harvey con un cargamento
secreto:
2.000 bombas de gas mostaza que vertieron en el
agua. Los marineros que cayeron al agua quedaron
impregnados en mostaza nitrogenada. De los aproximadamente 600 hombres
afectados, 83 fallecieron.
Sin embargo, parte de la mostaza sulfúrica que estalló fue vaporizada y
formó una densa nube sobre el
puerto de Bari exponiendo a otras 250.000 personas,
de las cuales 1.000 fallecieron (5). Los efectos tóxicos de este agente
fueron estudiados por diferentes
médicos y científicos de la época entre los cuales
figuraban Goodman y Gilman de la universidad de
Yale (6). Posteriormente, Alexander Haddow en 1948
describió las partes críticas del agente mostaza como
agente antineoplásico y su aplicación se desarrolló
para pacientes con linfoma y leucemia debido a las
propiedades mielosupresivas que se observaban entre
quienes habían sido accidentalmente expuestos y en
militares estadounidenses utilizados para la investigación de estos
agentes biológicos (4).
El tratamiento del cáncer en los Estados Unidos fue
dominado por la cirugía y la radioterapia hasta mediados de los años
sesenta, cuando diferentes observaciones demostraron que la radiación
ya había alcanzado
su máxima eficacia de curabilidad cercana al 33% debido a la presencia
de enfermedad sistémica no identificada (7).
En 1939, Charles Huggins introdujo la
terapia
hormonal basado en observaciones del efecto de estrógenos
en cáncer de seno hechas por Beatson en 1896. Huggins trató hombres con
cáncer de próstata mediante
manipulación hormonal y logró establecer respuestas
cuantificando los niveles de fosfatasa ácida sérica (7).
Este trabajo fue una importante contribución para el
desarrollo de terapias sistémicas y le valió el Premio
Nobel a Huggins en 1966.
En 1949, se estimaba que tan solo 20% de los pacientes
con cáncer sobrevivían durante 5 años con las modalidades terapéuticas
de la época (8). Concomitantemente, diferentes fuentes comenzaron a
reportar sobre la
capacidad curativa del uso combinado de diferentes
agentes de quimioterapia.
El final de la Segunda Guerra Mundial marcó una
época de especial interés en la quimioterapia debido
a los importantes avances científicos. El primero fue el
hallazgo accidental de los efectos mielosupresivos del
gas mostaza que abrió el campo de los agentes alquilantes. Luego se
registraron los primeros estudios con
ácido fólico que resultaron en el descubrimiento de la
aminopterina, creando el campo de los antimetabolitos. En tercer lugar
se registró la rápida expansión de
antibióticos y el descubrimiento de la actividad antitumoral de algunos
de ellos, en particular las actinomicinas (9). En esa época se
reunieron aproximadamente
20 agentes con actividad antitumoral y arbitrariamente
se clasificaron en cuatro grupos diferentes: a) agentes
alquilantes polifuncionales (mostaza nitrogenada,
trietilén melamina [TEM], leukerán, busulfán, ciclofosfamida); b)
antimetabolitos (antagonistas del ácido fólico [metotrexate],
antagonistas de las purinas
[6-mercaptopurina], pirimidinas fluorinadas (5FU y
FUDR); c) antibióticos antitumorales (mitomicina C,
sarcomicina, actinomicina D y actinomicina F1) y d)
hormonas y esteroides misceláneos (andrógenos, estrógenos y
corticosteroides) (10). DeVita y Chu publicaron una excelente revisión
de los aspectos históricos
de esta época del desarrollo de la quimioterapia a raíz
del centenario de la introducción del conejo como modelo animal para el
desarrollo de la quimioterapia por
Paul Ehrlich (7).
A mediados de los años 1950, Heidelberg y colaboradores de la
Universidad de Wisconsin identificaron
una mayor captación y utilización del uracilo con
respecto a los tejidos normales en el metabolismo
del hepatoma en ratas. Basado en esta observación,
Heidelberg utilizó este evento bioquímico y sintetizó
el 5-fluorouracilo que hoy sigue siendo de importancia crítica en el
manejo de pacientes con cáncer colorectal.
Esta fué muy probablemente la primera
terapia
dirigida, terapia blanco, o terapia diana en la historia de
la oncología.
La gran mayoría de pruebas experimentales se realizaban en el
Sloan-Kettering Institute de Nueva York.
Otros programas de la época fueron desarrollados en
el Chester Beatty Research Institute de Londres y la
Children’s Cancer Research Foundation de Boston.
Investigadores prominentes como David Karnofsky,
Cornelius Rhoads y Sidney Farber lideraron estas actividades. Sin
embargo, estos esfuerzos se tornaron
insuficientes y fue así como en 1955, surgió el Centro de Servicio
Nacional de Quimioterapia en Cáncer (CCNSC) en respuesta a necesidades
públicas y
científicas de la comunidad en general. Este servicio
evaluaba 40.000 - 50.000 compuestos anualmente. Sin
embargo, solo una pequeña fracción de estos era de
interés suficiente para justificar estudios en animales,
y un número aún menor –solamente aquellos seguros
y con eficacia promisoria– se evaluaban en pacientes
con cáncer en diferentes hospitales de los Estados Unidos(10). Debido a
los muy pocos éxitos obtenidos en las terapias durante la década de los
1950, la lucha
contra el cáncer se tornó pesimista. Por esa época, Min
Chiu Li exitosamente curó pacientes con coriocarcinoma. Sin embargo, se
pensaba que, por ser un tumor
híbrido, su regresión podría haber sido espontánea.
Min Chiu Li fue destituido de su cargo por persistir
con esta idea; pero más tarde, Li desarrollaría la primera terapia
combinada efectiva para curar el cáncer
de testículo (11). Estos fueron los primeros dos tumores en ser curados.
En 1966, el CCNSC se incorporó a la estructura del
Instituto Nacional de Cáncer (NCI) de EEUU como
parte del programa de quimioterapia dirigido por
Zubrod, y hoy es conocido como el Programa de
desarrollo de terapias (Developmental Therapeutics
Program). Para 1974, este programa recibía 68 millones de dólares del
gobierno Federal y producía
casi tres millones de modelos de tumores implantados en ratones. El
CCNSC evaluaba aproximadamente 40.000 compuestos anuales y dio origen
al
programa multibillonario de la industria farmacéutica contra el cáncer.
Muy a pesar de estos tempranos
avances en la aplicación de quimioterapia y agentes
sistémicos contra el cáncer, la quimioterapia no era
considerada una especialidad y mucho menos una
ciencia. En las pocas instituciones donde se aplicaba
por primera vez, como la Universidad de Columbia
en Nueva York, era vista como la aplicación de venenos a pacientes con
cáncer y los internos y residentes no eran autorizados a rotar en
aquellos pisos (7).
Sin embargo, para 1960, el modelo animal de ratón
L1210 fue validado para estudiar leucemia y al final
de la década, aproximadamente 25% de los niños
con leucemia aguda alcanzaban remisión completa
con agentes únicos. No obstante, estas respuestas
eran de duración y limitada a meses. Diferentes instituciones de la
época como el Roswell Park Medical Institute en Buffalo (Jim Holland),
St. Jude’s in
Memphis (Don Pinkel), Boston Children’s Cancer
Center (Sidney Farber), Memorial Sloan-Kettering
Cáncer Center (Joe Burchenal) y el Centro Clínico
del Instituto Nacional del Cáncer en Bethesda (Emil
Frei y Emile Freireich) continuaban evaluando combinaciones de agentes
en esta enfermedad. Avances
considerables ocurrieron también en pacientes con
enfermedad de Hodgkin mediante el uso de alcaloides de la vinca (Eli
Lilly) y el descubrimiento de la
procarbazina.
En 1970, la leucemia infantil por primera vez fue considerada como una
enfermedad con potencialmente
curable y posteriormente, la enfermedad de Hodgkin
fue tratada también con la combinación de agentes
que incluían Mostaza Nitrogenada, Vincristina, Metotrexate
(posteriormente Procarbazina) y Prednisona
(MOMP y MOPP). El primer estudio clínico fue publicado en la revista
Annals of Internal Medicine en
1970 y demostró respuestas en 80% de los pacientes
(12). Para el final de la década de los sesenta, la quimioterapia había
demostrado que podía curar grupos
selectos de pacientes con cáncer, y con estos datos había un renovado
sentido de esperanza que contrastaba
con el pesimismo que caracterizó los primeros avances
en la década de los años cincuenta.
La oncología médica fue oficialmente establecida en
los Estados Unidos como subespecialidad de medicina
interna en 1973 y la quimioterapia era su arma más
atractiva y eficaz.
Principios básicos de tratamiento
Las drogas utilizadas para quimioterapia han tenido
también una importante aplicación en las enfermedades no neoplásicas.
Enfermedades como la artritis
(metotrexate y ciclofosfamida), el lupus eritematoso
(ciclofosfamida), enfermedad de Crohn (6-mercaptopurina), anemia de
células falciformes (hidroxiurea),
psoriasis (metotrexate) y transplante de órganos sólidos (metotrexate y
azatioprina) son comúnmente tratadas con agentes antineoplásicos.
El gran avance en la investigación en cáncer durante
las ultimas tres décadas resultó en una explosión de
agentes terapéuticos en el siglo XXI. Esta era marcó el
comienzo de las terapias diana (agentes dirigidos contra blancos
moleculares establecidos en células malignas) (13) y posteriormente el
desarrollo de una nueva
generación de agentes inmuno-moduladores que a su
vez sirvieron de partida al campo de la inmuno-oncología, hoy
reconocida como una disciplina por la academia y la industria
farmacéutica.
Sin embargo, a pesar del rápido desarrollo de estas
nuevas modalidades terapéuticas, la quimioterapia
continúa siendo la terapia antineoplásica más utilizada, y su
combinación con estas nuevas armas terapéuticas ya ha demostrado ser
exitosa (14). Nuevamente,
al igual que en la década de los años setenta, diferentes estudios
sugieren que la combinación de diferentes
agentes está asociado a mayor eficacia y potencial de
curabilidad. Esta premisa resulta de suma importancia, por cuanto la
combinación de agentes y grupos
terapéuticos requiere un conocimiento avanzado de
biología tumoral, farmacología, fisiología y resistencia
a drogas.
Combinación de agentes antineoplásicos
Hay varios principios biológicos para tener en cuenta
al combinar agentes quimioterapéuticos a fin de alcanzar la máxima
eficacia y tolerabilidad posibles. En términos generales, es aceptado
que estos son los cinco
principios básicos para considerar cuando se administran agentes en
combinación:
- Utilizar agentes con actividad antitumoral individual conocida.
- Utilizar agentes con diferentes mecanismos de acción.
- Utilizar agentes con diferentes mecanismos de resistencia.
- Utilizar agentes con diferente perfil de toxicidades.
- Conocer las posibles interacciones entre los diversos agentes
utilizados.
En la combinación de agentes también debe tenerse
en cuenta que existe una
toxicidad inmediata
(aquella
que resulta dentro de las primeras 3 semanas de tratamiento) y otra
acumulativa
(después de varios ciclos de
tratamiento). Este perfil de toxicidades hace imprescindible evaluar
los pacientes siete días después de su
primera administración y un día antes de cada ciclo a
fin de reconocer el estado general del paciente, evaluar
los efectos adversos, su intensidad, y tomar medidas
para ajustar su tolerabilidad.
Perfil de toxicidades
El desarrollo farmacológico de los agentes de quimioterapia que hoy
conocemos ha sido un camino difícil y con muchos obstáculos. Miremos
por ejemplo el
desarrollo del cisplatino (15). En el estudio de Fase I,
Higby, Wallace y Holland trataron 45 pacientes con
cáncer de vejiga, seno, seminoma, coriocarcinoma,
y carcinoma de células pequeñas del tiroides en dos
esquemas diferentes de cisplatino intravenoso a dosis
escaladas. Las toxicidades limitantes fueron falla renal, náusea,
vómito y tinitus. Entre los pacientes evaluados, cinco alcanzaron
respuesta completa y otros
cuatro, respuestas parciales. Sin duda alguna, este nuevo agente
conocido como Cis-diamminedichloroplatinum (NSC-119875) demostraba una
de las actividades
antitumorales más potente jamás vista, pero su perfil
de toxicidad estuvo a punto de llevarlo a la descontinuación. Este
ejemplo nos demuestra la importancia
de incorporar los estudios de farmacoquinética y farmacodinamia en los
estudios iniciales a fin de predecir
al máximo las toxicidades y desarrollar planes de tratamiento que nos
ayuden a definir el mejor esquema
y dosis para el ulterior desarrollo de cada agente. El
desarrollo de terapias de apoyo sistémico encaminadas
a mejorar los síntomas generales y proteger los órganos blanco ha sido
también un factor determinante en el desarrollo de la oncología que hoy
conocemos. Los
agentes antieméticos, factores de crecimiento celular,
agentes de protección ósea y analgésicos, entre otros,
han tenido un gran impacto en la tolerabilidad a agentes
quimioterapéuticos.
De manera similar, hay varios ejemplos de agentes
aprobados por la FDA a dosis mayores de las que rutinariamente se
utilizan. Entre ellos, tenemos el de la
gemcitabina, un nucleósido análogo que recibió su
primera aprobación en mayo de 1996 para pacientes
con cáncer de seno previamente tratadas con doxorubicina adyuvante
(16). La dosis inicialmente aprobada fue 1.250 mg/m² los días 1 y 8 de
cada 21 días en
combinación con paclitaxel 175 mg/m² administrado
el dia 1 de cada ciclo. Otros estudios demostrarían que
como agente único, en pacientes con cáncer de páncreas refractario a
5FU, la administración de gemcitabina a una dosis de 1.000 mg/m²
semanales durante
7 semanas consecutivas o hasta alcanzar toxicidad limitante, seguida de
1.000 mg/m² semanales durante
3 de cada 4 semanas tendría la eficacia suficiente para
su aprobación en cáncer de páncreas (16). Hoy día, el
uso rutinario de gemcitabina como agente único se ha
generalizado a dosis semanales de 800 mg/m² durante
3 de cada 4 semanas a fin de evitar la alta toxicidad
observada con el régimen inicialmente aprobado por
la FDA. Otro ejemplo similar es el de la azacitidina.
La aprobación inicial de azacitidina por la FDA (mayo
2004) comprendía una dosis diaria de 75 mg/m2 los
primeros siete días de cada mes. La dosis podía escalar a 100 mg/m² en
caso de pobre respuesta y siempre
y cuando la tolerabilidad permaneciera en un rango
seguro (17). Un estudio posterior demostró que su
utilización diaria por cinco días en vez de siete, era
similar en seguridad y eficacia (18). A pesar del progreso en la
definición de dosis ideal, aún la mayoría de
los estudios clínicos encaminados a encontrar la dosis
ideal utilizan la dosis con toxicidad limitante (DLT) y
la dosis máxima tolerada (MTD). Más recientemente,
el desarrollo de terapias diana y agentes moduladores
de inmunidad han llevado a la revisión de estos conceptos y la adopción
de métodos de evaluación más
sofisticados (19).
Tipos de quimioterapia
Los agentes utilizados en quimioterapia se clasifican
en varios grupos farmacológicos de acuerdo con su
estructura, mecanismo de acción, y metabolismo. La
clasificación de Goodman y Gilman es ampliamente
reconocida y ha servido de referencia a generaciones
de médicos y oncólogos durante varias décadas (20).
Esta clasificación agrupa los diferentes agentes en cinco grandes
categorias:
- Agentes Alquilantes.
- Antimetabolitos.
- Productos Naturales
- Hormonas y Agonistas.
- Agentes Misceláneos.
Los diferentes grupos, agentes más representativos,
mecanismo de acción, metabolismo y principales toxicidades están
resumidos en la
tabla 1. Esta
tabla no
incluye inhibidores de tirosín kinasas (terapias diana)
ni inmunoterapia, por cuanto estos agentes no son normalmente
considerados agentes citotóxicos.
Aunque en realidad desde un principio todos los agentes de uno u otro
modo han sido “
terapias diana”
debido a la capacidad de inhibir o afectar alguna estructura
crítica para el funcionamiento de células malignas, dicho término se
acuñó a partir de 2001, con la aprobación del Imatinib Mesylate
(Gleevec, Glivec). Este
nuevo grupo de agentes, conocidos también como inhibidores de las
tirosín kinasas o terapias dirigidas, fue
desarrollado para bloquear, inhibir, o modificar estructuras celulares
críticas idealmente únicas a células con
comportamiento biológico maligno. El Imatinib fue
diseñado para inhibir la proteína de la kinasa de tirosina de bcr-abl
creada por la translocación cromosómica conocida como el cromosoma
Filadelfia y responsable
de la transformación oncológica en la leucemia mieloide crónica.
Gleevec también inhibe c-Kit, el cual se
encuentra mutado en pacientes con el tumor estromal
gastrointestinal (GIST), y controla esta enfermedad en
un número considerable de pacientes (21).
Respuesta tumoral a la quimioterapia
Siempre ha sido conocido que el cáncer era el resultado de división
celular descontrolada. De manera
lógica, se infería que los agentes para tratar la enfermedad debían
tener la capacidad de destruir los mecanismos de mitosis celular. Fue
así como, desde un
principio, la quimioterapia fue desarrollada a partir de
observaciones que confirmaban su toxicidad en tejidos
humanos o se sintetizaban a partir de compuestos con
la capacidad para destruir células en diferentes fases de
proliferación (22, 23). Los tratamientos generalmente
están diseñados para destruir masas tumorales y erradicar todas las
células tumorales. A veces, este plan
es exitoso y se alcanza la cura; pero frecuentemente,
los tumores disminuyen de tamaño y crecen de nuevo
tornándose resistentes al tratamiento original.
La resistencia tumoral es un proceso biológico complejo responsable de
las respuestas tumorales que observamos después de la exposición a
agentes citotóxicos (
Figura 1).
El ejemplo representado en la figura
1 demuestra un tumor expuesto a seis ciclos de quimioterapia. Las
letras A-D corresponden a diferentes
tiempos del tratamiento y la transición de clones de
color amarillo a verde en el tumor, y el crecimiento
celular asociado, reflejan respuestas comúnmente observadas en la
consulta oncológica. En este caso en
particular, cabe preguntarnos si el tratamiento administrado destruyó
clones tumorales sensibles dejando
intactos aquellos clones resistentes a la quimioterapia,
y que esos clones resistentes continuaron creciendo
de manera exponencial durante el tratamiento (Hipótesis de
Goldie-Coldman) (24), o si por el contrario,
la progresión en el tamaño y número de esos implantes tumorales es el
resultado de resistencia adquirida
asociada a mutaciones tumorales que surgieron como
respuesta a los agentes tóxicos administrados durante
el tratamiento (
resistencia inducida)
(25). Esta última,
relacionada con flujo celular de drogas, persistencia de
células madre cancerígenas (CSCs), transición epitelial-mesenquimal
(EMT), y disminución de apoptosis.
La adquisición de resistencia a drogas también está
mediada por mutaciones, cambios en la expresión de
genes, ajustes alternativos en el RNA, etc.
Estas observaciones iniciales llevaron al desarrollo del
modelo de Skipper-Schabel-Wilcox mediante el cual
se postulaba que “una dosis determinada de un agente determinado debía
destruir aproximadamente la
misma fracción, más no el mismo número de tumores
de tamaño diferente, siempre y cuando se utilizara la
misma exposición a la droga, y la fracción de crecimiento y la
proporción de poblaciones celulares con
fenotipo resistente fueran iguales” (26). A su vez, este
modelo dió nacimiento a la hipótesis de muerte celular
exponencial (Log-Kill) mediante la cual se postulaba
que si la duplicación celular es constante, el tiempo (x)
que toma un tumor en crecer de 1.000 células a 10.000
células es igual al tiempo que toma para crecer de 10
millones a 100 millones de células (22). Basándose en
el modelo de crecimiento celular Gompertziano en
el cual, a medida que la masa celular crece, aumenta
por una disminución constante de la proporción de su
tamaño por una unidad de tiempo determinada (27),
Larry Norton y Richard Simon desarrollaron la hipótesis de Norton y
Simon, la cual postula que las células
tumorales son destruidas por quimioterapia a una tasa
directamente proporcional a la tasa de crecimiento celular al principio
del tratamiento (28). Estos conceptos
fundamentales de crecimiento celular han dado origen
a través de los años a conceptos de gran importancia
clínica como el uso secuencial de agentes de quimioterapia, y los
esquemas de dosis densas en linfoma y
seno (29, 30). Una excelente fuente de consulta para este tema se
encuentra en esta dirección electrónica de
la Librería Nacional de Medicina:
https://www.ncbi.nlm.nih.gov/books/NBK20771/
La predicción y caracterización de estas respuestas y
procesos biológicos se hace más compleja por fenómenos como la
heterogeneidad tumoral que a su vez
dificulta el desarrollo e interpretación de modelos
matemáticos de crecimiento y migración celular. Desde el punto de vista
clínico, estas observaciones han
sido aplicadas estadísticamente bajo diferentes figuras
como “tiempo para progresión (TTP)”, “duración de
la respuesta (DOR)” o “sobrevida libre de progresión
(PFS)” para evaluar la eficacia de agentes quimioterapéuticos (31).
Es también común observar tumores del mismo tipo
histológico sustancialmente más sensibles que otros
expuestos al mismo agente durante el mismo periodo
de tiempo. Estos diferentes fenómenos de respuesta tumoral tienen una
variable común:
sensibilidad tumoral.
En este aspecto, es también pertinente e importante
anotar que la primera línea de tratamiento es generalmente aceptada
como la más eficaz y que las líneas
subsecuentes son en general consideradas paliativas y
asociadas a menor eficacia. Esta observación y dogma
de manejo clínico nos reitera la presencia de resistencia
tumoral, ya sea adquirida o existente y nos debe invitar
a reflexionar y planear el siguiente agente para tratar
la enfermedad.
Otro aspecto importante para tener en cuenta durante
el uso de combinaciones de quimioterapia es la proyección de la
respuesta tumoral basada en la toxicidad
acumulada y la muerte celular medida por medio de
estudios radiográficos (CT, MRI), metabólicos (PET/
CT), o bioquímicos (marcadores tumorales) (
Figura
2). En este sentido, la respuesta tumoral radiográfica y
metabólica temprana ya ha sido reconocida como un
factor predictivo importante de sobrevida en pacientes
con linfoma Hodgkin y no Hodgkin (32). Es probable
que este principio también aplique a otros subtipos histológicos.
Sabemos también que el tratamiento con agentes individuales es
generalmente utilizado para el cuidado
paliativo de pacientes con estado funcional pobre y a
quienes un perfil de toxicidad bajo conlleva a una mejor calidad de
vida, pero pocas probabilidades de grandes respuestas tumorales.
Alternativamente, las combinaciones de compuestos generalmente resultan
en
mayores respuestas antitumorales y mayor índice de
curabilidad, pero desde luego, también están asociadas a mayor
toxicidad. De esta manera, en el arte de
la administración de quimioterapia, a veces se utilizan
terapias combinadas para inducir una mayor respuesta
y recuperar la función de algún órgano en particular,
pero de manera similar, frecuentemente utilizamos
regímenes con agentes únicos dirigidos a prestar una
función paliativa y menos tóxica para el huésped.
En términos generales, la resistencia a agentes de quimioterapia está
mediada por dos procesos generales:
farmacoquinético (alteración de la exposición celular
intracelular), o farmacodinámico (p.e. inhabilidad para
inducir citotoxicidad). Infortunadamente, muchas veces la resistencia a
agentes específicos es mixta y resulta de diferentes mecanismos de
resistencia (
Tabla
2). Diferentes grupos de investigación exploran estos
diversos mecanismos y buscan terapias para reducir el
desarrollo de resistencia a la quimioterapia.
Futuro de la quimioterapia
La aplicación de modernos avances tecnológicos a
los agentes existentes ha resultado en el desarrollo de
nuevos agentes quimioterapéuticos. Quizás uno de los
ejemplos más exitosos es el nab-paclitaxel (nanoparticle albumin-bound
paclitaxel). Este compuesto es una
formulación de paclitaxel libre de solventes. El paclitaxel requiere
del uso de solventes como CremphorEL en su preparación, el cual está
asociado a algunas de sus toxicidades.
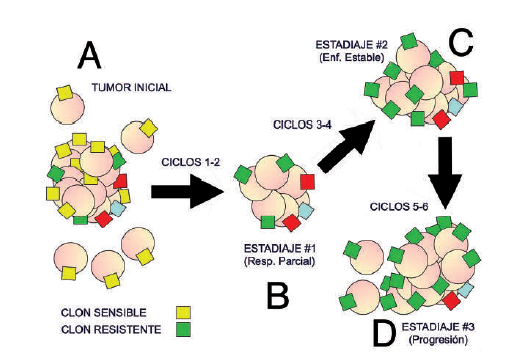
Figura 1. Esta figura ejemplifica la respuesta tumoral en un
paciente tratado con quimioterapia citotóxica. A.
Tamaño tumoral en los estudios imagenológicos de base. El tamaño
disminuye considerablemente en las imágenes
obtenidas después de 1-2 ciclos de tratamiento. B. Tamaño tumoral
después de tratamiento con quimioterapia
eficaz para destruir los clones sensibles (amarillos). C. Tamaño
tumoral después de 4 ciclos de terapia. Nótese el
incremento celular consistente mayormente por clones resistentes
(verde). Sin embargo, los estudios de estadiaje
reflejan enfemedad estable y el tratamiento no se modifica. D. El tumor
resultante está conformado mayormente
por células de clones resistentes a la quimioterapia seleccionada y las
imágenes nos confirman progresión de la
enfermedad en uno o varios órganos diferentes.
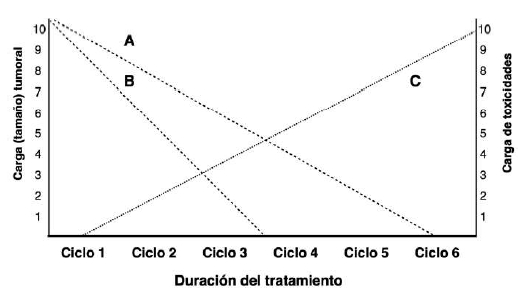
Figura 2. La duración del tratamiento (eje X) se encuentra limitada
por las variables de los ejes Y (Tamaño tumoral y
toxicidad acumulada). A. El área dentro de la curva A demuestra la
rapidez e intensidad de destrucción tumoral para
alcanzar respuesta completa al tratamiento. B. Muestra destrucción
tumoral del 100% después de completar tres
ciclos de terapia. Los ciclos 4-6 servirían para consolidar la
respuesta tumoral en este ejemplo. La línea C sugiere
acumulación linear de toxicidades a medida que progresa el tratamiento.
En esta figura, el área por encima de la
línea A coincide son toxicidad inaceptable y la necesidad de un cambio
en el tratamiento.
Tabla 1. Agentes de Quimioterapia, Mecanismo de acción,
Metabolismo, y Toxicidades más comunes
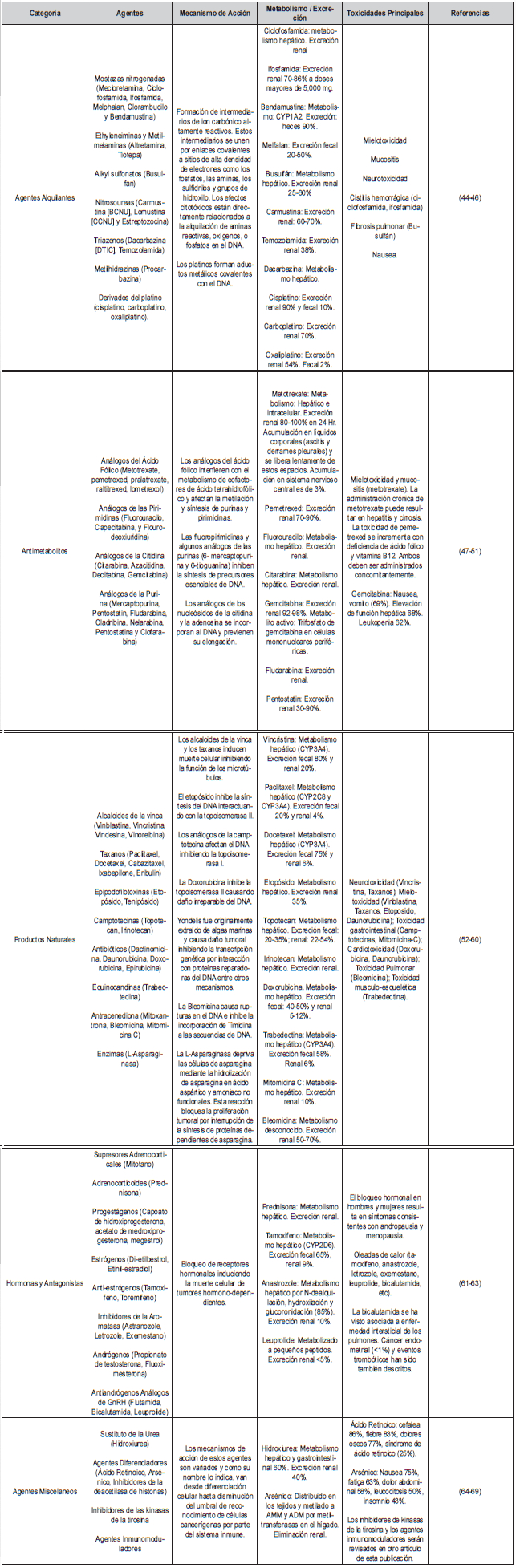
Modificada de Goodman & Gilman: La base farmacológica de la
terapia(20).
Tabla 2. Mecanismos mediadores de resistencia quimioterapia

Adaptado de Mellor H.R. y Callaghan R: Resistance to Chemotherapy
in Cancer: A Complex and Integrated Cellular Response.
Pharmacology 2008;81:275-300(70)
La nueva formulación es preparada
formando una suspensión coloidal de nanopartículas
por homogenización del paclitaxel a alta presión en
presencia de albúmina sérica. El Nab-paclitaxel tiene
varias ventajas prácticas sobre el Cremphor-EL-paclitaxel incluyendo
una infusión más corta (30 minutos)
y la no necesidad de premedicación. El Nab-paclitaxel
utiliza los mecanismos de transporte de la albúmina
endógena para concentrar el agente dentro del tumor
(33). Su eficacia y perfil de toxicidades le valió la aprobación por la
FDA para pacientes con cáncer de seno,
pulmón y páncreas.
La capacidad de las terapias citotóxicas para inducir
respuestas significativas cuando se administran en
combinación con otras formas de tratamiento como la
radioterapia, los agentes inmuno-moduladores (34), y
las terapias diana (35) ha sido demostrada en diferentes estudios y ha
llevado a posicionar estos regímenes
como tratamiento estándar en cáncer de pulmón (36-
39), linfoma (40-42), seno (43), y muchos otros en las
últimas décadas.
Las mutaciones genómicas críticas y responsables del
comportamiento maligno de la mayoría de los clones
celulares de un tumor se limitan a menos de un 15%
en el común de las neoplasias sólidas. Por ello, aunque
las terapias dirigidas y la inmunoterapia son eficaces
en un alto número de pacientes, su combinación con
quimioterapia es todavía necesaria en la mayoría de
pacientes.
Es muy probable que la heterogeneidad tumoral presente en la gran
mayoría de tumores obligue a seguir
utilizando terapias combinadas encaminadas a desactivar y destruir
diferentes mecanismos de crecimiento e
invasión celular tumoral. Finalmente, la combinación
de diferentes formas de tratamiento (neo-adyuvante,
adyuvante, y diferentes líneas de terapia para enfermedad sistémica) va
a continuar mejorando la sobrevida
de pacientes con cáncer en el siglo XXI y convertir el
cáncer en una dolencia crónica similar a otras tantas
que enfrentamos a diario.
Referencias
1. Long PH. Paul Ehrlich and modern
chemotherapy. Bull
N Y Acad Med. 1952;28(5):344-6.
2. Lectures N. Paul Ehrlich –
Biographical. NobelMedia
AB 20201967; 2020 [consultado 09 septiembre 2020].
Disponible en:
https://www.nobelprize.org/prizes/medicine/1908/ehrlich/biographical/.
3. Thorburn AL. Paul Ehrlich: pioneer
of chemotherapy and cure by arsenic (1854-1915). Br J Vener Dis.
1983;59(6):404-5.
4. Pechura CM. From the Institute of
Medicine. JAMA.
1993;269(4):453.
5. Wilke C. From Chemical Weapon to
Chemotherapy,
1917–1946 The Scientist. 2019 [consultado 22 septiembre 2020].
Disponible en:
https://www.the-scientist.com/foundations/from-chemical-weapon-to-chemotherapy--19171946-65655.
6. Goodman LS, Wintrobe MM, Dameshek
W, Goodman
MJ, Gilman A, McLennan MT. Nitrogen mustard therapy. Use of
methyl-bis(beta-chloroethyl)amine hydrochloride and
tris(beta-chloroethyl)amine hydrochloride for Hodgkin's disease,
lymphosarcoma, leukemia
and certain allied and miscellaneous disorders. JAMA.
1984;251(17):2255-61.
7. DeVita VT, Jr., Chu E. A history
of cancer chemotherapy.
Cancer Res. 2008;68(21):8643-53.
8. Gellhorn A, Jones LO. Chemotherapy
of malignant disease. Am J Med. 1949;6(2):188-231.
9. Schepartz SA. Historical overview
of the National Cancer Institute Fermentation Program. Recent Results
Cancer Res. 1978;63:30-2.
10. Li MC. Current status of cancer
chemotherapy. J Natl
Med Assoc. 1960;52(5):315-20.
11. Li MC, Whitmore WF, Jr., Golbey
R, Grabstald H. Effects
of combined drug therapy on metastatic cancer of the
testis. JAMA. 1960;174:1291-9.
12. Devita VT, Jr., Serpick AA,
Carbone PP. Combination
chemotherapy in the treatment of advanced Hodgkin's
disease. Ann Intern Med. 1970;73(6):881-95.
13. FDA. Approval for Imatinib
Mesylate for the treatment of
patients with chronic myelogenous leukemia after therapy with
interferon. FDA.gov. 2001 [consultado 19 octubre 2020]. Disponible en: https://www.accessdata.fda.
gov/drugsatfda_docs/nda/2001/21335_Gleevec.cfm.
14. Benitez JC, Remon J, Besse B.
Current Panorama and
Challenges for Neoadjuvant Cancer Immunotherapy.
Clin Cancer Res. 2020;26(19):5068-77.
15. Higby DJ, Wallace HJ, Jr.,
Holland JF. Cis-diamminedichloroplatinum (NSC-119875): a phase I study.
Cancer
Chemother Rep. 1973;57(4):459-63.
16. FDA. Approval package for
gemcitabine hydrochloride
- Center for Drug Evaluation and Research accessdata.
fda.gov.1996 [consultado 4 octubre 2020 ]. Disponible
en:
https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=020509.
17. FDA. Azacitidine approval -
Center for Drug Evaluation
and Research access.fda.gov. 2004 [consultado 04 octubre 2020].
Disponible en: https://www.accessdata.fda.
gov/drugsatfda_docs/nda/2004/50-794_Vidaza_Prntlbl.
pdf.
18. Fili C, Malagola M, Follo MY,
Finelli C, Lacobucci I, Martinelli G et al. Prospective phase II Study
on 5-days azacitidine for treatment of symptomatic and/or
erythropoietin
unresponsive patients with low/INT-1-risk myelodysplastic syndromes.
Clin Cancer Res. 2013;19(12):3297-308.
19. Takimoto CH. Maximum tolerated
dose: clinical endpoint
for a bygone era? Target Oncol. 2009;4(2):143-7.
20. Goodman AL, Gilman A. Goodman
& Gilman’s The
Pharmacological Basis of Therapeutics. 12a ed. Brunton L, Chabner B,
Knollman B, editors; 2011.
21. Heinrich MC, Blanke CD, Druker
BJ, Corless CL. Inhibition of KIT tyrosine kinase activity: a novel
molecular
approach to the treatment of KIT-positive malignancies.
J Clin Oncol. 2002;20(6):1692-703.
22. Norton L. Cancer log-kill
revisited. Am Soc Clin Oncol
Educ Book. 2014:3-7.
23. Hansen E, Read AF. Cancer
therapy: Attempt cure or
manage drug resistance? Evol Appl. 2020;13(7):1660-
72.
24. Chen JH, Kuo YH, Luh HP. Optimal
policies of noncross-resistant chemotherapy on Goldie and Coldman's
cancer model. Math Biosci. 2013;245(2):282-98.
25. Aleksakhina SN, Kashyap A,
Imyanitov . Mechanisms of
acquired tumor drug resistance. Biochim Biophys Acta
Rev Cancer. 2019;1872(2):188310.
26. Surbone A, Norton L. Kinetics of
breast neoplasms. Minerva Med. 1994;85(1-2):7-16.
27. Norton L, Simon R, Brereton HD,
Bogden AE. Predicting the course of Gompertzian growth. Nature.
1976;264(5586):542-5.
28. Norton L, Simon R. The
Norton-Simon hypothesis revisited. Cancer Treat Rep. 1986;70(1):163-9.
29. Untch M, Bergh J, Citron M, Hudis
CA, Huober J, Mobus V et al. Dose-Dense Therapy. Breast Care (Basel).
2008;3(2):134-8.
30. Hudis CA, Schmitz N. Dose-dense
chemotherapy in
breast cancer and lymphoma. Semin Oncol. 2004;31(3
Suppl 8):19-26.
31. Saad ED, Katz A. Progression-free
survival and time to
progression as primary end points in advanced breast
cancer: often used, sometimes loosely defined. Ann Oncol.
2009;20(3):460-4.
32. Querellou S, Valette F,
Bodet-Milin C, Oudoux A, Carlier
T, Harousseau JL et al. FDG-PET/CT predicts outcome
in patients with aggressive non-Hodgkin's lymphoma
and Hodgkin's disease. Ann Hematol. 2006;85(11):759-
67.
33. Miele E, Spinelli GP, Miele E,
Tomao F, Tomao S. Albumin-bound formulation of paclitaxel (Abraxane
ABI-007)
in the treatment of breast cancer. Int J Nanomedicine.
2009;4:99-105.
34. Garon EB, Rizvi NA, Hui R, Leighl
N, Balmanoukian AS,
Eder JP et al. Pembrolizumab for the treatment of nonsmall-cell lung
cancer. N Engl J Med. 2015;372(21):2018-
28.
35. Hurwitz H, Fehrenbacher L,
Novotny W, Cartwright T,
Hainsworth J, Heim W et al. Bevacizumab plus irinotecan, fluorouracil,
and leucovorin for metastatic colorectal
cancer. N Engl J Med. 2004;350(23):2335-42.
36. West H, McCleod M, Hussein M,
Morabito A, Rittmeyer
A, Conter HJ et al. Atezolizumab in combination with
carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy
alone as first-line treatment for Nacimiento dmetastatic non-squamous
non-small-cell lung cancer
(IMpower130): a multicentre, randomised, open-label,
phase 3 trial. Lancet Oncol. 2019;20(7):924-37.
37. Paz-Ares L, Luft A, Vicente D,
Tafreshi A, Gumus M,
Mazieres J et al. Pembrolizumab plus Chemotherapy for
Squamous Non-Small-Cell Lung Cancer. N Engl J Med.
2018;379(21):2040-51.
38. Gandhi L, Rodriguez-Abreu D,
Gadgeel S, Esteban E,
Felip E, De Angelis F et al. Pembrolizumab plus Chemotherapy in
Metastatic Non-Small-Cell Lung Cancer. N
Engl J Med. 2018;378(22):2078-92.
39. Garon EB, Ciuleanu TE, Arrieta O,
Prabhash K, Syrigos
KN, Goksel T et al. Ramucirumab plus docetaxel versus placebo plus
docetaxel for second-line treatment of
stage IV non-small-cell lung cancer after disease progression on
platinum-based therapy (REVEL): a multicentre, double-blind, randomised
phase 3 trial. Lancet.
2014;384(9944):665-73.
40. Ogura M, Ando K, Taniwaki M,
Watanabe T, Uchida T,
Ohmachi K et al. Feasibility and pharmacokinetic study of bendamustine
hydrochloride in combination with
rituximab in relapsed or refractory aggressive B cell nonHodgkin's
lymphoma. Cancer Sci. 2011;102(9):1687-92.
41. Martino R, Perea G, Caballero MD,
Mateos MV, Ribera
JM, de Oteyza JP et al. Cyclophosphamide, pegylated
liposomal doxorubicin (Caelyx), vincristine and prednisone (CCOP) in
elderly patients with diffuse large B-cell
lymphoma: results from a prospective phase II study.
Haematologica. 2002;87(8):822-7.
42. Zinzani PL, Santoro A, Gritti G,
Brice P, Barr PM, Kuruvilla J et al. Nivolumab Combined With
Brentuximab Vedotin for Relapsed/Refractory Primary Mediastinal Large
B-Cell Lymphoma: Efficacy and Safety From the Phase II
CheckMate 436 Study. J Clin Oncol. 2019;37(33):3081-
9.
43. Slamon D, Eiermann W, Robert N,
Pienkowski T, Martin
M, Press M et al. Adjuvant trastuzumab in HER2-positive
breast cancer. N Engl J Med. 2011;365(14):1273-83.
44. Wheeler GP. Studies related to
the mechanisms of action of cytotoxic alkylating agents: a review.
Cancer Res.
1962;22:651-88.
45. Emadi A, Jones RJ, Brodsky RA.
Cyclophosphamide
and cancer: golden anniversary. Nat Rev Clin Oncol.
2009;6(11):638-47.
46. Reedijk J, Lohman PH. Cisplatin:
synthesis, antitumour
activity and mechanism of action. Pharm Weekbl Sci.
1985;7(5):173-80.
47. White JC. Recent concepts on the
mechanism of action
of methotrexate. Cancer Treat Rep. 1981;65 Suppl 1:3-
12.
48. Parker WB, Cheng YC. Metabolism
and mechanism of
action of 5-fluorouracil. Pharmacol Ther. 1990;48(3):381-
95.
49. Maslak P, Chanel S, Camacho LH,
Soignet S, Pandolfi
PP, Guernah I et al. Pilot study of combination transcriptional
modulation therapy with sodium phenylbutyrate and
5-azacytidine in patients with acute myeloid leukemia or
myelodysplastic syndrome. Leukemia. 2006; 20(2):212-7.
50. Robak T, Lech-Maranda E, Korycka
A, Robak E. Purine
nucleoside analogs as immunosuppressive and antineoplastic agents:
mechanism of action and clinical activity.
Curr Med Chem. 2006;13(26):3165-89.
51. Raymond E, Faivre S, Woynarowski
JM, Chaney SG.
Oxaliplatin: mechanism of action and antineoplastic activity. Semin
Oncol. 1998;25(2 Suppl 5):4-12.
52. Liu LF, Desai SD, Li TK, Mao Y,
Sun M, Sim SP. Mechanism of action of camptothecin. Ann N Y Acad Sci.
2000;922:1-10.
53. Sartiano GP, Lynch WE, Bullington
WD. Mechanism
of action of the anthracycline anti-tumor antibiotics,
doxorubicin, daunomycin and rubidazone: preferential
inhibition of DNA polymerase alpha. J Antibiot (Tokyo).
1979;32(10):1038-45.
54. Martinez-Serra J, Maffiotte E,
Martin J, Bex T, NavarroPalou M, Ros T et al. Yondelis(R) (ET-743,
Trabectedin)
sensitizes cancer cell lines to CD95-mediated cell death:
new molecular insight into the mechanism of action. Eur
J Pharmacol. 2011;658(2-3):57-64.
55. van Maanen JM, Retel J, de Vries
J, Pinedo HM. Mechanism of action of antitumor drug etoposide: a
review. J
Natl Cancer Inst. 1988;80(19):1526-33.
56. Dorr RT. Bleomycin pharmacology:
mechanism of action
and resistance, and clinical pharmacokinetics. Semin
Oncol. 1992;19(2 Suppl 5):3-8.
57. Larsen AK, Galmarini CM,
D'Incalci M. Unique features
of trabectedin mechanism of action. Cancer Chemother
Pharmacol. 2016;77(4):663-71.
58. Muller WE, Zahn RK. Bleomycin, an
antibiotic that removes thymine from double-stranded DNA. Prog Nucleic
Acid Res Mol Biol. 1977;20:21-57.
59. Kumar K, Kaur J, Walia S, Pathak
T, Aggarwal D. Lasparaginase: an effective agent in the treatment
of acute lymphoblastic leukemia. Leuk Lymphoma.
2014;55(2):256-62.
60. Pagliardi GL, Gabutti V, Gavosto
F. Mechanism of action of L-asparaginase on the cell cycle and growth
in acute lymphoblastic leukemia. Acta Haematol.
1973;50(5):257-68.
61. Lipov EG, Joshi JR, Sanders S. A
new mechanism of
action for tamoxifen. Lancet Oncol. 2009;10(6):542.
62. Miller WR. Aromatase inhibitors:
mechanism of action
and role in the treatment of breast cancer. Semin Oncol.
2003;30(4 Suppl 14):3-11.
63. Furr BJ, Tucker H. The
preclinical development of bicalutamide: pharmacodynamics and mechanism
of action.
Urology. 1996;47(1A Suppl):13-25; discussion 9-32.
64. Camacho LH, Soignet SL, Chanel S,
Ho R, Heller G,
Scheinberg DA et al. Leukocytosis and the retinoic
acid syndrome in patients with acute promyelocytic
leukemia treated with arsenic trioxide. J Clin Oncol.
2000;18(13):2620-5.
65. Camacho LH. Clinical applications
of retinoids in cancer
medicine. J Biol Regul Homeost Agents. 2003;17(1):98-
114.
66. Camacho LH. CTLA-4 blockade with
ipilimumab: biology, safety, efficacy, and future considerations.
Cancer
Med. 2015;4(5):661-72.
67. Camacho LH. Novel therapies
targeting the immune system: CTLA4 blockade with tremelimumab
(CP-675,206),
a fully human monoclonal antibody. Expert Opin Investig
Drugs. 2008;17(3):371-85.
68. Brahmer JR, Tykodi SS, Chow LQ,
Hwu WJ, Topalian
SL, Hwu P, et al. Safety and activity of anti-PD-L1 antibody in
patients with advanced cancer. N Engl J Med.
2012;366(26):2455-65.
69. Yarbro JW. Mechanism of action of
hydroxyurea. Semin
Oncol. 1992;19(3 Suppl 9):1-10.
70. Mellor HR, Callaghan R.
Resistance to chemotherapy
in cancer: a complex and integrated cellular response.
Pharmacology. 2008;81(4):275-300.
Recibido:
Diciembre 16, 2020
Aprobado: Diciembre 17, 2020
Correspondencia:
Luis H. Camacho
lhcamacho@cobd.us






