Resumen
Frente al panorama creciente de contagios y con restricciones tanto
financieras como logísticas para el acceso oportuno a las vacunas
disponibles para la COVID-19, ¿valdría la pena, desde el
costo-beneficio como
de la selección de candidatos, evaluar la inmunidad individual contra
SARS-CoV-2 para la optimización y
priorización de la vacunación en países con dichas restricciones?
Basados en la respuesta inmune al SARSCoV-2, los antecedentes
históricos y las condiciones del país, se presentan argumentos para la
discusión
de la evaluación individual de la inmunidad al SARS-CoV-2 en la
estrategia de vacunación. Si tal fuese el
escenario, la implementación de una prueba costo efectiva y
reproducible debería ser discutida y un estudio
piloto considerado, el cual podría ser también útil en la evaluación de
la inmunogenicidad de las vacunas
Palabras clave: COVID-19; SARS-CoV-2; Vacunas; inmunidad;
anticuerpos; costo-efectividad; política pública.
IMMUNITY AND VACCINATION AGAINST COVID-19
Abstract
Given the spread of infection and the fi nancial and logistical
constraints regarding timely access to
the vaccines available for COVID-19, would it be worthwhile, from both
a cost-benefi t and candidate
selection standpoint, to evaluate individual SARS-CoV-2 immunity for
optimizing and prioritizing vaccination in countries with such
restrictions? Based on the immune response to SARS-CoV-2, historical
background and country conditions, arguments are presented to discuss
individual assessment of immunity to SARS-CoV-2 as part of the National
COVID-19 Vaccine Program. If this were the scenario,
the implementation of a cost-eff ective and reproducible test should be
discussed and a pilot study
considered, this could also be useful in the evaluation of the
immunogenicity of the vaccines.
Keywords: COVID-19; SARS-CoV-2; Vaccines; immunity;
antibodies; cost-eff ectiveness; public policy

¹ Centro de Estudio de Enfermedades Autoinmunes (CREA),
Escuela de Medicina y Ciencias de la Salud, Universidad del Rosario,
Bogotá, Colombia.
² Grupo de Ciencias Básicas Médicas, Facultad de Medicina,
Universidad de los Andes,
Bogotá, Colombia.
³ Facultad Ciencias de la
Salud. Grupo de Investigación en Inmunología y Patología, Universidad
del Magdalena, Santa Marta, Colombia.
⁴ Facultad de Medicina,
Universidad de Antioquia, Medellín, Colombia.
⁵ Corporación Colombiana
de Investigación Agropecuaria (AGROSAVIA), Mosquera, Colombia.
⁶ Escuela de Medicina y
Ciencias de la Salud, Universidad del Rosario, Bogotá, Colombia.
⁷ Consultor privado,
Bogotá, Colombia.
Introducción
La historia natural de la COVID-19, enfermedad
causada por el SARS-CoV-2, comienza a conocerse
gracias a la investigación científica. No todos los pacientes que se
infectan desarrollan la enfermedad. Un
porcentaje variable de la población infectada, pero
que corresponde a la mayoría, es asintomático o presenta síntomas
leves. En los demás infectados, 15% al
30%, la enfermedad puede ser severa o crítica.
Frente al panorama creciente de contagios, con restricciones tanto
financieras como logísticas para el acceso a las vacunas recientemente
disponibles, ¿valdría
la pena, desde el costo-beneficio como de la selección
de candidatos, evaluar la inmunidad individual contra
SARS-CoV-2 para la optimización y priorización de la
vacunación en países con dichas restricciones?
El Plan Nacional de Vacunación COVID-19 en Colombia recomienda no
incluir a personas con antecedente de COVID-19 en la fase 1 (1); sin
embargo, no
se considera la valoración de la inmunidad humoral, la
cual podría permitir seleccionar mejor los candidatos y
contribuir a optimizar las dosis, más aún cuando el número de contagios
es impreciso, por testeo insuficiente,
subregistro y rezago; y dado que los resultados de los
estudios de seroprevalencia no son útiles en situaciones individuales.
En el presente artículo presentamos
argumentos para la discusión acerca de la importancia
de la evaluación individual de la inmunidad humoral
al SARS-CoV-2 en la campaña de vacunación.
Respuesta inmune al SARS-CoV-2
El virus SARS-CoV-2 induce una respuesta inmune
celular, anticuerpos específicos y memoria inmunológica (2,3). La
respuesta inmune humoral contra
SARS-CoV-2 está dirigida principalmente contra
las proteínas S y N (abreviado respectivamente de
“spike” y nucleocápside) del virus (4). Esta respuesta
de anticuerpos varía entre individuos y según la gravedad de la
enfermedad (5). Grzelak y col. (6) observaron en pacientes
hospitalizados con COVID-19
una seroconversión y anticuerpos neutralizantes, que
se unen al virus e interfieren con su capacidad de infectar células,
entre 5 y 14 días después del inicio de
los síntomas. Los niveles de anticuerpos IgG contra
la proteína S se correlacionan con niveles de los anticuerpos
neutralizantes (5).
Dado el corto tiempo trascurrido desde la aparición
de la COVID-19 y con la evidencia disponible, no hay
certeza sobre la duración de la respuesta inmune contra el SARS-CoV-2.
En el estudio de Wang y col. (7)
los anticuerpos neutralizantes fueron bajos durante
los primeros 7 a 10 días después del inicio de los síntomas y
aumentaron posteriormente.
La respuesta humoral se acompaña de una respuesta
celular. Dan y col. (3) observaron que los anticuerpos IgG contra a la
proteína S fueron relativamente
estables durante más de 6 meses, y que las células B
de memoria específicas de la proteína S fueron más
abundantes a los 6 meses que al mes después de la
aparición de los síntomas. Los linfocitos T CD4+ específicos del
SARS-CoV-2 y los T CD8+ disminuyeron con una vida media de 3-5 meses.
Las cinéticas
de anticuerpos, células B de memoria, linfocitos T
CD4+ y T CD8+ para el SARS-CoV-2 fueron diferentes (3).
De la misma manera que no hay certeza con respecto a la duración de la
inmunidad natural, no la
hay sobre la duración de la inmunidad adquirida por
vacunación. Sin este conocimiento, el cálculo de la
inmunidad colectiva podría ser impreciso. De otra
parte, dada la diversidad de los métodos utilizados
en los estudios de seroprevalencia y la ausencia de
uno universal para la detección de anticuerpos contra
SARS-CoV-2, la comparación de los resultados es difícil e inexacta.
Métodos de detección de anticuerpos
Hay dos tipos generales de pruebas de anticuerpos:
aquellas que detectan anticuerpos de unión y aquellas
que detectan anticuerpos neutralizantes. Las primeras usan proteínas
purificadas de SARS-CoV-2 para
determinar la unión de anticuerpos, en alguna de las
siguientes plataformas: ensayo inmunocromatográfico a base de oro
coloidal (también conocido como
inmunoensayo de flujo lateral), inmunoensayo quimioluminiscente (CLIA),
y ensayo inmunoabsorbente
ligado a enzimas (ELISA). Las dos últimas son muy
específicas y permiten la semi-cuantificación de la
respuesta inmune y, en ocasiones, la cuantificación.
Ambas son altamente reproducibles (8). La diferencia
más importante está en la sensibilidad, las técnicas luminométricas
(CLIA) son más sensibles. Las pruebas
para detección de anticuerpos neutralizantes exigen la
utilización de cultivos celulares en presencia del virus
o, en su defecto, de un pseudovirus (9).
Perspectiva histórica
En algunas enfermedades infecciosas la inmunidad
natural es superior a la de la vacuna (p.ej., sarampión,
varicela y paperas) y en otras ocurre lo contrario (p.ej.,
neumococo, meningococo, virus del papiloma humano) (10). A nivel
individual, la determinación previa
del estado inmunológico frente a un agente infeccioso
es importante para la toma de decisión de vacunarse.
Algunas vacunas generan una respuesta inmune que
puede disminuir con el tiempo requiriendo un refuerzo, el cual es
guiado por el examen de anticuerpos
(p.ej., Hepatitis B) (10). Sin embargo, la medición del
estado inmunológico contra el SARS-CoV-2 podría no
ser una medida apropiada, dado que no se cuenta con
un método universal para la medición de la inmunidad
humoral ni celular. Tampoco existe un antecedente de
vacunación masiva con estudio serológico previo, el
cual podría retrasar el proceso de vacunación.
Análisis de costos
En Colombia, en el 2020, se registraron 1.642.775 personas contagiadas (
https://www.ins.gov.co/Noticias/Paginas/Coronavirus.aspx)
equivalente, aproximadamente, a un 3,4% de los más de 48.3 millones de
habitantes que estima el Departamento Administrativo
Nacional de Estadística (
https://www.dane.gov.co/)
para la población total del país. La tasa de letalidad
fue 2,63%. Así, las necesidades de vacunación total se
acercarían a 46.6 millones de habitantes, descontando
la población infectada (se debería excluir también, por
ahora, la población infantil), y sin tener en cuenta a la
población migrante, que tendría derecho a la vacuna
por principio universal.
Independiente de la vacuna seleccionada, el costo de
vacunar la totalidad de la población colombiana estaría entre 1.86 y
3.73 billones de pesos al incluir los
costos de la vacuna, el costo económico asociado al
ingreso que deja de percibir el trabajado informal y el
costo operativo de la vacunación (11). Este valor asume un esquema
veloz de vacunación y, por lo tanto, no
considera el costo que puede generar una vacunación
pausada en la que un porcentaje de la población continuará
contagiándose. Adicionalmente, hay preocupación sobre la capacidad
estatal para la vacunación en
zonas alejadas de las principales ciudades, donde las
capacidades instaladas y humanas son modestas.
La incapacidad de disponer de dosis oportunas para la
población, de aplicarlas a una velocidad superior a la del
contagio y la posibilidad de vacunar a personas con inmunidad natural,
son razones para considerar las pruebas de anticuerpos como argumento
para la priorización.
En la
Tabla 1 se presentan los
valores de referencia para
el cálculo de la costo- efectividad de una prueba de inmunidad. Con un
20% de inmunidad, se estaría gastando
ineficientemente el equivalente a 9.387.600 vacunas por
las cuales se invertirían recursos por algo más de 2.8 billones de
pesos. Esto quiere decir que, al dividir estos dos valores, el costo
perdido por unidad es de $298.288 pesos
y sería lo máximo que se podría gastar en una prueba
de anticuerpos. El segundo valor de referencia es mayor,
porque considera el costo que se incurre en el tratamiento
de la población mayor. No hay una cifra exacta ante la
ausencia de evidencia sobre la capacidad de los adultos
mayores de generar inmunidad. Asumiendo un nivel de
inmunidad del 70%, el 30% de los adultos podrían generar sobrecostos
por atención adicional. En dicho caso el
valor máximo para una prueba de inmunidad sería de
$509.000 aproximadamente.
Tabla 1. Inmunidad vs. Gasto Ineficiente.
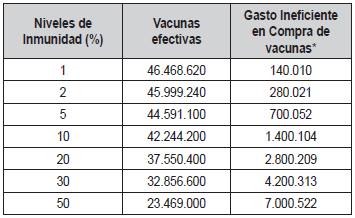
Nota: Cálculos asumiendo tasas de efectividad del 100% para
vacuna Pfizer y 20% de inmunidad.
* En millones de pesos
Los recursos económicos involucrados son muy altos
y los impactos que generan sobre la sociedad justifican
preguntarse no solo por el esquema de priorización
poblacional, sino también por alternativas para hacer
más eficiente este esfuerzo fiscal que el Estado está
asumiendo con cargo a futuros sacrificios en términos
de política pública.
¿Qué es y por qué es importante la
inmunidad de rebaño?
La inmunidad de rebaño (del inglés “
herd
inmunity”) es
también conocida como inmunidad de grupo, colectiva
o comunitaria, y hace referencia a la protección que
adquiere una población contra una enfermedad infecciosa específica. Se
logra cuando se alcanza el umbral
de inmunidad colectiva, es decir, el punto en el cual la
proporción de personas susceptibles es inferior a la necesaria para la
transmisión del agente infeccioso. Para
calcular el umbral hay varios modelos matemáticos,
que incluyen el número reproductivo básico (R₀), que
corresponde al número de personas infectadas por un
individuo en una población totalmente susceptible, lo
cual ocurre al inicio; o el número reproductivo efectivo (R
e),
o número
de infectados por un caso en una
población parcialmente inmune (12), el cual cambia
durante el tiempo en función de las medidas de control
que se aplican. Por lo tanto, el umbral y la inmunidad
colectiva son dinámicos.
La forma adecuada de lograr la inmunidad colectiva es
mediante la vacunación de la población. La inmunidad
colectiva es importante para proteger a las personas que
no pueden vacunarse. Se ha estimado que para generar inmunidad
colectiva es necesario vacunar al 70%
de la población (1,13). Sin embargo, la cifra podría ser
inexacta por la variablidad en los factores que afectan
el cálculo del umbral (R
e
, composición y características
de la población, e inmunidad adquirida) así como por
la posibilidad de reinfección; todo lo cual favorecería la
necesidad de evaluar la inmunidad humoral individual
antes de la vacunación. Recientemente se estimó, en un
modelo matemático, el impacto de la evaluación de la
inmunidad humoral individual en función de la edad de
quienes se vacunarían; y se observó una mejoría en el
beneficio marginal por dosis (14).
¿Qué es la reinfección y qué tan
importante es en el contexto de las
vacunas actuales?
La reinfección se refiere a la posibilidad de volver a sufrir un
proceso infeccioso producido por un agente que
ya produjo un evento previo. En SARS-CoV-2, así como sucede con otros
coronavirus, la reinfección no es la excepción (
https://bnonews.com/index.php/reinfection-tracker-suspected-cases/
). Este es un argumento a favor
de la vacunación generalizada sin necesidad de conocer
el estado inmunológico, siempre y cuando las vacunas
protejan contra las nuevas variantes virales.
La reinfección debe sospecharse cuando se contrae la
enfermedad nuevamente (confirmada mediante prueba diagnóstica), un
tiempo después, generalmente superior a 90 días, de haberse recuperado.
En este caso,
la reinfección debe confirmarse por secuenciamiento y
demostración de nuevas mutaciones. La reinfección es
un factor muy importante a monitorear en enfermedades infecciosas, ya
que es un indicio de disminución de
la respuesta inmune protectora, o de mutaciones.
De lo innato y el medio ambiente
Los factores genéticos, epigenéticos y medioambientales
influyen en el desarrollo de enfermedades trasmisibles y no
trasmisibles. Las características internas de una población
pueden afectar el desarrollo y severidad de una infección.
Esto explica porque un grupo variable de individuos sanos
no desarrolla la enfermedad luego de la exposición a un
microorganismo, o porque hay grupos vulnerables que la
desarrollan de forma más severa que otros.
La influencia de la etnicidad en el riesgo y severidad
de la COVID-19 ha sido observada (15), así como el
efecto del índice de pobreza (16) y de la contaminación del aire
(16,17) en la mortalidad. Las interacciones huésped-patógeno son
vitales para comprender las
enfermedades infecciosas, su tratamiento y prevención. Así como existe
una susceptibilidad poblacional
e individual (“The COVID-19 host genetics initiative”
https://www.covid19hg.org/results/),
considerar la
variación del genoma del SARS-CoV-2 (18) (
www.gisaid.org) contribuirá al conocimiento de la
patogénesis de la COVID-19 y a las estrategias de prevención,
incluyendo la vacunación.
Otro aspecto medioambiental que influye en la respuesta inmune es el
estado nutricional (19), incluyendo los niveles de ciertas vitaminas,
en particular la
vitamina D, cuya deficiencia ha sido asociada con la
severidad de la COVID-19 (20). Estudios que evalúan
su eficacia en la enfermedad se están llevando a cabo.
La relación entre Vitamina D y vacunación contra
COVID-19 no se conoce.
Conclusión
La evaluación individual de la inmunidad al SARSCoV-2 podría contribuir
en la estrategia de optimización y priorización de la vacunación. Si
tal fuese el
escenario, la implementación de un método reproducible y costo-efectivo
debería ser considerada, y una
prueba piloto realizada, la cual, podría ser útil, adicionalmente, para
la evaluación de la inmunogenicidad
de las vacunas y toma de decisiones futuras.
Agradecimientos
Los autores agradecen a todos quienes nos compartieron sus opiniones
durante el desarrollo de este artículo
(
https://twitter.com/JuanMAnayaC/status/1336681065524629507?s=20),
a Gustavo Gámez, de la Universidad de Antioquia, Colombia; y a Jorge
Osorio, de
la Universidad de Wisconsin, E.U.
Conflicto de interés
Los autores declaramos no tener ningún conflicto de
interés. Las opiniones expresadas no corresponden a
posturas institucionales ni oficiales.
Conflicto de interés
Los autores declaramos no tener ningún conflicto de
interés. Las opiniones expresadas no corresponden a
posturas institucionales ni oficiales
Referencias
1. Plan Nacional de Vacunación Contra
el COVID-19 [Internet].2021 [consultado 06 enero 2021]. Disponible en:
https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/VS/pnv-contra-covid-19.pdf
2. Tay MZ, Poh CM, Rénia L, MacAry
PA, Ng LFP. The trinity of COVID-19: immunity, inflammation and
intervention. Nat Rev Immunol. 2020;20:363-74.
3. Dan JM, Mateus J, Kato Y, Hastie
KM, Yu ED, Faliti CE et
al. Immunological memory to SARS-CoV-2 assessed for
up to 8 months after infection. Science. 2021;eabf4063.
4. Shrock E, Fujimura E, Kula T,
Timms RT, Lee IH, Leng
Y et al. Viral epitope profiling of COVID-19 patients reveals
cross-reactivity and correlates of severity. Science.
2020;370:eabd4250.
5. Okba NMA, Müller MA, Li W, Wang C,
GeurtsvanKessel
CH, Corman VM et al. Severe acute respiratory syndrome coronavirus
2-specific antibody responses in coronavirus disease patients. Emerg
Infect Dis. 2020;26:1478-
88.
6. Grzelak L, Temmam S, Planchais C,
Demeret C, Tondeur L, Huon C et al. A comparison of four serological
assays for detecting anti-SARS-CoV-2 antibodies in
human serum samples from different populations. Sci
Transl Med. 2020;12:eabc3103.
7. Wang K, Long QX, Deng HJ, Hu J,
Gao QZ, Zhang
GJ et al. Longitudinal dynamics of the neutralizing antibody response
to SARS-CoV-2 infection. Clin Infect Dis.
2020;ciaa1143.
8. Guo CC, Mi JQ, Nie H.
Seropositivity rate and diagnostic accuracy of serological tests in
2019-nCoV cases: a
pooled analysis of individual studies. Eur Rev Med Pharmacol Sci.
2020;24:10208-10218.
9. Chau CH, Strope JD, Figg WD.
COVID-19 clinical
diagnostics and testing technology. Pharmacotherapy.
2020;40:857-868.
10. Bloom BR, Lambert P-H. The
Vaccine Book, 2a ed. Elsevier, 2016.
11. Inmunidad y vacunación
Suplementario.xlsx [Internet].
Google Docs. 2021 [consultado 06 enero 2021] Disponible en:
https://drive.google.com/file/d/11bxByeahvgnjnUn0TaKCtOaXW8pP76f1/view?usp=drivesdk
12. Randolph HE, Barreiro LB. Herd
Immunity: Uniderstanding COVID-19. Immunity. 2020;52:737-41.
13. Aschwanden C. The false promise
of herd immunity for
COVID-19. Nature. 2020;587(7832):26-8.
14. Bubar KM, Reinholt K, Kissler SM,
Lipsitch M, Cobey
S, Grad YH et al. Model-informed COVID-19 vaccine
prioritization strategies by age and serostatus. medRxiv
2020.09.08.20190629
15. Sze S, Pan D, Nevill CR, Gray LJ,
Martin CA, Nazareth
J et al. Ethnicity and clinical outcomes in COVID-19: A
systematic review and meta-analysis. EClinicalMedicine. 2020;29:100630.
16. Rodriguez-Villamizar LA,
Belalcázar-Ceron LC, Fernández-Niño JA, Marín-Pineda DM, Rojas-Sánchez
OA,
Acuña-Merchán LA et al. Air pollution, sociodemographic and health
conditions effects on COVID-19 mortality in Colombia: An ecological
study. Sci Total Environ.
2020;144020.
17. Pozzer A, Dominici F, Haines A,
Witt C, Münzel T, Lelieveld J. Regional and global contributions of air
pollution to risk of death from COVID-19. Cardiovasc Res.
2020;116(14):2247-2253.
18. Lauring AS, Hodcroft EB. Genetic
Variants of SARSCoV-2-What Do They Mean? JAMA. 2021;.Zimmermann
P, Curtis N. Factors that influence the immune response
to vaccination. Clin Microbiol Rev. 2019;32:e00084-18.
19. Pereira M, Dantas Damascena A,
Galvão Azevedo LM,
de Almeida Oliveira T, da Mota Santana J. Vitamin D deficiency
aggravates COVID-19: systematic review and
meta-analysis. Crit Rev Food Sci Nutr. 2020;:1-9.
Recibido:
Enero 5, 2021
Aprobado: Enero 8, 2021
Correspondencia:
Juan-Manuel Anaya
juan.anaya@urosario.edu.co



