La mejor manera de
predecir el futuro es creándolo.
Peter Drucker
La transición histórica de la contemporaneidad y la
notable expansión social (cambios en los factores de
riesgo) y poblacional, han hecho de los siglos XX y
XXI la era de las enfermedades crónicas no transmisibles. En 1900, un
recién nacido tendría una esperanza
media de vida al nacer próxima a los 35 años. No obstante, para 2010,
la perspectiva vital se había expandido hasta los 82 años en los países
con mayor desarrollo
económico. La dinámica cambiante de la senectud permitirá que cuatro de
cada diez niños nacidos después
del año 2010 alcancen los 100 años de vida (1). En el
pasado, la mayoría de las muertes estaba relacionada
a enfermedades infecciosas como la neumonía, tuberculosis, o patologías
gastrointestinales agudas. En la
actualidad, las causas se concentran en el cáncer y en
la enfermedad cardiovascular. Ahora, la incidencia de
las enfermedades crónicas se reúne en las poblaciones
con ingresos bajos y medios, que soportan el 80% de la
carga global de tales entidades (2).
La Organización de Naciones Unidas (ONU) pronosticó durante el último
cambio de siglo que la población mundial llegaría a 7 mil millones en
2021, y a 8.3
mil millones en 2030 (3). Esta variación ha permitido
prever que para el 2040 el número de casos incidentes
de cáncer alcanzará los 29,5 millones, y las muertes
relacionadas los 16,4 millones cada año. El desarrollo
del cáncer sigue la senda de su humanidad. El crecimiento demográfico
mundial ha permitido modelar
que para el 2030 habrá 41 megaciudades con más de
10 millones de habitantes, hallazgo que conllevará a la
urbanización progresiva y a la modificación de hábitos
plurales que repercutirán en el estilo de vida. Para el
mismo periodo, la atmosfera se calentará 1,5 grados
Celsius disminuyendo los niveles de ozono, aumentando la contaminación
en 35%, generando inundaciones, sequias y aumento de la pobreza,
eventos que
amplificarán el efecto global del cáncer en la humanidad y, la
necesidad de esta para lograr controlarlo
(4). La
Figura 1 muestra la
carga mundial del cáncer,
considerando la incidencia y mortalidad por región
(2012 – 2017).
De forma similar, se ha calculado que en los siguientes
20 años el costo medio del diagnóstico y tratamiento del cáncer se
duplicará globalmente. Para el 2040,
se proyecta que la inversión mensual promedio por
paciente para el tratamiento de primera línea en las
cinco patologías más prevalentes se acercará a los
$ 3.040 USD (costos de bolsillo del paciente), mientras
los seguros (sin importar el país o el formato de aseguramiento)
deberán asumir un monto medio anual
próximo a los $130.000 USD. Siendo así, para mantener la cobertura
global de la enfermedad la inversión
anual superará los 450 billones de dólares (5,6).

¹ Grupo Oncología Clínica y Traslacional, Clínica del
Country. Fundación para la Investigación Clínica y Molecular Aplicada
del
Cáncer (FICMAC). Grupo de Investigación en Oncología Molecular y
Sistemas Biológicos (Fox-G), Universidad El Bosque. Bogotá,
Colombia.
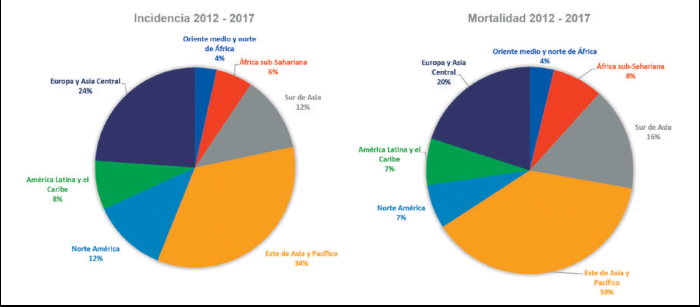
Figura 1. Carga mundial del cáncer, recuento para la distribución
por incidencia y mortalidad según la región
geográfica (datos para hombres y mujeres entre 0 y 70 años). Figura
reproducida y modificada con autorización de
Bray F, Jemal A, Grey N, et al. Global cancer transitions according to
the Human Development Index (2008-2030): a
population-based study. Lancet Oncol. 2012 Aug;13(8):790-801.
Esta
información es concordante con la estimación de que
el 67% de los pacientes oncológicos que residen en países de ingresos
bajos y medios requerirán alguna terapia oncológica de alto costo,
siendo las indicaciones
más comunes e importantes a nivel global, el cáncer de
pulmón (16.4%), el cáncer de seno (12.7%), y el cáncer
colorrectal (11.1%). La creciente necesidad de la oncología, una
ciencia que nació formalmente en la década
de 1960, ha hecho que se requiera una fuerza mundial
de atención próxima a los 65.000 profesionales, cifra
que será cercana a los 160.000 médicos en 2040 (7).
Por otra parte, durante los últimos 50 años las tasas de
mortalidad por cáncer han disminuido en la mayoría
de los países altamente desarrollados (
Figura
2), en
gran parte, por las enormes variaciones en el control
de los estados avanzados de la enfermedad gracias a
la inclusión de la genómica y la medicina de precisión,
por la introducción de la inmunoterapia altamente
efectiva, el perfeccionamiento de los programas de
diagnóstico temprano y de prevención, y la mejoría
sistemática de la cirugía y la radioterapia, además del
control óptimo de su morbilidad. En contraposición,
las tasas de mortalidad por cáncer de seno, próstata,
colon y pulmón, han seguido aumentando en los países en transición, o
en el mejor de los casos solo se han
estabilizado (8,9).
Recientemente, el estudio ICBP SURVMARK-2 demostró que la supervivencia
por cáncer ha mejorado
significativamente en siete países de ingresos altos a
partir de 1995. En estos lugares, las variaciones han
sido especialmente evidentes para las formas más agresivas de cáncer de
pulmón, colorrectal, ovario, esófago, estómago y páncreas (10). Las
medianas generales
de supervivencia fueron superiores en Australia, Canadá y Noruega,
donde la mejor tendencia fue para el
cáncer de recto que tuvo un aumento que osciló entre 9
y 21 puntos porcentuales. Este hallazgo está soportado
por las variaciones positivas en las técnicas quirúrgicas, incluida la
escisión mesorrectal total, el uso de la
radioterapia preoperatoria y la administración de quimioterapia cuando
se consideró necesario.
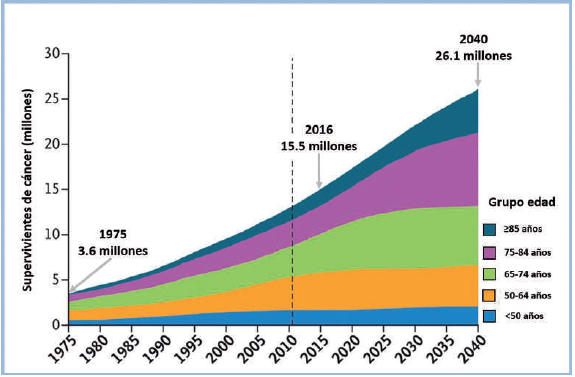
Figura 2. Cambio de las características demográficas de los
supervivientes de cáncer en los Estados Unidos. La
figura muestra la cantidad de largos supervivientes de cáncer según los
estratos de edad, comenzando en 1975,
cuando hubo 3.6 millones de supervivientes, y proyectado a 2040, donde
el estimado alcanza los 26,1 millones.
La línea vertical discontinua en 2011 indica el año en que la población
nacida entre 1946 y 1964 cumplió 65 años
(Figura reproducida y modificada de Bluethmann SM, Mariotto AB, Rowland
JH. Anticipating the “silver tsunami”:
prevalence trajectories and comorbidity burden among older cancer
survivors in the United States. Cancer Epidemiol
Biomarkers Prev 2016;25:1029-36.
Los datos
más significativos se obtuvieron en la población menor
de 75 años y podrían estar relacionados con un acceso
amplio a la terapia sistémica adyuvante, así como por
la mejor tolerancia a los tratamientos más agresivos.
De forma similar, un común denominador para la
aproximación a estos logros en los países con mejor
desarrollo económico es la gestión e implementación
de los planes nacionales de cáncer, que consideran a
la enfermedad como una prioridad en salud pública,
acelerando los procesos diagnósticos, favoreciendo el
acceso a los mejores tratamientos, direccionando las
vías de atención, y cuantificando objetivamente los
desenlaces (10). La
Figura 3
muestra la diferencia
gráfica entre las tasas de mortalidad por edad en dos
quinquenios a partir de 1981 y 2006, incluyendo los
eventos cardiovasculares, el cáncer y otras causas (11).
El objetivo primario del tratamiento del cáncer siempre ha sido y sigue
siendo curar la enfermedad. Sin
embargo, las diversas intervenciones existentes en la
actualidad no proporcionan una garantía completa,
en consecuencia, los pacientes requieren extensos seguimientos para
descartar una recaída. Con el advenimiento de la Pan-Omica (exploración
sistemática de
la expresión génica) se han desarrollado nuevos tratamientos
habilitados por novedosas tecnologías que
facilitan la personalización del manejo. Los avances de la tipificación
molecular a gran escala han permitido la caracterización de los
defectos somáticos y en
línea germinal en tumores individuales, favoreciendo
la identificación de nuevas opciones terapéuticas.
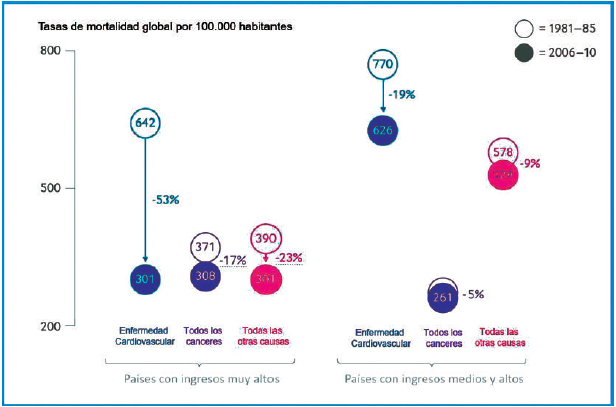
Figura 3. Cambios en las tasas de mortalidad estandarizadas por
edad en entre los 40 y 84 años para 1981-85 y
2006-10 debido a enfermedades cardiovasculares (ECV), todos los
cánceres y otras causas de muerte en hombres
y mujeres combinados. Figura reproducida y modificada con autorización
de Cao B, Bray F, Beltrán-Sánchez H, et al.
Benchmarking life expectancy and cancer mortality: global comparison
with cardiovascular disease 1981-2010. BMJ.
2017 Jun 21;357:j2765.
Las plataformas han evolucionado hasta identificar la carga mutacional,
diferentes firmas de mutaciones complejas, antígenos específicos del
tumor, y la evaluación
de la heterogeneidad intra y extratumoral que explica
muchas veces la dinámica del cambio (12). Hace poco,
el consorcio Pan-Cancer Analysis of Whole Genomes
reportó el análisis de la secuenciación de más de 2.600
muestras que incluyen 38 tipos diferentes de cáncer
procesados en 4 continentes por investigadores con
750 filiaciones. Este proyecto resaltó el alcance y complejidad de la
valoración molecular, al encontrar que
solo el 5% de los tumores no presentan alteraciones
génicas conductoras, mientras el resto tienen entre 4 y
5 mutaciones dominantes que proporcionan una ventaja selectiva. En
paralelo, se identificó que buena parte de los canceres exhiben
catástrofes genómicas como
la cromoplexia (17%) y la cromotripsis (22%), eventos que provocan
inestabilidad genómica explicando
el avance de la enfermedad (14). La conjunción de
este conocimiento amplió las intervenciones clásicas
concentradas en la quimioterapia, la cirugía, y radioterapia, hasta
alcanzar una pléyade de consideraciones
que contempla la terapia génica y celular, la inmunoterapia específica,
la terapia blanco dirigida, y novedosos modelos diagnósticos como la
biopsia líquida. La
Figura 4 ilustra las diversas
alternativas de tratamiento
que se utilizan e investigan en la actualidad para beneficiar el
control del cáncer.
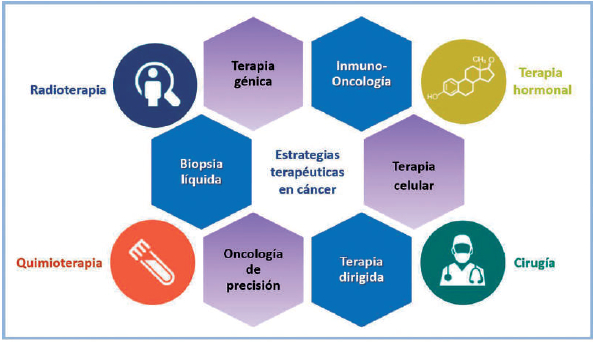
Figura 4. Diversificación de las estrategias terapéuticas
utilizadas
en la actualidad para favorecer el control y curación del cáncer.
El pasado, como el futuro, es indefinido y existe sólo
como un espectro de posibilidades. Dentro de ellas, la
oncología ha abierto las puertas para la formulación
de vacunas terapéuticas hechas a la medida, capacitadas para reformular
mutaciones aleatorias propias de
cada individuo. Comparando las secuencias de ADN
tumoral con las de células sanas, se pueden seleccionar
aquellas alteraciones que tienen una mayor probabilidad de provocar
fuertes reacciones inmunológicas en
el hospedero. La mayoría de estas vacunas son partículas de ARN
mensajero capaces de forjar instrucciones para crear proteínas
específicas, en este caso
un antígeno tumoral que prepara al sistema inmune
adaptativo contra el tumor. En una dimensión similar, a partir del 2018
vivimos la primera aprobación de
una terapia celular contra el cáncer. Esta tecnología
conocida como terapia con células CAR-T consiste en
la manipulación genética consciente de las células inmunitarias del
paciente para que se dirijan contra un
antígeno tumoral determinado. El mayor interés en
este modelo se basa en la posibilidad de generar efectores capaces de
destruir las células neoplásicas sin
alterar las normales. Una nueva frontera tecnológica
relaciona la edición génica a través de CRISPR/Cas9
para modificar la expresión de genes represores de la
respuesta inmune (por ejemplo, PD-1). Adicionalmente el uso de
CRISPR/Cas9 permite cortar el genoma
en lugares definidos, generando secuencias que serán
complementarias a las de los ARN guía que se han
utilizado. Esto ha permitido la eliminación funcional
de genes o la introducción de mutaciones, así como la
modificación de la transcripción en diferentes niveles.
La integración de CRISPR/Cas9 también ha permitido la edición de nuevas
células CAR-T. Por último,
la identificación y caracterización del microbioma humano y su vínculo
con la generación y modulación del
cáncer ha promovido la tipificación del “enteroma”
que facilita la interacción entre el sistema inmune y el
microbioma intestinal para favorecer el control óptimo
de la enfermedad (14).
Desde el año 2007 se han iniciado más de 35.000 experimentos clínicos
en cáncer, lo que equivale a más de la tercera parte de la
investigación en este formato a nivel
global. En la última década, el número de estudios iniciados ha
aumentado en más del 75%, y el portafolio
de medicamentos en desarrollo llegando a fases avanzadas se expandió en
63% desde 2013 (actualmente
incluye 849 moléculas en investigación). Gracias a
una inversión compuesta entre los entes gubernamentales, privados y la
industria farmacéutica, más de 158
billones de dólares han permitido el impulso de 450
inmunoterapias con 60 mecanismos diferentes de acción, así como la
producción de 98 biocompuestos de
última generación (terapia génica, celular y nucleótidos anti-sentido).
Durante los últimos cinco años, 69
terapias novedosas han recibido más de 90 indicaciones alrededor del
mundo, incluyendo, por primera vez
una perspectiva agnóstica (15).
Este viaje de cientos de millas aún no recorridas, inició
con un solo paso, el de la curiosidad intelectual que negó
todos los dogmas, la fuerza motriz del libre examen, la
caída del criterio de los padres de la medicina. La oncología se acerca
por primera vez a la curación de múltiples
enfermedades en estado avanzado, y quienes escriben
estas frases han tenido oportunidad de ver esta realidad.
La recopilación de la historia del cáncer y el cáncer en
la historia se resume en dos números especiales de la
Revista Medicina que intentan reconstruir las bases y
evolución del soberano entre todos los males.
Referencias
1.Adams C, Grey N, Magrath I, Miller
A, Torode J. The
World Cancer Declaration: is the world catching up?
Lancet Oncol. 2010;11:1018–20.
2. Alwan A, Maclean DR, Riley LM,
Tursan d'Espaignet E,
Maters CD, Stevens GA et al. Monitoring and surveillance of chronic
non-communicable diseases: progress
and capacity in high-burden countries. Lancet. 2010;
376:1861–68.
3. Beaglehole R, Bonita R, Alleyne G,
Horton R, Li L, Lincoln P et al. UN High-Level Meeting on
Non-Communicable Diseases: addressing four questions. Lancet.
2011;378: 449–55.
4. Farmer P, Frenk J, Knaul FM,
Shulman LN, Alleyne G,
Armstrong L et al. Expansion of cancer care and control
in countries of low and middle income: a call to action.
Lancet. 2010; 376:1186–93.
5. WHO report on the global cancer
epidemic, 2008. The
MPOWER package fresh and alive. [Internet] Geneva: World Health
Organization; 2008 [consultado 10
octubre 2020]. Disponible en:
https://apps.who.int/iris/bitstream/handle/10665/43818/9789241596282_eng.pdf?sequence=1
6. Bray F, Jemal A, Grey N, Ferlay J,
Forman Dl. Global
cancer transitions according to the Human Development
Index (2008-2030): a population-based study. Lancet
Oncol. 2012;13(8):790-801.
7. De Santis CE, Bray F, Ferlay J,
Lortet-Tieulent J, Anderson B, Jemal A. International Variation in
Female Breast
Cancer Incidence and Mortality Rates. Cancer Epidemiol Biomarkers Prev.
2015;24:1495-506.
8. Patel R, Liu WK, Patel HR,
Pickering L, Afshar M. Are
health-care policies restricting further progress in cancer
survival outcomes? Lancet Oncol. 2019;20(12):e657.
9. Arnold M, Rutherford MJ, Bardot A,
Ferlay J, Anderson
TM, Myklebust TA et al. Progress in cancer survival,
mortality, and incidence in seven high-income countries
1995-2014 (ICBP SURVMARK-2): a population-based
study. Lancet Oncol. 2019;20(11):1493-1505.
10. Cao B, Bray F, Beltrán-Sánchez H,
Ginsburg O, Soneji
S, Soerjomataram I. Benchmarking life expectancy and
cancer mortality: global comparison with cardiovascular
disease 1981-2010. BMJ. 2017;357:j2765.
11. Berger MF, Mardis ER. The
emerging clinical relevance of genomics in cancer medicine. Nat Rev
Clin Oncol.
2018;15(6):353–365.
12. ICGC/TCGA Pan-Cancer Analysis of
Whole Genomes
Consortium. Nature. 2020;578:82-93.
13. Wartman LD. The future of cancer
treatment using precision oncogenomics. Cold Spring Harb Mol Case Stud.
2018;4(2): a002824.
14. Global Oncology Trends 2019.
[Internet]. Iqvia.com 2020
[consultado 10 octubre 2020]. Disponible en:
https://www.iqvia.com/insights/the-iqvia-institute/reports/global-oncology-trends-2019.
Recibido:
Diciembre 20, 2020
Aprobado: Diciembre 21, 2020
Correspondencia:
Andrés Felipe Cardona
cardona@clinicadelcountry.com






