Resumen
La Organización Mundial de la Salud (OMS) declaró alerta sanitaria
mundial por el aumento de casos
y la aparición del COVID-19 en otros países, que llevó con el paso de
los días, a declarar por parte de
esta organización el estado de pandemia, el 11 de marzo de 2020. En
Colombia, el primer caso se registró el día 6 de marzo de 2020. El
estado nutricional por exceso o déficit y las enfermedades crónicas
no transmisibles se consideran factores que incrementan el riesgo de
complicaciones en pacientes con
COVID-19. Si bien no hay alimentos o suplementos nutricionales que
puedan prevenir la infección por
COVID-19, mantener una dieta saludable y hacer ejercicio es una parte
transcendental para apoyar un
sistema inmunológico competente.
La recomendación existente sugiere que los pacientes infectados deben
evaluarse nutricionalmente a
su ingreso hospitalario, y aquellos que se encuentran en riesgo, deben
recibir fortificación y/o suplementación oral desde un principio,
idealmente con adición de vitaminas, en especial vitamina D y
minerales. Se recomienda una fórmula que aporte alrededor de 30 g de
proteína y 400 kcal por toma.
Una herramienta fácil y práctica es el “Nutritional Risk Asssessment”
(NRS-2002) debido a que considera el estado de gravedad de la
enfermedad como también la edad.
En los pacientes con COVID-19 no críticos, la alimentación enteral es
siempre la vía de elección,
aunque es necesario evaluar si cubre más del 60% de los requerimientos
proteico-calóricos, en caso
negativo se debe considerar la nutrición parenteral total o
suplementaria. Se recomienda la nutrición
enteral por sonda nasogástrica y a un goteo continuo para evitar la
distensión, favorecer la tolerancia y
disminuir el riesgo de contaminación. En los pacientes en estado
crítico es necesario evaluar el riesgo
de síndrome de realimentación, común en pacientes con Índice de Masa
Corporal (IMC) bajo, multimórbidos y ayunos prolongados. El soporte
nutricional en cuidado crítico debe comenzar con el 70%
de los requerimientos calóricos y se progresa paulatinamente. El aporte
proteico debe estar entre 1,3 a 2,0 g de proteína, administrar viales
de vitaminas y minerales diariamente. El empleo de emulsiones
de lípidos a base de soya exclusivamente, no se recomienda, por sus
efectos proinflamatorios.
Una vez dado de alta de la UCI se debe continuar con una monitoría
nutricional, debido a que se
puede presentar disfagia y un desgate proteico/calórico importante.
La oportuna intervención nutricional dentro del manejo integral de los
pacientes con COVID-19, acelera la recuperación, disminuye las
complicaciones, la mortalidad, la estancia hospitalaria y los costos
de hospitalización.
Palabras clave: (DeCS) COVID-19; Nutritional Risk Screening 2002;
soporte nutricional. proteína de suero,
suplementos nutricionales orales, ácidos grasos omega 3.


¹ ND, MBA. Miembro Asociado Academia Nacional de Medicina.
Expresidente Fundador de la Asociación Colombiana de Nutrición Clínica.
Director Centro Latinoamericano de Nutrición.
² MD, FACP. Especialista en
Medicina Interna y Nefrología, Fundación Universitaria Juán N. Corpas.
Miembro Correspondiente Academia Nacional de Medicina. Presidente
Asociación Colombiana Medicina Interna - Capítulo Central 2018 - 2020.
Profesor Asistente Pontifi cia Universidad Javeriana - Hospital
Universitario San Ignacio. Jefe Servicio de Nefrología Clínica Marly.
³ MD. Médico,
especialista en cirugía general, Universidad Nacional de Colombia.
Expresidente de la Asociación Colombiana de Cirugía. Maestro de la
Cirugía Colombiana. Miembro Correspondiente de la Academia Nacional de
Medicina. Presidente del Tribunal de Ética Médica de Bogotá.
RECOMMENDATIONS OF THE NATIONAL ACADEMY
OF MEDICINE ON FOOD AND NUTRITION AGAINST
THE INFECTION BY SARSCOV2- COVID-19
Abstract
On January 30th World Health Organization (WHO) declared COVID-19 a
Public Health
Emergency of International Concern. On March 11, 2020, cases continued
to grow all over the
world, and the WHO declared COVID-19 a global pandemic. In Colombia,
the first case was
registered on March 6, 2020. Abnormal nutritional status due to excess
or deficit and chronic
non-communicable diseases are considered to increase the risk of
complications in patients
with COVID-19. While there are no foods or nutritional supplements that
can prevent COVID-19 infection, maintaining a healthy diet and regular
exercise is a critical part of supporting
a robust immune system.
The existing recommendations suggest that infected patients should be
nutritionally screened
upon admission to the hospital, and those at risk should receive
fortification and/or oral supplementation from the beginning, ideally
with the addition of vitamins, minerals, and vitamin
D. It is also recommended to prescribe a formula that provides around
30 g of protein and
400 kcal per dose. An easy and practical tool is the “Nutritional Risk
Assessment” (NRS-2002)
because it considers both age and the severity of the disease.
In non-critical patients with COVID-19, enteral feeding is always the
route of choice; but it is
necessary to assess whether it covers more than 60% of the
protein-calorie requirements, if
not, total or supplemental parenteral nutrition should be considered.
Enteral nutrition by nasogastric tube and a continuous drip is
recommended to avoid bloating, promote tolerance, and
reduce the risk of contamination.
In critically ill patients, it is necessary to assess the risk of
refeeding syndrome, common in
patients with low BMI, multimorbid and prolonged fasting. Nutritional
support in critical care
must start with 70% of the caloric requirements and progress gradually.
The protein intake must be between 1.3 to 2.0 g of protein and include
daily administration of vials of vitamins
and minerals. The exclusive use of soy-based lipid emulsions is not
recommended due to its
pro-inflammatory effects.
Once discharged from the ICU, nutritional monitoring should be
continued, as dysphagia and
significant protein-calorie malnutrition may occur.
The timely nutritional intervention within the comprehensive management
of patients with COVID-19, accelerates recovery, reduces complications,
mortality, hospital length of stay, and
hospitalization costs.
Keywords: (MeSH) COVID-19; Nutritional Risk Screening 2002;
nutritional support, whey proteins, oral nutritional supplements, omega
3 fatty acids.
Introducción
La alimentación es parte fundamental del sistema
inmune. La cantidad y calidad de los diferentes alimentos que se
consumen a lo largo de la vida influyen
directamente en la actividad y respuesta del sistema
inmune.
El primer caso reportado en el mundo de una infección respiratoria que
afectaba a humanos, fue en Wuhan, China en la provincia de Hubei, en el
mes de
diciembre de 2019 (1). A partir de ese momento se
identificaron varios casos que fueron diagnosticados
como un nuevo coronavirus SARS CoV2 que causa la
enfermedad COVID-19 (2). Dado el rápido crecimiento de casos que
comprometieron diferentes regiones de
China, se declaró el estado de emergencia y del estado
de alerta sanitaria tras la aparición de una epidemia
viral. La propagación de la infección continuó y el 30
de enero del 2020 (3) la Organización Mundial de la
Salud (OMS) declaró alerta sanitaria mundial por el
aumento de casos y la aparición en otros países, que
llevó con el paso de los días, a declarar por parte de
esta organización el estado de pandemia, el 11 de marzo de 2020. En
Colombia, el primer caso se registró el
día 6 de marzo de 2020 (4).
La mortalidad de los pacientes infectados por coronavirus, en su gran
mayoría, ha sido en pacientes que
han requerido atención en Unidad de Cuidados Intensivos (UCI). Para
todo paciente que ingrese a una institución hospitalaria es de alta
importancia establecer
medidas de aporte nutricional adecuados y más aún,
en aquellos casos de internación en UCI, donde la nutrición óptima es
crucial durante el transcurso de la
enfermedad porque la malnutrición es un factor pronóstico de genera
grandes complicaciones y aumento
de la mortalidad como lo demuestra el estudio de Maruyama T et al (5)
que describió a 1.345 pacientes infectados por influenza que
presentaban malnutrición.
Si bien no hay alimentos o suplementos nutricionales
que puedan prevenir la infección por COVID-19, mantener una dieta
saludable es una parte transcendental
para apoyar un sistema inmunológico competente.
Existe evidencia científica del papel primordial que
desempeñan determinados nutrientes en el funcionamiento adecuado del
sistema inmune. El principal nutriente requerido es la proteína de alto
valor biológico,
como también lo son las vitaminas A, B6, B12, folato
D, C y E; micronutrientes como el zinc, cobre, hierro
y selenio; y la selección del tipo de grasa. El estudio
de la micro-biota, ha avanzado cada vez más, aumentando la
identificación de genes (ADN) de abundantes
microorganismos que habitan en el intestino y que se
mantienen allí por tiempos variables y que presentan
características dominantes, transitorias o escasas que
se movilizan a lo largo del tracto digestivo. Esto ha
permitido identificar, que pocas cantidades de poblaciones bacterianas
de alta patogenicidad, no desencadenen en enfermedad, dada la cantidad
limitada de las
mismas.
La microbiota intestinal juega un papel fundamental en la respuesta y
regulación del sistema inmune.
El desequilibrio entre la proporción de microorganismos saprofitos y
los patógenos al interior del intestino humano o disbiosis intestinal,
es una condición
que podría estar presente en pacientes infectados por
COVID-19, así como sucede en muchas otras infecciones. Los enfoques
dietéticos para lograr un microbiota
saludable también pueden beneficiar al sistema inmunitario. Con
respecto al tipo de grasas, hay evidencia
que en el síndrome de dificultad respiratoria del adulto (SDRA) la
tormenta de citoquinas puede ser atenuada por los ácidos grasos omega
3, posiblemente a
través de su metabolismo a mediadores especializados
en resolución (6). En la actualidad no existe un tratamiento
nutricional específico frente al COVID-19. La
disbiosis que se presenta en la COVID 19 es producida
por el fenómeno inflamatorio intestinal afectando sus
microvellosidades y produciendo diarrea como uno
de los tantos síntomas descritos en la enfermedad. No
debe olvidarse la presencia de vómito en algunos casos
como consecuencia del mismo fenómeno inflamatorio
de la mucosa gastrointestinal, que pueden contribuir a
un deterioro agudo en el estado nutricional.
Antecedentes
A partir de diciembre de 2019, la nueva enfermedad
por coronavirus ha causado alta morbimortalidad en
la población mundial, uno de los grandes retos que se
plantea se basa en establecer la forma más adecuada
de nutrir a las personas afectadas por la infección independiente del
grado de severidad que presenten.
El estado nutricional por exceso o por déficit y las enfermedades
crónicas no transmisibles se consideran
factores que incrementan el riesgo de complicaciones
en pacientes con COVID-19. Correia (7) menciona
el ejemplo de Italia, donde las tasas de mortalidad
en el adulto mayor aumentaron en los pacientes con
COVID-19 (8). Sin embargo, esta observación no se
sabe si se encuentra relacionada exclusivamente con la
edad, o es debido a que este grupo de personas tiene
mayores comorbilidades, que, en conjunto con la polifarmacia y el
aislamiento social, los hace más vulnerables a las deficiencias
nutricionales. En China, la edad
avanzada (≥65 años) y la presencia de comorbilidades
se asocian con un curso más grave de COVID-19 (9).
La tasa mayor de mortalidad se debió a enfermedad
cardiovascular (ECV) (10,5%) seguida por diabetes
mellitus (7,3%), enfermedades respiratorias crónicas
(6,3%), hipertensión (6,0%) y cáncer (5,6%)10. No debemos olvidar que
hay patologías como la enfermedad
ulcero-péptica y la hepatopatía crónica que influyen
de por sí, en las alteraciones nutricionales de los individuos y por
ende contribuirán negativamente en el
curso de la enfermedad que nos ocupa.
La obesidad se considera como un estado inflamatorio crónico que puede
interferir con la respuesta inmunológica aguda al virus. Se piensa como
un factor de
riesgo para presentar las comorbilidades mencionadas
y así mismo, se relaciona con alteraciones metabólicas tales como
dislipidemia y resistencia a la insulina
y también con un mayor riesgo de neumonía (10,11).
La obesidad inhibe tanto la respuesta de las células T
CD8+ específicas para el virus, como también las respuestas de
anticuerpos a la vacuna contra la influenza
estacional (12). En Colombia, según los datos del ENSIN (13) el
sobrepeso y la obesidad afectan al 56,4%
de la población y a nivel mundial fue del 52% de la
población para el 2016 (14).
La medición de las características antropométricas
y los parámetros metabólicos es crucial para estimar
mejor el riesgo de complicaciones en pacientes con
COVID-19.
En el momento actual se encuentra en estudio si existe
un vínculo directo endocrino y metabólico entre la hipertensión
arterial y la diabetes mellitus y la infección
por coronavirus, que podría involucrar a la enzima
convertidora de angiotensina 2 (15).
Pues un mecanismo de citotoxicidad propuesto es que
el virus gracias a su afinidad por las células endoteliales, vincule
las partículas virales a los receptores de la
enzima convertidora de angiotensina y provoque activación inmunológica
que causa liberación exagerada
de citoquinas. En especial, interleucina 1, 6 y 8 que
son sustancias pro inflamatorias que activan las endotoxinas y
linfocitos con la consecuente liberación de
superóxido y alteraciones severas de la coagulación.
Precauciones con el manejo de
alimentos
El contraer COVID-19 a través de alimentos o sus envases, es muy poco
probable. La ruta de transmisión primaria es a través del contacto
interpersonal o cuando una
persona infectada tose o estornuda y las gotas entran en
contacto con estas. El coronavirus no puede multiplicarse en los
alimentos, para su transmisión necesita de un
huésped humano o animal para hacerlo (16).
En los hogares se recomienda higienizar todos los alimentos y las
compras que lleguen a la casa. Para esto
se deben limpiar todos los productos que lleguen a
nuestros domicilios.
Los alimentos empacados se deben lavar con agua
y jabón y si esto no es posible por sus características
individuales, se pueden desinfectar con una toalla
desechable y un atomizador con una mezcla de fácil
preparación en casa, a base de 30 ml de agua y 70 ml
de alcohol. Una vez higienizados los alimentos, la toalla se debe
desechar y se procede al lavado de manos.
En el caso de las frutas y verduras deben lavarse con
abundante agua y si la superficie no lo permite se recomienda utilizar
una toalla húmeda. En los productos enlatados, se debe limpiar la
superficie. La Organización Mundial de la Salud (OMS) y el Center of
Disease Control (CDC por su sigla en inglés) (17,18)
no recomiendan utilizar jabón, detergente, ni productos comerciales
para el lavado de alimentos; solo agua
abundante.
Es recomendable limpiar y desinfectar las superficies
porque el virus puede mantenerse en cobre 4 horas,
cartón 24 horas y plásticos y acero inoxidable hasta 2
o 3 días (19).
Recomendaciones nutricionales de
alimentación saludable en población
sin COVID-19
La mejor recomendación nutricional para apoyar el
sistema inmunológico es el consumo de una dieta de
alimentos diversos y variados de origen animal y vegetal que se
encuentren alineados con las pautas actuales
de alimentación saludable.
Solamente en algunos casos, en aquellas personas que
se encuentran con deficiencias preexistentes como sucede en
malnutridos, pérdida de peso o enfermedades
desgastantes, puede llegar a requerirse suplementar algunos
micronutrientes como lo son las vitaminas C, D
y E, el zinc y selenio. Otro factor importante es el que
desempeña la microbiota intestinal en la educación y
la regulación del sistema inmune, siendo la disbiosis
intestinal una característica muy importante de varias
enfermedades infecciosas. Por lo tanto, los alimentos
para lograr un microbiota saludable también pueden
beneficiar al sistema inmunitario. Existe evidencia de
que las bacterias probióticas, particularmente algunos lactobacilos y
bifidobacterias, pueden modificar la microbiota, modular la respuesta
inmune y proteger contra infecciones, incluso del tracto respiratorio.
Muchos
alimentos de origen vegetal altos en fibra y los alimentos fermentados
desempeñan un papel en la creación
y el mantenimiento de una microbiota intestinal saludable y, por lo
tanto, también ayudarán a fortalecer el
sistema inmunológico (6,20).
Otro de los nutrientes que se deben tener en cuenta
son el tipo de grasas, disminuyendo las grasas saturadas,
racionalizando el empleo de las poliinsaturados y
aumentando el empleo de omega 3, los cuales contienen EPA y DHA que
poseen propiedades antiinflamatorias las cuales actúan para disminuir
la producción
de esicosanoides inflamatorios producidos a partir del
ácido araquidónico (6,20).
El consumo de fuentes de selenio es fundamental,
según Zhang
et al (21) se
correlacionan los niveles
de este micronutriente con las tazas de curación en
COVID-19, con el agravante que Colombia se encuentra en un región donde
el suelo es pobre en selenio (22).
Se puede decir que es prudente que las personas consuman cantidades
suficientes de nutrientes esenciales
para apoyar su sistema inmunológico y ayudarles a
combatir los patógenos en caso de infección. El consumo de una
alimentación variada con fuentes de productos de origen vegetal y
animal y consistente con las
guías actuales de alimentación saludable, es lo mejor
para apoyar el sistema inmunológico. Las personas
con ingesta subóptima de varios nutrientes esenciales
presentan una respuesta inmune deficiente. En la
tabla 1, se muestra que la
mejor dieta para apoyar el
sistema inmunológico es una ingesta diversa y variada de verduras,
frutas, nueces, semillas, granos y legumbres, junto con algunas carnes,
huevos, productos
lácteos y pescado altos en grasa. Esta alimentación es
consistente con las pautas de una alimentación saludable la cual
contraindica el consumo de alimentos
procesados en exceso y los “productos chatarra “ que
contienen cantidades excesivas de grasas saturadas y
azúcar (20,23,24).
Las recomendaciones puntuales para la población
sana sobre las especificaciones de una alimentación
saludable para fortalecer su sistema inmune son:
- Hidratación adecuada, evitando resequedad en
mucosas.
- Tomar agua o agua con limón, entre 6 y 8 vasos
por día. No consumir bebidas azucaradas, jugos,
bebidas deportivas o agua de panela.
- Alimentación balanceada alta en proteína.
- Alta en proteína animal.
– Carne o pollo magra: dos porciones
por día.
– Carne roja: máximo dos veces por
semana.
– Pescado: mínimo dos veces por semana.
– Carnes procesadas: máximo una vez por semana.
– Huevos: 2
- 4 unidades por semana.
- Leche y derivados bajos en grasa: 2 - 3 veces por día.
- Harinas y Cereales: 3 - 5 por día.
– Papa, arroz, plátano, yuca, plátano.
– Pan integral.
– Cereales.
- Nueces, semillas y leguminosas: 4 - 5 por semana.
– Leguminosas: fríjol, arveja, lenteja,
garbanzo
y haba.
– Nueces, semillas y olivas.
- Frutas y verduras: 5 porciones por día.
- Aceites, grasas y salsas: 2 a 3 porciones por día.
– Evitar grasa saturada (origen animal)
y usar
preferiblemente insaturada (aceite de canola) y
seleccionar fuentes de omega 3 como el aceite
de oliva y el aceite de pescado (salmón).
- Azúcares y dulces: menos de dos porciones por
semana.
- Otros:
– Alimentos frescos variados, evitar
los ultras
procesados, prefiriendo los alimentos naturales para cocinar/preparar
en casa.
– Reduzca al máximo el consumo de sal.
– Evitar el consumo de bebidas alcohólicas.
Tabla 1. Alimentos fuentes de nutrientes que soportan el sistema
inmune
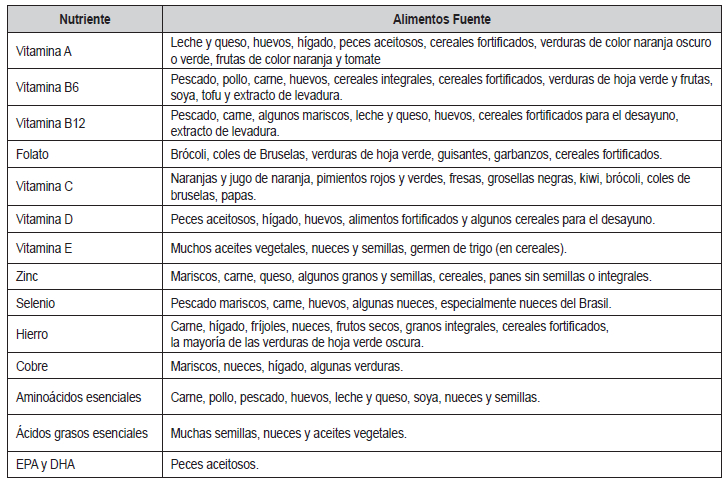
DHA, docosahexaenoico, EPA, eicosapentaenoico. Modificado de Calder
et al 2020 (6)
La publicación de la Universidad Nacional de Colombia24 hace alusión al
“Plato Saludable de la Familia
Colombiana” (25), en el cual se recomienda que, en
cada tiempo de comida, deben incluirse alimentos variados y adecuados
de todos los grupos, consumirlos
frescos, disminuir el consumo de alimentos procesados, y reducir el
consumo de grasas y azúcares.
Las medidas de distanciamiento social y las normas estrictas acerca de
las visitas a los consultorios y hospitales han
generado la necesidad de hacer un contacto remoto tanto
para los pacientes sin COVID-19 o aquellos que se encuentran con
COVID-19 en cuarentena en sus hogares. Por esta
razón la OMS (26) ha recomendado el empleo de telemedicina para
facilitar el diagnóstico y tratamiento de los pacientes. En el artículo
de Krznaric (27), se propone una
herramienta sencilla de evaluación nutricional que puede
ser utilizada como parte de la telemedicina y determinar
de forma rápida y práctica el estado nutricional.
Finalmente, dentro de un plan de alimentación saludable siempre debe
existir un programa de actividad
física con el objeto de mantener tanto el estado físico
como el mental (24,27,28). La oficina regional de Europa de la OMS (29)
desarrolló una guía sencilla para estar físicamente activo en un
espacio limitado, que se
incorpora a la recomendación general de 75 minutos
por semana de actividad física de intensidad moderada
y si es intensa 150 minutos por semana.
Recomendaciones nutricionales en las
diferentes fases y estadios de COVID-19
Existen recomendaciones nutricionales orientadas a
aumentar la sensibilidad del personal asistencial clínico de pacientes
con infección por COVID-19 con el
fin de mejorar los desenlaces clínicos. Mucho de la literatura, está
orientada para la atención de pacientes
críticos por las diferentes fases que acompañan a la
enfermedad viral y que se relacionan con una mayor
progresión del deterioro clínico y a su vez, nutricional.
Han sido descritas 3 fases de progresión que acompañan a muchas
enfermedades virales similares y la
progresión de la infección por COVID-19 hace parte
de este mismo comportamiento fisiopatológico, manifestaciones clínicas
y posibles planteamientos terapéuticos que se deben integrar dentro del
contexto de la
enfermedad. Ver
figura 1 (30).
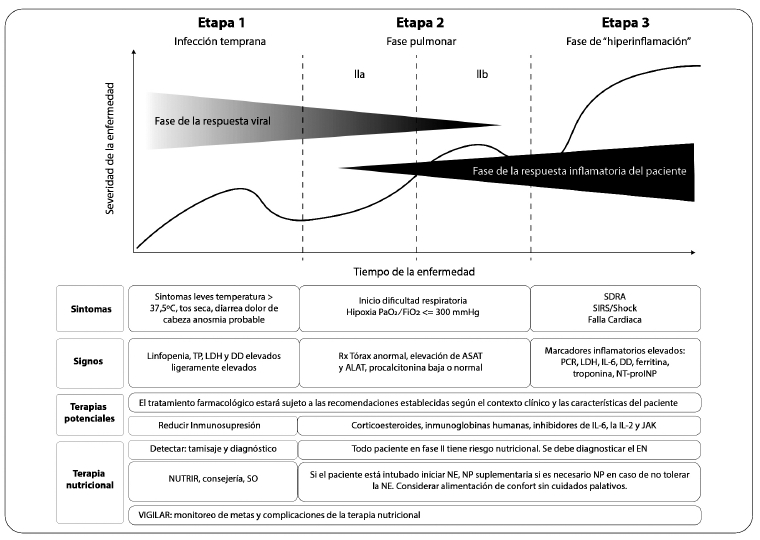
Figura 1. Fases de la enfermedad COVID-19 y opciones terapéuticas
nutricionales.
(ALAT: alaninoaminotransferas; ASAT: aspartatoaminotransferasa; DD:
D-dimeros; EN: estado nutricional;
IL: interleucina; JAK: Janus quinasa; LDH: lactato deshidrogenasa; NE:
nutrición enteral; NP: nutrición parenteral;
PCR: proteína C reactiva; SDRA: síndrome de dificultad respiratoria
aguda; SIRS: síndrome de respuesta inflamatoria
sistémica; SO: suplementos nutricionales orales; TP: tiempo de
protrombina). Tomado de Siddiqi et al 2020 (30).
Tabla 2. Evaluación del riesgo nutricional (NRS-2002)
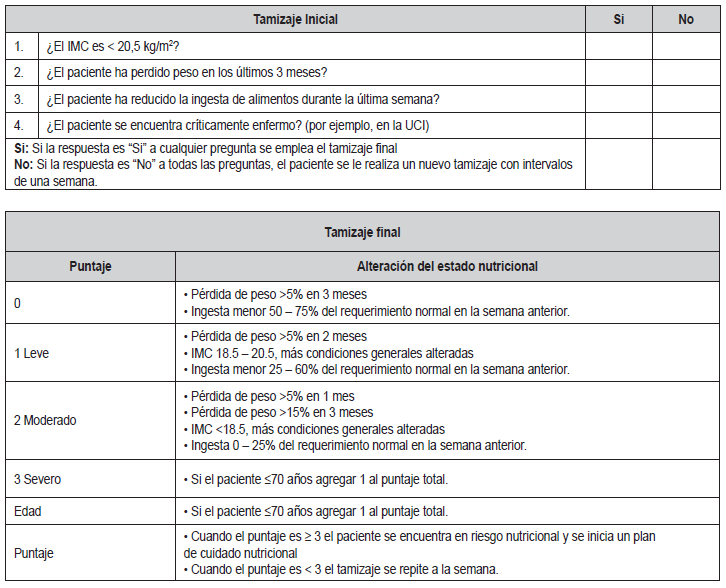
Modificado de Kondrup et al (35).
Las recomendaciones nutricionales en un paciente
recién diagnosticado con COVID-19 se enfocan en el
manejo de los síntomas iniciales como la fiebre, los
problemas respiratorios y en algunos casos la disgeusia
y la anorexia. Por esta razón, se debe vigilar el estado
de hidratación, la ingesta de alimentos y determinar el
estado nutricional. Algunos pacientes serán confinados a sus
residencias y otros, dependiendo de su gravedad pueden requerir
hospitalización y dependiendo de
su evolución, incluso manejo en la unidad de cuidado
intensivo.
Inicialmente, se recomienda hacer una tamización nutricional sencilla
para determinar el riesgo, se establece
el peso y la talla y se calcula el índice de masa corporal. Debido a
las restricciones del contacto directo,
es mejor solicitar la información verbalmente y que
el paciente proporcione los datos que conozca sobre su talla y el peso
actual o el último que recuerde (31).
Aunque no se disponga de literatura específica para
COVID-19, la recomendación existente sugiere que los
pacientes infectados deben evaluarse nutricionalmente
a su ingreso hospitalario, y aquellos que se encuentran
en riesgo, deben recibir suplementación oral desde un
principio (31–33). Caccialanza et al (31), presentan un
protocolo pragmático de manejo nutricional para los
pacientes no críticos con COVID-19. Comienzan con
la tamización nutricional basada en el “Malnutrition
Universal Screening Tool” (MUST, por su sigla en inglés), luego se
determina tanto del riesgo como el requerimiento proteico calórico, se
realiza una monitoría sobre la ingesta diaria y se evalúa el
mantenimiento
del estado nutricional o su deterioro. Una herramienta
fácil y práctica además del MUST (34) o el “Nutritional Risk
Asssessment” (NRS-2002) (35). Berger sugiere el empleo del NRS-2002
como una alternativa de
tamizaje más precisa debido a que considera la edad,
lo cual es muy importante para COVID-19, como también la condición
crítica del paciente. Cuando el resultado es igual o mayor a 3, el
paciente se encuentra en
riesgo nutricional y se debe iniciar un plan de cuidado
nutricional. Ver
Tabla 2.
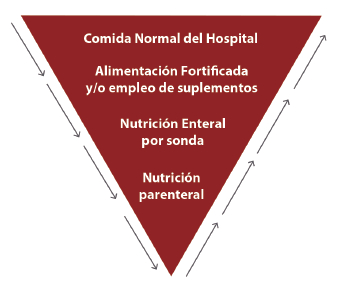
Figura 2. Esquema de progresión de alimentación.
Tomado de Howard P. 37.
Manejo nutricional del paciente
hospitalizado no crítico con
COVID-19
La mayoría de los pacientes hospitalizados con
COVID-19 presentan al ingreso inflamación severa,
anorexia y deshidratación, lo que lleva a una reducción significativa
de la ingesta de alimentos (31). Un
número importante de ellos desarrolla al poco tiempo,
insuficiencia respiratoria que puede requerir ventilación no invasiva
(VNI) o incluso presión positiva continua de la vía aérea (CPAV)
(31,33). Otros síntomas
que acompañan a la infección viral son con frecuencia
los gastrointestinales que se reflejan como diarrea, vómito y náuseas
los cuales afectan la ingesta y absorción de los alimentos (36).
Alimentar a los pacientes en forma adecuada mientras
están en el hospital, genera beneficios tanto clínicos
como financieros. Un enfoque es considerar la intervención nutricional
como un proceso continuo en el
que diferentes profesionales tienen varias funciones en
distintos momentos. De esto se deduce que las necesidades individuales
de los pacientes pueden ser satisfechas por el profesional de nutrición
y dietética quien
debe ayudar a que se alcance los requerimientos nutricionales diarios y
de un equipo de soporte nutricional
que lo acompañe cuando se requiere de una terapia
médica especializada, ver figura 2 (37).
Fortificación de la alimentación
Se recomienda considerar ofrecer a los pacientes infectados en el
hospital una alimentación hiperproteica y
considerar para los refrigerios alimentos densamente
calóricos de fácil masticación, deglución y absorción,
debido a que algunos refieren dificultad para alimentarse debido a su
sintomatología. Algunos ejemplos
son el yogurt, kumis, pudín, queso campesino o cuajada, compotas de
fruta o fruta blanda partida y huevo.
Por lo tanto, Caccialanza et al (31) en su protocolo de manejo de
COVID-19 en paciente no crítico, propusieron tomar un decisión rápida y
pragmática en el
manejo de los pacientes con COVID-19 y más que
realizar una tamización y evaluación de parámetros
bioquímicos, su procedimiento era aún más proactivo
y comenzar con suplementación nutricional con 20 g
por vía oral a base de proteína de suero (una o dos veces por día)
durante las comidas y una solución intravenosa de micronutrientes, los
cuales contienen tanto
vitaminas como minerales. Seleccionaron proteína de
suero por sus propiedades anabólicas y antioxidantes
combinadas con su fácil digestibilidad (38,39). Entre
las ventajas están sus propiedades inmunológicas (40),
su actividad antiviral (41), los beneficios clínicos en
caquexia y desnutrición (42,43), y la recuperación del
sistema inmune en pacientes con VIH (44).
Caccialanza et al (31), consideran la suplementación
de vitaminas y minerales debido a que muchos de estos pacientes no
cumplen con la recomendación diaria
ideal (RDI) o llegan al hospital con déficits anteriores
que son perjudiciales durante las infecciones virales.
Incluso, este mismo autor, considera la suplementación de vitamina D
dependiendo de los resultados
sanguíneos. Esto se justifica por la evidencia que indica que el
restablecimiento a los valores normales en
pacientes infectados puede favorecer la recuperación,
tal como sucede en aquellos con tratamiento antiretroviral, en quienes
se reducen los niveles de inflamación
y se incrementa la inmunidad en contra de patógenos
(45-47).
Nutrición entérica
Durante el seguimiento en el hospital, después de esta
primera fase de fortificación nutricional a base de módulos de
proteína, aquellos pacientes que se encuentren en riesgo de acuerdo con
el resultado del tamizaje
nutricional deben recibir entre 2 a 3 suplementos nutricionales orales
(250 ml) que les proporcione entre
600 – 900 kcal/día y entre 35 – 55 g proteína/día (31).
Esta recomendación está en línea con las guías de la
Sociedad Euro-pea de Metabolismo y Nutrición Clínica (ESPEN) (33) que
sugieren el empleo de suplementos orales con densidad calórica de 400
kcal y 30
g de proteína, los cuales deben ser ofrecidos después o
entre los tiempos de comidas. En el informe de la Asociación Americana
de Nutrición Enteral y Parenteral
(ASPEN) (48) acerca de los procesos de práctica de
soporte nutricional en pacientes con COVID-19, menciona la necesidad de
unir la administración de módulos o suplementos con los tiempos de
comida, con
el fin de disminuir el riesgo de contaminación de los
cuidadores y reducir el gasto generado por el empleo
de equipos de protección personal (EPP).
Los pacientes deben continuar con la monitoría tanto
de sus condiciones médicas como nutricionales. En el
caso de empeorar su condición respiratoria y que lleguen
a requerir ventilación no invasiva (VNI) o presión positiva continua en
la vía aérea (CPAV, por sus siglas en
inglés) y que su consumo sea menor de dos porciones
de suplemento oral por día, se sugiere nutrición enteral.
Esta se recomienda considerando que la mayoría de los
pacientes tienen falla de un solo órgano y, en ausencia
de shock, la función intestinal se preserva, aunque la
administración de sedantes y medicamentos, la pueden
alterar. El empleo de nutrición enteral por sonda nasogástrica (SNG) es
la indicación más frecuente, vigilando de manera cercana el residuo
gástrico, el cual si es
≥ 500 ml, la vía pospilórica es una opción (33). Algunos
autores (31,33,48) consideran que a pesar de que la nutrición enteral
deba ser la primera opción, en los pacientes
con COVID-19 esta indicación es discutible debido a que
una SNG puede resultar en escapes de aire y comprometer la efectividad
del VNI o del CPAV (31,33,48). Además, la disponibilidad de máscaras de
VNI que tengan
un puerto para SNG son escasas. En el informe ASPEN
(48) mencionado anteriormente, se resalta la dificultad
de los accesos de nutrición enteral a través de ostomías
por el incremento de los riesgos de contaminación por
COVID-19, durante el procedimiento y la manipulación.
Otro de los problemas que se pueden presentar con
la alimentación enteral es la distensión abdominal secundaria a la
ventilación con presión positiva a través
de las máscaras faciales. Esta distensión afecta adversamente la
función diafragmática, comprometiendo
las condiciones respiratorias. Singer et al (49), consideran que la
nutrición enteral durante la VNI puede
percibirse como insegura debido al posible riesgo de
aspiración, por lo que estos pacientes terminan no recibiendo las
cantidades proteico-calóricas necesarias.
Por esta razón aquellos en riesgo nutricional deben
recibir en forma temprana, nutrición parenteral, evitando el deterioro
nutricional y el aumento del riesgo
de complicaciones (50). Aunque la nutrición enteral
siempre ha sido la vía de elección por excelencia, en
el caso de los pacientes con COVID-19, tanto ESPEN
como ASPEN, recomiendan considerar la nutrición
parenteral total o suplementaria en forma temprana,
en casos de nutrición insuficiente por la vía enteral.
Esto con el objeto de disminuir los riesgos de complicaciones y
alcanzar las metas nutricionales requeridas.
A las dificultades técnicas de nutrición enteral se le
agrega que a esta patología se le asocian alteraciones
gastrointestinales que se pueden ver agravadas por el
uso de antiretrovirales, los cuales suelen prescribirse
con frecuencia (51).
Determinación de los requerimientos
proteicos y calóricos
La dificultad en la disponibilidad y la esterilización
de los calorímetros genera la necesidad de estimar los
requerimientos calóricos a través de ecuaciones predictivas. ESPEN
recomienda 27 kcal/kg de peso /día
en > 65 años con multimorbilidades y 30 kcal/ kg de
peso/día en pacientes con bajo peso y con morbilidades (33).
Caccialanza et al (31) recomienda emplear la
ecuación de Harris Benedict, con un factor de corrección de 1,5. En los
pacientes con un índice de masa
corporal (IMC) > 30 kg/m²
, se utiliza el peso ideal,
el cual se determina considerando un IMC ideal de
23 kg/m²
. En la actualidad no hay datos publicados
de calorimetría indirecta para guiarnos, por lo tanto,
se recomienda la estimación calórica con base en fórmulas predictivas.
Las necesidades proteicas se estiman a 1,5 g/kg e igual
que se mencionó anteriormente. En aquellos con un
IMC > 30 kg/m² se calcula sobre el peso ideal, o sea
estimándolo a partir de 23 g/kg de corporal. ESPEN
recomienda proveer por lo menos 1 g/ kg de proteína
y ajustar dependiendo de la edad y comorbilidades que
presente el paciente (33).
Nutrición parenteral
La nutrición parenteral en los pacientes no críticos
con COVID19 debe cumplir con las metas nutricionales planteadas. Es
importante tener en cuenta que
todos los nutrientes se deben considerar, por lo tanto,
preferiblemente sería una mezcla 3 en 1 de los macronutrientes y
siempre agregando las necesidades de
electrolitos, vitaminas y minerales, que pueden tener
desequilibrios serios. Se pueden emplear las mezclas
tricamerales o bicamerales, pero recordando que es necesario cumplir
con las metas de proteína y evaluar los
niveles de triglicéridos.
Diariamente es necesario infundir los viales de vitaminas y minerales
en 100/250 ml de solución salina;
estos no vienen incorporados y no se pueden agregar
a las mezclas tricamerales, para no alterar el sistema
cerrado.
Además del monitoreo de electrolitos, se deben evaluar los niveles de
vitamina D y en caso de existir una
deficiencia, suplementarla (29).
El aporte calórico se debe hacer dependiendo de las
características del paciente, evaluando los parámetros
metabólicos y clínicos de este. Se requiere solicitar
exámenes de laboratorio básicos como son: glucemia, albúmina, perfil de
lípidos, electrolitos y pruebas de
función hepática, creatinina y BUN.
En caso de que la glucemia presente valores por encima de 180 mg/dl, es
necesario emplear insulina para
mantenerla por debajo de este valor, sin embargo, se
debe tener en cuenta que la infusión de dextrosa debe
estar máximo entre 3 – 4 mg/kg/min (52-55).
Las emulsiones de lípidos son la fuente calórica alterna e
indispensable. Es recomendable, sobre todo en
el caso del manejo en los pacientes con COVID-19 el
empleo de emulsiones de mezclas de lípidos con omega 3, preferiblemente
aquellos con aceite de pescado
y limitando el empleo de emulsiones de lípidos a base
únicamente de soya (33,48,56-59). Estudios recientes
muestran los beneficios del empleo de emulsiones de
lípidos con mezclas de aceite de soya, aceite de coco,
aceite de oliva y aceite de pescado porque aportan
cantidades de omega 3 y PUFAs (poliinsaturated fatty
acids, por su sigla en inglés) que actúan como fármaco- nutrientes y,
al mismo tiempo como agentes antiinflamatorios (60-62).
La administración de triglicéridos puede estar entre
0,7 - 1,3 g/kg de peso e incrementarse hasta 1,5 g/kg en
el caso de necesitar alcanzar los requerimientos energéticos. Es
importante tener en cuenta que existen 100
g de grasa por cada 500 ml de emulsiones de lípidos al
20 %. La ventaja de las nuevas generaciones de emulsiones de lípidos es
que contienen mezclas de éstos que
reducen el aporte de omega 6; por ejemplo, el que contiene aceite de
pescado tiene una proporción de 30 %
soya, 30 % TCM, 25 % oliva y 15 % aceite de pescado.
Otra de las mezclas recomendadas es la que contiene 20 % soya y 60 %
oliva; en comparación con las
emulsiones anteriores que eran 100 % soya (63). Para
fines prácticos, no se recomienda la administración de
más de una botella de 500 ml de emulsiones de lípidos
por día y se sugieren mezclas tres en uno para que la
infusión sea lenta y continua. Los pacientes que reciben las emulsiones
de lípidos se deben monitorear con
valores de triglicéridos en sangre; si estos son mayores
400 mg/l requieren una reducción en las cantidades
infundidas y si son mayores de 1.000 mg/l, se deben
suspender (63).
Idealmente, se sugiere que las bombas de infusión tengan equipos de
extensión que permitan estar fuera de
las habitaciones de los pacientes para evitar contaminación o el empleo
de PPE (64). Ver
Figura 3.
Manejo nutricional del paciente
crítico con COVID-19
Las unidades de cuidado intensivo están recibiendo
un importante número de pacientes con insuficiencia
respiratoria secundaria al COVID-19. La terapia médica nutricional es
una parte integral del manejo del
paciente en estado crítico incluyendo aquellos con
COVID-19; sin embargo, con esta patología constituye un desafío poderla
incorporar de manera rutinaria.
Como no existe aún mucha evidencia sobre el manejo
en esta enfermedad, las recomendaciones disponibles
se basan en la evidencia del manejo de pacientes críticos, con sepsis y
con síndrome de dificultad respiratoria del adulto (33,54).
Según Berger (65), solo hasta el estudio de Zhao et al
(66), quienes emplearon el Nutritional Risk Screening
(NRS por sus siglas en inglés) (35) y lo correlacionaron
con marcadores inflamatorios, tuvieron en cuenta la
presencia de sintomatología que altera el estado nutricional. Las tres
razones principales que afectan el
estado nutricional según Zhao
et al (66)
son:
- Estado hipercatabólico con alteraciones metabólicas secundarias a
la infección severa, tales
como estrés inflamatorio, hipoxia, reposo en
cama. Esto resulta en gluconeogénesis, proteólisis, oxidación acelerada
de grasa e hipoalbuminemia.
- Pérdida de apetito y reducción de la ingesta de
alimentos lo cual influye en déficits nutricionales. Esto se observó en
el 60 % de los pacientes
estudiados (66).
- Las intervenciones médicas tales como la ventilación mecánica y
el empleo de antibióticos de
amplio espectro, alteran el funcionamiento del
tracto gastrointestinal y retardan o impiden el
proceso de recuperación y agravan el estado inflamatorio.
Zhao et al (66) concluyeron
que la mayoría de los
pacientes graves en estado crítico se encuentran
en riesgo nutricional y a mayor riesgo peores resultados.
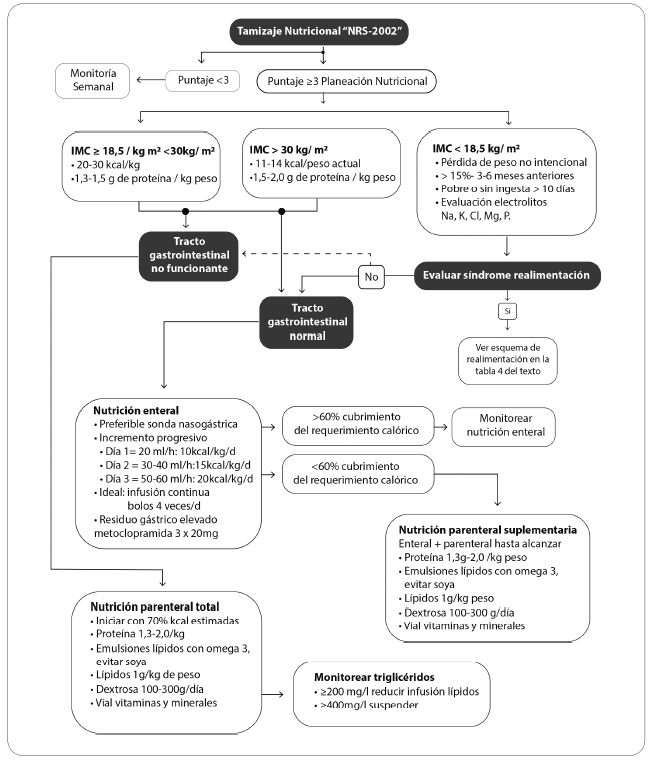
Figura 3. Algoritmo decisión nutricional para el paciente
hospitalizado no crítico con COVID-19.
* De acuerdo con esquema de Caccialanza R et al (31). Autoría propia
Evaluación nutricional
Dada la situación de riesgo en el contagio y la limitación de los
equipos de protección personal (EPP), se
recomienda encontrar la información necesaria en la
historia clínica o recurrir al personal que tiene acceso
con los EPP para que informe los datos requeridos,
con una explicación previa acerca de la necesidad y la
metodología. Se pueden emplear otros recursos como
es solicitarle información a los familiares vía telefónica, o
entrevistar al paciente, si es posible. La información obtenida se debe
guardar en la historia clínica,
aclarando la metodología empleada y coordinar con el
grupo médico la mejor alternativa acerca de las características del
soporte nutricional64. Si el paciente viene
de hospitalización, debería llegar con el resultado de
la tamización del MUST o preferiblemente del NRS2002 y si no lo tiene
se debe hacer debido a que es importante utilizarla para tener alguna
información del
estado nutricional, debido a las limitantes de contacto
con el paciente. En la medida que el riesgo nutricional
sea mayor, el tiempo de inicio del soporte debe ser más
urgente. Algunas veces, se requiere una nueva evaluación nutricional y
de las condiciones metabólicas del
paciente, con el objeto de tomar una decisión sobre el
tipo de soporte nutricional, debido a que la condiciones cambian en
forma rápida, pudiendo agravarse o
dando lugar a dificultades con el manejo nutricional
(33). Tal como menciona Berger (65), la tamización
es solo el primer paso que debe conducir a la acción
de implementar el soporte nutricional. En el estudio
de Zhao
et al (66), solo el
25 % de los 371 pacientes
recibieron soporte nutricional. En los pacientes en estado crítico 12 %
recibieron nutrición parenteral,15 %
nutrición enteral y 8 % la combinación entre nutrición
enteral y nutrición parenteral suplementaria.
Soporte nutricional
La vía de elección para la alimentación sigue siendo
la alimentación enteral y muchos de los pacientes
podrán recibirla a través de una sonda nasogástrica,
idealmente, en infusión continua. Es necesario evaluar
las cantidades administradas y compararlas con los
requerimientos nutricionales estimados con el fin de
adecuarlas o tomar una nueva decisión de administración de nutrición.
Para la determinación del requerimiento calórico, mientras ESPEN
recomienda el empleo de calorimetría indirecta con desinfección de
equipos (33), ASPEN sugiere
la estimación de acuerdo con fórmulas de predicción
por el temor de contaminación (54). En la práctica, con
la poca disponibilidad de calorímetros, el gran número
de pacientes, la escasez de personal de salud y/o restricción de EPP,
se recomienda durante la primera semana
hidratar adecuadamente al paciente, comenzar con un
aporte calórico bajo con <70 % de los requerimientos
y proteico de por lo menos 1,5 g/kg de peso; teniendo
en cuenta que el objetivo calórico solo se debe tratar de
alcanzar después de pasada una semana.
Existen algunas observaciones de estudios no publicadas que indican un
gasto de energía muy alto en
estos pacientes. Pero teniendo en cuenta los riesgos
de la sobrealimentación y la ausencia de datos concretos, preferimos
mantenernos del lado seguro en el suministro calórico, mientras que
apuntamos a dosis
más altas de proteínas, estando estas en el orden de
1,5 g/kg de peso.
Síndrome de Realimentación
En cuidado crítico se sugiere comenzar con el 70% de
las calorías estimadas o inclusive menos, debido a que
el aporte a base de dextrosa es bajo (54,67,68) e incrementarlas de
manera gradual para evitar el síndrome
de realimentación (SR). En la tabla 3 están disponibles
los criterios para determinar el riesgo de presentarlo
(68-70). Este principalmente sucede debido a los cambios metabólicos
causados por el paso de un estado
catabólico a uno anabólico, que se caracterizan por un
desplazamiento intracelular de electrolitos, incremento en la
utilización de tiamina y retención de agua y
sodio. Con el objeto de evitar el SR y sus complicaciones, desde el
inicio del soporte nutricional, es necesario
monitorear los niveles de fosfato, potasio, magnesio y
sodio; administrar tiamina, contar las calorías tanto enterales como
parenterales y alcanzar las metas calóricas
en forma gradual. Las cantidades proteicas totales pueden administrarse
desde el primer día del tratamiento,
siempre y cuando exista una adecuada función renal.
El SR puede ocurrir con la administración exclusiva o
mixta de nutrición parenteral y enteral.
La provisión nutricional debe ser instaurada en forma cuidadosa. En los
pacientes de alto riesgo, como
son aquellos con un IMC de 14 kg/m²
, ingesta entre
0 - 25 % de los requerimientos diarios, pérdida de
peso >15 días, o pérdida de peso > 20 %, se debe comenzar con 5
kcal/kg/d. En la
tabla 4, se
encuentra
la explicación del manejo del paciente con SR (69).
Vía, colocación de la sonda y método
de administración de nutrición enteral
La nutrición entérica debe ser la primera elección
para la alimentación de los pacientes cualquiera
que sea su condición (33,54,71). Se sabe que cerca
de la mitad de los pacientes con COVID-19 desarrollan hipomotilidad que
puede resultar en intolerancia gastrointestinal por lo menos durante 24
h (72)
y alrededor del 4% de los pacientes en estado crítico
con dismotilidad intestinal presentan evidencia de isquemia del
intestino grueso o delgado (73). Esto no
se puede explicar exclusivamente por la vasoconstricción generada por
el empleo de vasopresores y opioides requeridos para facilitar la
ventilación mecánica,
sino que parece ser que esta intolerancia se encuentra
exacerbada por las implicaciones gastrointestinales
secundarias al SARS-CoV-2 (73).
Tabla 3. Criterios para la identificación del riesgo de síndrome de
realimentación
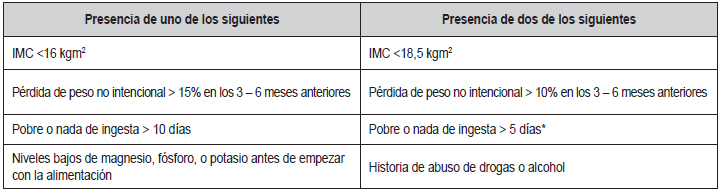
*Según Berger (comunicación personal) el SR en los pacientes en
estado crítico, se puede presentar incluso con solo 3 días de
inanición,
donde en muchos de ellos ya se presenta hipofosfatemia. Modificado de
Stanga et al (69).
Tabla 4. Esquema de realimentación en síndrome de realimentación
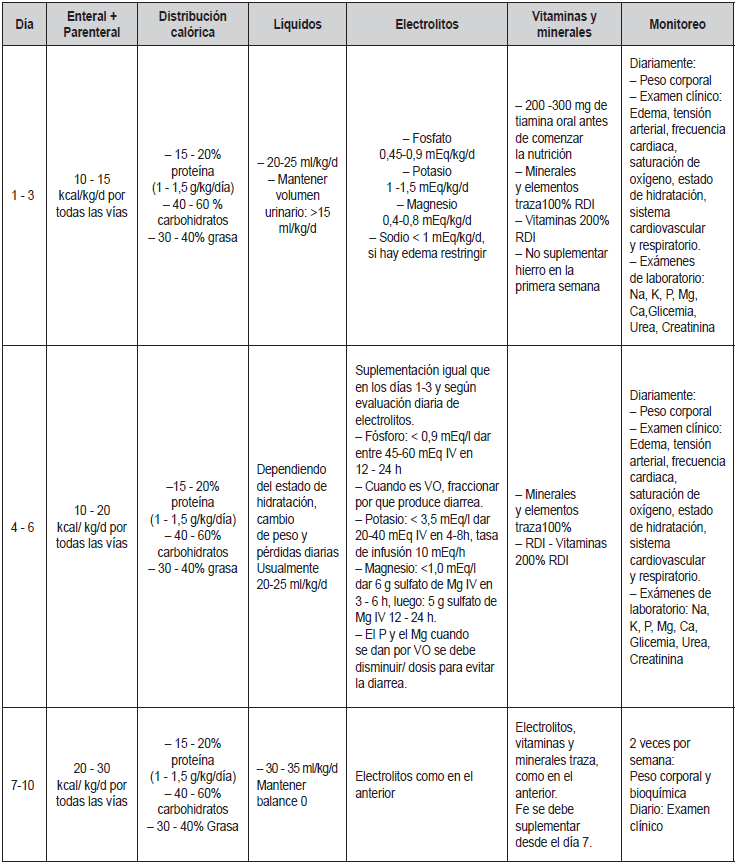
La nutrición entérica puede comenzarse a razón de
10 - 20 ml/ hora, preferiblemente por vía nasogástrica y en infusión
continua (68). Berger (comunicación
personal) sugiere para el día 1: 20 ml /hora; día 2,
30 - 40 ml/h y el día 3, entre 50 - 60 ml/h.
En la fase aguda del paciente en estado crítico, la dosis de nutrición
enteral debe tratar de alcanzar entre
20 kcal/kg de peso corporal actual y un objetivo proteico entre 1,2 -
2,0 g/kg de peso actual. El volumen
se incrementa en forma paulatina según tolerancia,
empleando sondas entre 10 -12 Fr. Si el paciente tiene
una sonda de drenaje, se puede utilizar con objeto de
reducir el posible contagio y dificultad en el paso de
una nueva, debido a que los pacientes pueden toser o
estornudar durante el procedimiento para su colocación (48).
La experiencia temprana en pacientes con COVID-19
sugiere que los síntomas gastrointestinales que pueden
manifestarse como intolerancia a la nutrición enteral,
están asociados con una mayor gravedad de la enfermedad. El monitoreo
del volumen del residuo gástrico
no es confiable para la detección del retardo en el vaciamiento y del
riesgo de aspiración y por el contrario
en algunos casos termina siendo una razón para descontinuar el empleo
de la nutrición enteral y aumentar
el riesgo de contagio del personal de salud (74). Es preferible evaluar
la distensión abdominal mediante un
examen físico diario y la confirmación del paso de heces y gases. En
estas circunstancias, si el examen abdominal no sugiere una
complicación aguda se pueden
considerar proquinéticos (metoclopramida 3 x 20 mg)
(Berger comunicación personal). Estas intervenciones
se deben "agrupar" con otras actividades requeridas
por el paciente para minimizar la exposición al virus
del personal de atención primaria.
Las guías de ESPEN (33), por su parte, recomiendan
evaluar el residuo gástrico y si este es mayor de 500ml,
se debe colocar una sonda post pilórica tan pronto
como sea posible. La sonda distal solo se indica en casos extremos en
los que la nutrición enteral por sonda
nasogástrica no se tolere. Se recomienda pasar la sonda al lado de la
cama, evitando procedimientos como
fluoroscopia o endoscopia, con el fin de disminuir
el riesgo de contagio por parte del personal de salud
(48,53,64). El control se hace por rayos X, en lo posible unido a otro
procedimiento radiográfico (48). Se
sabe que la colocación postpilórica no necesariamente disminuye el
riesgo de broncoaspiración y la sonda
puede desplazarse con mayor frecuencia cuando los
pacientes se colocan en posición decúbito prono (75).
La infusión continua es el método de elección y como
alternativa bolos 4 veces/día. Idealmente se sugiere
colocar las bombas de infusión fuera del cuarto del paciente para
evitar un mayor número de contactos (48).
Se puede emplear una fórmula estándar polimérica,
con al menos 20% de proteína y agregar módulos proteicos para alcanzar
las cantidades requeridas (48,64).
Algunos pacientes pueden requerir ventilación mecánica invasiva con
protección y ventilación pulmonar
abierta, y en ocasiones podrían desarrollar hipoxemia
refractaria, por lo que es necesario colocarlos en posición decúbito
prono para mejorar la oxigenación y aumentar el aclaramiento de la
secreción bronquial. La
lesión pulmonar tan severa que presentan con frecuencia los pacientes
con COVID-19 hace que los eventos
de aspiración así sean por volúmenes pequeños, sean
de extrema gravedad. Según reporta Adam et al (75)
los episodios de emesis y aspiración ocurren con mayor frecuencia con
el cambio de posición de supina
a la posición prono y viceversa. Por esta razón, para
reducir el riesgo de aspiración, sugieren suspender la
alimentación por sonda una hora antes de colocar al
paciente en posición prono, evitar residuos gástricos
altos, emplear nutrición enteral continua y en algunos
casos, considerar la colocación distal de la sonda. En
caso de no poder lograr la colocación de la sonda o la administración
total de los requerimientos nutricionales y estos sean menores del 60%
por día se debe empezar nutrición parenteral total o suplementaria
(64),
debido a que muchos de estos pacientes ya vienen con
un estado de malnutrición por el desgaste previo antes del ingreso a la
UCI. Esto se agrava debido a que,
durante el curso temprano de la admisión a la UCI, el
inicio de la nutrición enteral se retrasa con frecuencia
por la presencia de shock, hipoxemia, hipercapnia o
acidosis potencialmente mortales (75). La interacción
entre las enfermedades infecciosas y el estado nutricional demuestran
que una nutrición deficiente conduce
a una mayor patogenicidad del agente infeccioso (76).
En la figura 4, se puede observar el algoritmo de elección de nutrición.
Nutrición parenteral total
La nutrición parenteral total en los pacientes con COVID-19 en la UCI,
sigue los mismos principios que el
manejo del paciente en estado crítico. Puede indicarse
como tratamiento nutricional inicial, como suplementaria a la nutrición
enteral o secundaria a la supresión
de la nutrición enteral. En todos los casos es necesario
evaluar al paciente tanto su estado nutricional como
metabólico.
Los pacientes que presenten un IMC < 18,5 kg/m²
requieren una decisión rápida de soporte nutricional
debido a su estado de depleción y a los efectos de desgaste severo que
causa el COVID-19; esto puede incrementarse con periodos prolongados de
inanición o
semiinanición, aumentando el riesgo nutricional. En
ellos el SR se puede presentar fácilmente, más aún,
cuando pertenecen a la tercera edad. El cálculo calórico puede
estimarse de una manera simple utilizando
entre 25 – 30 kcal/ kg/d de peso (65), dada la dificultad para
determinarla por calorimetría indirecta.
Aquellos con IMC > 30 kg/m² el riesgo que presentan
es la sobrealimentación con las complicaciones metabólicas derivadas
por esta causa que agravan la enfermedad de base (54,55).
Los cálculos proteicos y calóricos se pueden realizar
a partir del peso ideal calculado con IMC 23 kg/m²
y la administración calórica debe comenzar con el
70 % de los requerimientos (67,68). La provisión proteica debe estar
entre 1,3 - 2,0 g/kg peso los cuales
deben administrarse en forma progresiva, siempre evaluando la función
renal (54,55,67).
En pacientes obesos (IMC entre 30 - 40 kg/m²
) el aporte calórico debe estar entre 11 - 14 kcal/kg de peso
actual y aportes proteicos entre 2,0 - 2,5 g de proteína
por kg de peso ideal (54).
El aporte de carbohidratos a base de glucosa en la
mezcla de nutrición parenteral debe estar entre 100
- 150 g/día dependiendo de los niveles de glucemia,
los cuales se deben mantener entre 140 - 180 mg/dl
(54,55,65,67). Tal como se describió anteriormente
en la sección del manejo del paciente no crítico con
COVID-19 y recordar que el aporte calórico de la glucosa es de 3,4
kcal/g.
La selección del tipo de lípidos es fundamental por
las implicaciones proinflamatorias que presentan las
emulsiones a base de soya (33,56,60,60-64,77,78) por
lo tanto, se recomienda el empleo de mezclas de lípidos, las cuales
provean omega 3 y disminuyan el aporte en exceso de omega 6, tal como
se observa en el anexo 1. Esto requiere monitoría de triglicéridos en
sangre
cuyos parámetros también fueron descritos sección del
manejo del paciente no crítico con COVID-19.
Una fuente de lípidos que no es muy clara es a través del empleo del
propofol siendo necesario evaluar
los efectos tanto metabólicos como calóricos. Este se
encuentra disponible en una emulsión similar a los lípidos parenterales
al 10 % y proporciona 1,1 kcal/ml
como grasa. La preparación disponible contiene 1 - 2 % de propofol, 10
% aceite des soya, 1,2 % de fosfolípidos de huevos emulsificados como
agente emulsificador; 2,25 % glicerol como agente de tonificación y
ajuste del hidróxido de sodio para ajustar el pH. El
propofol contiene 1,1 kcal/ml. Por lo tanto, a una tasa
de infusión de 20 ml/h en 24 h, el valor calórico de
la infusión de propofol es 20 x 1,1 × 24 = 528 kcal
(79). En el estudio de Bousie et al (79), el promedio de
propofol en los primeros 7 días fue de 297 kcal. Como
se mencionó el exceso de ácido linoleico promueve la
inflamación, la coagulación, la inmunosupresión y en
cantidades altas perjudican la elongación de los omega-3 (EPA y DHA)
(33,56,60–64,77,78).
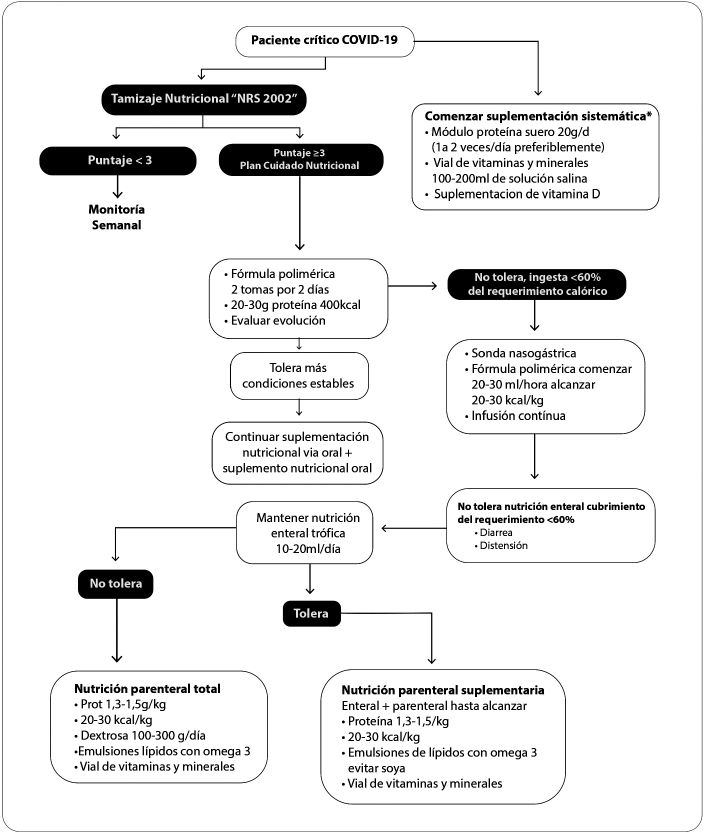
Figura 4. Algoritmo de elección nutricional del paciente
hospitalizado crítico con COVID-19.
Autoría propia
El aporte de viales de vitaminas y minerales debe ser
diario y es mandatorio; el contenido de los viales disponibles se
encuentra en los anexos 2 y 3. La suplencia
de electrolitos debe manejarse de acuerdo con las condiciones diarias.
Los pacientes críticamente enfermos
tienen una mayor posibilidad de disminuir los niveles
séricos de fósforo y potasio, excepto en escenarios
donde se presenta falla renal y las concentraciones estén elevadas, por
lo tanto, es necesario hacer ajustes
en el aporte de estos electrolitos y evaluar los niveles
de fósforo sanguíneo dentro de la monitoria rutinaria.
Berger (80) enfatiza la necesidad de crear procedimientos de operación
o estándar (SOP) que se deben
adaptar a nivel local para el seguimiento de la nutrición enteral y
parenteral. En este SOP se incluyen las
observaciones clínicas, los parámetros de laboratorio
(incluida la glucosa en sangre, los electrolitos, los triglicéridos,
las pruebas hepáticas) y el monitoreo del
gasto energético y la composición corporal, centrándose en la
prevención y la detección temprana de complicaciones relacionadas con
la nutrición.
Nutrición parenteral suplementaria
En pacientes para quienes la nutrición enteral exclusiva no cubre las
demandas proteico-calóricas se recomienda el empleo de nutrición
parenteral suplementaria.
La indicación se basa en no permitir la ausencia de alimentación por
más de 72 h independiente de su vía de
administración. Se sabe que la subalimentación durante varios días está
asociada con pérdida muscular y debilidad, mayor riesgo de infección,
duración prolongada de la ventilación mecánica y aumento en la estancia
en la UCI con el subsecuente incremento de mortalidad (81,82). En el
estudio de Heidegger
et al
(83) se demostró una reducción del 35 % del riesgo de infección
nosocomial cuando se empleó la nutrición parenteral
suplementaria en aquellos pacientes cuyo aporte por la
nutrición enteral era menor del 60 %. En el caso de los
pacientes con COVID-19, algunos pueden presentar
alteraciones gastrointestinales que impiden la utilización de la vía
entérica (81,82) y otros debido al soporte
ventilatorio que reciben, se les administra solamente
cantidades tróficas de nutrición enteral la cual ayuda
a mantener la integridad del tracto gastrointestinal,
pero sin lograr el aporte proteico calórico requerido
o incluso de vitaminas y minerales (84). La nutrición
parenteral suplementaria es una respuesta para lograr
el manejo de una terapia médica nutricional apropiada
y complementa la nutrición enteral. Esta se puede ser
administrada por un catéter central o periférico. En la
tabla 5 (33) se muestra la relación del tipo de nutrición
con relación al soporte respiratorio.
Manejo nutricional del paciente post
COVID- 19
Los pacientes con COVID-19 se pueden dividir en
aquellos que estuvieron en cuarentena en sus hogares,
aquellos hospitalizados, pero no requirieron intubación y los manejados
con ventilación mecánica en la
unidad de cuidado intensivo.
El manejo más sencillo, pero igual de importante es
el de las personas que se encuentran en el hogar en cuarentena. En
ellos, la recomendación debe tener una
alimentación balanceada y en lo posible realizar actividad física. Las
características de esta alimentación
se explicaron al principio del artículo, recordando la
importancia de seleccionar una alimentación alta en
proteínas, preferiblemente de alto valor biológico (origen animal). En
caso de anorexia y pérdida de peso,
es necesario consultar un profesional en nutrición y
dietética y considerar la inclusión de suplementos altos en proteína
(30 g) y energía (400 kcal), tal como lo
recomiendan las guías de ESPEN (33). En los casos
leves y de acuerdo con la información publicada (85)
se observó que el tiempo de recuperación es de aproximadamente 2
semanas.
Tabla 5. Soporte nutricional dependiendo del soporte respiratorio
en la UCI
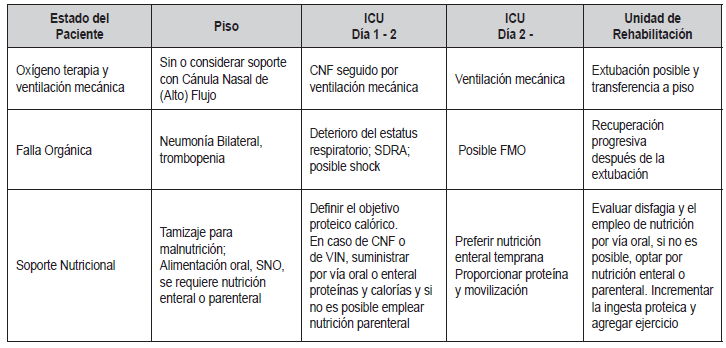
Según la progresión de la infección, se propone una terapia
nutricional médica en asociación con el soporte respiratorio en el
entorno
de cuidados intensivos. Abreviaturas: UCI, unidad de cuidados
intensivos; CNF, cánula nasal de flujo; VM, ventilación mecánica; SDRA
agudo, síndrome de dificultad respiratoria; FMO, falla multiorgánica;
SNO, suplemento nutricional oral. Tomado de Barazzoni et at (33)
El compromiso nutricional como es de esperar es mayor en los casos
severos o en quienes estuvieron en cuidado intensivo. Este grupo de
pacientes va a presentar
un desgaste proteico-calórico importante secundario
al hipercatabolismo e hipermetabolismo secundario a
la infección y al estado crítico que padecieron, situación que puede
verse empeorada en aquellos que recibieron un soporte nutricional
inadecuado o nulo. En
ellos la recuperación puede tardar entre 4 - 8 semanas
siempre y cuando se encuentren en un programa de recuperación
nutricional y terapia física. Esta movilidad
reducida lleva a una atrofia muscular rápida, pérdida
de la fuerza y disminución de la funcionabilidad. El
estudio de Kortebein (86), muestra que solo 10 días de
reposo en adultos mayores sanos inducen una disminución del 30 % en la
síntesis de proteínas musculares
y una reducción de la masa magra en las piernas del
6 % que resulta en una reducción de la fuerza muscular
del 16 %. Esto se expresa como una disminución de la
masa magra total que no necesariamente se traduce
en un cambio de peso, pero si en una pérdida de masa
muscular, implicando una ganancia de tejido adiposo
y deterioro del estado de salud en general. Cuando se compara con lo
que sucede en adultos jóvenes después
de 14 - 28 días de reposo en cama, el fenómeno de
sarcopenia en el adulto mayor es mucho más severo
(87,88). Ser dado de alta de la UCI, no necesariamente quiere decir que
está recuperado, debido a que se
presentan complicaciones secundarias como malnutrición, fatiga,
cansancio e incluso discapacidad mental,
entre otros (87). Esto se ve agravado por la presencia
de disfagia que ocurre en los pacientes con intubación
orotraqueal prolongada, la cual alcanza a durar hasta
21 días después de la extubación, con mayor efecto en
los adultos mayores en quienes la prevalencia se incrementa hasta el 56
% de los pacientes después de
48 h de intubación orotraqueal (89). Una de las causas
importantes de disfagia es su relación con la pérdida
de masa muscular por lo que es necesario emplear las
pruebas de deglución idealmente realizados por un
fonoaudiólogo con los debidos equipos de protección
personal. En algunos casos se puede recurrir a la colaboración de las
enfermeras encargadas del cuidado
diario o emplear recursos de telemedicina. Estos son
una forma rápida para identificar la probabilidad de
disfagia, evaluar la seguridad de la ingesta de alimentos por vía oral
y la necesidad de una forma alternativa
de alimentación (90). Si el paciente presenta alteraciones de la
deglución se recomienda el empleo de sonda
nasogástrica en lugar de una sonda de gastrostomía
debido a la simplicidad de la inserción y a la minimización de los
riesgos tanto para el paciente como para
los profesionales de salud o en ocasiones para los cuidadores del
paciente en caso de ser dados de alta con
dichos dispositivos.
En lo que respecta a la alimentación por vía oral, el
aspecto de la comida para disfagia no siempre tiene
el mejor color, sabor o aspecto y las características
dependen de la recomendación del profesional en fonoaudiología (90,91).
Ver
Figuras 5 y 6.
En algunos casos, la disfagia se puede ver agravada por
la presencia de anosmia, anorexia y disgeusia que suelen acompañar esta
enfermedad. Nuevamente es necesario monitorear la ingesta por vía oral
y si es menor
que el 60 % de los requerimientos diarios, se recomienda la
fortificación de alimentos con módulos de proteína y aceite de oliva
con las comidas; el empleo de
suplementos nutricionales orales, nutrición enteral por
sonda nasogástrica o distal y en caso necesario nutrición parenteral
total o suplementaria según se muestra
tanto en la
figura 2 como se
describe en el algoritmo en
la
figura 5 (33,90).

Figura 5. Clasificación de la consistencia de alimentos y
bebidas para el manejo de la disfagia.
Modificado de Burgos R et al (90)
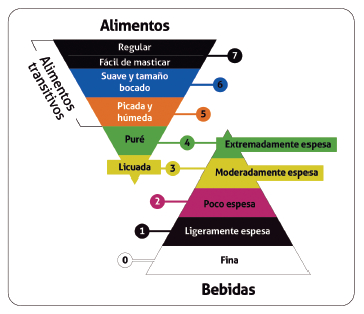
Figura 6. Clasificación de la consistencia de alimentos y
bebidas para el manejo de la disfagia.
Tomado de International Dysphagia Diet Standardization
Initiative (91)
Conclusión
El COVID-19 está aquí para quedarse. La intervención
nutricional hace parte del manejo integral y del enfoque terapéutico de
cualquier paciente. La nutrición es
resultado de un proceso que viene desde tiempo atrás
donde una alimentación balanceada y el ejercicio es
parte fundamental. Es necesario considerar el impacto
de los hábitos de estilo de vida y el consumo de alimentos poco
saludables tanto en la susceptibilidad como a
la recuperación del COVID-19. Por lo tanto, nuestra
recomendación es que las personas se abstengan de comer alimentos altos
en grasas saturadas y azúcar y en
su lugar consuman fuentes proteicas de alto valor biológico, frutas,
verduras y leguminosas, grasas no saturadas fuentes de omega 3 y
antioxidantes para mejorar
la respuesta de la función inmune.
En general los pacientes que se recuperarán de
COVID-19, presentan un desgaste nutricional elevado,
reflejado en pérdida de peso a expensas principalmente de la masa
muscular, fatiga y disfagia entre otros,
incrementando las posibilidades de enfermedades
crónicas. Esta situación puede verse agravadas por la
inoportuna intervención nutricional dentro del manejo integral de los
pacientes con COVID-19, lo cual
genera efectos secundarios que incrementan las complicaciones, retardan
la recuperación, aumentan la estancia hospitalaria y los costos de
hospitalización. Los
pacientes con mayor riesgo de desplome nutricional
requieren un seguimiento estricto, en especial adultos
mayores, pacientes frágiles o multimorbidos.
Un soporte nutricional oportuno, adecuado y razonable para pacientes
con alto riesgo nutricional en
pacientes con COVID-19, podría mejorar efectivamente el estado
nutricional y los resultados clínicos.
Una adecuada implementación y cumplimiento de
las recomendaciones nutricionales esenciales para
los pacientes y como parte de un proceso interno de
las instituciones de asignar recursos, proporciona un
mejor impacto en supervivencia de esta enfermedad
potencialmente mortal en especial en población más
susceptible. Es nuestra responsabilidad integrar dentro
de los procesos de atención la valoración nutricional
temprana, en especial en pacientes con infección por
SARS Cov2-Covid-19 para combatir la malnutrición
que de por sí, ya compromete a gran parte de nuestra
población colombiana y puede aparecer o empeorar al
contagiarse con esta enfermedad.
Agradecimientos
A la profesora Mette Berger, por la revisión del texto
y los aportes al mismo. La Dra. Mette Berger fue la
jefe del Servicio de Cuidados Intensivos para Adultos
y Quemaduras del Hospital Universitario de Lausanna
CHUV, Lausana, Suiza por 30 años. Es uno de los líderes de las guías de
cuidado crítico de la Sociedad Europea de Nutrición Clínica y
Metabolismo (ESPEN).
Es la presidenta de la sección Metabolismo-NutriciónEndocrinología de
la ESCIM, y dirige el grupo de trabajo sobre directrices de elementos
traza de ESPEN.
Cumplimiento de normas éticas
Consentimiento informado: Este estudio es una revisión de la
literatura, y como tal no hay necesidad de un
consentimiento informado ni de aprobación del Comité de Ética
Institucional.
Conflictos de interés
Patricia Savino Lloreda es asesora científica de Boydorr
Nutrition.
Financiación
Este estudio fue autofinanciado.
Referencias
1. Phan LT, Nguyen TV, Luong QC,
Nguyen TV, Nguyen
HT, Le HQ, et al. Importation and Human-to-Human
Transmission of a Novel Coronavirus in Vietnam. N Engl
J Med. 2020;382(9):872–4.
2. Zhu N, Zhang D, Wang W, Li X, Yang
B, Song J, et al.
A Novel Coronavirus from Patients with Pneumonia in
China, 2019. N Engl J Med. 2020;382(8):727–33.
3. Bouadma L, Lescure F-X, Lucet J-C,
Yazdanpanah Y,
Timsit J-F. Severe SARS-CoV-2 infections: practical
considerations and management strategy for intensivists. Intensive Care
Med. 2020;46(4):579–82.
4. Coronavirus Disease (COVID-19) -
events as they happen
[Internet].2019 (consultado el 28 de julio de 2020]. Disponible en:
https://www.who.int/emergencies/diseases/novel-coronavirus-2019/events-as-they-happen
5. Maruyama T, Fujisawa T, Suga S,
Nakamura H, Nagao
M, Taniguchi K, et al. Outcomes and Prognostic Features of Patients
With Influenza Requiring Hospitalization
and Receiving Early Antiviral Therapy: A Prospective
Multicenter Cohort Study. Chest. 2016;149(2):526–34.
6. Calder PC. Nutrition, immunity and
COVID-19. BMJ Nutrition, Prevention & Health [Internet]. 2020
[consultado
el 29 de julio de 2020];3(1). Disponible en:
https://nutrition.bmj.com/content/3/1/74
7. Correia M. Nutrition in times of
Covid-19, how to trust
the deluge of scientific information. Curr Opin Clin Nutr
Metab Care. 2020;23(4):288–93.
8. Zhou F, Yu T, Du R, Fan G, Liu Y,
Liu Z, et al. Clinical
course and risk factors for mortality of adult inpatients
with COVID-19 in Wuhan, China: a retrospective cohort
study. Lancet. 2020;395(10229):1054–62.
9. Stefan N, Birkenfeld AL, Schulze
MB, Ludwig DS. Obesity and impaired metabolic health in patients with
COVID-19. Nat Rev Endocrinol. 2020;16(7):341–2.
10. Wu Z, McGoogan JM.
Characteristics of and Important
Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China:
Summary of a Report of 72
314 Cases From the Chinese Center for Disease Control
and Prevention. JAMA. 2020;
11. Costa D, Barbalho MC, Miguel GPS,
Forti EMP, Azevedo JLMC. The impact of obesity on pulmonary function in
adult women. Clinics (Sao Paulo). 2008;63(6):719–24.
12. Short KR, Kedzierska K, van de
Sandt CE. Back to the
Future: Lessons Learned From the 1918 Influenza Pandemic. Front Cell
Infect Microbiol. 2018;8:343.
13. Ministerio de Salud y Protección
Social. Encuesta Nacional
de Situación Nutricional de Colombia. [Internet]. 2015 [consultado el
28 de julio de 2020]. Disponible en:
https://www.minsalud.gov.co/Paginas/Gobierno-presenta-Encuesta-Nacional-de-Situaci%C3
14. Obesity and overweight.
[Internet].2020 [consultado el
20 de julio de 2020]. Disponible en: https://www.who.int/newsroom/factsheets/detail/obesity-and-overweight
15. Bornstein SR, Dalan R, Hopkins D,
Mingrone G, Boehm
BO. Endocrine and metabolic link to coronavirus infection. Nat Rev
Endocrinol. 2020;16(6):297–8.
16. COVID-19 and Food Safety:
Guidance for Food Businesses [Internet].2019 [consultado el 28 de julio
de
2020]. Disponible en:
https://www.who.int/publicationsdetail-redirect/covid-19and-food-safety-guidance-forfood-businesses
17. Centers for Disease Control and
Prevention CDC. Coronavirus Disease 2019 (COVID-19). [Internet]. 2020
(consultado el 28 de julio de 2020). Disponible en:
https://www.cdc.gov/coronavirus/2019-ncov/daily-life-coping/
foodand-COVID-19.html
18. Centers for Disease Control and
Prevention CDC. Steps
to Safe and Healthy Fruits & Vegetables. [Internet]. 2020
[consultado el 28 de julio de 2020]. Disponible en:
https://www.cdc.gov/foodsafety/communication/stepshealthyfruits-veggies.html
19. van Doremalen N, Bushmaker T,
Morris DH, Holbrook
MG, Gamble A, Williamson BN, et al. Aerosol and surface stability of
HCoV-19 (SARS-CoV-2) compared to
SARS-CoV-1. medRxiv. 2020;
20. Cena H, Calder PC. Defining a
Healthy Diet: Evidence
for The Role of Contemporary Dietary Patterns in Health
and Disease. Nutrients. 2020;12(2).
21. Zhang J, Taylor EW, Bennett K,
Saad R, Rayman MP.
Association between regional selenium status and reported outcome of
COVID-19 cases in China. Am J
Clin Nutr [Internet].2020 [consultado el 28 de abril de
2020];111(6):1297-1299. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7197590/
22. Carmona-Fonseca J, Guzmán-Pérez
V. Estudio piloto
sobre selenio plasmático en personas sanas de Antioquia, Colombia.
Perspectivas en nutrición humana.
2011;13(1):11–20.
23. U.S. Department of Health and
Human Services. Dietary
Guidelines for Americans, 2015-2020. 8th ed. Parker
Publishing Company; 2020. 144p p.
24. Vargas M. Alimentación saludable
y balanceada – Guías
alimentarias basadas en alimentos. En: Cubillos S, Vargas M, Guerrero
L, Pinzón G, Pinzón O, Molina N, editores. Recomendaciones de
alimentación y nutrición ante
la declaración de emergencia sanitaria por COVID-19
en Colombia. Primera. Bogotá, Colombia: Universidad
Nacional de Colombia; 2020. p. 23–31.
25. ICBF. Educación Alimentaria y
Nutricional. [Internet].2020
[consultado el 28 de julio de 2020]. Disponible en: https://www.icbf.gov.co/bienestar/nutricion/educacion-alimentaria
26. Strengthening the health system
response to COVID-19 –
Recommendations for the WHO European
Region: policy brief, 1 April 2020 [Internet].2020 [consultado el 28 de
julio de 2020). Disponible en:
https://www.euro.who.int/en/health-topics/health-emergencies/coronavirus-covid-19/technical-guidance/strengthening-the-health-system-response-to-covid-19/
strengthening-the-health-system-response-to-covid19-recommendations-for-the-who-europeanregionpolicybrief,-1-april-2020
27. Krznarić Ž, Bender DV, Laviano A,
Cuerda C, Landi F,
Monteiro R, et al. A simple remote nutritional screening
tool and practical guidance for nutritional care in primary practice
during the COVID-19 pandemic. Clin Nutr.
2020;39(7):1983–7.
28. Varios. Atención y
recomendaciones de alimentación y
nutrición en COVID-19. Conexión nutrición [Internet].
2020 [consultado el 28 de abril de 2020]. Disponible en:
https://conexionnutricion.com/producto/suplemento2/
29. How to stay physically active
during COVID-19 selfquarantine [Internet]. 2020 [consultado el 28 de
julio
de 2020]. Disponible en:
https://www.euro.who.int/en/health-topics/disease-prevention/physical-activity/news/news/2020/3/how-to-stay-physically-active-during-covid-19-self-quarantine
30. Siddiqi HK, Mehra MR. COVID-19
illness in native and
immunosuppressed states: A clinical-therapeutic staging
proposal. J Heart Lung Transplant. 2020;39(5):405–7.
31. Caccialanza R, Pedrazzoli P,
Cereda E, Gavazzi C, Pinto C, Paccagnella A, et al. Nutritional Support
in Cancer Patients: A Position Paper from the Italian Society
of Medical Oncology (AIOM) and the Italian Society of
Artificial Nutrition and Metabolism (SINPE). J Cancer.
2016;7(2):131–5.
32. Jin Y-H, Cai L, Cheng Z-S, Cheng
H, Deng T, Fan Y-P,
et al. A rapid advice guideline for the diagnosis and
treatment of 2019 novel coronavirus (2019-nCoV) infected pneumonia
(standard version). Mil Med Res.
2020;7(1):4.
33. Barazzoni R, Bischoff SC, Breda
J, Wickramasinghe K,
Krznaric Z, Nitzan D, et al. ESPEN expert statements
and practical guidance for nutritional management
of individuals with SARS-CoV-2 infection. Clin Nutr.
2020;39(6):1631–8.
34. “MUST” Toolkit [Internet].2020
[consultado el 29 de julio de 2020].Disponible en:
https://www.bapen.org.uk/screening-and-must/must/must-toolkit
35. Kondrup J, Allison SP, Elia M,
Vellas B, Plauth M, Educational and Clinical Practice Committee,
European Society of Parenteral and Enteral Nutrition (ESPEN). ESPEN
guidelines for nutrition screening 2002. Clin Nutr.
2003;22(4):415–21.
36. Chen N, Zhou M, Dong X, Qu J,
Gong F, Han Y, et al.
Epidemiological and clinical characteristics of 99 cases
of 2019 novel coronavirus pneumonia in Wuhan, China:
a descriptive study. Lancet. 2020;395(10223):507–13.
37. Howard P. Practical nutritional
support: working together
to make it happen. Proc Nutr Soc. 2001;60(3):415–8.
38. McPherson RA, Hardy G. Clinical
and nutritional benefits of cysteine-enriched protein supplements. Curr
Opin
Clin Nutr Metab Care. 2011;14(6):562–8.
39. Rondanelli M, Faliva MA, Gasparri
C, Peroni G, Spadaccini D, Maugeri R, et al. Current opinion on dietary
advice in order to preserve fat-free mass during a low-calorie
diet. Nutrition. 2020;72:110667.
40. Cross ML, Gill HS.
Immunomodulatory properties of
milk. Br J Nutr. 2000;84 Suppl 1:S81-89.
41. Ng TB, Cheung RCF, Wong JH, Wang
Y, Ip DTM, Wan
DCC, et al. Antiviral activities of whey proteins. Appl Microbiol
Biotechnol. 2015;99(17):6997–7008.
42. Teixeira FJ, Santos HO, Howell
SL, Pimentel GD. Whey
protein in cancer therapy: A narrative review. Pharmacol
Res. 2019;144:245–56.
43. Cereda E, Turri A, Klersy C,
Cappello S, Ferrari A, Filippi
AR, et al. Whey protein isolate supplementation improves body
composition, muscle strength, and treatment
tolerance in malnourished advanced cancer patients undergoing
chemotherapy. Cancer Med. 2019;8(16):6923–
32.
44. Olsen MF, Abdissa A, Kæstel P,
Tesfaye M, Yilma D, Girma T, et al. Effects of nutritional
supplementation for HIV
patients starting antiretroviral treatment: randomised
controlled trial in Ethiopia. BMJ [Internet]. 2014 [consultado el 29 de
julio de 2020];348. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4022776/
45. Jiménez-Sousa MÁ, Martínez I,
Medrano LM, Fernández-Rodríguez A, Resino S. Vitamin D in Human
Immunodeficiency Virus Infection: Influence on Immunity and
Disease. Front Immunol. 2018;9:458.
46. Havers F, Smeaton L, Gupte N,
Detrick B, Bollinger
RC, Hakim J, et al. 25-Hydroxyvitamin D insufficiency
and deficiency is associated with HIV disease progression and
virological failure post-antiretroviral therapy
initiation in diverse multinational settings. J Infect Dis.
2014;210(2):244–53.
47. Gruber-Bzura BM. Vitamin D and
Influenza-Prevention
or Therapy? Int J Mol Sci. 2018;19(8).
48. ASPEN. Informe de ASPEN sobre
procesos de práctica
de soporte nutricional con COVID-19. American Society
for Parenteral and Enteral Nutrition. [Internet]. 2020 [consultado el
29 de julio de 2020];14. Disponible en:
https://www.nutritioncare.org/uploadedFiles/Documents/Guidelines-and-Clinical-Resources/COVID19/ASPEN-Nutrition-Support-COVID-19-The-First-Response-Spanish.pdf
49. Singer P, Rattanachaiwong S. To
eat or to breathe? The
answer is both! Nutritional management during noninvasive ventilation.
Crit Care. 2018;22(1):27.
50. Kogo M, Nagata K, Morimoto T, Ito
J, Sato Y, Teraoka
S, et al. Enteral Nutrition Is a Risk Factor for Airway
Complications in Subjects Undergoing Noninvasive
Ventilation for Acute Respiratory Failure. Respir Care.
2017;62(4):459–67.
51. Pan L, Mu M, Yang P, Sun Y, Wang
R, Yan J, et al.
Clinical Characteristics of COVID-19 Patients With
Digestive Symptoms in Hubei, China: A Descriptive,
Cross-Sectional, Multicenter Study. Am J Gastroenterol.
2020;115(5):766–73.
52. Sobotka L, Soeters P, Jolliet P,
Pichard C, Singer P. Nutritional support in the critically ill and
septic patients. En:
Sobotka L, Allison S, Meier R, Schneider S, Soeters P,
editores. Basics in clinical nutrition. 5th ed. Prague: House Galén;
2019. p. 402–9.
53. Singer P, Berger MM, Van den
Berghe G, Biolo G, Calder P, Forbes A, et al. ESPEN Guidelines on
Parenteral
Nutrition: intensive care. Clin Nutr. 2009;28(4):387–400.
54. McClave SA, Taylor BE, Martindale
RG, Warren MM,
Johnson DR, Braunschweig C, et al. Guidelines for the
Provision and Assessment of Nutrition Support Therapy
in the Adult Critically Ill Patient: Society of Critical Care
Medicine (SCCM) and American Society for Parenteral
and Enteral Nutrition (A.S.P.E.N.). JPEN J Parenter Enteral Nutr.
2016;40(2):159–211.
55. Savino P, Patiño JF. Metabolismo
y nutrición del paciente
en estado crítico. Rev Colomb Cir. 2016;31(2):108–27.
56. Calder PC, Grimble RF. Nutrients
that influence inflammation and immunity: omega-3 fatty acids. En:
Sobotka L, editor. Basics of Clinical Nutrition. 4th edición.
[Internet]. Galen; 2011 [consultado el 16 de marzo de
2019]. p. 292–9. Disponible en:
https://eprints.soton.ac.uk/337381/
57. Calder PC, Jensen GL, Koletzko
BV, Singer P, Wanten
GJA. Lipid emulsions in parenteral nutrition of intensive
care patients: current thinking and future directions. Intensive Care
Med. 2010;36(5):735–49.
58. Singer P, Shapiro H, Theilla M,
Anbar R, Singer J, Cohen
J. Anti-inflammatory properties of omega-3 fatty acids
in critical illness: novel mechanisms and an integrative
perspective. Intensive Care Med. 2008;34(9):1580–92.
59. Mizock BA, DeMichele SJ. The
acute respiratory distress
syndrome: role of nutritional modulation of inflammation
through dietary lipids. Nutr Clin Pract. 2004;19(6):563–74.
60. Wanten GJA, Calder PC. Immune
modulation by parenteral lipid emulsions. Am J Clin Nutr.
2007;85(5):1171–84.
61. Calder PC. Lipids for intravenous
nutrition in hospitalised adult
patients: a multiple choice of options. Proc
Nutr Soc. 2013;72(3):263–76.
62. Green P, Theilla M, Singer P.
Lipid metabolism in critical
illness. Curr Opin Clin Nutr Metab Care. 2016;19(2):111–5.
63. Adolph M, Carpenttier P, Sobotka
L. Lipids. En: Sobotka
L, Allison S, Meier R, Schneider S, Soeters P, editores.
Basics in clinical nutrition. 5th ed. Prague: House Galén;
2019. p. 383–9.
64. ASPEN. Nutrition therapy in the
patient with COVID-19
disease requiring ICU. ASPEN; 2020 p. 9.
65. Berger MM. Nutrition Status
Affects COVID-19 Patient
Outcomes. JPEN J Parenter Enteral Nutr. 2020;
66. Zhao X, Li Y, Ge Y, Shi Y, Lv P,
Zhang J, et al. Evaluation
of Nutrition Risk and Its Association With Mortality Risk
in Severely and Critically Ill COVID-19 Patients. JPEN J
Parenter Enteral Nutr. 2020;
67. Singer P, BlaserAR, Berger
MM,Alhazzani W, Calder PC,
Casaer MP, et al. ESPEN guideline on clinical nutrition in
the intensive care unit. Clin Nutr. 2019;38(1):48–79.
68. Berger MM, Berger MM, editores.
General ICU Patients.
En: Critical Care Nutrition Therapy for Non-nutritionists
[Internet]. Switzerland: Springer International Publishing;
2018 [citado el 28 de julio de 2020].p.1–13. Disponible
en: https://www.springer.com/gp/book/9783319586519
69. Stanga Z, Sobotka L, Schueltz P.
Refeeding syndrome.
En: Sobotka L, Allison S, Forbes, A, Meier R, Schneider
S, Soeters P, editores. Basics in clinical nutrition. 5th ed.
Prague: House Galén; 2019. p. 383–9.
70. Mehanna HM, Moledina J, Travis J.
Refeeding syndrome: what it is, and how to prevent and treat it. BMJ.
2008;336(7659):1495–8.
71. Singer P, Cohen J. How could we
make nutrition in
the intensive care unit simple? Rev Bras Ter Intensiva.
2016;28(4):369–72.
72. Arkin N, Krishnan K, Chang MG,
Bittner EA. Nutrition in
critically ill patients with COVID-19: Challenges and special
considerations. Clin Nutr. 2020;39(7):2327–8.
73. Kaafarani HMA, Moheb ME,
Hwabejire JO, Naar L,
Christensen MA, Breen K, et al. Gastrointestinal Complications in
Critically Ill Patients With COVID-19. Ann
Surg. 2020;
74. Saez de la Fuente I, Saez de la
Fuente J, Quintana
Estelles MD, Garcia Gigorro R, Terceros Almanza LJ,
Sanchez Izquierdo JA, et al. Enteral Nutrition in Patients
Receiving Mechanical Ventilation in a Prone Position.
JPEN J Parenter Enteral Nutr. 2016;40(2):250–5.
75. Adam MD, Dhaliwal R, Rupinder D,
Day AG, Andrew
GD, Ridley EJ, et al. Comparisons between intragastric and small
intestinal delivery of enteral nutrition in the
critically ill: a systematic review and meta-analysis. Crit
Care. 2013;17(3):R125.
76. Beck MA, Levander OA. Host
nutritional status and its
effect on a viral pathogen. J Infect Dis. 2000;182 Suppl
1:S93-96.
77. Calder PC. The 2008 ESPEN Sir
David Cuthbertson
Lecture: Fatty acids and inflammation--from the membrane to the nucleus
and from the laboratory bench to
the clinic. Clin Nutr. 2010;29(1):5–12.
78. Vanek VW, Seidner DL, Allen P,
Bistrian B, Collier S,
Gura K, et al. A.S.P.E.N. position paper: clinical role for
alternative intravenous fat emulsions. Nutr Clin Pract.
2012;27(2):1–43.
79. Bousie E, van Blokland D, Lammers
HJW, van Zanten
ARH. Relevance of non-nutritional calories in mechanically ventilated
critically ill patients. Eur J Clin Nutr.
2016;70(12):1443–50.
80. Berger MM, Reintam-Blaser A,
Calder PC, Casaer M,
Hiesmayr MJ, Mayer K, et al. Monitoring nutrition in the
ICU. Clin Nutr. 2019;38(2):584–93.
81. Berger MM, Achamrah N, Pichard C.
Parenteral nutrition in intensive care patients: medicoeconomic
aspects.
Curr Opin Clin Nutr Metab Care. 2018;21(3):223–7.
82. Petros S, Horbach M, Seidel F,
Weidhase L. Hypocaloric
vs Normocaloric Nutrition in Critically Ill Patients: A Prospective
Randomized Pilot Trial. JPEN J Parenter Enteral
Nutr. 2016;40(2):242–9.
83. Heidegger CP, Berger MM, Graf S,
Zingg W, Darmon
P, Costanza MC, et al. Optimisation of energy provision with
supplemental parenteral nutrition in critically ill
patients: a randomised controlled clinical trial. Lancet.
2013;381(9864):385–93.
84. Oshima T, Heidegger C-P, Pichard
C. Supplemental Parenteral Nutrition Is the Key to Prevent Energy
Deficits in
Critically Ill Patients. Nutr Clin Pract. 2016;31(4):432–7.
85. Report of the WHO-China Joint
Mission on Coronavirus
Disease 2019 (COVID-19) [Internet]. 2020 [consultado
el 28 de julio de 2020]. Disponible en:
https://www.who.int/publications-detail-redirect/report-of-the-who-china-joint-mission-on-coronavirus-disease-2019-(covid-19)
86. Kortebein P, Ferrando A, Lombeida
J, Wolfe R, Evans
WJ. Effect of 10 days of bed rest on skeletal muscle in
healthy older adults. JAMA. 2007;297(16):1772–4.
87. Inoue S, Hatakeyama J, Kondo Y,
Hifumi T, Sakuramoto
H, Kawasaki T, et al. Post-intensive care syndrome: its
pathophysiology, prevention, and future directions. Acute Med Surg.
2019;6(3):233–46.
88. Ferrando AA, Lane HW, Stuart CA,
Davis-Street J, Wolfe
RR. Prolonged bed rest decreases skeletal muscle and
whole body protein synthesis. Am J Physiol. 1996;270(4
Pt 1):E627-633.
89. Frajkova Z,Tedla
M,TedlovaE,Suchankova M,GeneidA.
Postintubation Dysphagia During COVID-19 OutbreakContemporary Review.
Dysphagia. 2020;35(4):549–57.
90. Burgos R, Segurola H, Bretón I.
Soporte nutricional del
paciente con ictus. Nutr Hosp. 2014;29(2):57–66.
91. International Dysphagia Diet
Standardisation Initiative.
What is the IDDSI Framework? – IDDSI [Internet]. 2019
[consultado el 26 de marzo de 2019]. Disponible en:
https://iddsi.org/framework/
Recibido:
Agosto 3 de 2020
Aprobado: Agosto 5 de 2020
Correspondencia:
Patricia Savino Lloreda
patricia.savino@gmail.com
Anexo 1. Composición de Emulsiones de Lípidos
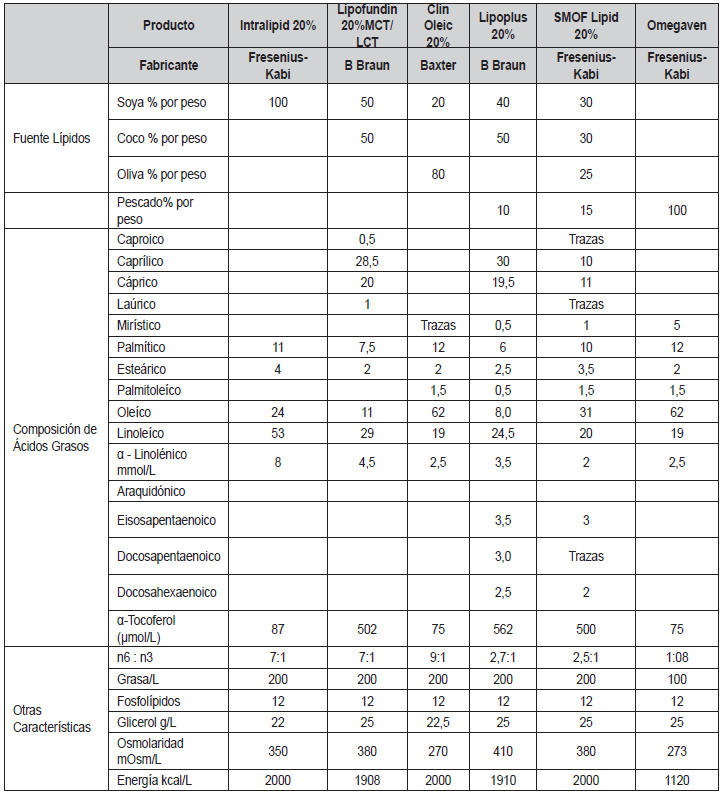
Información provista por la casa farmacéutica.
Anexo 2. Contenido de elementos traza para uso intravenosa
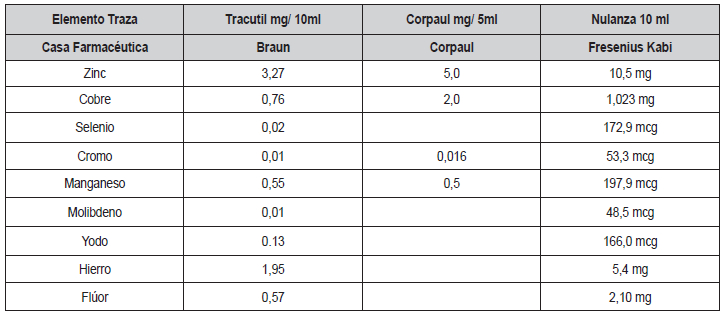
Información provista por la casa farmacéutica
Anexo 3. Contenido de vitaminas en multivitamínicos para uso intravenoso
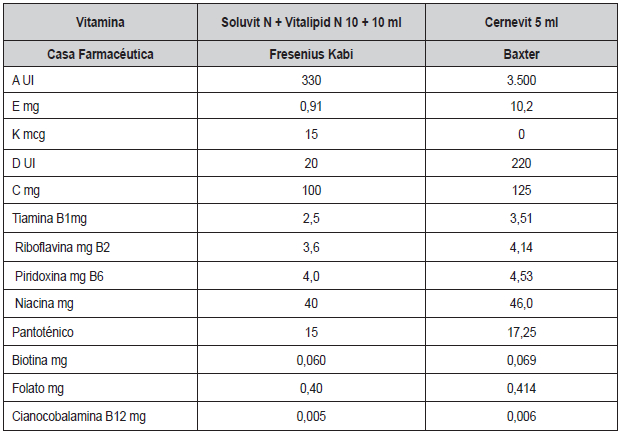
Información provista por la casa farmacéutica.

















