Resumen
Fundamento: El estudio de la
gasometría arterial en el paciente críticamente enfermo es elemental
para establecer la conducta a seguir. Entre sus alteraciones se destaca
la acidosis metabólica, trastorno
más común, letal y de mayor complejidad terapéutica en estos pacientes.
Objetivo: Profundizar en los
aspectos relacionados con la descripción de los algoritmos de
interpretación gasométrica para la acidosis metabólica basada en la
aproximación fisiológica Henderson Hasselbalch.
Método: Se realizó
una búsqueda en PubMed de los artículos que abordan la sistemática de
lectura e interpretación de la
gasometría arterial en la acidosis metabólica. Se consultaron artículos
en español e inglés. Se expone
en cada acápite una valoración sobre la impresión personal de los
autores, basado en la práctica clínica
diaria en el hospital donde laboran.
Resultados:
Los pasos lógicos establecidos para la interpretación
de la gasometría arterial permiten inicialmente identificar la acidosis
metabólica, luego los trastornos
asociados y la compensación respiratoria de una forma sistemática.
Conclusiones: El cálculo correcto
de cada fórmula, independientemente del algoritmo escogido, representa
la semiología del trastorno
que establecerá el diagnóstico definitivo.
Palabras clave: Equilibrio Ácido-Base; Análisis de los
Gases de la Sangre; Cetosis; Acidosis metabólica; Anión GAP; Gasometría
arterial.


¹ Doctor en Medicina. Especialista de 1er grado en Medicina
Intensiva y Emergencias. Profesor Asistente. Aspirante a Investigador.
Unidad de Cuidados Intensivos. Hospital clínico-quirúrgico docente
Celia Sánchez Manduley. Granma. Cuba.
² Doctora en Medicina. Especialista de 1er grado en Medicina Interna.
Profesor Instructor. Aspirante a Investigador. Servicio de Medicina
Interna. Hospital clínico-quirúrgico Celia Sánchez Manduley. Granma.
³ Doctora en Medicina.
Especialista de 2do grado en Imagenología. Profesor auxiliar.
Departamento de Imagenología. Hospital clínico-quirúrgico Celia Sánchez
Manduley. Granma. Cuba.
THE INTERPRETATION OF ARTERIAL
BLOOD GASES IN METABOLIC ACIDOSIS
Abstract
Introduction: Arterial blood
gases on critically-ill patients is essential to establish the
procedures to follow. Being an indirect measuring tool of metabolic
state, it requires a systematic
knowledge that may lead to a pathology. Among its alterations,
metabolic acidosis is considered as the most common, lethal and
therapeutically complex disorder on these patients.
Objective: Deepen aspects
related to the description of the algorithms of gasometric
interpretation for metabolic acidosis based on Henderson Hasselbalch’s
approach.
Method: A
bibliographic search of all papers related to the reading and
interpretation of arterial blood
gases on metabolic acidosis was made. It included articles both in
Spanish and English. Each
of the subtitles, provides a valuation on author’s personal viewpoints
based on their daily clinical experience in their hospitals.
Results: the logical steps
established for the interpretation of
arterial blood gases lead to the initial identification of metabolic
acidosis, then to the disorders
associated to it and the systematic respiratory compensation, in spite
of the different methods
used by the consulted authors.
Conclusions:
Regardless the algorithm chosen, the correct
calculation of each formula, represents the semiology of the disorder
that will lead to the final
diagnosis.
Keywords: (MeSH) Acid-base balance; Analysis of blood
gases; Ketosis, Metabolic acidosis; GAP
anion; arterial blood gases.
Introducción
El estudio de la gasometría
arterial en el paciente críticamente enfermo es elemental para
establecer diagnósticos, tratamientos y predecir su desenlace. Por tal
motivo, su uso como herramienta indirecta de medición del estado
metabólico requiere un conocimiento
sistematizado que oriente de manera fidedigna hacia
una patología. (1)
Dentro del amplio espectro que representan estos trastornos, se
encuentra la acidosis metabólica, disturbio
usualmente encontrado en pacientes que realizan estancias en diferentes
escenarios clínicos como la sala
de urgencias y emergencias, terapia intensiva, quirófanos, salas de
hemodiálisis entre otros. Por lo que su
identificación y manejo consecuente, dependen tanto
de la calidad de la muestra de sangre extraída, su conservación, como
también del conocimiento del clínico
que la recibe.
Con frecuencia, los textos que comentan estos temas
presentan diferencias entre la manera de identificación gasométrica de
este trastorno, dejando un vacío
en cuanto al consenso de cuál es la mejor manera de
identificarlos. Este artículo de revisión narrativa centra
su objetivo en la descripción de los diferentes algoritmos de lectura
sistemática e interpretación de la gasometría arterial en la acidosis
metabólica. Tiene como
novedad la presentación de las diversas formas de realizar el
diagnóstico, de manera tal que el que consulta
escoja la más adecuada para sí; también se presentan
consideraciones de los autores sobre estos métodos,
basados en la evidencia científica, la fisiopatología y la
experiencia acumulada en el manejo desde el escenario clínico donde
laboran.
Estrategia de búsqueda y criterio de
selección
Las referencias para esta revisión fueron identificadas
mediante la búsqueda en PubMed de los artículos que
abordan la sistemática de lectura e interpretación de la
gasometría arterial en la acidosis metabólica. En los
términos de búsqueda se incluyeron libros dedicados
a la medicina de cuidados críticos, medicina de emergencias,
nefrología, fisiología médica y bioquímica.
Solamente se revisaron las publicaciones en inglés y
español. Se seleccionaron 44 bibliografías que cumplieron con los
criterios de selección.
Desarrollo
Acidosis metabólica: definición
Es un trastorno caracterizado por la acumulación de
iones hidrógeno procedentes de los ácidos no volátiles a consecuencia
de la producción excesiva de ácidos endógenos, pérdidas anormales de
bicarbonato
(HCO₃
-
) o disminución de la excreción renal de ácidos no volátiles (2). Se
asocia a potencial de hidrógeno (pH) bajo y bajas concentraciones de
bicarbonato
plasmático (3).
Los sistemas amortiguadores de pH del organismo se
encargan de minimizar los cambios que puede provocar en el pH esta
carga ácida en el sistema. Cualquier
alteración que cause: hiperproducción de ácido, pérdida de las reservas
buffer, excreción pobre de ácido, trae
como consecuencia un balance positivo de protones
(H+), lo que desencadena una acidosis metabólica (4).
Conceptos básicos
Conociendo los valores normales en la gasometría
de algunas variables como: pH: 7,35 a 7,45; presión
parcial de dióxido de carbono (PCO₂
)
:
35 a 45 mmHg;
bicarbonato (HCO₃
-
): 22 a 26 mEq/l y exceso de bases
(BE): ±2,5 mEq/l (5, 6) se puede establecer las bases
comparativas para determinar el tipo de trastorno que
presenta el paciente, así como, si existen otros trastornos
sobreañadidos o compensatorios.
De esta secuencia de valores, se puede definir que un
cambio de valores en la PCO₂ y/o HCO₃
- influirán en
el pH extracelular, modificándolo independientemente de los sistemas
compensadores fisiológicos.
De manera que, cuando una de estas 2 variables, se
mueve lo suficiente como para provocar un cambio en
los valores habituales del pH, se utiliza el sufijo emia y
en dependencia de ese cambio se está en presencia de
una acid
emia (pH<7,35) o
alcal
emia (pH>7,45). Esta
terminología es bastante general, y permite englobar
los trastornos tanto respiratorios como metabólicos.
Así pues, también se puede inferir que si el trastorno
afecta la PCO₂ el trastorno se denomina
acido-básico
respiratorio, mientras, si es para el HCO₃
-
, entonces se
trata de un trastorno
acido-básico
metabólico.
El control estricto del pH, en el líquido extracelular
requiere una proporción PCO₂
/HCO₃
- bastante constante, así, un cambio en una determinante específica,
debe ir acompañado de un cambio proporcional en la
otra determinante, para que se mantenga la proporción PCO₂
/HCO₃
- y el pH constante.
De esta manera es cómo funciona el control ácidobásico, con los
mecanismos fisiológicos pertinentes, a
una alteración respiratoria (cambio de la PCO₂
), debe ir acompañado de una alteración metabólica (cambio
de la HCO₃
-
) y viceversa, con el objetivo de mantener
el pH constante (
Tabla 1)
(7-9).
El cambio inicial en la PCO₂
y
/o HCO₃
- se denomina trastorno acido-básico primario; mientras que la
respuesta siguiente se le llama trastorno acido-básico
compensador o secundario. Es necesario destacar que
casi siempre, las respuestas compensatorias no son lo
suficientemente intensas para mantener el pH constante (no corrigen el
trastorno), solo se limitan al cambio
de pH en función de las otras 2 variables.
Interpretación de la gasometría arterial en
la acidosis metabólica
Identificación del trastorno primario
Existen varias formas para identificar el trastorno primario; en la
experiencia práctica de los autores de este
artículo, manejando los valores del HCO₃
- y la PCO₂
,
como se muestran a continuación, han resultado útiles
para el trabajo diario.
Acidemia (pH < 7,35): si HCO₃
- < 22 mmol/l es acidosis metabólica o PCO₂ > 45 mmHg es acidosis
respiratoria y Alcalemia (pH > 7,45): si HCO₃
- > 26 mmol/l
es alcalosis metabólica o PCO₂ < 35 mmHg (alcalosis
respiratoria) (3, 6, 7)
De manera que el trastorno primario podría ser:
una Acidemia (pH < 7,35) por Acidosis metabólica
(HCO₃
- < 22 mmol/l).
Otra manera de establecer el trastorno primario, es a
través del cálculo del pH Predicho (pH p), este método
establece como referencia un valor de pH intermedio
(7,40) y utiliza la PCO₂ medida en el gasómetro, a través de la
siguiente fórmula:
pH p = 7,40 + ((40 – PCO₂
)/200)(10)
La interpretación de este resultado sería de la siguiente manera: Si el
pH p y el pH medido son similares
entonces el trastorno primario es respiratorio. Si el resultado es
desigual y se mueven en el mismo sentido
(ambos aumentan o disminuyen), el trastorno es respiratorio con
asociación de otro trastorno metabólico.
Por último, si el resultado es desigual y se mueven en
sentidos opuestos (una aumenta mientras el otro disminuye), entonces el
trastorno es metabólico solo (10).
Este método, aunque muy efectivo en cálculos, cae en el
trance cualitativo para identificar el trastorno primario.
El tercer método que se propone, utiliza también los
valores de pH y PCO₂ de la gasometría. Según este método, existirá
alteración acido-básica primaria, siempre que la PCO₂ y el pH se
encuentren fuera de los
valores normales. Si tanto el pH como la PCO₂ están alterados, se
comparará el cambio de dirección de estos. Si ambos cambian en la misma
dirección (ambos
aumentan o disminuyen), el trastorno primario es metabólico, y si ambos
cambian en direcciones opuestas,
entonces el trastorno primario es respiratorio (7).
Tabla 1. Trastorno acido-básico primario y mecanismo de
compensación (2, 7-9)
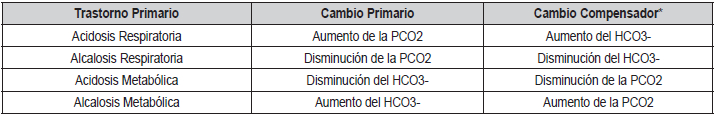
* Los cambios compensatorios pretenden mantener constante la
relación PCO₂
/HCO₃
-
Concluyendo, estos métodos tienen la desventaja de
no determinar el trastorno primario si el pH se encuentra
eufémico. Ambos métodos se
describen en la
tabla 2.
Los autores recomiendan la primera forma, basado en
la experiencia adquirida.
¿Qué hacer si el pH es eufémico y los
valores gasométricos están alterados?
Como se explicó anteriormente, al revisar una gasometría, se encuentra
un pH en límites normales (eufémico), sin embargo, el bicarbonato y la
PCO₂ están
alterados ambos. Este evento denota un trastorno mixto. El objetivo
entonces es recurrir al Exceso de Bases
y compararlos con los valores normales.
El exceso de Bases se refiere a la cantidad de base requerida para
volver el pH de la sangre de un individuo
al valor normal (pH 7,4) (11,12).
Su valor normal de referencias es ±2,5 (5). Si los valores se
encuentran dentro de los rangos ±2,5, entonces
el trastorno primario es respiratorio. Si se encuentran
fuera del rango ± 2,5 el trastorno es metabólico. Es la
interpretación básica más usada por los autores de este
artículo en la práctica diaria.
Evaluación de la estructura del trastorno o
la asociación a otros
Una vez identificado el trastorno primario, en este
caso acidemia por acidosis metabólica, se debe calcular una serie de
parámetros que ayudarán a estructurar este disturbio; es decir, estos
cálculos representan
la semiología del desequilibrio desde el punto de vista
matemático.
Cálculo de la Brecha Aniónica (GAP o
Anión GAP)
Una vez identificada la Acidosis metabólica, lo siguiente es el cálculo
de los aniones no medibles del
plasma. ¿Qué es el Anión GAP? Las concentraciones
de aniones y cationes en el plasma deben ser iguales
para mantener la neutralidad eléctrica. Luego no existe un hiato
aniónico real en el plasma. Pero solo se
miden habitualmente ciertos aniones y cationes en el
laboratorio clínico. El catión que se mide normalmente es el Na+ y los
aniones suelen ser el Cl– y el HCO₃
-
.
El hiato aniónico (que es solo un concepto diagnóstico) es la
diferencia entre los aniones no medidos y los cationes no medidos (11,
13).
Tabla 2. Identificación del trastorno acido-básico primario a
través del ¨pH Predicho¨ y la ¨relación pH/PCO₂¨
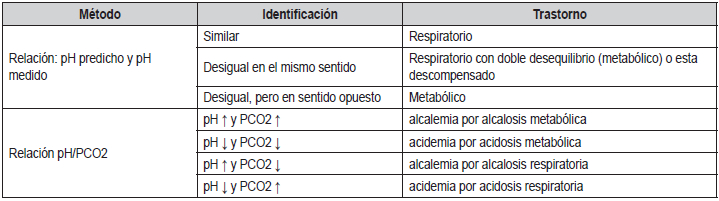
La diferencia (Aniones No Medibles (A-
) – Cationes
No Medibles (Ca+)) es una medida de la abundancia
relativa de aniones no medidos, que se denomina brecha Aniónica, hiato
Aniónico, GAP o Anión GAP.
Hasta la fecha, son inespecíficos los rangos normales de la brecha
aniónica, pues dependen de los
electrólitos que se estén midiendo. En la mayoría de
los departamentos de cuidados intensivos, la fórmula más común para
obtener la brecha aniónica es:
Na+–(Cl–
+HCO₃
-
) (14-18).
Las indicaciones para el cálculo del Anión GAP son
trastornos primarios de acidemia o acidosis de componente metabólico en
sospecha de intoxicaciones o estados de hipoperfusión. No se recomienda
en la alcalemia o trastornos de componente respiratorio. Donde
la fórmula completa es: (Na++K+)–(Cl+HCO₃
-
) (19-
21). El hecho de que variaciones significativas en más
o menos en la concentración de K+ sean incompatibles
con la vida, sumado a su concentración significativamente menor que la
del Na+ y los aniones que se miden habitualmente, hace que, en la
práctica, el cálculo de la Brecha Aniónica se haga acorde a la primera
ecuación (Na+–(Cl–
+HCO₃
-
))(22).
Usualmente los valores del GAP (intervalo de referencia para valores
normales) varía de laboratorio en
laboratorio, aunque los valores mayores a 20 mmol/l
siempre son considerados anormales, al igual que los
valores menores a 10 mmol/l. El debate literario se ha
concentrado en el valor clínico que representa la acidosis metabólica
con el GAP sobre esos valores (10 a 20
mmol/l), sin embargo, una aproximación pragmática
pudiera ser, el considerar activamente el buscar una
causa para la acidosis metabólica ¨
anión
GAP
elevado¨
cuando esta sobrepasa los 14 mmol/l (o 18 mmol/l si
se incluye el K+ en la ecuación, con límite mínimo: 8
mmol/l) (23, 24).
Otros autores prefieren rangos de referencia normales
hasta 15 puntos. Habitualmente con la exclusión del
K+ del cálculo; puede interpretarse como anormal a
partir de 12 puntos (19). Los autores de este artículo
en la práctica clínica usan los valores de referencia sin
el uso del potasio, entre 8 y 12 mmol/l, coincidiendo
con otros autores (13).
Como se comentó anteriormente, el cálculo de la Brecha Aniónica,
complementa el diagnóstico diferencial
de la acidosis metabólica, así las cosas, la acidosis
metabólica puede clasificarse en: acidosis metabólica
con anión GAP (brecha aniónica positiva) y acidosis
metabólica No anión GAP o hiperclorémica. Algunas
de sus causas se expresan a continuación: (3, 5, 17,
24-26).
Con ANIÓN GAP aumentado: acidosis láctica (tipo
A, tipo B), cetoacidosis (del anciano, del ayuno, del
diabético, del alcohólico), intoxicaciones exógenas
(metanol, etanol, etilenglicol, paraldehído), terapia
antirretroviral de VIH, enfermedad renal crónica
Con ANIÓN GAP normal: ingestión de ácido clorhídrico y sustancias
relacionadas (cloruro de amonio),
soluciones parenterales ricas en aminoácidos catiónicos. Por pérdidas
de bicarbonato o sus precursores
(diarreas, fistulas biliares o pancreáticas), comunicación
urinario-intestinal (ureterosigmoidostomía,
ureteroileostomía, ampliación vesical con intestino),
acidosis tubular renal, acidosis poshipocápnica, inhibidores de la
anhidrasa carbónica, acidosis dilucional,
hipoaldosteronismo.
Estas mismas causas de acidosis metabólicas hiperclorémicas, se pueden
dividir en relación al valor del
potasio sérico, el cual está estrechamente relacionado
con la regulación electroquímica del sistema.
Influencia de la Albúmina
Una causa de error en la interpretación del GAP, consiste en no
advertir la contribución de la albúmina. Un
hecho común en los pacientes que ingresan a los servicios de atención
al grave es el estado hipoalbuminémico que presentan, secundario a las
complicaciones
de base. Representa la más importante limitación del
cálculo del anión GAP. Por lo cual debe ser ajustado
según las concentraciones de albúmina sérica. (24) La
equivalencia aniónica de la albúmina es igual a 0,25
mEq/l por cada gramo de albúmina por litro (22).
Se han propuesto 3 métodos para
corregir
el GAP por la
influencia de la albúmina, en los pacientes con hipoalbuminemia.
Uno de ellos consiste en calcular el
anión
GAP
esperado
usando las concentraciones de albumina y fosfato respectivamente. Ya
que estas variables, responden a una
gran parte del
hiato Aniónico normal:
AG esperado (mEq/l)
= (2 x albumina (g/dl))+ (0,5 x PO₄ (g/dl)).
Se compara luego el valor calculado usando el método
tradicional (Na+)–(Cl– + HCO₃
-
) con el valor esperado. Si el GAP calculado es mayor que el esperado,
la
diferencia se atribuye a aniones no medidos de
ácidos
no volátiles. (27) El segundo método, es un método de
ajuste al GAP de la albúmina, mediante la siguiente
ecuación: GAP
ajustado=GAP
calculado + 2,5 x (4,5 –
Albúmina (g/dl)) (5,
24, 28-30). La equivalencia aniónica
de la albúmina es igual a 0,25 mEq/l por cada gramo
de albúmina por litro. (22)Los autores del presente artículo utilizan
este método para corregir el GAP.
El tercer método involucra el valor de lactato y se describe de la
siguiente manera: GAP
Corregido= AG + 0,25
× (40 − Albúmina) − lactato. Valor normal de AG: 3-11
mEq/l (31). Jiménez Murillo y colaboradores (32) expresan que en estas
situaciones es necesario ajustarlo
incrementando el Anión GAP en una unidad por cada
cuatro que descienda la albúmina de su valor normal.
Otros autores sin embargo expresan que un descenso de la albúmina desde
4,0 hasta 2,0 g/dL reduce el
GAP por 5,0 mEq/dL (por cada gramo que desciende
el valor normal de la albúmina, el GAP lo hace por
2,5). Otras causas de descenso del GAP además de la
hipoalbuminemia lo son: mieloma igG, intoxicación
por bromuros, sobredosis de salicilatos, hipercalcemia,
hipermagnesemia, hipertrigliceridemia y toxicidad por
litio (33).
Determinación del hiato-hiato, para las
Acidosis Metabólicas con GAP aumentado
Cuando exista una acidosis metabólica con GAP aumentado, es posible
determinar otro trastorno acidobásico metabólico (una acidosis
metabólica GAP normal o una alcalosis metabólica); al comparar el
exceso
de anión GAP (diferencias entre el medido y el normal)
con el déficit de HCO₃
- (diferencia de la concentración
plasmática de HCO₃
- medido y la normal).
A continuación, se presentan 3 métodos por los cuales
se puede realizar este cálculo.
Una a través de la fórmula del HCO₃
-
Corregido, la cual
representa la usada por los autores de este artículo en
la práctica clínica: HCO₃
−
Corregido= HCO₃
−
med + (GAP
- 12). Se interpreta de la siguiente forma: Si HCO₃−
Corregido
< 22 mmol/l: acidosis metabólica no anión GAP
asociada (acidosis metabólica hiperclorémica). Si
HCO₃−
Corregido >26 mmol/l: alcalosis metabólica asociada (15).
La segunda manera presenta la proporción (exceso de
GAP/déficit de HCO₃
-
) o (∆GAP/∆ HCO₃
-
). Usando 12 mEq/l como valor del anión GAP normal y
24 mEq/l como concentración plasmática normal de
HCO₃
- en el líquido extracelular se establece: Exceso
de GAP/déficit de HCO₃- = (GAP
calculado - 12) / (24 -
HCO₃-
medido) o (∆GAP/∆HCO₃-
)(3, 7, 12, 18).
Cuando un ácido fijado, se acumula en el líquido extracelular (acidosis
metabólica GAP aumentado), la
disminución del HCO₃
- sérico es equivalente al aumento del anión GAP y la proporción
∆GAP/∆HCO₃
- =1.
Sin embargo, cuando aparece una acidosis hiperclorémica, la disminución
del HCO₃
- sérico es mayor que el aumento del anión GAP y la proporción
∆GAP/∆HCO₃
- cae por debajo de la unidad (<1).
Por lo tanto, cuando existe una acidosis metabólica
con anión GAP elevado, una proporción ∆GAP/∆
HCO₃
- inferior a 1 indica la coexistencia de una acidosis metabólica GAP
normal (hiperclorémica). Por
otra parte, cuando en presencia de una acidosis GAP
elevado se añaden bases (HCO₃
-
), la disminución del
bicarbonato sérico es menor que el aumento del anión
GAP y la proporción ∆GAP/∆HCO₃
- es mayor que la
unidad (>1). Por lo tanto, cuando exista una acidosis
metabólica con anión GAP elevado, una proporción
∆GAP/∆HCO₃
- >1 indica coexistencia de una alcalosis metabólica (7, 34). Varios
autores han probado
esta fórmula con diferentes resultados y aclaran que
no se ha llegado a consenso en cuanto a los valores de
laboratorio que se pueden tomar (3). Reveron y colaboradores (12)
refieren este algoritmo de manera cualitativa, o sea solo comparando
los resultados de la ∆
GAP y ∆ HCO₃
-. Las posibles interpretaciones de esta
fórmula se exponen en la
Tabla 3.
Tabla 3. ∆GAP/∆ HCO₃- y su interpretación
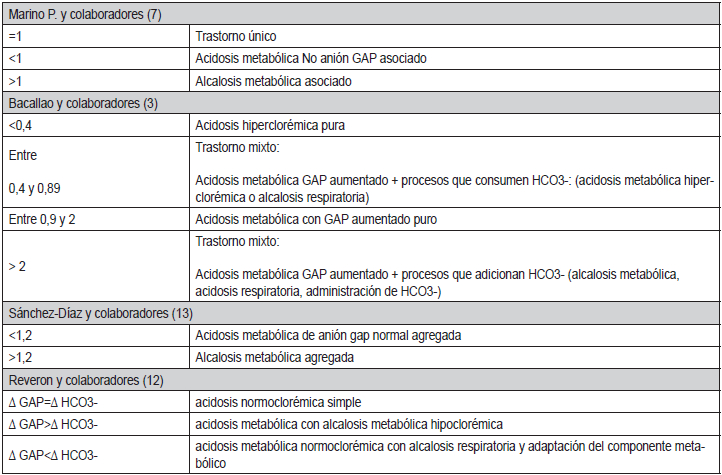
La cetoacidosis diabética, es el ejemplo clásico de estas 2
asociaciones.
El tercer método, está concerniente al ΔGAP, que relaciona el
incremento del AG (AG
Calculado - 12) y la disminución del bicarbonato (24 - HC0₃
-
actual). Para su cálculo
se utiliza la siguiente fórmula: ΔGAP= (AG
Calculado - 12)
- (24 - HC0₃
actual) Pueden ocurrir tres situaciones:
- El ΔGAP es normal (O±6). La cuantía de la elevación del ΔGAP es
igual que el valor de disminución del bicarbonato. Se trata de una
acidosis
metabólica simple con GAP elevado.
- El ΔGAP es superior a +6. La cuantía del incremento del GAP es
mayor que el grado de disminución del bicarbonato. En ese caso hay una
alcalosis
metabólica o una acidosis respiratoria asociada a
la acidosis metabólica con GAP elevado, es decir,
hay que identificar otro proceso que esté aumentando el bicarbonato.
- El GAP es inferior a -6. La cuantía de la elevación del
GAP es menor que el valor de disminución del bicarbonato. En esa
situación hay una acidosis metabólica
con GAP normal o una alcalosis respiratoria asociada
a la acidosis metabólica con AG elevado (32).
El cálculo del intervalo
osmolar
(lO) (llamado también
gap osmolar) a través de la fórmula: IO= osmolaridad
medida
– osmolaridad
Calculada (normal<10 mOsm/l) es útil
en el diagnóstico diferencial de las acidosis metabólicas
con GAP elevado por tóxicos exógenos, así: lO aumentado: en
intoxicaciones por metanol (por cada 100 mg/
dl aumenta el gap osmolar en 32 mg/dl), etilenglicol
(incrementa el gap osmolar en 16mOsmol/kg por cada
100 mg/dl) o alcohol isopropílico (14, 32, 35). Bacallao
y colaboradores (3) recomiendan agregar las concentraciones de etanol
en el cálculo de la osmolaridad.
Determinación de la brecha aniónica
Urinaria (BAu) para las Acidosis anión
GAP normal (hiperclorémica)
Ante acidemia metabólica con brecha aniónica normal, es útil la
determinación de la brecha aniónica urinaria (BAu) para definir si la
alteración se debe a causas renales, o extrarrenales. En términos
prácticos, si
la brecha aniónica es normal ante una acidosis metabólica, hay una
pérdida de HCO₃
– (principalmente
del tubo digestivo o a nivel renal) o un aumento en
el volumen de líquido extracelular (acidosis hiperclorémica inducida
por la administración parenteral de
solución de cloruro de sodio). La fórmula es: BAu =
(Na+ + K+) – Cl- (2, 13, 24, 32). Cuando el pH urinario es menor de 6,5
se excluye el HCO₃
- (como en la
fórmula). Su cálculo es muy similar al Anión GAP
pero esta incluye al potasio debido a sus altas concentraciones
urinarias (3).
Si la brecha aniónica está aumentada, hay un exceso
de ácidos fuertes que se están agregando o no pueden eliminarse. No
obstante, también se debe tener en
cuenta que la disminución de los cationes principales
(K+, Ca+) y la concentración falsamente elevada del
Na+ aumentan la brecha aniónica (2; 13).
Otra posible interpretación de estos resultados sería:
Si Cloro > (Na+ + K+) Causa extrarrenal: Indica la
existencia de ion NH₄ en orina o acidificación orina
normal (Diarrea, íleo, fístulas pancreáticas y biliares,
derivación urétero-intestinal, laxantes, cloruro de calcio, sulfato de
magnesio o colestiramina)
Si Cloro < (Na+ + K+) Causa renal: No se produce excreción de NH₄.
Hay pérdida renal de bicarbonato. Por
otro lado, si hay hipopotasemia + pH Urinario > 5,5:
Acidosis tubular renal tipo II: primaria (transitoria,
genética o idiopática), alteración anhidrasa carbónica
(déficit acetazolamida), sulfanilamida y síndrome de
Fanconi (36).
Solo hay 2 condiciones donde el GAP urinario no es
útil para estimar las diferencias descritas: Acidosis metabólica con
GAP sérico muy elevado o depleción de
volumen con elevada contención de sodio (12).
Compensación respiratoria para acidosis
metabólica
En el estado estable de la acidosis metabólica existe
una relación precisa, bien definida y predecible entre
la magnitud del descenso del bicarbonato y el grado de
hipocapnia. Existen al menos tres fórmulas que proveen una estimación
de la compensación respiratoria:
PCO
2esperado =últimos 2 dígitos del pH x 100 (37)
PCO
2esperado =(HCO₃
- medido)+ 15 defendida por Agrifoglio Rotaeche y colaboradores (18) y
Lovesio (37) como
la más ampliamente usada por su rapidez práctica.
PCO
2esperado = (1,5 x HCO₃
-
) + 8 (±2). Esta última, la
más utilizada por autores consultados (5, 32, 37-39) y
recomendada por los autores del presente artículo.
De esta manera, al revisar la gasometría, debemos compararlo con la
PCO₂ medida y concluir lo siguiente: Si
la PCO₂ medido es igual a la PCO₂ esperado entonces
el Trastorno está Compensado (acidosis metabólica
compensada), si la PCO₂ medido es menor a la PCO₂
esperado entonces estamos en presencia de una alcalosis
respiratoria asociada (el trastorno se llamaría entonces
acidosis metabólica primaria con alcalosis respiratoria
asociada) por el contrario si la PCO₂ medido es mayor
al PCO₂ esperado entonces hay una acidosis respiratoria
asociada y el trastorno se denominaría acidosis metabólica primaria con
acidosis respiratoria asociada (2, 40-42).
Por otra parte, Ayus, Caramelo y Tejedor (43), muestran un método
cualitativo que consiste en el descenso por debajo de 1mmHg de la PCO₂
desde 4 mmHg
por cada mEq/l que baja el HCO₃
- desde 25 mEq/. Si
el deceso es mayor que 4 mmHg o más, existe alcalosis respiratoria
asociada. Si el deceso es menor que 4
mmHg o más, coexiste una dificultad de la compensación ventilatoria y
se halla una acidosis respiratoria
subyacente.
Muchos autores varían en cuanto al grado de compensación respiratoria
para determinado ph, algunos plantean que la PCO₂ disminuye 1,2 mmHg
por
cada mEq/l de descenso del HCO₃
-
, (31) por lo que la
formula quedaría: PCO₂ Normal - (ΔHCO₃
- x 1,2) =
PCO₂ esperado (±2) (42).
Otros plantean que por cada 1 mEq/l de descenso
del HCO₃
- (desde 25 mEq/l), la PCO₂ disminuye 1
mmHg. (44)
Consideración especial de la gasometría
arterial: la altura sobre el nivel del mar
A medida que ascendemos sobre el nivel del mar la
presión barométrica disminuye y en consecuencia también lo hacen la
presión inspirada de oxígeno (PiO₂
) y
la presión arterial de oxígeno (PaO₂
). La hipoxemia
aumenta la ventilación minuto (VE) disminuyendo
PCO₂ (45).
Este fenómeno evidentemente altera el patrón gasométrico, debido a los
mecanismos primarios y compensadores antes expuestos (Toda compensación
respiratoria, conlleva a una respuesta metabólica (46)).
A razón de los autores de este artículo, los valores tomados como
referencia se establecen a nivel del mar.
Coincidiendo con investigadores consultados (5, 47).
A manera de conclusiones, podemos decir, que el trastorno acido-básico
más complejo de determinar en
toda su extensión es la Acidemia por Acidosis metabólica, debido que
junto a este trastorno pueden aparecer hasta dos defectos más asociados
(Acidemia por
Acidosis Metabólica anión GAP y No anión GAP con
una alcalosis respiratoria compensatoria).
El cálculo correcto de cada fórmula (independientemente del algoritmo
escogido), representa la semiología del trastorno, lo que establecerá
el diagnóstico
definitivo.
Los autores de este articulo sugieren el siguiente algoritmo:
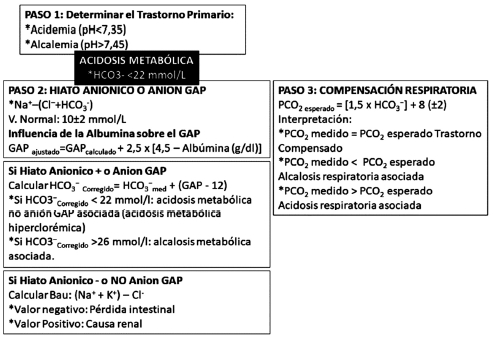
Gráfica 1. Algoritmo de Identificación de la Gasometría arterial en
la Acidosis Metabólica.
(Colectivo de autores UCI Hospital clínico-quirúrgico docente Celia
Sánchez Manduley)
Conflictos de interés
Los autores declaran no tener conflicto de interés.
Referencias
1. Márquez González H, Pámanes
González J, Márquez
Flores H, Gómez Negrete A, Muñoz Ramírez MC, Villa
Romero AR. et al. Lo que debe conocerse de la gasometría durante la
guardia. Revista Médica del Instituto
Mexicano del Seguro Social [Internet] 2012 [Consultado
29 de septiembre de 2019];50(4):389-396. Disponible
en:
https://www.medigraphic.com/pdfs/imss/im-2012/im124j.pdf
2. Caballero López A, Caballero López
AD. Trastornos del
equilibrio acido básico. En: Quesada Pantoja J. ed. Terapia Intensiva T
2. Imagenología en el paciente grave.
Medio Interno. [Internet].4ta edición. La Habana. Editorial Ciencias
Médicas. 2019 [Consultado 29 de septiembre de 2019]. p 188 – 245.
Disponible en:
http://www.bvs.sld.cu/libros-texto/terapia-intensiva2-imagenologia-cuartaedicion/terapia-intensivaii-4taed-cap18.pdf
3. Bacallao Méndez R, Mañalich Comas
R. Trastornos del
equilibrio hidromineral y ácido-base. Visión fisiopatológica.
[Internet]. 1ª edición. La Habana. Editorial Ciencias
Médicas, 2017. Disponible en:
http://www.bvs.sld.cu/libros/trastornos-equlibrio-hidromineral-acido-base/indice-p.htm
4. Roca Goderich R. Temas de Medicina
Interna. Colectivo
de autores. 5ta edición. La Habana: Editorial Ciencias
Médicas. 2017. Disponible en:
http://bvs.sld.cu/libros_texto/roca-temas-medicina-interna-tomo1-quintaedicion/indice-p.html
5. Díaz Santos G, Ortiz Ruiz G. ¿Cómo
interpretar los gases arteriales? Un enfoque integral: Revisión
narrativa
de la literatura. [Internet] NetMD.2019. Disponible en:
https://revistamedicina.net/ojsanm/index.php/Medicina/article/view/1397
6. Jara Álvarez OP, Rea Quinllay JR.
Estudio comparativo
de la teoría de Stewart y la ecuación de Henderson Hasselbach, en la
interpretación de las alteraciones ácido -
base de pacientes en estado de choque en el servicio de
emergencia del hospital Eugenio Espejo, período enero
- junio 2016 [Especialista en Emergencias y Desastres].
Pontificia Universidad Católica del Ecuador. Facultad de
Medicina 2017. Disponible en:
http://repositorio.puce.edu.ec/bitstream/handle/22000/13304/STEWARD-HENDERSON-HASSELBACH-EN-CHOQUE.pdf?sequence=1&isAllowed=y
7. Marino PL. Interpretaciones
Acidobásicas. En: Lazar T,
Dernosky N. ed. El libro de la UCI. 4ta edición.España:
Lippincott Williams & Wilkins. 2014.
8. Botey Puig A. Alteraciones del
equilibrio acidobásico. En: Rozman C. Dir. Medicina Interna.
[Internet].
18va edición. España: Elsevier. 2016. Disponible en:
https://www.clinicalkey.es/#!/content/book/3-s2.0-
B9788490229965000880
9. Acosta Prieto D. editor.
Pediatría. Diagnóstico y tratamiento.[Internet]. 3era ed. La Habana.
Editorial Ciencias
Médicas, 2016. Disponible en:
http://www.bvscuba.sld.cu/libro/pediatria-diagnostico-y-tratamiento-tercera-edicion/
10. Saínz Menéndez B. Alteraciones
del equilibrio acido
básico. Revista Cubana de Cirugía. [Internet]. 2006
[Consultado 29 de septiembre de 2019];45(1). Disponible en:
http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-74932006000100011&lng=es.
11. Hall John E. Guyton & Hall.
Tratado de fisiología médica.
13era edición. Barcelona: Elsevier. 2016.
12. Fernández Reverón F. Alteraciones
de los equilibrios
hidromineral y ácido-base.[Internet]. La Habana. Editorial Ciencias
Médicas. 2015. Disponible en:
http://www.bvscuba.sld.cu/libro/alteraciones-de-los-equilibrios-hidromineral-y-acido-base/
13. Sánchez Díaz JS, Martínez
Rodríguez EA, Méndez
Rubio LP, Peniche Moguel KG, Huanca Pacaje JM,
López Guzmán C, et al. Equilibrio ácido-base. Puesta al día. Teoría de
Henderson-Hasselbach. Medicina Interna de México. [Internet]. 2016
[Consultado 29
de septiembre de 2019];32(6):646-60. Disponible en:
https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=71558
14. Palmer BF, Clegg DJ.Anion gap
metabolic acidosis. Portuguese Journal of Nephrology &
Hypertension. [Internet]
2017 [Consultado 29 de septiembre de 2019];31(2):73-
78. Disponible en: https://pdfs.semanticscholar.org/ebbf/f1f915a508a82d473def0ae8c3c6cac55ad1.pdf
15. Caughey AB. Maternal Blood Gas
Physiology. En:
Jeffrey P. editor in chief. Critical Care Obstetrics.
6a edición .Hoboken: John Wiley & Sons Ltd. 2019.
Disponible en:
https://onlinelibrary.wiley.com/doi/abs/10.1002/9781119129400.ch5
16. Killu K. ed. Fundamental Critical
Care Support.[Internet]
6ta edición. Society of Critical Care Medicine. 2017. Disponible en:
https://epdf.pub/queue/fundamental-critical-care-support.html
17. Achinger SG, Ayus JC. Blood Gas
Analysis and Acid–
Base Disorders. En: Joseph Layon editor in chief. Civetta, Taylor &
Kirby’s critical care. 5a edición. Philadelphia: Wolters Kluwer 2018
18. Agrifoglio Rotaeche A, Herrero de
Lucas E, Sánchez
Sánchez SM, Flores Cabeza E. Protocolo diagnóstico
de la acidosis metabólica. Medicine. 2015;11(79):4768-
71.
19. Márquez González H, Cárdenas
Fragoso J, Muñoz Ramírez M, Mota Nova A, Otero Vergara MÁ,
Almeida Gutiérrez E, et al. Los gaps, una inteligente herramienta para
interpretar el desequilibrio ácido base. Residente [Internet]. 2015
[Consultado 29
de septiembre de 2019];10(2):93-100. Disponible en:
https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=60501
20. Laverde Sabogala CE, Valencia
Cárdenas AR, Vega
Sandoval CA. Una causa inusual de acidosis metabólica severa: ayuno
prequirúrgico. Revista Colombiana de
Anestesiología. 2014;42(4):312–316.
21. Tipping R, Nicoll A. Mechanisms
of hypoxaemia and
the interpretation of arterial blood gases. Surgery.
2018;36(12):675-81.
22. Ramírez JA. Brecha aniónica
plasmática. Archivos Argentinos de Pediatria. [Internet] 2005
[Consultado 29 de
septiembre de 2019];103(1):51. Disponible en:
https://www.sap.org.ar/docs/publicaciones/archivosarg/2005/A1.51-56.pdf
23. Hamilton PK, Morgan NA, Connolly
GM, Maxwell AP.
Understanding Acid-Base Disorders. Ulster Medical.
Journal. [Internet] 2017 [Consultado 29 de septiembre
de 2019];86(3):161-166. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5849971/
24. Hastings R, Bowker R. Acid-base
physiology and interpreting blood gas results. Paediatrics and Child
Health [Internet]. 2018 [consultado 29 de septiembre de
2019];28(7):301-7. Disponible en: https://www.paediatricsandchildhealthjournal.co.uk/article/S1751-7222(18)30072-6/abstract
25. Kelen GD, Nicolaou DD, Cline DM.
Acid-Base Disorders
En: Judith E. Tintinalli Ed. in Chief. Tintinalli’s Emergency Medicine.
A Comprehensive Study Guide. 8a edición.
McGraw-Hill Education. 2016 p 79-89
26. Rastegar M, Nagami GT. Non–Anion
Gap Metabolic
Acidosis: A Clinical Approach to Evaluation. American.
Journal of Kidney Diseases. [Internet]. 2017 [citado 29
de septiembre de 2019];69(2):296-301. Disponible en:
https://www.sciencedirect.com/science/article/abs/pii/S0272638616305157
27. Kaufman DC, Kitching AJ, Kellum
JA. Acid-Base Balance. En: Hall JB, Schmidt GA ed. Principles of
Critical
Care. 4th edición. McGraw-Hill Education 2015 p. 968-
974
28. Ramón Albarate M, Ortiz P de S,
Alcazar Arroyo R,
Corchete Prats E. Algoritmos en nefrología. Trastornos
hidroelectrolíticos y del equilibrio acido-base. Edición
Grupo Nacional Nefrología de la Sociedad Española de nefrología.
Barcelona. 2011. Disponible en: http://static.elsevier.es/nefro/otras_pubs/algoritmos_sen_1.pdf
29. García Quintana JM, Santamaría
Olmo R, Palenzuela Martín S; Delgado Lista J. Trastornos del equilibrio
acido-base. En: Delgado Lista J. Ed. Guía de atención
rápida en clínicas médicas. Barcelona: Elsevier 2014.
p 328-332. Disponible en: https://www.clinicalkey.es/#!/content/book/3-s2.0-B9788490224144000625
30. Fores Novales B, Diez Fores P,
Aguilera Celorrio LJ.
Evaluación del equilibrio ácido-base. Aportaciones del
método de Stewart. Revista Española de Anestesiología
y Reanimación. [Internet]. 2016 [citado 29 de septiembre
de 2019];63(4):212-9. Disponible en: http://www.sciencedirect.com/science/article/pii/S0034935615001103
31. Vaquerizo Alonso CI, Carreño
Ponfil R. Acidosis y alcalosis metabólica. En: Montejo JC, García de
Lorenzo A,
Marco P, Ortiz C. autores. Manual de medicina intensiva
5ta edición. Barcelona: Elsevier. 2017 p 190-195. Disponible en: https://www.clinicalkey.es/#!/content/book/3-s2.0-B9788490229460000439
32. Calderón de la Barca Gázquez JM,
Montero Pérez FJ,
Calvo Rodríguez, Jiménez Murillo L. Alteraciones del
equilibrio acidobásico. En: Jiménez Murillo L, Montero
Pérez FJ ed. Medicina de urgencias y emergencias. Guía
diagnóstica y protocolos de actuación. España: Elsevier.
2018 p 502-506. Disponible en: https://www.clinicalkey.es/#!/content/book/3-s2.0-B9788491132080000784
33. Reddi AS. Acid-Base Disorders.
Clinical Evaluation and
Management. Switzerland: Springer Nature. 2020.
34. Sánchez Díaz JS, Peniche Moguel
KG, Martínez Rodríguez EA, Cortés Románc JS, Rivera Solís G, Díaz
Gutiérreza SP, et al. Falsas creencias de los trastornos
ácido-base. Acta Colombiana de Cuidado Intensivo.
2018;18(4):243-250.
35. Faria DK, Mendes ME, Sumita NM.
The measurement
of serum osmolality and its application to clinical practice and
laboratory: literature review. Jornal Brasileiro de
Patologia e Medicina Laboratorial.2017;53(1)38-45.
36. Dueñas Jurado JM, Muñoz Guillén
NM. Acidosis Metabólica. En: de la Cal Ramírez MA cor. Manejo agudo de
los trastornos electrolíticos y ácido base. 2da Edición.
Barcelona: Editorial Digital Asus. 2015. p 56-59.
37. Lovesio Carlos. Acidosis
metabólica. En: Mestre EO ed.
Medicina Intensiva. 8va edición. Rosario: Corpus Libros
Médicos y Científicos. 2008. p 1403-1416
38. Sánchez Díaz JS, Martínez
Rodríguez EA, Peniche
Moguel KP, Díaz Gutiérrez SP, Pin Gutiérrez E, Cortés Román JS, et al.
Interpretación de gasometrías:
solo tres pasos, solo tres fórmulas. Medicina Critica.
2018;32(3):156-159
39. Cruz Mosquera FE, Herrera
Caballero AM, Tapia Angulo
PE, Arango Arango AC. Diseño de una aplicación móvil
para la interpretación de gases arterio-venosos. Archivos de Medicina
(Manizales) [Internet]. 2018 [consultado 29 de septiembre de
2019];18(1):24-33. Disponible
en:
http://revistasum.umanizales.edu.co/ojs/index.php/archivosmedicina/article/view/2583
40. Nieto Ríos JF, Bello Márquez DC.
Integración en la
interpretación de los electrolitos y los gases sanguíneos. En: Memorias
XXIII Simposio de Residentes de
Medicina Interna UPB. Enfoques prácticos en medicina interna, Editorial
UPB. 2017. Disponible en:
https://www.researchgate.net/publication/322665638-INTEGRACION-EN-LA-INTERPRETACION-DE-LOS-ELECTROLITOS-Y-LOS-GASES-SANGUINEOS
41. Ferrerira JP. Acidosis
Metabólica. Conceptos Actuales.
Revista Pediátrica Elizalde. 2015;6(1-2):1-54.
42. D´Annunzio Á. Claves para el
diagnóstico e interpretación del ácido base. En: Mestre EO ed. El
laboratorio
del paciente crítico. 1a edición. Rosario: Corpus Libros
Médicos y Científicos. 2009. p 51-54.
43. Ayus, Tejedor, Caramelo. Agua,
electrolitos y equilibrio
acido-base. Aprendizaje mediante casos clínicos. Editorial
Panamericana. 2012
44. Suárez Vargas M, Torres Guinea M,
Roca Muñoz A. Alteraciones del equilibrio acido-base. En: Jiménez AJ
cor.
Manual de protocolos de actuación y urgencias. 4ta edición. España:
Editorial grupo SANED. 2014.
45. Lasso Apráez JI. Interpretación
de los gases arteriales en Bogotá (2.640 msnm) basada en el nomograma
de Siggaard-Andersen. Una propuesta para facilitar y
unificar la lectura. Revista Colombiana de Neumología.2014;26(1):25-36.
46. Hinojosa Campero WE. Gasometría
arterial y adaptación en la altura. Revista Médico-Científica “Luz
y Vida” [Internet] 2011 [consultado 21 de mayo de
2020];2(1):39-45. Disponible en: http://www.redalyc.org/articulo.oa?id=325028222008
47. Tinoco Solórzano A, Román
Santamaría A, Charri Victorio J. Gasometría arterial en diferentes
niveles de altitud
en residentes adultos sanos en el Perú. Horiz Med [Internet] 2017
[citado 21 de mayo de 2020]; 17(3):6-10.
Disponible en: http://doi.org/10.24265/horizmed.2017.
v17n3.02
Recibido:
Marzo 13 de 2020
Aprobado: Mayo 14 de 2020
Correspondencia:
Ariel Sosa Remón
asosa@infomed.sld.cu







