Resumen
La pandemia por el virus SARS-CoV-2 y la enfermedad que produce
(COVID-19) afecta virtualmente
a todos los países del mundo; el número de individuos afectados se
incrementa y cambia constantemente; la población con mayor riesgo son
los individuos ≥70 años con comorbilidades de base como
diabetes mellitus, hipertensión arterial, EPOC, obesidad, entre otras.
El 17 de marzo de 2020 se declaró en Colombia el “estado de emergencia
económica y social”, y quedó consignado que el país se
debía preparar para afrontar cerca de 4 millones de contagios por
SARS-CoV-2. Al 25 de agosto de
2020, más de 500.000 casos confirmados y alrededor de 20.000 muertes,
hacen parte del espectro de
la distribución de la pandemia en nuestro país, una realidad que denota
una menor tasa de letalidad
y de mortalidad respecto a otros países. Algunos factores que pueden
explicar lo anterior son el cierre
de escuelas y universidades, el cese de algunas actividades de trabajo
presencial, la ausencia de viajes
nacionales e internacionales y el autoaislamiento para personas mayores
de 70 años, entre otros. Esta
revisión describe los aspectos básicos en términos de la salud pública
que deben tenerse en cuenta en
la pandemia por COVID-19.
Palabras clave: COVID-19, pandemia, inmunidad, letalidad,
mitigación, supresión.


¹ Médico especialista en Medicina Interna y Endocrinología, MSc en
Epidemiología, Doctor (Hon.) en Ciencias de la Salud, PhD en Ciencias
Biomédicas. Director del Grupo de estudio en Enfermedades Metabólicas,
Departamento de Medicina Interna, Universidad del Cauca,
Popayán-Colombia.
² Médico Residente del
programa de Medicina Interna, Departamento de Medicina Interna, Grupo
de investigación en Enfermedades Metabólicas, Universidad del Cauca,
Popayán, Colombia.
THE COVID-19 PANDEMIC IN COLOMBIA:
A VIEW FROM PUBLIC HEALTH
Abstract
The SARS-CoV-2 virus pandemic, and the disease it produces (COVID-19)
affects virtually all
countries in the world, the number of affected individuals is
constantly increasing and changing; the population with the highest
risk are individuals ≥70 years of age with underlying comorbidities
such as diabetes mellitus, hypertension, COPD, obesity, among others.
On March
17, 2020, the “state of economic and social emergency” was declared in
Colombia, and it was
stated that the country should prepare to face close to 4 million
people infected by SARSCoV-2. As of August 25, 2020, more than 500,000
confirmed cases and around 20,000 deaths
are part of the spectrum of the distribution of the pandemic in our
country, a reality that denotes a lower fatality and mortality rate
compared to other countries. Some factors that explain
the above are the closure of schools, universities, the cessation of
some face-to-face work
activities, the absence of national and international travel and
self-isolation for people over 70
years of age, among others. This review describes the basic public
health issues to consider
in the COVID-19 pandemic.
Keywords: (MeSH) COVID-19, pandemic, immunity, fatality,
mitigation, suppression.
Introducción
El 31 de diciembre de 2019, la
Comisión Municipal de
Salud y Sanidad de Wuhan (provincia de Hubei, China) informó acerca de
un grupo de 27 personas con
diagnóstico de neumonía de etiología desconocida, que
compartían una exposición común a un mercado mayorista de mariscos,
pescados y animales vivos, de los
cuales siete casos fueron catalogados como graves (1).
El inicio de los síntomas del primer caso fue el 8 de
diciembre de 2019. El 7 de enero de 2020, las autoridades chinas
identificaron como agente causal a un
nuevo virus de la familia Coronaviridae, que posteriormente se denominó
SARS-CoV-2, cuya secuencia genética fue compartida por las autoridades
chinas el 12
de enero de 2020 (1,2). A su vez, la enfermedad producida por
SARS-CoV-2 se ha denominado COVID-19.
Los coronavirus son miembros de la subfamilia
Orthocoronavirinae dentro de la
familia
Coronaviridae (orden
Nidovirales). Esta subfamilia
comprende cuatro géneros:
Alphacoronavirus,
Betacoronavirus, Gammacoronavirus y Deltacoronavirus. El
SARS-CoV-2 es un
Betacoronavirus
(ARN monocatenario de sentido positivo) (2).
Se considera que los reservorios de SARS-CoV-2 son
los murciélagos y otros animales salvajes. COVID-19
es una enfermedad zoonótica, lo que significa que puede transmitirse de
los animales a los humanos, pero
una vez se produce la infección en el humano, no requiere de los
animales para su propagación. Aunque aún no se han identificado los
huéspedes intermedios,
se ha considerado entre otros, al pangolín, un género
de mamíferos folidotos de la familia
Manidae
(3,4).
Los coronavirus que afectan al ser humano pueden
producir cuadros clínicos que van desde el resfriado común, hasta otros
más graves –como los producidos por
los virus del síndrome respiratorio agudo grave (SARS)
y el síndrome respiratorio de oriente próximo (MERSCoV)–. El SARS-Cov-2
se transmite de persona a persona por gotitas, contacto y fómites.
COVID-19 tiene
un período de incubación promedio entre 4 y 14 días,
con un rango que puede ir desde 0 hasta 24 días, y se
considera una enfermedad emergente (4,5).
Los síntomas más comunes de COVID-19 son fiebre,
fatiga, tos seca y producción de esputo. El cuadro sindromático, en
general es leve y se manifiesta de forma
progresiva y gradual. Algunos individuos afectados no
desarrollan ningún síntoma, por lo que su transmisión
puede ser asintomática, y la mayoría –cerca del 80 %– se
recupera de la enfermedad, sin requerir manejo específico. Alrededor
del 20 % de los afectados por COVID-19
desarrolla una enfermedad grave, con empeoramiento
manifiesto de sus síntomas respiratorios (6,7).
Las personas consideradas de mayor riesgo son los
adultos mayores y las que están antecedidas de comorbilidades como
hipertensión arterial, diabetes mellitus,
insuficiencia cardiaca, enfermedad cardiovascular, enfermedad pulmonar
crónica, entre otras (
Figura 1).
El 11 de marzo de 2020, la Organización Mundial
de la Salud (OMS) declaró a la COVID-19 como una
pandemia (8,9). La tasa de incidencia nacional es de
861,2 casos por cada 100.000 habitantes; los departamentos y distritos
que superan la tasa nacional son en
su orden: Amazonas (3.346,0), Barranquilla (2.651,0),
Bogotá (1.936,3), Cartagena (1.724,1), Santa Marta
(1.202,3) y Atlántico (955,7).
Tomando como punto de corte el 13 de agosto de
2020, la tasa de mortalidad nacional es de 280,8
muertes/millón de habitantes; la distribución por regiones con tasas
mayores a la nacional (por millón de
habitantes) es la siguiente: Amazonas (1.328,8), Barranquilla
(1.225,8), Bogotá (528,9), Córdoba (497),
Buenaventura (490), Cartagena (476,3), Sucre (430,9),
Atlántico (430,5) y Santa Marta (404,7). Según el
tipo de atención, son reportados como recuperados el
57,7 % de los casos confirmados y fallecidos el 3,3 %.
La proporción de casos graves y mortales es el 7,5 %
de la totalidad de los casos. Entre los casos activos,
el 89,0 % están en casa, en hospitalización general se
reportan el 17,2 % y en unidad de cuidados intensivos (UCI) el 1,6 %.
Del total de casos en la población
de 60 años, la proporción de casos graves y fatales es del 28,9 %,
hospitalizados 11,0 %, UCI 1,1 % y fallecidos 16,8 %.
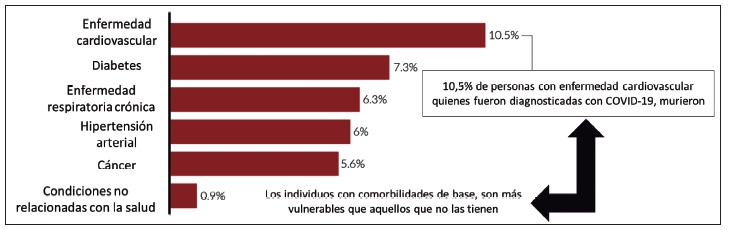
Figura 1. COVID-19: Tasas de letalidad en estadios tempranos, según
comorbilidades de base (febrero 2020).
Fuente: Adaptado y modificado de: China, 2020. China CDC Weekly.
OurWorldinData.org
64,1 % de las defunciones se presentan en hombres. El 74,3 % de los
fallecidos están en
el grupo de edad ≥60 años, las personas que presenta el mayor número de
muertes están en el rango de
70-79 años, seguida por el grupo de 80-89 años. En
comparación con otros países de Latinoamérica, Colombia es uno con las
menores tasas de incidencia
(478 por 100.000 habitantes) respecto a otros como
Perú (1.212/100.000), Panamá (1.507/100.000), Chile (1.819/100.000),
Brasil (1.157/100.000) y Bolivia
(636/100.000). De igual forma, la tasa de mortalidad
para Colombia es (17/100.000), mucho menor respecto a la de Brasil
(42/100.000), Chile (49/100.000), Panamá (33,8/100.000), México
(33/100.000) y Ecuador (32,8/100.000). Algunos aspectos pueden haber
influenciado los datos anteriormente expuestos. Por
ejemplo, el 18 de marzo de 2020 el gobierno colombiano emitió el
Decreto 420 (Ministerio del Interior), el
cual indicaba el cierre de escuelas, universidades, y se
establecía el cese de casi todas las actividades que tienen un carácter
presencial, junto al cierre de aeropuertos y la suspensión de viajes
por vía aérea (nacionales e
internacionales), la restricción de reuniones públicas y
privadas y el autoaislamiento para las personas mayores de 70 años,
entre otras. A pesar de ello, el número
de pacientes contagiados en el país sigue aumentando. Para el 15 de
agosto de 2020 el número de casos
confirmados fue de 456.689, con 14.810 muertes. Las
medidas de aislamiento preventivo, distanciamiento, mitigación y
contingencia, si bien han permitido
que el número de muertes no haya sido del impacto
inicialmente esperado, en comparación con otros países, no han
originado una reducción significativa ni
constante de la velocidad de contagios. A lo anterior
debe sumarse que, el acceso a la realización de pruebas
diagnósticas dista de ser el ideal, las pruebas mismas
son deficientes en calidad y cantidad, la red hospitalaria es precaria
en el número de camas disponibles
para la atención de pacientes COVID-19; las medidas
epidemiológicas decretadas generan confusión en la
población, todo esto sumado a una evidente ausencia
de cultura cívica y adherencia por parte de los ciudadanos, augura que
a mediano plazo el número de casos sobrepase, inclusive, el planteado
por el gobierno
nacional el 17 de marzo de 2020, cuando se declaró el
“estado de emergencia económica y social”, y quedó
consignado que el país se debía preparar para afrontar
un número de 3.989.853 contagios por SARS-CoV-2;
de éstos, 550.600 se catalogarían como “severos” y
187.523 serían casos “críticos”.
Definición y comportamiento de las
pandemias
La cantidad de una enfermedad en particular que suele
estar presente en una comunidad se denomina nivel inicial o endémico de
la enfermedad. Este nivel no es necesariamente el nivel deseado, que de
hecho puede ser igual
a 0, sino el nivel observado. Asumiendo que el nivel no
es lo suficientemente alto como para agotar el grupo de
personas susceptibles, en ausencia de intervención la enfermedad puede
continuar ocurriendo a este nivel indefinidamente. Por lo tanto, el
nivel de referencia a menudo
se considera el nivel esperado de la enfermedad.
Si bien existen algunas enfermedades que son tan raras
en una población determinada, un solo caso justifica
una investigación epidemiológica (por ejemplo, la rabia). Otras
enfermedades ocurren con mayor frecuencia, por lo que solo las
desviaciones de la norma justifican una investigación. Una enfermedad
esporádica
se refiere a aquella que ocurre con poca frecuencia y
de manera irregular. Endemia se refiere a la presencia
constante y a la prevalencia habitual de una enfermedad o agente
infeccioso en una población dentro de un
área geográfica. Hiperendemia se refiere a los niveles
altos y persistentes de la forma de aparición de las enfermedades.
Ocasionalmente, la cantidad de enfermedad en una comunidad se eleva por
encima del nivel
esperado. El término epidemia se refiere a un aumento -a menudo
repentino- en el número de casos de una
enfermedad por encima de lo que normalmente se espera en esa población
y en dicha área. El concepto de
brote, tiene la misma definición de epidemia, pero a
menudo se usa para un área geográfica más limitada.
Por su parte, pandemia se refiere a una epidemia que
se ha extendido por varios países o continentes y que
suele afectar a un gran número de personas.
Las epidemias ocurren cuando un agente y huéspedes
susceptibles están presentes en cantidades adecuadas,
y el agente puede transportarse eficazmente desde una
fuente a los huéspedes susceptibles. Más específicamente, una epidemia
puede resultar del aumento reciente en la cantidad o virulencia del
agente o de la reciente introducción del agente en un entorno donde no
había estado antes; también puede surgir de un medio
de transmisión mejorado (para que las personas más
susceptibles estén expuestas) o de un cambio en la susceptibilidad de
la respuesta del huésped al agente y/o
de factores que aumentan la exposición del huésped (o
implicar la presentación a través de nuevos portales de
entrada). La descripción anterior de “epidemia” parte
del supuesto que es aplicable solo a agentes infecciosos, aunque otras
enfermedades no infecciosas pueden presentarse también en proporciones
epidémicas,
como la obesidad y la Diabetes Mellitus (10,11).
COVID-19 como enfermedad transmisible
Como concepto, una enfermedad transmisible es
aquella causada por un agente infeccioso específico
o por sus productos tóxicos, que se manifiesta por la
transmisión de ellos, de un reservorio a un huésped
susceptible, ya sea directamente de una persona o por
un animal infectado, o indirectamente por medio de
un huésped intermediario, de naturaleza vegetal o animal, de un vector
o del medio ambiente inanimado
(12). En la historia natural de las enfermedades transmisibles, se
asume que los casos clínicos de la enfermedad pasan por una fase
preclínica detectable, y que
en ausencia de una intervención específica, potencialmente los casos
preclínicos progresarán a la fase clínica. De igual forma, los períodos
de tiempo de cada
etapa son importantes para la detección, el tamizaje y
la intervención, bien sea con medidas preventivas o terapéuticas sobre
factores del agente, del huésped y del
ambiente. En las enfermedades transmisibles, el período de latencia es
el tiempo que transcurre desde el momento de la infección hasta que el
individuo se vuelve
infeccioso. Por su parte, el período de incubación es el
tiempo que transcurre desde la infección, hasta la presencia de
síntomas (
Figura 2). Las
relaciones entre los
diferentes componentes que conllevan al surgimiento
de una enfermedad transmisible se establecen por medio de la llamada
“cadena epidemiológica, o de infección”; a partir de allí, se ordenan
los “eslabones” que
determinan los aspectos de la interacción entre agente,
huésped y medioambiente (10,11).
Concepto de inmunidad de rebaño y
número reproductivo básico (R0)
La base teórica de la inmunidad de rebaño, colectiva
o de grupo, fue introducida por Sir William H. Hamer en 1906, en el
contexto de una discusión sobre la
dinámica del sarampión. Hamer argumentaba que el
número de transmisiones –llamada también “capacidad de infectar”– por
cada caso de sarampión, era una
función del número de individuos susceptibles en la
población. Lo anterior permitió establecer que la incidencia futura de
la enfermedad es una función del producto de la prevalencia actual por
el número actual de
individuos susceptibles; a esto se le acuñó el término
de “ley epidemiológica de acción de masas” (12,13).
Posteriormente, se describió el denominado “teorema
del umbral” en el cual se postulaba que la densidad de
individuos susceptibles en una población debía superar un valor crítico
para que un brote epidémico apareciese. Por su parte, el R0, es un
parámetro importante
para medir la dinámica de una enfermedad, porque a partir de un valor
“umbral” de 1,0 indica cuando ocurriría un brote. Entonces, R0 es el
número de casos
secundarios que produciría un caso primario al introducirse en un grupo
de personas susceptibles. Si R0 >1
se produce una epidemia; si R0= 1, se denomina endemia, y si R0 < 1,
existe control de la infección. Por lo
tanto, R0 es un parámetro decisivo para determinar si
una epidemia es susceptible de control (14,15).
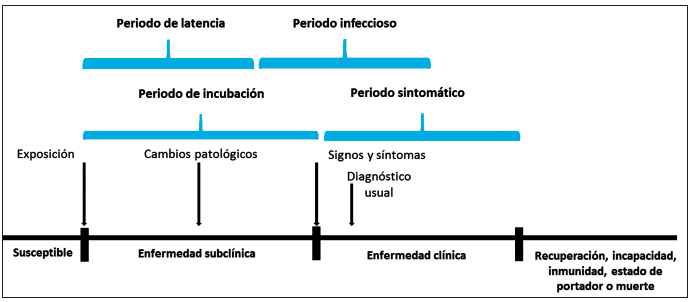
Figura 2. Historia natural de una enfermedad transmisible.
Fuente: adaptado y modificado de: Rothman KJ. Modern Epidemiology.
First Edition. Little, Brown and Co.; Boston, 1986.
La inmunidad de rebaño es útil para definir los objetivos y las
estrategias de los programas de vacunación,
puesto que permite determinar la intensidad de las intervenciones que
hay que aplicar para impedir brotes
epidémicos, y para controlar y eliminar enfermedades
infecciosas.
Su concepto se basa en que ante una elevada proporción de individuos
inmunes presentes en una comunidad, se dificultaría entonces la libre
circulación del
patógeno, pues faltarían sujetos susceptibles para mantener su
transmisión y el proceso infeccioso entraría en
una fase de control (13,16).
En la inmunidad de rebaño, se aplican principalmente
dos indicadores: el R0 y la proporción crítica de vacunados (Pc) o
umbral de vacunados, que permite -al
menos teóricamente- bloquear la transmisión de la infección cuando
existe una vacuna específica, para un
patógeno específico. R0 y Pc son propios de cada infección, y el valor
del R0 permite calcular el valor de
la Pc (17).
Para evitar una epidemia, la Pc por vacunar se calcula como: 1 -
(1/R0). Por ejemplo, si se supone que el
sarampión tiene un R0 de 17, la Pc debe ser como mínimo: [1 - (1/17) =
0,94], o sea, del 94 % (se debería
vacunar al menos el 94 % de la población para frenar
la propagación del brote).
Se ha establecido que el R0 para COVID-19 está entre 2 y 3; por lo
tanto, si existiere una vacuna con eficacia demostrada, la Pc debería
ser como mínimo:
[1 - (1/2,0) = 0,5], es decir, del 50 % (para un R0 preestablecido de
2,0); y para un R0 de 3,0, la Pc sería de
[1 - (1/3,0) = 0,67], es decir, del 67 %.
No obstante, el valor del R0 es cambiante desde el momento en que
comienza la epidemia; por ejemplo, entre
más alto el valor de R0, más rápido será también el pico
del brote, el R0 también disminuye con la aplicación de
medidas de salud pública (por ejemplo, el aislamiento
social). Además, el R0 cambia de acuerdo con parámetros como la tasa de
contactos, que se refiere al número
de personas con las cuales tenemos contacto en el día,
de la probabilidad de infección después de un contacto
y de la duración del periodo infeccioso (17,18).
Lo anterior se puede analizar brevemente con la siguiente información:
para poliomielitis, el nivel de la Pc para
bloquear la transmisión de la enfermedad es variable
(aunque en los Estados Unidos se alcanzó con una cobertura poblacional
del 65-70 %, en Brasil fue necesario
una cobertura del 100 %, además de la repetición anual
de la vacuna durante 8-9 años, en las mismas cohortes
de niños susceptibles). Los ejemplos anteriores indican
que la inmunidad de rebaño depende no solo del nivel
de vacunación alcanzado, sino también de la fuerza de
transmisión del agente en la zona (18,19).
La otra manera de aplicar la inmunidad de rebaño
como concepto poblacional, es esperar a que exista
una cantidad suficiente de personas infectadas. Por
ejemplo, sin generar medidas de aislamiento, distanciamiento,
cuarentena, etc., hipotéticamente, si la
COVID-19 continúa propagándose al ritmo en que lo
está haciendo, un número importante de la población se
infectará y, si sobreviven, desarrollarán inmunidad ante
el virus, lo que originaría que el brote desapareciera por
sí mismo puesto que el virus tendría cada vez más dificultades en
encontrar un huésped susceptible o vulnerable. Claro está, aún no se ha
establecido totalmente que
los individuos que se infecten por SARS-CoV-2 desarrollen inmunidad
permanente y duradera (hasta ahora,
este concepto sería meramente hipotético).
La propagación ampliada, imparable e incontrolable
de COVID-19 –sin estrategias ni medidas de control–
es precisamente el peor escenario posible que se pueda
imaginar. El valor porcentual estimado de afectación
de la población mundial para originar inmunidad de
rebaño para el COVID-19 es del 60 % (20). Los que
defienden esta hipótesis, plantean que se podría no
solo frenar la propagación del virus, sino que, al mismo tiempo, se
desarrollaría la inmunidad de rebaño de
manera “controlada”. No obstante, optar por la inmunidad de rebaño como
la primera o única opción para
enfrentar la pandemia actual, sería una estrategia muy
arriesgada desde el punto de vista de la salud pública,
ya que una proporción importante de individuos se
presentaría en un corto periodo de tiempo como casos graves o críticos,
los cuales requerirían manejo intrahospitalario o en unidades de
cuidados intensivos,
lo que colapsaría al sistema de salud (ya que el R0 se
haría mucho más alto, y el pico del brote se haría más
rápido), y reduciría considerablemente su capacidad
de respuesta (
Figura 3).
Por otra parte, si se disminuye la velocidad de la propagación
–aplanamiento de la curva– potencialmente
la estabilidad del sistema de salud se mantendría, y se
tendría una mejor capacidad de respuesta en términos
de atención, situación que se traduciría en una menor
tasa de letalidad por disponer de un mayor recurso humano y
tecnológico, al igual que se tendría un mayor
acceso a los servicios de hospitalización y de unidades
de cuidados intensivos (21).
Tasa de letalidad por COVID-19
La tasa de letalidad es un parámetro que se calcula a
partir del número de muertes por la enfermedad (en el
numerador de la fórmula), sobre el número de casos
diagnosticados de la enfermedad (en el denominador).
La tasa de letalidad para COVID-19 puede ser variable, y pudiera estar
sobreestimada o infraestimada. Por
ejemplo, la tasa de letalidad puede estar sobreestimada
si se toma el número de eventos fatales respecto a los
pacientes catalogados como “críticos”. En este caso, es más probable
que los pacientes críticos tengan desenlaces fatales y, por ende, se
estaría encontrando un resultado que solo es aplicable a los individuos
“críticos”,
mientras que, si tomamos el número de eventos fatales
respecto a los pacientes asintomáticos o sintomáticos
leves, este valor sería muy bajo, ya que la probabilidad
de desenlaces fatales en ambos grupos es muy baja,
y estaríamos infraestimando la tasa de letalidad. Este
resultado solo debería interpretarse y extrapolarse en
individuos asintomáticos o sintomáticos leves (21,22).
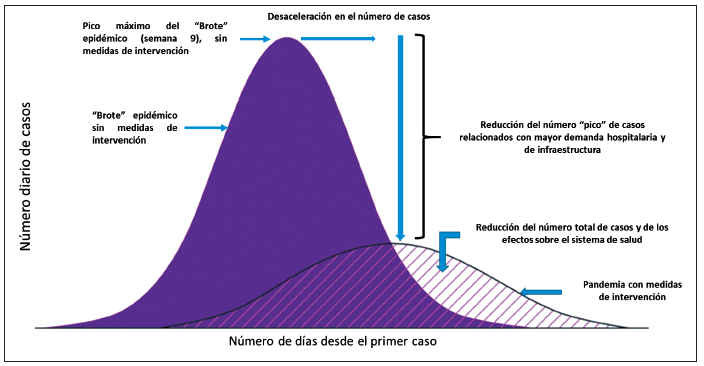
Figura 3. Concepto de aplanamiento de la curva en epidemiología de
las epidemias, ver el texto para más detalles.
Fuente: Adaptado y modificado de: CDC/John Hopkins Medicine
Es importante resaltar que, en los brotes emergentes
de una infección viral, la tasa de letalidad a menudo
se sobreestima en las primeras etapas (porque la detección de casos
está muy sesgada hacia los casos más
graves). En algunos casos, puede ser útil determinar la
tasa de letalidad de acuerdo con diferentes grupos de
riesgo, por ejemplo por rango de edad, ya que en este
caso, permitiría tener un panorama general de la distribución de los
eventos fatales en población específica
(niños, adultos mayores, comorbilidades de base, etc.).
Hasta ahora, la tasa de letalidad por COVID-19 a nivel
mundial está entre 3,5 y 4,0 %; la mayor tasa de letalidad se ha
documentado en individuos >70 años; sin
embargo, esta tasa puede disminuir o aumentar con
el tiempo, y puede variar según la ubicación y las características
basales de la población infectada (22,23).
(
Figura 4).
Adicionalmente, se debe tener en cuenta que desde el
momento en que inicia el incremento del número de
casos, existe un periodo entre la adquisición de la infección y la
muerte (ese periodo está entre 21 y 24 días).
De hecho, se ha documentado que el tiempo entre el
comienzo de los síntomas hasta el desenlace “muerte”
puede ser entre 2 y 8 semanas. Por lo tanto, la velocidad a la que el
número de casos aumenta (que es el
denominador de la ecuación) siempre será mayor que
la velocidad a la cual se presentan los desenlaces fatales. Esto
significa que, algunas personas afectadas por COVID-19 morirán en un
periodo de tiempo más largo, afectando los resultados derivados de la
ecuación y
por ende, la interpretación debe hacerse con sumo cuidado. Por eso,
darle una gran importancia a la tasa de
letalidad mientras una epidemia todavía está en curso,
como ocurre con COVID-19, puede resultar en una
interpretación ingenua, inocente y engañosa, ya que
en el momento del análisis, el resultado es claramente desconocido para
una proporción no despreciable
de individuos.
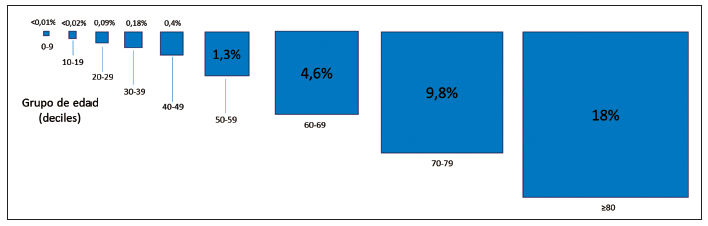
Figura 4. Tasa de letalidad por COVID-19, según grupos de edad.
Fuente: adaptado y modificado de: Ourworlindata.org
En otras palabras, las cifras de muertes
actuales pertenecen a unas cifras totales de casos del
pasado, y no a la cifra actual de casos en los que el
resultado (recuperación o muerte) de una proporción
(los casos más recientes) no se ha determinado. Por su
parte, la tasa bruta de mortalidad es otra medida muy
simple, que mide la probabilidad de que cualquier individuo de la
población muera por una enfermedad. Se
calcula dividiendo el número de muertes por una enfermedad entre la
población total. Por ejemplo, si hubo
10 muertes en una población de 1.000 individuos, la
tasa bruta de mortalidad sería [10/1.000] es decir, 1 %.
Otro indicador a tener en cuenta es la tasa de letalidad
por infección, la cual se calcula como el número de
muertes por una enfermedad, dividido por el número
total de casos; entonces, si 10 individuos mueren por
una enfermedad y 500 la padecen, tasa de letalidad por
infección es: (10/500) es decir, 2 %. Por ende, se necesita el número
total de casos y el número total de muertes.
Sin embargo, hay que tener en cuenta que se desconoce
el número total de casos de COVID-19 debido a que no
todas las personas con COVID-19 se someten a las diferentes pruebas
diagnósticas, y por ende, este indicador
no se puede calcular con precisión (23-25).
Velocidad de duplicación de los casos
La velocidad de duplicación de los casos es un factor
fundamental en el análisis de las pandemias porque
mide el tiempo a partir del cual se duplica el número
de pacientes afectados. Por ejemplo, si hoy el número
de pacientes infectados fue de 1.000, y hace 3 días fue
de 500, entonces podemos decir que el tiempo necesario para duplicar el
número de casos es de 3 días (para
COVID-19 se ha calculado en 5-7 días). Sin embargo,
esto es totalmente cambiante y es muy difícil predecir
dicho cambio a futuro; es más, para COVID-19 el cambio es exponencial y
no lineal, y debe pensarse siempre de esta forma, ya que si comenzamos
a “linealizar”
(sic.) una función que es exponencial (al evaluarla de
manera intuitiva), caeríamos en un tipo de sesgo conocido como “sesgo
de crecimiento exponencial” (25-27).
Estrategias de intervención en pandemias
Cuando los virus pandémicos aparecen, puede haber
varias “olas” de brotes con un intervalo de 3 a 9 meses entre ellas, lo
que sugiere que los programas de prevención que involucran vacunas o
medicamentos antivirales deben ser implementados más extensamente
para la segunda ola, en especial, cuando no ha habido
exposición previa conocida al agente (28).
Las acciones de prevención dirigidas a identificar de
forma oportuna el brote inicial y a reforzar la vigilancia
epidemiológica, permitirán tener una respuesta
más oportuna. Entre las estrategias de intervención
utilizadas en las pandemias se destacan medidas farmacológicas y no
farmacológicas, a saber:
a.
Medidas farmacológicas: uso de
vacunas, medicamentos antivirales y no antivirales.
b. Medidas de barreras físicas:
lavado de manos,
uso de máscaras, alcohol, guantes, batas, etc.
c. Aislamiento: es la
separación de personas con
una enfermedad infecciosa específica, en sitios
como el hogar, hospitales, etc.
d. Cuarentena: es la separación
y restricción del movimiento de un grupo de personas que no ha
desarrollado la enfermedad, pero que se ha expuesto al
agente infeccioso.
e. Detección en los diferentes puertos
de entrada:
aeropuertos, terminales de transporte, puertos fluviales, etc.
f. Distanciamiento social: es
la separación espacial
de al menos un metro entre los infectados y los no
infectados. Esta medida abarca también el distanciamiento social en el
lugar de trabajo.
Para COVID-19 hay dos tipos de intervenciones posibles en el momento:
a.
Mitigación: esta intervención se enfoca en desacelerar y
ralentizar la propagación de la epidemia, aunque no siempre la detiene.
Su propósito
es disminuir la demanda máxima de atención médica, y proteger a los
individuos con mayor riesgo
de seriedad de la enfermedad.
b. Supresión: su objetivo es
revertir el crecimiento de
la epidemia, es decir, llevar el R0 a un valor <1,0.
El
Imperial College de
Londres describió muy recientemente cinco medidas de salud pública que,
ante la
ausencia de vacunas y tratamientos farmacológicos
efectivos, podrían ayudar a frenar la propagación del
COVID-19. Estas medidas, solas o en combinación,
serían aplicables por ahora para el Reino Unido y los
Estados Unidos, pero podrían eventualmente extrapolarse a nuestro medio
(29). Las medidas son: aislamiento de casos en el hogar, cuarentena
domiciliaria,
distanciamiento social de las personas >70 años, cierre
de escuelas y universidades.
Al modelar los datos disponibles, descubrieron que las
combinaciones darían como resultado una de dos situaciones:
a. En la primera (mitigación), las
intervenciones podrían retrasar la propagación de la infección, pero
no interrumpirían por completo su propagación.
Esta estrategia reduciría la demanda en el sistema
de salud, y al mismo tiempo protegería a aquellos
con mayor riesgo de enfermedad grave. Para este
primer escenario, se estimaron 250.000 muertes (teniendo en cuenta que
este valor es 50 % menor de
lo que se presentaría sin la intervención) y, por lo
tanto, colapsaría igualmente su sistema de salud.
b. En la segunda (supresión), las intervenciones
podrían interrumpir la transmisión y reducir el
número de casos a niveles bajos. Pero, en el instante en que estas
intervenciones se ‘relajen’ en el
tiempo, se pronostica un aumento en el número de
casos, a menos que las intervenciones se pudieran
mantener constantes en el tiempo.
Para ambas intervenciones, se puede predecir que para
un R0 inicial de 2,6 las estrategias como el distanciamiento social,
bajaría el R0 a un valor menor de 1,0
(al reducir el número promedio de contactos diarios en
> 70 %) (29,30). Recientemente, se realizó una revisión de medidas
como la cuarentena sola o en combinación
con otras medidas de salud pública para controlar el
COVID-19; en ella, y teniendo en cuenta que la certeza de la evidencia
se consideró baja a muy baja, según
“GRADE”, se encontró un efecto benéfico de las medidas de cuarentena
simuladas (la cuarentena de individuos expuestos a casos confirmados o
sospechosos
evitó entre un 44 y 81 % de los casos incidentes, y entre
el 31y 63 % de las muertes, en comparación con ninguna medida.
Asimismo, se encontró que entre más
pronto se apliquen las medidas de cuarentena, mayor
será el ahorro en términos de inversión poblacional.
Cuando se evaluaron los efectos de una cuarentena
con otras medidas de prevención y control, tales como
el cierre de escuelas, restricciones de viajes y distanciamiento
social, se evidenció un mayor efecto en la reducción de nuevos casos,
de transmisiones y muertes,
que con las medidas individuales aisladas (31).
Intervenciones para Colombia y escenarios
hipotéticos
Las intervenciones como mitigación y supresión son
las mejores herramientas con las que contamos actualmente. Es de
esperar que medidas más intensivas,
como la supresión, sean difíciles de mantener a lo largo
del tiempo, ya que el ser humano requiere interacción
social, laboral, física, espiritual, religiosa, etc. Por lo
tanto, aunque se prevé que las intervenciones en salud
pública aplanen la curva de la pandemia, hasta tanto
no se disponga de una vacuna o de tratamientos efectivos para tratar la
infección, lo lógico es que se presente
un nuevo “brote” (o varios) semanas o meses después
de que la sociedad decida continuar con su vida (un
fenómeno que puede definirse como de “relajación”
o de “agotamiento” del individuo y de la comunidad
ante las recomendaciones de aislamiento social, distanciamiento, etc.).
Por lo anterior, una estrategia adicional podría ser
implementar dichas medidas de manera alterna, por
ejemplo, hacer un distanciamiento social durante 2 o
3 semanas, alternando con un periodo de liberación
controlada de la población durante 1 o 2 semanas, siguiendo medidas
como el uso de tapabocas, higiene
de manos, evitar conglomeraciones, etc., seguido nuevamente por otro
periodo de distanciamiento social.
Esta estrategia para COVID-19 no ha sido testeada en
estudios comunitarios o ecológicos, pero es una alternativa más viable
que el distanciamiento social permanente. Este esquema tendría que ser
evaluado cada 2 o
3 semanas, para poder medir el impacto de la medida.
Otra estrategia es que a través de un aislamiento social
específico (estratificado por riesgo individual, y no a
toda la población), es decir, solamente de la población
de mayor riesgo (adulto mayor, comorbilidades de
base, etc.) permitiendo que la población laboralmente
activa, siga laborando bajo recomendaciones estrictas
de cuidado (uso de tapabocas, lavado de manos, etc.),
evitando las aglomeraciones, lo que implicaría que se
deben regular actividades como: asistencia a eventos
masivos, uso de los diferentes medios de transporte
público, etc.) (32). Finalmente, se debe tener en cuenta
que en Colombia, el trabajo informal según el DANE
(2019) es del 47,5 % (33), por ello, las grandes preguntas son: ¿quién
asumiría los gastos y el impacto de no
producir, no laborar, no estudiar, etc.?, somos una sociedad que puede
soportar cuarentenas prolongadas?,
estamos preparados para una gran recesión económica? Probablemente, la
última estrategia, es decir el
aislamiento social específico y estratificado por riesgo
individual, sea la más viable.
De acuerdo con lo anterior, se podrían presentar en
Colombia tres escenarios hipotéticos:
• Escenario
1: se afecta un número muy grande de
la población, ya que la relajación o el agotamiento social ante las
recomendaciones y medidas de
salud pública (lo cual haría que la infección se
propague rápidamente) harían colapsar al sistema
de salud, y no se podría brindar la atención necesaria a aquellos que
la requerirían; por ende, la
tasa de letalidad se elevaría considerablemente, no
solo por COVID-19, sino también por otras condiciones que requerirían
manejo hospitalario y no
podrían recibir la atención necesaria. Lo anterior
podría, potencialmente, originar inmunidad de
rebaño y protección al grupo poblacional que no
logra infectarse por COVID-19.
• Escenario 2: se afecta un
número muy grande de
la población y, a mediano plazo las intervenciones
farmacológicas podrían, eventualmente, reducir
el número de casos, especialmente aquellos que
requieren hospitalización. Aun así, el sistema de
salud ya estaría colapsado.
• Escenario 3: que se aplique
la “teoría de juegos”
en especial el llamado “dilema del prisionero”
(34). En este, se analizan los incentivos que tienen
dos sospechosos de un crimen para delatar a su
compañero o proclamar su inocencia. Se trata de
un juego no cooperativo, con suma no nula y de la
categoría equilibrio de Nash; el equilibrio de Nash
es una situación en la que los jugadores no tienen ningún incentivo
para cambiar su estrategia,
teniendo en cuenta las decisiones de sus oponentes. Gracias a este
ejercicio, podemos comprender
la dificultad que pueden tener dos personas para
cooperar, incluso si esa cooperación fuera la mejor
opción para las dos.
En la mayoría de sus versiones, es un juego simétrico,
es decir, los castigos de cada prisionero son los mismos
(35). Para nuestra situación actual, el “dilema del prisionero” se
aplicaría de la siguiente forma, asumiendo
que una decisión entre dos individuos puede aplicarse
a una población específica:
Dos individuos (Juan y Pedro) podrían no cooperar
con las medidas de intervención para frenar de alguna
forma la pandemia por COVID-19, aunque parezca
que lo mejor para ambos sea hacerlo; habría, entonces, dos categorías
para Juan y Pedro, y cada una de
estas categorías reflejaría un impacto para toda la población. Estas
opciones serían:
a. Juan es “juicioso” (acata y adopta
las normas y las
recomendaciones de intervención no farmacológica para COVID-19) y, Juan
no lo es (hace exactamente lo contrario que hace Juan el “juicioso”).
b. Las mismas dos categorías las tendría Pedro (“juicioso” o “no
juicioso”).
Entonces, el dilema se puede plantear de diversas formas y en distintos
escenarios, con ganancias mayores o
menores para Juan o Pedro, y, lógicamente, para la población.
Considerando, por ejemplo, que se deben aislar
ambos, siendo asintomáticos pero contagiados por el
SARS-CoV-2, la única opción en la que ganamos todos,
es que Juan y Pedro sean “juiciosos”; por ende, en cualquier otra
opción, todos perdemos (
Figura 5).
En los primeros dos escenarios, se afectaría un número importante de la
población, pero en el primero, se plantea un horizonte “cataclísmico”
no tanto por el
número total de muertes, sino por la forma como quedaría nuestro
sistema de salud: exangüe. En el segundo
escenario, el sistema de salud también quedaría exangüe, pero con una
magnitud teórica o esperada menor
que en el primero. De una u otra forma, perderíamos
sin duda ante COVID-19.
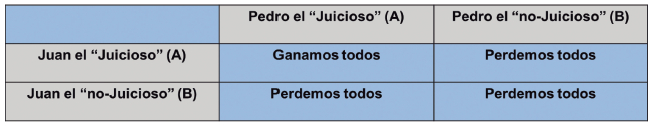
Hay 4 categorías posibles, AA, AB, BA,
y BB. La categoría AA es la única en la que ganamos todos, las
categorías AB,
BA, y BB demuestran que siempre perdemos si Juan y Pedro,
conjuntamente, no acatan ni adoptan las recomendaciones.
Figura 5. Dilema del prisionero como un problema de la teoría de
juegos, y COVID-19. Ver el texto para más detalles.
Fuente: Archivo de los autores.
En el tercer escenario, se demuestra que la única opción viable que
tenemos es que todos, sin excepciones,
pensemos y decidamos como un solo ser, como una
sola alma. Esta hipótesis nos reta a levantarnos y recuperarnos, a
implementar aspectos de flexibilidad
ideológica, política y religiosa, tolerancia, amor mutuo, respeto,
empatía y compasión; aspectos de difícil
consecución en conjunto, pero no imposibles.
Conflictos de interés
Los autores declaramos no tener conflictos de interés.
Referencias
1. Wuhan seafood market pneumonia
virus isolate WuhanHu-1, complete genome. 23 de enero de 2020-
[Internet] Ncbi.nlm.nih.gov. 2020 [consultado: 17 de marzo
de 2020]. Disponible en: http://www.ncbi.nlm.nih.gov/nuccore/MN908947.3
2. Novel Coronavirus (2019-nCoV)
situation reports [Internet]. Organización Mundial de la Salud. 2020
[consultado 16 de marzo de 2020]. Disponible en:
https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports.
3. Paules CI, Marston HD, Fauci AS.
Coronavirus Infections—More Than Just the Common Cold. JAMA [Internet].
2020 [consultado10 de marzo de 2020]323(8):707.;
Disponible en:
https://jamanetwork.com/journals/jama/fullarticle/2759815.
4. Cyranoski D. Mystery deepens over
animal source of
coronavirus. Nature. 2020;579(7797):18-19.
5. Cui J, Li F, Shi Z-L. Origin and
evolution of pathogenic
coronaviruses. Nat Rev Microbiol. 2019;17(3):181-92.
6. Linton NM, Kobayashi T, Yang Y,
Hayashi K, Akhmetzhanov AR, Jung S et al. Epidemiological
characteristics of
novel coronavirus infection: A statistical analysis of publicly
available case data. medRxiv [Internet] 2020 [consultado 18 de Marzo
2020];2020.01.26.20018754. Disponible en:
https://www.medrxiv.org/content/medrxiv/early/2020/01/28/2020.01.26.20018754.full.pdf.
7. Riou J, Althaus CL. Pattern of
early human-to-human
transmission of Wuhan 2019 novel coronavirus (2019-
nCoV), December 2019 to January 2020. Euro Surveill.2020;25(4):1-5.
8. Coronavirus disease (COVID-19)-
Organización Mundial de la Salud [Internet]. Who.int. 2020 [consultado
14
de marzo de 2020] Disponible en: https://www.who.int/emergencies/diseases/novel-coronavirus-2019.
9. Principles of Epidemiology |
Lesson 1 – section 11 [Internet]. Cdc.gov. 2020 [consultado 14 de
agosto de 2020].
Disponible en:
https://www.cdc.gov/csels/dsepd/ss1978/lesson1/section11.html.
10. Madad S, Moskovitz J, Boyce MR,
Cagliuso NV, Katz R.
Ready or Not, Patients Will Present: Improving Urban
Pandemic Preparedness. Disaster Med Public Health
Prep. 2020;:1-4.
11. Koonin LM. Novel coronavirus
disease (COVID-19) outbreak: Now is the time to refresh pandemic
plans.J Bus
Contin Emer Plan. 2020;13(4):1-15.
12. Hamer WH. Epidemic disease in
England—the evidence of variability and of persistency of type.
Lancet.1906;1:733-39.
13. Peeples L. Rethinking herd
immunity. Nat Med.
2019;25(8):1178-80.
14. Wallinga J, Lipsitch M. How
generation intervals shape
the relationship between growth rates and reproductive
numbers. Proc Biol Sci.2007;274(1609):599-604.
15. Liu QH, Ajelli M, Aleta A, Merler
S, Moreno Y, Vespignani
A. Measurability of the epidemic reproduction number in
data-driven contact networks. Proc Natl Acad Sci U S A.
2018;115(50):12680-12685.
16. Fox JP, Elveback L, Scott W,
Gatewood L, Ackerman
E. Herd immunity: basic concept and relevance to public health
immunization practices. Am J Epidemiol.
1971;94(3):179-89.
17. Marcus C, Pontasch J, Duff J,
Khambadkone T, Fink
B, et al. Developing “Herd Immunity” in a Civilian Community Through
Incorporation of “Just-In-Time” Tourniquet Application Training.
Prehosp Disaster Med.
2019;34(5):481-485.
18. Dudley MZ, Privor-Dumm L, Dubé È,
MacDonald NE.
Words matter: Vaccine hesitancy, vaccine demand, vaccine confidence,
herd immunity and mandatory vaccination. Vaccine. 2020;38(4):709-711.
19. Schwingel JM. Exploring
Infectious Disease Outbreaks
and Herd Immunity Through Simulations with a Visual
Appeal. J Microbiol Biol Educ. 2018;19(2).: jmbe-19-85.
20. Sanche S, Lin YT, Xu C,
Romero-Severson E, Hengartner N, Ke R. High Contagiousness and Rapid
Spread
of Severe Acute Respiratory Syndrome Coronavirus 2.
Emerg Infect Dis. 2020;26(7):1470-1477.
21. Moghadas SM, Shoukat A,
Fitzpatrick MC, Wells CR,
Sah P, Pnadey A et al. Projecting hospital utilization during the
COVID-19 outbreaks in the United States. Proc
Natl Acad Sci 2020;117(16):9122-9126.Onder G, Rezza
G, Brusaferro S. Case-Fatality Rate and Characteristics
of Patients Dying in Relation to COVID-19 in Italy. JAMA.
2020;..
22. Yang S, Cao P, Du P, Wu Z, Zhuang
Z, Yang L et al.
Early estimation of the case fatality rate of COVID-19 in
mainland China: a data-driven analysis. Ann Transl Med.
2020;8(4):128-128..
23. Leung C. Clinical features of
deaths in the novel coronavirus epidemic in China. Rev Med Virol.
2020;30(3)..
24. Li LQ, Huang T, Wang YQ, Wang ZP,
Liang Y, Huang T
et al. 2019 novel coronavirus patients’ clinical characteristics,
discharge rate, and fatality rate of meta-analysis.
J Med Virol. 2020;92(6):577-583.
25. Chowell G, Viboud C. Is it
growing exponentially fast? Impact of assuming exponential growth for
characterizing
and forecasting epidemics with initial near-exponential
growth dynamics. Infect Dis Model. 2016;1(1):71-8.
26. Jung SM, Akhmetzhanov AR, Hayashi
K, Linton NM,
Yang Y, Yuan B et al. Real-Time Estimation of the
Risk of Death from Novel Coronavirus (COVID-19) Infection: Inference
Using Exported Cases. J Clin Med.
2020;9(2):523.
27. Madhav N, Oppenheim B, Gallivan
M, Mulembakani P,
Rubin E, Wolfe N. Pandemics: Risks, Impacts, and Mitigation. En:
Jamison DT, Gelband H, Horton S, Jha P,
Laxminarayan R, Mock CN-et al, ed. por Disease Control Priorities
[Internet], 3a edición.. Washington DC: The
World Bank; 2017[consultado 18 de marzo de 2020].
P.315-345. Disponible en:
http://dcp-3.org/sites/default/files/chapters/DCP3%20Volume%209_Ch%2017.
pdf Ferguson NM, Laydon D, Nedjati-Gilani G, Imai N,
Ainslie K, et al. On behalf of the Imperial College COVID-19 Response
Team. Impact of non-pharmaceutical
interventions (NPIs) to reduce COVID-19 mortality and
healthcare demand. [Internet]. Imperial.ac.uk.2020 [consultado 25 de
Marzo de 2020]. Disponible en: https://www.imperial.ac.uk/media/imperial-college/medicine/sph/ide/gida-fellowships/Imperial-College-COVID19-NPI-modelling-16-03-2020.pdf
28. Jarvis CI, Van Zandvoort K, Gimma
A, Prem K, CMMID
COVID-19 working group, et al. Quantifying the impact
of physical distance measures on the transmission of
COVID-19 in the UK.[Internet]. 2020 [consultado 13 de
abril de 2020]; Disponible en:
https://www.researchgate.net/publication/340427835-Quantifying-the-impact-of-physical-distance-measures-on-the-transmission-of-COVID-19-in-the-UK.
020].
29. Nussbaumer-Streit B, Mayr V,
Dobrescu AIulia, Chapman A, Persad E, et al. Quarantine alone or in
combination with other public health measures to control
COVID-19: a rapid review. Cochrane Database of Systematic Reviews 2020;
4(4):CD013574.
30. Ahmed F, Zviedrite N, Uzicanin A.
Effectiveness of workplace social distancing measures in reducing
influenza
transmission: a systematic review. BMC Public Health.
2018;18(1):518..
31. DANE. Medición de empleo informal
y seguridad social.
Trimestre móvil noviembre 2019 - enero 2020. Boletín
Técnico Gran Encuesta Integrada de Hogares (GEIH).
[Internet] Departamento Nacional de Estadística. 2020.
[consultado 24 de Marzo de 2020]. Disponible en:
https://www.dane.gov.co/files/investigaciones/boletines/ech/ech-informalidad/bol-ech-informalidad-nov19-ene20.pdf
32. Cardinot M, Griffith J, O’Riordan
C, Perc M. Cooperation
in the spatial prisoner’s dilemma game with probabilistic
abstention. Sci Rep. 2018;8(1):14531. .
33. Babajanyan SG, Melkikh AV,
Allahverdyan AE. Leadership scenarios in prisoner’s dilemma game.
Physica A: Statistical Mechanics and its Applications.
2020;545:123020.
Recibido:
Abril 20 de 2020
Aprobado: Mayo 18 de 2020
Correspondencia:
Hernando Vargas-Uricoechea
hernandovargasuricoechea@gmail.com
hernandovargas@unicauca.edu.co








