LA TERCERA PANDEMIA DE PESTE DE 1855
María Claudia Ortega López1
Resumen
El presente escrito surge durante la cuarentena, aceptada por el pueblo
colombiano desde el mes de
marzo y siguientes del año común 2020 por disposición gubernamental,
para disminuir el riesgo de
contagio y de muerte durante la Pandemia
del “Coronavirus”, SARS-CoV-2, Covid19.
Todas las epidemias, plagas y pandemias conocidas sobre la faz de la tierra, han formado parte de la evolución y la naturaleza humana. Hoy, en pleno siglo XXI, después de haber viajado al espacio, haber conquistado la Luna, de tener medios de comunicación instantáneos, “casi telepáticos”, una estructura proteica virtualmente invisible, microscópica, “inerte”, nos mantiene confinados en el mismo tiempo, a más de la mitad de los 7.800 millones de Seres Humanos que cohabitamos en el Planeta Azul. Nada ni nadie nos había exhortado a tantas personas juntas a detenernos durante horas, días, quizá semanas o aún meses, a pensar en lo insignificantes que somos ante el implacable poder de la Naturaleza.
Palabras clave: Tercera Pandemia; Yersinia pestis; Respuesta Inmunológica; Zoonosis; Rattus rattus; Rattus norvegicus; Xenopsylla cheopis; Ctenocephalides felis; Pulex irritans.


1 MD. Pediatra. Supra-especialista alergia e inmunología clínica. Especialista en Gestión Aplicada a los Servicios de Salud. Hospital Infantil Universitario de San José. Hospital Universitario Fundación Santa Fe de Bogotá. Miembro Correspondiente Academia Nacional de Medicina. Profesora Asociada Fundación Universitaria de Ciencias de la Salud. Presidente Fundación Alejandra Ortega López. Bogotá, Colombia.
THE THIRD PLAGUE PANDEMIC OF 1855
Abstract
This document has been prepared during the quarantine accepted by the
Colombian people
since March of the calendar year 2020 by order of the government, to
reduce the risk of contagion and death during the “Coronavirus” Pandemic, SARS-CoV-2, Covid19.
All known epidemics, plagues and pandemics on the face of the earth have been part of evolution and human nature. Today, in the 21st century, after having traveled to space, having conquered the Moon, having instantaneous, “almost telepathic” means of communication, a virtually invisible, microscopic, “inert” protein structure, is keeping half of us, the 7,8 billion human beings who inhabit this Blue Planet, confined simultaneously. Nothing and no one had exhorted so many people to stop for hours or days perhaps weeks or even months to think about how insignificant we are in the face of the implacable power of nature.
Keywords: Third Pandemic; Yersinia pestis; Immune Response; Zoonosis; Rattus rattus; Rattus norvegicus; Xenopsylla cheopis; Ctenocephalides felis; Pulex irritans.
Historia Tercera Pandemia
La peste bubónica es una enfermedad infecciosa que ha causado tres pandemias mortales reconocidas en la historia de la humanidad durante los últimos milenios: Desde mediados del siglo VI hasta mediados del siglo VIII la Peste de Justiniano; desde mediados del siglo XIV hasta mediados del siglo XVIII la Peste Medieval; y desde finales del siglo XIX hasta mediados del siglo XX, la Tercera Pandemia, que comenzó hacia el año 1855 en la provincia China de Yunnan – Kunming, región sur-occidente, donde la plaga causó múltiples brotes desde 1772. Devastó a China e India durante casi un siglo, se extendió por el mundo gracias al importante tráfico naval de rutas marítimas entre países como Japón, Taiwán, India, Sudáfrica, Suramérica y el oeste de Norteamérica. Solo en India se estimó la muerte de 12,5 millones de habitantes a causa de la enfermedad en el período comprendido entre 1898 y 1918. Se sabe poco sobre la fase histórica de la peste -entre la Segunda y la Tercera Pandemia- a pesar de que se describe la transición temporal, geográfica y filogenética de la misma. En esta época -Tercera Pandemia-, se causaron brotes esporádicos en países del Medio Oriente incluido Egipto y focos originarios de Asia Central, según se revela en investigaciones moleculares actuales [1-4]. Durante la Tercera Pandemia de peste bubónica (con la exclusión de la peste neumónica que ocurre cuando la peste infecta los pulmones, ya sea principalmente por la propagación de gotas infecciosas o, secundariamente, como una complicación de la peste bubónica), la transmisión de humano a humano se consideró importante [5]; se estima que fue la responsable de tres cuartos (3/4) de los casos mortales, dos siglos antes durante el brote de 1665 en Eyam - Inglaterra. En Europa, la Tercera Pandemia se restringe a la era pre-antibiótica [6].La Yersinia pestis, el agente etiológico de la peste, es una bacteria coco-bacilo gram negativa, pertenece a la familia de las Enterobacteriaceae, uno de los patógenos más “exitosos conocidos” transmisores de zoonosis; en huéspedes infectados se comporta como un patógeno intracelular facultativo. Cada una de las pestes identificadas en el histórico de la humanidad, tuvo una difusión geográfica amplia de Y. pestis, lo que ha permitido su distribución mundial en el tiempo, con focos o brotes que aún se observan [3, 4,7]. Estos focos de la “modernidad” tienen un relativo buen control, dadas las condiciones de higiene, el uso de antibióticos y el manejo de vectores con insecticidas (dicloro difeniltricloroetano - DDT) y raticidas. Sin embargo, la Y. pestis es una amenaza permanente por la gravedad de la enfermedad que causa y su potencial uso como “arma en bioterrorismo” [8].
Se describe un brote de peste que tuvo lugar en El Cairo en 1801 entre la Segunda y la Tercera Pandemia, el que parece compartir más de las características epidemiológicas típicas de la Tercera Pandemia -los datos están disponibles en los relatos de oficiales médicos que acompañaban a la expedición napoleónica en Egipto-. La mayoría de los casos humanos fueron causados por infección transmitida por la pulga del roedor, no hay suficiente evidencia documentada de la época de transmisión de persona a persona [7]. Se estima que aproximadamente 5.000 personas murieron, lo que representa cerca del 2% de la población de 250.000 que vivía en ese momento en El Cairo. Esta mortalidad fue relativamente baja en comparación con algunos de los famosos brotes de peste bubónica que ocurrieron anteriormente, hacia el final de la Segunda Pandemia, por ejemplo: cerca del 50% en Génova y Nápoles en 1656; un 20% en Londres en 1665; y aproximadamente el 40% en Marsella en 1720. Sin embargo, debe tenerse en cuenta que las diferencias entre las dos pandemias no están claramente establecidas y que cada brote puede tener propiedades únicas debido a las condiciones locales particulares [9, 10,11].
La peste que comenzó en la década de 1890 en China causó tasas de mortalidad más bajas, presumiblemente como resultado en la mejora de condiciones de vivienda y prácticas de salud pública [9]. En 1894, cuando Hong Kong es golpeada por la peste, el tamaño de su población para ese momento era de aproximadamente 210.000 chinos, de los cuales entre el 1 y el 3% murió por la enfermedad [12]. Es durante esta epidemia de 1894 que Alexandre Yersin describe el agente bacteriano que causa la peste bubónica y sus rutas de transmisión por las pulgas. Este descubrimiento tendría consecuencias muy importantes en la lucha contra la peste y otras enfermedades infecciosas [13,14]. Como co-descubridor de la bacteria y casi de manera simultánea, se menciona al barón japonés Kitasato Shibasaburō. La peste, en los siguientes años se extendió por barcos de vapor infestados de ratas, a las principales ciudades portuarias de todo el mundo.
Después de 35 años de su aparición en Hong Kong, la Tercera Pandemia había provocado un estimado de 26 millones de casos de peste y más de 12 millones de muertes; la gran mayoría se presentaron en India. La dinámica de transmisión en la Tercera Pandemia se caracterizó por eventos de introducción única, seguidos de una rápida expansión y asentamiento en reservorios locales de roedores, lo que permitió un ciclo de transmisión de roedores-pulgas-roedores, combinación que parece esencial para el establecimiento de plagas en países recién colonizados. Este escenario tuvo lugar con la introducción de la peste en Brasil a través del puerto de Santos, São Paulo en 1899 o en Toamasina, el principal puerto de Madagascar, en 1898 [15]. En el siglo XXI, la peste está presente en Asia, África y América [16], los brotes recientes en Uganda [17], China [18], República Democrática del Congo [19] y Madagascar recuerdan que la peste sigue siendo un importante problema de salud pública. Madagascar, desde agosto a noviembre de 2017, experimentó un brote de peste neumónica sin precedentes, con múltiples focos, incluidas dos áreas urbanas principales:
Antananarivo, la capital y Toamasina, su principal puerto marítimo [20,14].
Respuesta Inmunológica y Yersinia pestis
Y. pestis surgió hace menos de 6.000 años de un ancestro bacteriano entérico, Y. pseudotuberculosis, a través de eventos de ganancia de genes y reducción del genoma, dando lugar a la aparición de mecanismos marcadamente diferentes de enfermedad, así como a preferencias de nicho y estilos de vida [21]. Un complejo conjunto de determinantes de virulencia, que incluyen las proteínas de la membrana externa de Yersinia (Yops) -efectores translocados directamente en células del huésped por adhesinas a través de un sistema de secreción tipo 3 (T3SS), que son los que neutralizan las células inmunes-, la proteasa Pla de amplio rango, la ausencia de patrones moleculares asociados a patógenos detectables (PAMPs), la modulación de la interacción innata de células inmunes del huésped y los sistemas de captura de hierro, desempeñan papeles críticos en las estrategias moleculares que emplea la Y. pestis para subvertir el sistema inmunológico humano, permitiendo la replicación bacteriana sin restricciones en los ganglios linfáticos (peste bubónica) y en los pulmones (peste neumónica). Algunas de estas proteínas inmunogénicas, así como el antígeno capsular F1 (proteína de pared), se explotan con fines de diagnóstico y son críticos en el contexto de la rápida aparición de la muerte en ausencia de tratamiento con antibióticos (menos de una semana para la peste bubónica –gangliosy menos de 48 horas para la peste neumónica –pulmones-). A pesar de ser causada por el mismo patógeno, la peste neumónica difiere de la peste bubónica por el modo de infección (aerosoles versus pulgas), el tejido objetivo (pulmones versus piel/ganglios linfáticos), su fisiopatología y letalidad [22].Los neutrófilos son una línea temprana de respuesta de la inmunidad innata e inflamación en sitios donde hay infección. Se acepta comúnmente que la Y. pestis se elimina de manera efectiva cuando los neutrófilos la fagocitan, pero puede sobrevivir y replicarse aún fagocitada.
Se ha demostrado su adaptación y crecimiento a temperatura del intestino medio de las pulgas a 21/26°C [23,24], vector en que el efector T3SS aún no está activado, así puede sobrevivir y replicarse posteriormente dentro de los neutrófilos humanos a 37°C [25]. La Y. pestis transita de este primer nicho a un segundo, cuando los macrófagos fagocitan a los neutrófilos infectados en un proceso de limpieza -polimorfonucleares apoptóticos- llamado efferocitosis [23]. Dentro de los macrófagos, Y. pestis puede sobrevivir en autofagosomas [26], también se describe que es capaz de inhibir la maduración fagosómica al perturbar la vía de reciclaje endosomal del huésped, permitiendo la replicación intracelular bacteriana [27,28]. La efferocitosis se acompaña a su vez de secreción de IL-1RA, citocina que ejerce efectos anti-inflamatorios al bloquear la señalización de IL-1R1. Esta estrategia permitiría también que Y. pestis reduzca los mecanismos de inmunidad innata y se multiplique, mientras tanto aumenta su T3SS e induce mayor apoptosis de macrófagos, un mecanismo no inflamatorio requerido para la infección bacteriana sistémica, tanto en la forma de peste bubónica como neumónica [23]. En los órganos diana, inocula preferentemente YopM en neutrófilos al reconocer específicamente su receptor de complemento de superficie 3 [29], resiste los efectos tóxicos de los neutrófilos por actividad del inhibidor de la lisozima Ivy [30] y del sistema regulador de dos componentes OmpR – EnvZ [31]. El proceso infeccioso implica la adhesión a las células huésped mediadas por lipoproteínas de Braun Lpp y proteínas como Ail, PsaA y Pla. Los efectores Yop, incluidos el YopH, YopE, YopT, YopJ, YpkA, YopM y YopK, se administran posteriormente a través del T3SS para desencadenar la apoptosis, inhibir la fagocitosis y bloquear la producción de citocinas.
Otro de los mecanismos de diseminación de Y. pestis es la necroptosis. Desde los ganglios linfáticos durante la fase preinflamatoria, la bacteria produce ruptura de la membrana celular que conduce a la liberación bacteriana y posterior captura por los fagocitos quimiotácticamente atraídos por fosfato de esfingosina-1 S1P [32]. Se ha documentado que Y. pseudotuberculosis redirige la apoptosis a la “piroptosis inflamatoria” dependiente de caspasa-1 en células preactivadas. La piroptosis inducida por Y. pestis resulta del bloqueo YopJ de la quinasa TAK1, que activa la caspasa-8 y gasdermina D formadora de poros. Paradójicamente, otros Yops (YopM y YopK) se oponen a la piroptosis al prevenir la inflamación y la activación de caspasas-1.
Así como Y. pestis puede inducir necroptosis, se ha descrito que al haber escisión de caspasa-8 en la señal de muerte celular inducida por Y. pestis, también la podría inhibir. La caspasa-8 controla la inmunidad antibacteriana y la producción de citocinas inducida por el receptor Toll-like. Los ratones que carecen de caspasa-8 son altamente susceptibles a la infección por Yersinia. En la fase neumónica los macrófagos alveolares residentes se dirigen al foco infeccioso seguidos de neutrófilos, la liberación de IL-1β/IL-18 dependiente del inflamasoma, ocurre después que las bacterias han ingresado al pulmón, pero no pueden causar inflamación debido a la liberación simultánea de receptores anti-inflamatorios IL-1RA bloqueadores de IL-1. En consecuencia, la IL-1RA parece jugar un papel clave en el establecimiento de la fase preinflamatoria de las formas bubónica y neumónica [22].
El transporte intracelular bacteriano por células dendríticas y monocitos, media en el tráfico de nodo a nodo de Y. pestis [33]. Los mecanismos de inmunidad innata se amplifican cuando la inmunidad adaptativa es efectiva. En tal sentido, las investigaciones describen un papel destacado para la IL-17 tanto en la inmunidad innata como en la adaptativa. Durante la respuesta innata, la IL-17 induce la producción de péptidos antimicrobianos y atrae neutrófilos [34] también activa macrófagos para producir IFNγ [35]. Durante la inmunidad adaptativa, los linfocitos T productores de IL-17 (células Th17) se describen como “LT ayudadores esenciales para curar” en caso de presentar la peste neumónica [36].
Si se permite que la infección se propague más allá del tejido linfoide de drenaje regional, se produce la fase de infección proinflamatoria y/o hiperinflamatoria. Esta fase séptica secundaria se caracteriza por una regulación ascendente masiva de citocinas inflamatorias que conducen rápidamente a falla multiorgánica y a la muerte del individuo infectado [37,38]. Los neutrófilos atraídos a los pulmones son responsables de la neumonía y la necrosis que destruye el tejido [39], el efector T3SS YopK es un modulador crítico de la apoptosis de macrófagos que promueve la progresión de la peste neumónica [40]. Por otro lado, el efector YopM inhibe la muerte de neutrófilos en el centro de las lesiones pulmonares, evitando la liberación de su contenido bactericida e inflamatorio [41].
Diagnóstico Clínico y Biológico
Tras un período de incubación de 1 a 7 días, las personas infectadas suelen presentar una enfermedad febril aguda con otros síntomas sistémicos inespecíficos, tales como fiebre de aparición súbita, escalofríos, dolor de cabeza y dolores generalizados, debilidad, náuseas y vómitos. La peste puede causar adenopatías masivas, a menudo supuradas (bubones), infección pulmonar grave y/o septicemia.Entre las pruebas de diagnóstico biológico, el aislamiento microbiano de Y. pestis sigue siendo el estándar de oro. Aunque Y. pestis puede crecer en medios de cultivo habituales, el uso de un agar con cefsulodinairgasan-novo-biocina (CIN) favorece su aislamiento en muestras polimicrobianas como el esputo. La OMS recomienda enjuagar la boca con agua antes de la recolección de la muestra para reducir las contaminaciones con la flora oral [42]. Después de una incubación de 2 o 3 días a 28°C, se pueden identificar colonias sospechosas en agar CIN mediante pruebas bioquímicas, PCR y lisis de fagos específicos de Y. pestis. El uso de sistemas de identificación automatizados son cada vez más frecuentes, son rápidos y pueden identificar eficientemente una gran variedad de bacterias; sin embargo, se han informado errores de identificación de Y. pestis [43]; por lo tanto, un laboratorio de referencia debe confirmar la asignación taxonómica [44].Propagación de Y. Pestis El conocimiento cuantitativo sobre qué factores naturales y antropogénicos influyen en la propagación global de la peste es limitado. Las clasificaciones de Y. pestis subdividieron diferentes poblaciones en biovares (Antiqua, Medievalis, Orientalis y Pestoides) en función de sus características fenotípicas (Pestoides también se designa como Microtus, rara vez ha infectado a los humanos). Las formas predominantes que al parecer causaron la peste de Justiniano, la Peste Negra y la Tercera Pandemia fueron Antiqua, Medievalis y Orientalis, respectivamente. Todos los biovares conocidos se encontraron en huéspedes (incluidos humanos) y vectores durante el período de la Tercera Pandemia. Dos cepas, 2.MED y 1.ORI3, -de los 15 genotipos más prevalentes: 1.ORI1, 1.ORI2, 1.ORI3, 2.MED1, 2.MED2, 2.MED3, 0.ANT1, 0.ANT3, 1.ANT1, 1.ANT2, 1.ANT3, 3.ANT1, 3.ANT2, 3.ANT3 y 4.ANT descritos-, se extienden significativamente más rápido que otros, posiblemente reflejando diferencias en los mecanismos de transmisión y virulencia entre las cepas [1, 45,46]. Se estima que la propagación mundial de la peste durante la Tercera Pandemia fue más rápida en regiones menos pobladas con alta proporción de pastizales o tierras forestales que en regiones densamente pobladas (al parecer por menos desarrollo sanitario, transmisión por comercio con poblaciones distantes de viajes con humanos, ratas y pulgas infectados). La temperatura mostró una asociación no lineal en forma de “U” con respecto a la velocidad de propagación, con un mínimo de alrededor de 20°C, la vegetación representó también un efecto no lineal dependiente de la región. Por el contrario, la precipitación manifestó un efecto de asociación positiva. Se plantea que el actual calentamiento global en regiones cálidas y tropicales y el aumento de las precipitaciones, podrían aumentar la propagación moderna de la peste [47]. Papel de las Ratas y Pulgas
Propagación de Y. Pestis
El conocimiento cuantitativo sobre qué factores naturales y antropogénicos influyen en la propagación global de la peste es limitado. Las clasificaciones de Y. pestis subdividieron diferentes poblaciones en biovares (Antiqua, Medievalis, Orientalis y Pestoides) en función de sus características fenotípicas (Pestoides también se designa como Microtus, rara vez ha infectado a los humanos). Las formas predominantes que al parecer causaron la peste de Justiniano, la Peste Negra y la Tercera Pandemia fueron Antiqua, Medievalis y Orientalis, respectivamente. Todos los biovares conocidos se encontraron en huéspedes (incluidos humanos) y vectores durante el período de la Tercera Pandemia. Dos cepas, 2.MED y 1.ORI3, -de los 15 genotipos más prevalentes: 1.ORI1, 1.ORI2, 1.ORI3, 2.MED1, 2.MED2, 2.MED3, 0.ANT1, 0.ANT3, 1.ANT1, 1.ANT2, 1.ANT3, 3.ANT1, 3.ANT2, 3.ANT3 y 4.ANT descritos-, se extienden significativamente más rápido que otros, posiblemente reflejando diferencias en los mecanismos de transmisión y virulencia entre las cepas [1, 45,46].Se estima que la propagación mundial de la peste durante la Tercera Pandemia fue más rápida en regiones menos pobladas con alta proporción de pastizales o tierras forestales que en regiones densamente pobladas (al parecer por menos desarrollo sanitario, transmisión por comercio con poblaciones distantes de viajes con humanos, ratas y pulgas infectados). La temperatura mostró una asociación no lineal en forma de “U” con respecto a la velocidad de propagación, con un mínimo de alrededor de 20°C, la vegetación representó también un efecto no lineal dependiente de la región. Por el contrario, la precipitación manifestó un efecto de asociación positiva. Se plantea que el actual calentamiento global en regiones cálidas y tropicales y el aumento de las precipitaciones, podrían aumentar la propagación moderna de la peste [47]. Papel de las Ratas y Pulgas
Papel de las Ratas y Pulgas en la Plaga
Al comienzo de la Tercera Pandemia se observó una fuerte asociación entre mortalidad en humanos y presencia de ratas infectadas, concluyendo que las ratas estuvieron involucradas en la transmisión de la enfermedad. Masanori Ogata, basado en sus experimentos, implicó a la pulga en la transmisión de la bacteria; hipótesis seguida por Paul-Louis Simond en 1898, durante la epidemia en la India, y posteriormente aceptada en 1902 gracias a los experimentos de Gauthier y Raybaud, quienes demostraron la transmisión de la enfermedad de una rata a otra por medio de la picadura de una pulga.Hubo dos especies de ratas comensales presentes en Europa, la rata negra Rattus rattus, también llamada rata de barco o rata de techo y la rata marrón Rattus norvegicus, también llamada rata de aguas residuales. La rata negra tiene una historia en Europa que se remonta a la época medieval, pero nunca ha estado presente en grandes cantidades porque el clima en Europa es demasiado frío para poder vivir y reproducirse fuera de edificios con calefacción. La rata marrón llegó a Europa desde Rusia durante la primera parte del siglo XVIII y abundaba en todas las ciudades europeas alrededor de 1900. Las dos especies son similares en apariencia, pero tienen un comportamiento muy diferente. Se afirma que la rata negra es un escalador eficiente, hace nidos en las paredes y techos de edificios, mientras que la rata marrón puede vivir al aire libre en el clima europeo, es buen nadador y hace nidos en el suelo, en bodegas o en tuberías de alcantarillado. Las dos especies de ratas “transportan” la misma especie de pulgas y son resistentes a la enfermedad. Por su comportamiento diferente, las ratas negras viven más cerca de los humanos que las ratas marrones. Durante la Tercera Pandemia, la peste fue transportada alrededor del mundo por ratas negras en barcos, ratas que no abundaban en Europa, excepto en almacenes de puertos y en algunas ciudades.
Diferentes especies de pulgas pueden transmitir la peste, como las que se encuentran comúnmente en ratas Xenopsylla cheopis vector biológico por excelencia, en gatos Ctenocephalides felis y en humanos Pulex irritans. La Y. pestis adopta una forma de vida única en el tracto digestivo de este vector como “dispositivo” simple y neutral que la transporta como patógeno microbiano, formando una biopelícula envuelta en una sustancia polimérica extracelular compleja. La localización y adherencia de la biopelícula al intestino anterior de la pulga es esencial para su transmisión posterior a los humanos [24].
Los ectoparásitos eran tan abundantes en Europa que el Tercer Congreso Internacional sobre Higiene Escolar, celebrado en París en 1910, aconsejó luchar contra ellos, porque “uno de cada tres niños estaba infestado”. En 1914, Charles Martín y Arthur Bacot describieron el mecanismo por el cual las bacterias, al multiplicarse en el proventrículo de la pulga - zona inmediatamente distal al esófago-, eran capaces de obstruir esta zona, impidiendo el paso del alimento (sangre) al estómago y perpetuar así pulgas hambrientas ávidas de sangre, que regurgitan microorganismos infecciosos durante la picadura. Estos hallazgos sirvieron para que el mismo año, la Tercera Comisión India de la Peste, estableciera la importancia de la pulga tropical de la rata, Xenopsylla cheopis, en la transmisión de la enfermedad. Las invasiones de alimañas en ese entonces, se asociaron con pobreza y condiciones de vida antihigiénicas (Figura 1 y Figura 2).
En los barrios más pobres de las ciudades, la mayoría de los casos fueron encontrados durante brotes como el de Oporto (1899), Glasgow (1900) y Marsella (1900 - 1921). Scheube a principios del siglo XX escribió: “El desarrollo y la propagación de la peste están influenciados en gran medida por las condiciones higiénicas desfavorables, esencialmente relacionadas con la miseria social” [48,49].
Hoy en pleno siglo XXI, la peste causa casos esporádicos e incluso algunos brotes anuales. Suramérica en la década del 2001 a 2011 fue uno de los territorios afectados durante la Tercera Pandemia de peste desatada en Hong Kong. Países como Ecuador, Brasil, Bolivia y Perú, son regiones donde aún prevalece la enfermedad con brotes o casos esporádicos, cuyo posible origen reside en condiciones socioeconómicas adversas, convivencia con roedores y factores climáticos desfavorables. En Colombia existen datos históricos sobre una “neumonía infecciosa” de alta mortalidad, que se presentó en los mismos meses durante tres años consecutivos (1913 a 1915) en los departamentos de Magdalena, Atlántico y Bolívar de la Costa Atlántica; este tipo de neumonía hizo pensar en la peste, sin que se hubiera podido demostrar con exactitud el agente infeccioso [50].
Conclusión
Las epidemias, pestes y pandemias durante la evolución natural del Planeta Tierra, nos mantienen alerta en el día a día de nuestro calendario vital y nos ponen de manifiesto la fragilidad de la vida humana, permitiéndonos recordar -sin ningún asomo de sutileza- que somos parte fundamental del equilibrio del Todo pero no el Todo.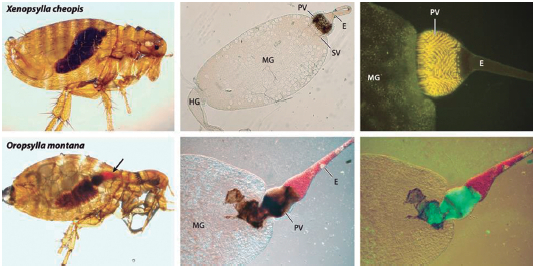
Figura 1. El hábitat del tracto digestivo de las pulgas de Y. pestis. De izquierda derecha, de arriba abajo: pulga intacta no infectada y muestras del tracto digestivo de Xenopsylla cheopis. Las imágenes inferiores: Oropsylla montana infectada con Y. pestis que expresa GFP (green fluorescent protein). El proventrículo de esta pulga está completamente bloqueado con una biopelícula de Y. pestis que impide que la sangre ingrese al intestino medio (flecha). Los intestinos disecados se visualizaron usando DIC (centro) o DIC y microscopía fluorescente (derecha). Las espinas proventriculares están recubiertas con cutícula, el mismo material que recubre el exoesqueleto, y son autofluorescentes.
Abreviaturas: DIC, contraste de interferencia diferencial; E, esófago; HG, intestino posterior; MG, intestino medio; PV, proventriculus; SV, válvula estomodeal. (Tomado y modificado de referencia 24).
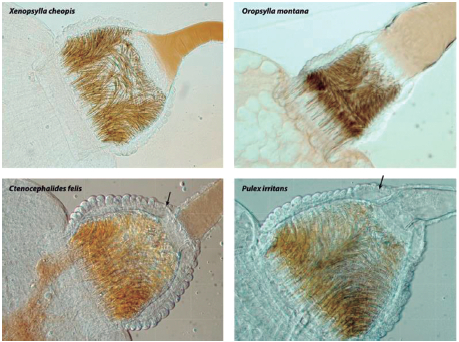
Figura 2. Diferencias anatómicas del intestino anterior que se correlacionan con la eficiencia de transmisión. Se muestra el proventrículo de dos vectores eficientes (Xenopsylla cheopis y Oropsylla montana) y dos vectores ineficientes (Ctenocephalides felis y Pulex irritans). Obsérvese la unión ancha y sin restricciones proventricular-esofágica de O. montana y las gruesas capas de músculo proventricular (flechas) que extienden y constriñen la base del esófago de C. felis y P. irritans. Tomado y modificado de referencia 24.
Referencias
1. Cui Y, Yu C, Yan Y, Li D, Li Y,
Jombart T, et al. Historical variations in mutation rate in an epidemic
pathogen, Yersinia
pestis. Proceedings of the National Academy of Sciences
of the United States of America. 2013; 110(2):577–82.
Epub 2012/12/29. 10.1073/pnas.1205750110.
2. Morelli G, Song Y, Mazzoni CJ,
Eppinger M, Roumagnac
P, Wagner DM, et al. Yersinia pestis genome sequencing
identifies patterns of global phylogenetic diversity. Nat
Genet. 2010; 42(12):1140– 3. Epub 2010/11/03. 10.1038/ng.705 [pii]
10.1038/ng.705.
3. Wagner DM, Klunk J, Harbeck M,
Devault A, Waglechner
N, Sahl JW, et al. Yersinia pestis and the Plague of Justinian 541–543
AD: a genomic analysis. The Lancet Infectious diseases. 2014;
14(4):319– 26. 10.1016/S1473-
3099(13)70323-2.
4. Perry RD, Fetherston JD. Yersinia
pestis-etiologic agent
of plague. Clin Microbiol Rev. 1997; 10(1):35–66. Epub
1997/01/01.
5. Raoult D, Mouffok N, Bitam I,
Piarroux R, Drancourt M.
2013. Plague: history and contemporary analysis. J. Infect. 66, 18–26.
(10.1016/j.jinf.2012.09.010).
6. Whittles LK, Didelot X.
Epidemiological analysis of the
Eyam plague outbreak of 1665– 1666. 2016. Proc. R.
Soc. B 283, 20160618 (10.1098/rspb.2016.0618).
7. Xavier Didelot, Lilith K.
Whittles, and Ian Hall. Model-based analysis of an outbreak of bubonic
plague in Cairo in
1801. J R Soc Interface. 2017 Jun; 14(131): 20170160.
PMCID: PMC5493801 Published online 2017 Jun 21.
Doi: 10.1098/rsif.2017.0160 PMID: 28637916.
8. Rotz LD, Khan AS, Lillibridge SR,
Ostroff SM, Hughes
JM. Public health assessment of potential biological terrorism agents.
Emerg Infect Dis. 2002; 8(2):225–30. Epub
2002/03/19. 10.3201/eid0802.010164.
9. Slack P. Plague: a very short
introduction. Oxford, UK:
Oxford University Press 2012. ISBN: 9780199589548.
10. Devaux CA. Small oversights that
led to the Great Plague of Marseille (1720–1723): lessons from the
past.
Infect. Genet. Evol. 14, 169–185. (10.1016/j.meegid.2012.11.016). 2013.
11. Cummins N, Kelly M, Ó Gráda C.
Living standards and
plague in London, 1560–1665. Econ. Hist. Rev. 69, 3–34.
(10.1111/ehr.12098). 2016.
12. Pryor EG. The great plague of
Hong Kong. J. Hong Kong
Branch R. Asiat. Soc. 1975; 15, 61–70.
13. Butler T. Plague history:
Yersin’s discovery of the causative bacterium in 1894 enabled, in the
subsequent century,
scientific progress in understanding the disease and the
development of treatments and vaccines. Clin. Microbiol.
Infect. 20, 202–209. (10.1111/1469-0691.12540) 2014.
14. WHO. Plague-Madagascar, Disease
outbreak news.
2017, http://www.who.int/csr/don/09-january-2017-plague-mdg/en/.
15. Dos Santos Grácio AJ,
Grácio MA. Plague: A Millenary
Infectious Disease Reemerging in the XXI Century. Biomed Res Int.
2017(33):1-8. Published online 2017 Aug
20. doi: 10.1155/2017/5696542.
16. Bertherat E. Plague around the
world, 2010–2015. Wkly
Epidemiol Rec. 2016; 91:89–104.
17. Respicio-Kingry LB, Yockey BM,
Acayo S, Kaggwa J,
Apangu T, Kugeler KJ, et al. Two distinct Yersinia pestis populations
causing plague among humans in the
West Nile region of Uganda. PLoS Negl Trop Dis. 2016;
10:e0004360.
18. Shi L, Yang G, Zhang Z, Xia L,
Liang Y, Tan H, et al. Reemergence of human plague in Yunnan, China in
2016.
PLoS ONE. 2018; 13:e0198067.
19. Abedi AA, Shako J-C, Gaudart J,
Sudre B, Ilunga BK,
Sha- mamba SKB, et al. Ecologic features of plague outbreak areas,
Democratic Republic of the Congo, 2004–
2014. Emerg Infect Dis. 2018; 24:210-20.
20. Andrianaivoarimanana V, Piola P,
Wagner DM, Rakotomanana F, Maheriniaina V, Andrianalimanana S, et
al. Trends of human plague, Madagascar, 1998–2016.
Emerg Infect Dis. 2019; 25:220-8.
21. McNally A, Thomson NR, Reuter S,
Wren BW. ‘Add, stir
and reduce’: Yersinia spp. as model bacteria for pathogen
evolution. Nat Rev Micro. 2016; 14:177-90.
22. Christian E. Demeure, Olivier
Dussurget Guillem Mas
Fiol, Anne-Sophie Le Guern, Cyril Savin, Javier PizarroCerdá Yersinia
pestis and plague: an updated view on
evolution, virulence determinants, immune subversion,
vaccination, and diagnostics. Genes and Immunity 2019;
20:357-370 https://doi.org/10.1038/s41435-019-0065-0.
23. Spinner JL, Winfree S, Starr T,
Shannon JG, Nair V, Steele- Mortimer O, et al. Yersinia pestis survival
and replication within human neutrophil phagosomes and uptake
of infected neutrophils by macrophages. J Leukoc Biol.
2014; 95:389–98.
24. Hinnebusch BJ, Jarrett CO, Bland
DM. ‘Fleaing’ the plague: adaptations of Yersinia pestisto its insect
vector that
lead to transmission. Annu Rev Microbiol. 2017; 71:215–
32.
25. Shannon JG, Hasenkrug AM, Dorward
DW, Nair V, Carmody AB, Hinnebusch BJ. Yersinia pestis subverts the
dermal neutrophil response in a mouse model of bubonic
plague. MBio. 2013; 4:e00170-13-e00170-13.
26. Pujol C, Klein KA, Romanov GA,
Palmer LE, Cirota C,
Zhao Z, et al. Yersinia pestis can reside in autophagosomes and avoid
xenophagy in murine macrophages
by preventing vacuole acidification. Infect Immun. 2009;
77:2251–61.
27. Connor MG, Pulsifer AR, Price CT,
Abu Kwaik Y, Lawrenz
MB. Yersinia pestis requires host Rab1b for survival in
macrophages. PLoS Pathog. 2015; 11:e1005241.
28. Connor MG, Pulsifer AR, Chung D,
Rouchka EC, Ceresa
BK, Lawrenz MB. Yersinia pestis targets the host endosome recycling
pathway during the biogenesis of the Yersinia-containing vacuole to
avoid killing by macrophages.
MBio. 2018;9:e01800-17
29. Merritt PM, Nero T, Bohman L,
Felek S, Krukonis ES,
Marketon MM. Yersinia pestis targets neutrophils via
complement receptor 3. Cell Microbiol. 2014; 17:666-87.
30. Derbise A, Pierre F, Merchez M,
Pradel E, Laouami S,
Ricard I, et al. Inheritance of the lysozyme inhibitor Ivy
was an important evolutionary step by Yersinia pestis
to avoid the host innate immune response. J Infect Dis.
2013; 207:1535-43.
31. Reboul A, Lemaître N, Titecat M,
Merchez M, Deloison G,
Ricard I, et al. Yersinia pestis requires the 2-component
regulatory system OmpR-EnvZ to resist innate immunity
during the early and late stages of plague. J Infect Dis.
2014; 210:1367-75.
32. Arifuzzaman M, Ang WXG, Choi HW,
Nilles ML, St John
AL, Abraham SN. Necroptosis of infiltrated macrophages
drives Yersinia pestis dispersal within buboes. JCI Insight.
2018; 3:35.
33. St. JohnAL,AngWXG, Huang
M-N,Kunder CA, ChanEW,
Gunn MD, et al. S1P-dependent trafficking of intracellular
Yersiniapestisthroughlymphnodesestablishesbuboesand
systemic infection. Immunity. 2014; 41:440-50.
34. Littman DR, Rudensky AY. Th17 and
regulatory T cells
in mediating and restraining inflammation. Cell. 2010;
140:845-58.
35. Bi Y, Zhou J, Yang H, Wang X,
Zhang X, Wang Q, et al. IL17A produced by neutrophils protects against
pneumonic
plague through orchestrating IFN-γ-activated macrophage programming. J
Immunol. 2014; 192:704-13.
36. Lin JS, Kummer LW, Szaba FM,
Smiley ST. IL-17 contributes to cell-mediated defense against pulmonary
Yersinia pestis infection. J Immunol. 2011; 186:1675-84.
37. Comer JE, Sturdevant DE, Carmody
AB, Virtaneva K, Gardner D, Long D, Rosenke R, Porcella SF, Hinnebusch
BJ. 2010. Transcriptomic and innate immune
responses to Yersinia pestis in the lymph node during bubonic plague.
Infect. Immun. 78:5086-5098.
38. Sebbane F, Gardner D, Long D,
Gowen BB, Hinnebusch BJ. 2005. Kinetics of disease progression and
host response in a rat model of bubonic plague. Am. J.
Pathol. 166:1427-1439.
39. Pechous RD, Sivaraman V, Price
PA, Stasulli NM, Goldman WE. Early host cell targets of Yersinia pestis
during primary pneumonic plague. PLoS Pathog. 2013;
9:e1003679.
40. Peters KN, Dhariwala MO, Hughes
Hanks JM, Brown CR,
Anderson DM. Early apoptosis of macrophages modulated by injection of
Yersinia pestis YopK promotes progression of primary pneumonic plague.
PLoS Pathog. 2013;
9:e1003324.
41. Stasulli NM, Eichelberger KR,
Price PA, Pechous RD,
Montgomery SA, Parker JS, et al. Spatially distinct neutrophil
responses within the inflammatory lesions of pneumonic plague. MBio.
2015; 6:e01530-15.
42. WHO. How to safely collect sputum
samples from patients
suspected to be infected with pneumonic plague. 2016.
Technical Guidance. www.who.int/csr/disease/plague/en.
43. Tourdjman M, Ibraheem M, Brett M,
DeBess E, Progulske B, Ettestad P, et al. Misidentification of Yersinia
pestis
by automated systems, resulting in delayed diagnoses of
human plague infections Oregon and New Mexico, 2010–
2011. Clin Infect Dis. 2012; 55:e58–e60.
44. Morelli G, et al. Yersinia pestis
genome sequencing identifies patterns of global phylogenetic diversity.
Nat Genet
2010; 42:1140–1143.
45. Achtman M, et al. Yersinia
pestis, the cause of plague, is
a recently emerged clone of Yersinia pseudotuberculosis.
Proc Natl Acad Sci USA. 1999; 96:14043-14048.
46. Lei Xu, Leif C. Stige, Herwig
Leirs, Simon Neerinckx,
Kenneth L. Gage, Ruifu Yang, Qiyong Liu, Barbara Bramanti, Katharine R.
Dean, Hui Tang, Zhe Sun, Nils Chr.
Stenseth, and Zhibin Zhang. Historical and genomic data
reveal the influencing factors on global transmission velocity of
plague during the Third Pandemic. Proc Natl Acad
Sci USA. 2019 Jun 11; 116(24): 11833-11838.
47. BramantiB,DeanKR,Walløe
L,Chr.StensethN. 2019The
Third Plague Pandemic in Europe. Proc. R. Soc. B 286:
20182429. http://dx.doi.org/10.1098/rspb.2018.2429.
48. Pollitzer R. Division of
Epidemiology, World Health Organization. Plague Studies. A Summary of
the History and
a Survey of the Present Distribution of the Disease. Bull.
Org. mond. Santé. Bull. World Hlth Org. 1951; 4:475-533.
49. Scheube B. The diseases of warm
countries: A handbook
for medical men. London, UK: Bale & Danielsson. 1908.
50. Faccini-Martínez A, Sotomayor HA.
Reseña histórica de
la peste en Suramérica: una enfermedad poco conocida
en Colombia. Biomédica. 2013; 33(1): 8-27. https://doi.org/10.7705/biomedica.v33i1.814.
Recibido: : 26 de Mayo de
2020
Aceptado: 15 de Junio de 2020
Correspondencia:
María Claudia Ortega López
mcol19@yahoo.com
Aceptado: 15 de Junio de 2020
Correspondencia:
María Claudia Ortega López
mcol19@yahoo.com