EPIDEMIOLOGÍA DE LAS PANDEMIAS
Diego Rosselli1
Resumen
Las epidemias han acompañado a la humanidad desde tiempos remotos. Se
ha visto que su comportamiento sigue unos patrones matemáticos que poco
a poco se han ido precisando. En este artículo
se revisan las seis fases que la OMS ha establecido para clasificar las
pandemias, se revisan la última
gran pandemia, la gripa española de 1918 y su impacto en Colombia, y el
último brote importante
ocasionado por un coronavirus: el SARS de 2002 y 2003. Finalmente, se
menciona la importancia de
los modelos matemáticos explicativos y predictivos, y se plantean
varios escenarios para el comportamiento futuro de la epidemia en
Colombia.Palabras clave: epidemiología; pandemia; política; democracia; simulación.


1 MD, EdM, MSc, Neurólogo. Departamento de Epidemiología Clínica y Bioestadística, Facultad de Medicina, Pontificia Universidad Javeriana. Miembro Correspondiente, Academia Nacional de Medicina. Bogotá, Colombia.
EPIDEMIOLOGY OF PANDEMICS
Abstract
Epidemics have accompanied humanity since ancient times. It has been
seen that their behavior follows mathematical patterns that have been
gradually clarifi ed. This article reviews the six phases that WHO has
established to classify pandemics, reviews the last major pandemic, the
Spanish fl u of 1918 and its impact in Colombia, as well as the last
major outbreak caused by a coronavirus: the 2002 and 2003, SARS.
Finally, the importance of explanatory and predictive mathematical
models is reviewed, and several scenarios are proposed for the future
behavior of the epidemic in Colombia.Keywords: epidemiology; pandemic; politics; democracy; simulation.
Epidemiología, pandemia y democracia
Epidemiología, pandemia y democracia comparten su origen, por lo menos desde la etimología; la raíz griega “demos” (δhμος), “pueblo”, está incluida en los tres términos. Desde su origen, que se remonta a los textos clásicos de Hipócrates, Aristóteles y Galeno, que usaron también “endemia” y “epidemia” con significados similares a los actuales, la palabra “pandemia” designa una enfermedad que afecta a todos (“pan”) los pueblos (“demos”) (1). El término “pandemia” podría aplicarse a cualquier epidemia que logre extenderse ampliamente, como lo afirma el Diccionario de la lengua española, cuando dice “enfermedad epidémica que se extiende a muchos países o que ataca a casi todos los individuos de una localidad o región.” Sin embargo, la Organización Mundial de la Salud (OMS) ha buscado poner algo de orden, y proporcionar para “pandemia” una definición operativa, que implica la afectación de seres humanos (aunque uno podría describir pandemias porcinas o aviares), y que cumpla con un citerio de severidad manifiesta. Se argumentó que, detrás de esa decisión podría haber influencias políticas cuando, en 2009, la página de la OMS modificó su definición del término para incluir, además de su extensión geográfica, la severidad y letalidad en seres humanos (2). El temor a causar zozobra con el término parece haber sido la razón.Desde 1999, y luego con su actualización en 2005 (3), la OMS venía planteando unas guías para que todos los países estuvieran preparados para enfrentar una posible pandemia. La oportunidad llegó en 2009, con el brote de influenza H1N1. Interesante ver cómo en esa ocasión la OMS fue atacada por haber “sobreactuado” y haber exagerado la importancia de la enfermedad (4,5), mientras que en este brote de Covid-19 se la ha acusado de lo contrario, y haber demorado la declaratoria de pandemia (6). La interpretación de este dilema entre sembrar un pánico innecesario o promover la indiferencia, tanto para la epidemiología como para la historia, es un claro indicador de la complejidad inherente al comportamiento biológico de los brotes infecciosos. Aunque la pandemia de H1N1 llegó a Colombia (7) y dejó numerosas víctimas fatales (8) el interés en el tema se desvaneció rápido.
Las fases de una pandemia
Sea como fuere, en 2009 la OMS estableció y divulgó las seis fases de una pandemia (9). Quizás previendo el mal uso de esta fases y la proliferación de lo que ha venido a llamarse “infodemia” (10), con abuso de noticias falsas y campo abonado para charlatanes que se aprovechan de la ignorancia y el temor de los ciudadanos (11), la misma OMS hizo entonces algunas aclaraciones sobre su documento, como por ejemplo advertir que las fases son una herramienta de planificación, no pretenden ser usadas como guía para predecir lo que sucederá en la pandemia, ni necesariamente implican que estas fases siempre ocurrirán en el mismo orden. Esta guía tampoco, advierte la OMS, se aplica a los períodos posteriores al pico, ni a la post pandemia (que sería más acertado llamar inter pandemia), con sus respectivas actividades de recuperación social y económica. Aunque la descripción original se refiere a brotes de influenza, estas fases se pueden aplicar a otras enfermedades infecciosas que se manifiesten a manera de brotes.La fase 1 corresponde a la interpandemia, cuando se identifican e idealmente se vigilan los virus que existen en animales, y que tengan potencial de afectar seres humanos. Se denomina fase 2 cuando ya se detectan seres humanos afectados por alguno de estos virus de animales, ya sean estos últimos salvajes o domésticos. En la fase 3 se describen grupos de personas (clústeres) afectadas por la enfermedad con características comunes; aunque ya puede haber transmisión de persona a persona, esta no es suficiente para desarrollar y mantener un brote en la comunidad.
Es en la fase 4, en el momento en que se describe transmisión comunitaria de persona a persona, cuando los países deben notificar la situación a la OMS y se debe organizar una intervención focalizada. En la fase 5, hay comunidades afectadas en, por lo menos, dos países de una misma de las regiones en que la OMS divide al mundo. La fase 5 indica que una pandemia puede ser inminente, pero ésta se declara cuando se llega a la fase 6, cuando hay transmisión comunitaria en países de dos o más regiones de la OMS.
Nótese que estas fases están pensadas específicamente para influenza, o quizás para otras enfermedades infecciosas de transmisión de humano a humano, y no para enfermedades transmitidas por vectores, pero que también muestran un comportamiento epidémico, como podrían ser la fiebre amarilla (12,13) o el dengue (14).
El SARS
Cuando la OMS actualizó sus pautas de clasificación y su definición de pandemia todavía estaba fresco el recuerdo de los estragos y los temores del SARS, ese otro coronavirus que se extendió por el mundo en 2002 y 2003. El sars afectó 29 países y dejó más de ocho mil víctimas fatales (15) pero, por alguna caprichosa razón, no tocó tierras latinoamericanas. Esta pandemia previa por coronavirus dejó numerosas lecciones para la que vivimos actualmente. Conviene comenzar resaltando la cercanía filogenética de las dos especies de coronavirus (16). Los coronavirus han estado entre nosotros desde hace muchos años, y sus primeras descripciones, así como su designación (que es realmente un alusión astronómica a la “corona solar”) data de los años 60. Hasta los 90, sin embargo, la virología poco se ocupó de ellos ya que, a pesar de que la Medicina veterinaria los había encontrado asociados a plagas en varias especies aviares y de mamíferos de interés comercial, como los cerdos, no se había demostrado su importancia en la Medicina humana (17).Actualmente, se reconocen 49 especies de coronavirus (18); por lo menos, tres de ellas, se sabe que producen síndromes respiratorios de curso relativamente benigno en seres humanos, pero otras tres, incluyendo el actual SARS-CoV-2, han sido responsables de importantes brotes epidémicos en este siglo: el SARS y el MERS. Es interesante resaltar que la cercanía genética entre las especies de coronavirus que afectan a los humanos (que es de cerca de 70% entre los virus del SARS y del Covid-19) es menor que la que existe entre el SARS-CoV-2 y los coronavirus identificados en murciélagos, cuya cercanía filogenética supera el 95% en varios estudios (19,20).
He aquí una breve cronología del SARS: la enfermedad se describió por primera vez en noviembre 2002 en la provincia de Guangdong, en el sur de China. Estuvo contenida en ese país, en donde se describieron 305 caos de esta infección respiratoria febril antes de que, en febrero de 2003, se presentaran los primeros casos en Hong Kong, afectando en gran medida a trabajadores de la salud. En marzo de 2003, ya tres laboratorios habían identificado el agente viral y, al poco tiempo, siete grupos habían secuenciado su genoma. Del brote de Hong Kong a la aparición de casos en Vietnam, de nuevo afectando personal de salud, transcurrieron escasos días; Singapur y Tailandia vinieron después, en una larga lista que para mayo de 2003 incluía 29 países de Asia, Oceanía, América del Norte, África, y Europa (España, Finlandia, Francia, Italia, Irlanda, Polonia, Reino Unido y Suecia) (21). Un caso importado probable en Colombia, y otro en Brasil fueron luego desmentidos, aunque nuestro país hizo algunos preparativos de bioseguridad (22). Tal vez lo más enigmático del SARS fue la forma como desapareció: el último caso se presentó en Toronto en junio de 2003, ocho meses después del primer paciente en China (23). Las autoridades sanitarias aducen que esto se debió a la efectividad de sus controles sanitarios, pero la posibilidad de una atenuación progresiva del virus ARN de cadena única, podría ser una explicación alternativa (16).
La gripa española
Otra pandemia de consecuencias demoledoras que nos deja valiosas lecciones fue la denominada gripa española de 1918 a 1920, cuyo legado de muertes ha sido estimado entre 50 y 100 millones de personas (24,25). El brote parece haberse originado en el Estado de Kansas, o más probablemente en Texas (26), en Estados Unidos, y haber sido llevado a Europa por soldados americanos.La enfermedad llegó relativamente rápido a Colombia, en donde los primeros casos se registraron en Bogotá en octubre de 1918. En su recuento histórico, Ospina Díaz y cols., no solo describen su presencia en numerosos municipios de Boyacá, sino que recogen registros de prensa en Barranquilla, Bucaramanga, Cartagena, Manizales, Medellín, Tunja y Túquerres (26). No puedo dejar pasar esta oportunidad de describir un registro inédito que, en la ciudad de Sogamoso, dejó mi bisabuelo Marcos Quijano retirado entonces para huir de la epidemia a su casa campestre “Las Lomitas”, ubicada en las afueras del pueblo. Cuenta don Marcos que en la casa vecina en donde vivían 5 personas, una sobrevivió: “los otros cuatro amortajados en lienzos y transportados en unas parihuelas fueron llevados al cementerio. No se conseguían cajas mortuorias, ya que los fabricantes, unos habían muerto y los que quedaban no daban abasto para satisfacer los pedidos. Cualquier lesión de bronquios, pulmones o corazón con la gripa era definitiva”. La presencia de comorbilidades, entonces, como ahora, eran factor de riesgo para mortalidad.
Desde la perspectiva epidemiológica, hay varias características de la pandemia del siglo pasado que conviene mencionar, una de ellas fue su velocidad de diseminación; lo que le tomó semanas o meses a esa pandemia, le ha tomado días al Covid-19. Entonces, como ahora, los grandes centros urbanos y los sitios que eran confluencia de caminos fueron atacados más temprano y con más virulencia. Otro hecho significativo fue que la pandemia de influenza de hace un siglo se ensañó con los adultos jóvenes, incluyendo a las madres gestantes, una diferencia significativa con la pandemia actual. Otra característica de esa pandemia fue su presentación en “olas” independientes, tres en total (cuatro según algunos). Cuando vamos apenas a mitad de la pandemia actual es difícil predecir si algo similar podría ocurrir con el Covid-19. Ya hay un país, sin embargo, que podría estar presentando esa segunda ola, se trata de Irán. Según las estadísticas de ourworldindata.org/, en ese país se presentó un primer pico a finales de marzo, que llevó a que se registraran 3.186 casos nuevos el 31 de marzo. Una intervención que incluyó cuarentena estricta, logró reducir el número de casos nuevos a 802 el 3 de mayo. Desde entonces, sin embargo, se presenta un crecimiento progresivo que ha llegado hasta 3.134 casos nuevos el 4 de junio (datos no publicados).
Así como he resaltado las diferencias entre la gripe española y el Covid-19, también conviene señalar sus similitudes. En ambos casos se presentaron ejemplos de encubrimiento de la realidad con fines políticos y buscando no ocasionar alarma. En común con muchos otros procesos epidémicos, tanto en esa como en esta pandemia, se buscó culpar a alguien y discriminar a determinados grupos humanos (27). Entonces, como ahora, la epidemia se ensañó en los grupos humanos más vulnerables (28).
La Figura 1 muestra las líneas de tendencia de la pandemia en tres regiones de la tierra: Europa, Norteamérica y Suramérica, según los datos suministrados por el portal Our World in Data (ourworldindata.org). Aquí se agrupan los datos de numerosos países, sin embargo, se hace evidente un pico más agudo del continente europeo, seguido de un lento declinar; una morfología de meseta aunque con algo de reducción progresiva en Norteamérica, y una curva ascendente que sugiere que en Suramérica el problema está todavía en sus fases iniciales.
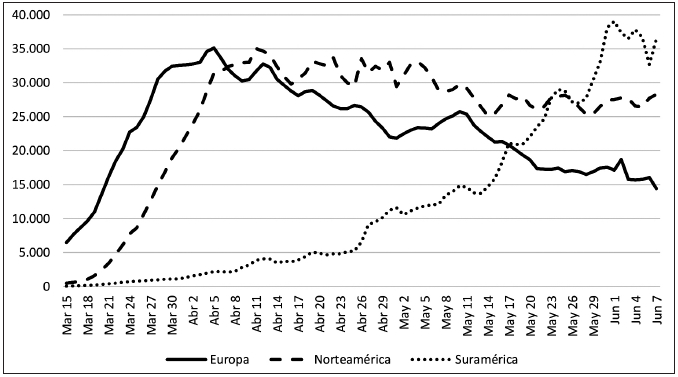
Figura 1. Número de casos nuevos diarios confirmados (Promedios de
5 días previos) de tres regiones del
mundo: Europa, Norteamérica y Suramérica.
Fuente: elaboración propia a partir de datos de Our World in Data
(ourworldindata.org). Adaptado de (29).
La simulación matemática
Las enfermedades, en su distribución en la población, siguen patrones que se pueden describir, y potencialmente proyectar en el futuro, en términos matemáticos. Ese es, entre otras, el campo de estudio tanto de la bioestadística como de la epidemiología (30). Es claro que la predicción de enfermedades crónicas sea relativamente más sencilla y, por ende, más precisa. Con enfermedades infecciosas, particularmente epidémicas y emergentes, el reto es mucho mayor (31). Lo modelos dinámicos más empleados para estas predicciones se denominan SEIR, que corresponde a la letras iniciales de susceptibles, expuestos, infectados y recuperados (en donde se incluyen los fallecidos) (32). La elaboración de estos modelos requiere una serie de variables que no siempre se conocen, lo que hace que sus predicciones deban verse con mucha cautela. La tasa de contagio, por ejemplo, puede sufrir muchas modificaciones de magnitud impredecible con las intervenciones gubernamentales (33). Otro gran reto es establecer el porcentaje de la población susceptible (que el caso del covid-19 es el 100%) que se infectará. Empleando esta metodología el autor ha realizado unas proyecciones de la epidemia de covid-19 que aparecen en la Figura 2. En ella se ilustran diferentes escenarios.Conclusiones
Aunque para los seres humanos actuales, esta pandemia es algo único y de gran trascendencia, la especie ya ha vivido brotes epidémicos aún más devastadores en el pasado. Aunque su comportamiento, su dispersión y su letalidad siguen patrones matemáticos, éstos solo se aclaran cuando son revisados a posteriori. Los modelos matemáticos son útiles para predecir los días o quizás semanas siguientes, pero su incertidumbre aumenta con el tiempo de la misma manera como crecen las epidemias: de manera exponencial.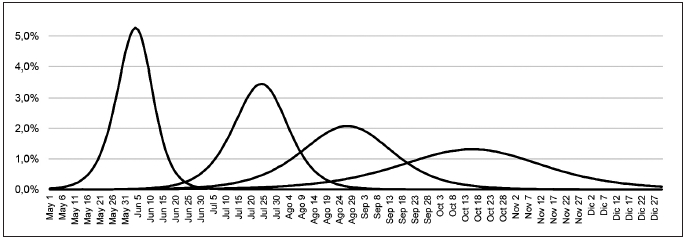
Figura 2. Curvas de comportamiento hipotético de la epidemia en
Colombia. Los porcentajes corresponden al
porcentaje de la población susceptible que se infectaría
simultáneamente. De izquierda a derecha corresponden a
si la epidemia se hubiera seguido comportando como lo hizo en las
primeras dos semanas, la segunda a las metas
esperadas con las medidas iniciales de cierre de centros educativos, la
tercera con las medidas de apertura parcial
actuales y la última de mantenerse una cuarentena rígida.
Fuente: elaboración del autor a partir de datos oficiales del Instituto Nacional de Salud (34).
Referencias
1. De Rezende JM. Epidemia, endemia,
pandemia, epidemiología. Rev Patol Trop. 1998; 27(1): 153-5.
2. Doshia P. The elusive definition
of pandemic influenza.
Bull World Health Organ. 2011; 89: 532-8.
3. WHO Global Influenza Preparedness
Plan. The role of
WHO and recommendations for national measures before and during
pandemics, World Health Organization.
2005 (WHO/CDS/CSR/GIP/2005.5)
4. Fineberg H. Pandemic preparedness
and response:
Lessons from the H1N1 Influenza of 2009. N Engl J
Med. 2014; 370(14): 1335-42.
5. Hung LS. The SARS epidemic in Hong
Kong: what lessons have we learned? J Royal Soc Med. 2003; 96: 374-
8
6. Sohrabi C, Alsafi Z, O’Neill N,
Khan M, Kerwan A, AlJabir A, et al. World Health Organization declares
global
emergency: A review of the 2019 novel coronavirus (COVID-19).
International J Surg. 2020; 76: 71-6.
7. Núñez LM, Aranda DF, Jaramillo C, Moyano LF, Osorio EdJ. Chronology
of a pandemic: the new influenza A
(H1N1) in Bogota, 2009-2010. Rev Salud Pública. 2011;
13(3): 480-91.
8. Rey-Benito GJ, Castro-Jiménez MÁ,
Castillo-Pabón JO.
Descriptive analysis of the first deaths for pandemic influenza (H1N1)
2009 in Colombia. Infectio. 2009; 13(4):
254-8.
9. World Health Organization.
Pandemic influenza preparedness and response: A WHO Guidance Document.
Geneva: World Health Organization; 2009. Available
from: https://www.ncbi.nlm.nih.gov/books/NBK143062/
10. Cinelli M, Quattrociocchi W,
Galeazzi A, Valensise
CM, Emanuele Brugnoli E, Schmidt AL, et al. The COVID-19 social media
infodemic. ArXiv. 2020; arXiv:
2003.05004v1.
11. Rosselli D. Covid-19: entre el
pánico y la indiferencia.
Acta Neurol Colomb. 2020; 36(2): 47-8.
12. Kieffer A, Hoestlandt C,
Gil-Rojas Y, Broban A, Castañeda-Cardona C, Rosselli D. The public
health benefits
and economic value of routine yellow fever vaccination
in Colombia. Value Health Reg Iss. 2019; 20: 60-5.
13. Hernández-Galvis J, Pizarro AB,
Cuestas JA, Castañeda-Cardona C, Rosselli D. La fiebre amarilla en
Colombia: de calamidad pública a enfermedad desatendida.
Acta Médica Perú. 2018; 35 (1): 55-9.
14. Laserna A, Barahona-Correa J,
Baquero L, CastañedaCardona C, Rosselli D. Economic impact of dengue
fever in Latin America and the Caribbean: a systematic
review. Rev Panam Salud Pública. 2018; 42: e111.
15. Dye C, Gay N. Modeling the SARS epidemic. Science,
2003; 300(5627): 1884-5.
16. Rosselli D, Yucumá D,
Rodríguez-Morales AJ, Esposito
S. Could SARS-CoV-2/COVID-19 simply fade away? Infez Med. 2020; 28
(Suppl 1): 1-3.
17. BMJ. Coronaviruses in animals and
humans (Editorial).
BMJ. 2020; 368: m634.
18. Gorbalenya AE, Baker SC, Baric
RS, de Groot RJ,
Drosten C, Gulyaeva AA, et al. Severe acute respiratory
syndrome-related coronavirus: The species and its viruses. BioRxiv.
2020; Disponible en: https://digital.csic.es/bitstream/10261/212994/1/Severe%20acute_Gorbalenya.pdf
19. Zhou P, Yang XL, Wang XG, Hu B,
Zhang L, Zhang
W, et al. A pneumonia outbreak associated with a new
coronavirus of probable bat origin. Nature Med. 2020;
579(7798): 270-3.
20. Zheng J. SARS-CoV-2: an emerging
coronavirus that
causes a global threat. Int J Biol Sci. 2020; 16(10): 1678.
21. Cherry JD. The chronology of the
2002–2003 SARS mini
pandemic. Paediatr Respir Rev. 2004; 5(4): 262-9.
22. Briceño Ayala L. El SARS y la
bioseguridad en Colombia. Rev Cienc Salud. 2004; 2(1): 41-5.
23. Low DE, McGeer A. SARS: One year
later. N Engl J
Med. 2004; 349(25): 2381-2
24. Johnson N, Mueller J. Updating
the accounts: Global
mortality of the 1918-1920 “Spanish” influenza pandemic. Bull Hist Med.
2002; 76(1): 105-15.
25. Ashton J. COVID-19 and the
‘Spanish’flu. J Royal Soc
Med. 2020; 113(5): 197-8.
26. Ospina J, Martínez A, Herrán O.
Impacto de la pandemia de gripa de 1918-1919 sobre el perfil de
mortalidad
general en Boyacá, Colombia. História, Ciências, Saúde. 2009; 16:
53-81.
27. Devakumar D, Shannon G, Bhopa SS,
Abubakar I. Racism and discrimination in COVID-19 responses. Lancet.
2020; 395(10231): 1194.
28. Zhicheng W, Tang K. Combating
COVID-19: health equity matters.” Nature Med. 2020; 26(4): 458.
29. Rosselli D. Covid-19 en Colombia:
los primeros 90 días.
Acta Neurol Colomb. 2020; 36 (Suppl 1): 1-6.
30. Rosselli D, Tarazona N, Aroca A.
La salud en Colombia
1953-2013: Un análisis de estadísticas vitales. Medicina
(Bogotá). 2014; 36(2): 120-35.
31. Wynants L, Van Calster B, Collins
G, Riley RD, Heinze
G, Schuit E, et al. Prediction models for diagnosis and
prognosis of covid-19: systematic review and critical appraisal. BMJ.
2020; 369: m1328.
32. González-Jaramillo V,
González-Jaramillo N, GómezRestrepo C, Palacio-Acosta CA, Gómez-López
A, Franco OH. Impact of the COVID-19 pandemic on the Colombian
population according to mitigation measures.
Preliminary data from epidemiological models for the
period March 18 to April 18, 2020. Rev Salud Pública.
2020; 22(2): e185789.
33. Patiño-Lugo DF, Vélez M, Salazar
PV, Vera-Giraldo CY,
Vélez V, Marín IC, et al. Non-pharmaceutical interventions for
containment, mitigation and suppression of COVID-19 infection. Colomb
Méd. 2020; 51(2): (en prensa).
34. Instituto Nacional de Salud.
Coronavirus (COVID - 2019)
en Colombia. Disponible en:
http://www.ins.gov.co/Noticias/Paginas/Coronavirus.aspx
Recibido: : 8 de Junio de
2020
Aceptado: 22 de Junio de 2020
Correspondencia:
Diego Rosselli
diego.rosselli@gmail.com
Aceptado: 22 de Junio de 2020
Correspondencia:
Diego Rosselli
diego.rosselli@gmail.com