LA CRISIS DE LA MEDICINA BASADA EN LA EVIDENCIA (MBE) EN TIEMPOS DE PANDEMIA
Luis Leonardo Rojas-Puentes1 , Andrés Felipe Cardona Zorrilla2
En 2014 Trisha Greenhalgh publicó en el BMJ un interesante análisis que
se titulaba Medicina Basada en la
Evidencia: un movimiento en crisis? (1); sin duda, un título
sugestivo e inquietante en particular para aquellos médicos que
hemos sido educados bajo la premisa que la Medicina
Basada en la Evidencia (MBE) es el nuevo paradigma de
la práctica médica y la respuesta a nuestros interrogantes
y problemas clínicos, a los que nos enfrentamos a diario
y, más aún, a quienes hemos hecho de la epidemiología
clínica una actividad complementaria. Sin dudar de los
beneficios que la MBE ha traído a nuestra profesión,
Greenhalgh expone una serie de problemas o inconvenientes que tal vez
muchos desconocemos o pasamos
por alto, como: su utilización para defender intereses
particulares; el volumen de la información que sobrepasa cualquier
capacidad de revisión o síntesis; beneficios
estadísticos que no se traducen en beneficios clínicos o
beneficios marginales; reglas o algorítmicos clínicos que
desconocen la individualidad y la singularidad de nuestros pacientes; y
recomendaciones que no se adaptan a la
multimorbilidad, condición común en quienes pretendemos beneficiar de
esta “mejor evidencia”.
Resulta fundamental entender estas dificultades, reconocerlas y plantear soluciones, en especial, en este momento de crisis en donde una condición nueva y desconocida nos golpea de una forma inimaginable, impensada e incierta. Hace apenas hace unos meses, el 31 de diciembre de 2019, cuando todo el mundo se encontraba preparando la despedida de un año y dándole la bienvenida al nuevo, la oficina de la OMS en China recibía el primer informe sobre una nueva condición de neumonía atípica causada por un agente desconocido. Tan solo unos días después, ya se había caracterizado el agente causal; posteriormente, para el 30 de enero, se declaraba como una emergencia de salud pública internacional y para el 11 de Marzo, se convertía en pandemia (2). Nadie estimaba que hoy, 6 meses después, nos enfrentaríamos a la amenaza más grande que ha tenido la humanidad en sus tiempos modernos y que ha generado, al momento de escribir este texto, más de 6 millones de contagios y 380 mil muertos (3). A causa de ello, se han colapsado los servicios de salud y las economías, no solo de nuestros frágiles sistemas, sino de aquellos otrora poderosos sistemas, modelos a seguir por ser pioneros en la investigación y generación del conocimiento médico, así como constructores e instructores de las bases de la MBE.


1 MD. Especialista en Medicina
Interna y Oncología Clínica. MSc(c) Epidemiología Clínica y
Bioestadística. Departamento de Oncología Clínica, Clínica Colsanitas.
Grupo de Investigación en Oncología Molecular y Sistemas Biológicos,
Universidad El Bosque. Bogotá, Colombia.
Como lo señala Greenhalgh, uno de los inconvenientes de la MBE es poder ser utilizada para algún beneficio particular. Cuando apenas existía una muy limitada evidencia con beneficios anecdóticos de la hidroxicloroquina y la cloroquina para el tratamiento de la infección por SARS-COV2, varios líderes políticos, algunos muy influyentes, catalogaron a estos medicamentos como la salvación para la pandemia, presionando a las distintas agencias reguladoras a dar una autorización exprés para su uso. El 28 de Marzo del 2020 la FDA autorizó su uso mediante el mecanismo de Autorización para Uso de Emergencia –EUA, por sus siglas en inglés-. Pocos días después, varios países, incluyendo Colombia, también autorizaron su uso, inclusive su uso como profilaxis (4). Tan rápido fue este proceso como la aparición de reportes sobre los riesgos y complicaciones de estos tratamientos, así como de las deficiencias metodológicas existentes en los estudios clínicos realizados hasta la fecha sobre el uso de estos medicamentos, como para aceptar su uso en esta indicación (5-7).
El 30 de marzo de 2020, un médico anestesiólogo en Gwatti (India) fallecía por un paro cardíaco secundario al uso de hidroxicloroquina, medicamento que fue aprobado en ese país para profilaxis del personal médico expuesto al SARS-COV2 (8). El 22 mayo se publica un trabajo desarrollado con más de 90 mil pacientes, que muestra la ineficacia de estos medicamentos para tratar la infección y, simultáneamente, la OMS suspende cualquier estudio clínico que se estuviese llevando a cabo con estos medicamentos (9). El 4 de junio, tras múltiples críticas y editoriales sobre dicho trabajo, los autores se retractan y la OMS acepta continuar con los estudios ya iniciados con el medicamento (10).
¿Es posible semejante vaivén de información en tan solo unos meses? No solo fue posible con este tema, sino que también ocurrió con casi todos los demás y tiene que ver en parte con el segundo problema de la MBE: la información científica es abrumadora y la velocidad de aparición sobrepasa cualquier capacidad de síntesis y análisis. Desde la publicación de los primeros casos de COVID-19 hasta el momento de escribir este texto, existen solo en PubMed un total de 19.153 publicaciones, 384 de ellas relacionadas con tratamiento. Para comprender esto, se estima que un médico de urgencias que atiende durante un turno a 18 pacientes, debe revisar en promedio 44 enfermedades, lo que le implicaría leer 3.679 páginas (solamente de guías de práctica clínica) para lo cual tardaría 122 horas, es decir, 5 días para mantenerse al día (11).
Para cuando alguien termine de leer la información publicada en PubMed sobre el SARS-COV2 hasta la fecha, mucha de la información no va a tener relevancia o no será útil. Dirigiéndose a la Conferencia de Seguridad de Múnich el 15 de febrero de 2020, el director general de la OMS, Dr. Tedros Adhanom Ghebreyesus, dijo: “no solo estamos luchando contra una epidemia, estamos luchando contra una infodemia”. La solución para este problema, desde algunas perspectivas, sería la síntesis de la información a través de revisiones sistemáticas de la literatura, la máxima de la MBE. Para realizar una buena revisión sistemática de la literatura se requiere al menos un año (12) y, claramente, no podríamos esperar un año para tomar decisiones clínicas respecto a los pacientes con infección por SARS-COV2. ¿Podrá entonces la MBE, bajo sus métodos tradicionales, dar respuesta a los problemas e interrogantes en tiempos de crisis por la pandemia COVID-19? La respuesta parece obvia y se requiere entonces un reenfoque de la metodología que hoy se utiliza.
Existen múltiples retos de la MBE para enfrentar esta crisis como por ejemplo retos en las estrategias metodológicas para analizar los datos del SARVS-COV2 (13). Los modelos estadísticos podrían jugar un papel fundamental en la “batalla contra el pánico mediante la información” (14) para evitar o, al menos minimizar, el riesgo de sesgos de los estudios clínicos o epidemiológicos.
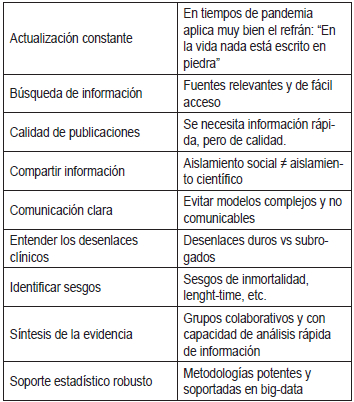
Algunas de las estrategias sugeridas para que la MBE se adapte a este enorme reto pueden ser (Tabla 1):
Tabla 1. Estrategias para la MBE
En definitiva, el mundo está en crisis, lo que implica que la economía, la política, el deporte y, por supuesto, ninguna disciplina científica -como la MBE- ha sido inmune a esto; o tal vez, la MBE no está en crisis, sino que estamos en crisis quienes la practicamos y en ocasiones lo hacemos erróneamente, olvidando sus fundamentos (23,24).
1. Greenhalgh T, Howick J, Maskrey N,
Evidence Based
Medicine Renaissance G. Evidence based medicine: a
movement in crisis? Rev BMJ. 2014; 348: g3725.
Resulta fundamental entender estas dificultades, reconocerlas y plantear soluciones, en especial, en este momento de crisis en donde una condición nueva y desconocida nos golpea de una forma inimaginable, impensada e incierta. Hace apenas hace unos meses, el 31 de diciembre de 2019, cuando todo el mundo se encontraba preparando la despedida de un año y dándole la bienvenida al nuevo, la oficina de la OMS en China recibía el primer informe sobre una nueva condición de neumonía atípica causada por un agente desconocido. Tan solo unos días después, ya se había caracterizado el agente causal; posteriormente, para el 30 de enero, se declaraba como una emergencia de salud pública internacional y para el 11 de Marzo, se convertía en pandemia (2). Nadie estimaba que hoy, 6 meses después, nos enfrentaríamos a la amenaza más grande que ha tenido la humanidad en sus tiempos modernos y que ha generado, al momento de escribir este texto, más de 6 millones de contagios y 380 mil muertos (3). A causa de ello, se han colapsado los servicios de salud y las economías, no solo de nuestros frágiles sistemas, sino de aquellos otrora poderosos sistemas, modelos a seguir por ser pioneros en la investigación y generación del conocimiento médico, así como constructores e instructores de las bases de la MBE.


1 MD. Especialista en Medicina
Interna y Oncología Clínica. MSc(c) Epidemiología Clínica y
Bioestadística. Departamento de Oncología Clínica, Clínica Colsanitas.
Grupo de Investigación en Oncología Molecular y Sistemas Biológicos,
Universidad El Bosque. Bogotá, Colombia.
2 MD. MSc. PhD Biología Tumoral.
Grupo Oncología Clínica y Traslacional, Clínica del Country. Fundación
para la Investigación Clínica y Molecular Aplicada del Cáncer (FICMAC).
Grupo de Investigación en Oncología Molecular y Sistemas Biológicos,
Universidad El Bosque. Bogotá, Colombia.
Como lo señala Greenhalgh, uno de los inconvenientes de la MBE es poder ser utilizada para algún beneficio particular. Cuando apenas existía una muy limitada evidencia con beneficios anecdóticos de la hidroxicloroquina y la cloroquina para el tratamiento de la infección por SARS-COV2, varios líderes políticos, algunos muy influyentes, catalogaron a estos medicamentos como la salvación para la pandemia, presionando a las distintas agencias reguladoras a dar una autorización exprés para su uso. El 28 de Marzo del 2020 la FDA autorizó su uso mediante el mecanismo de Autorización para Uso de Emergencia –EUA, por sus siglas en inglés-. Pocos días después, varios países, incluyendo Colombia, también autorizaron su uso, inclusive su uso como profilaxis (4). Tan rápido fue este proceso como la aparición de reportes sobre los riesgos y complicaciones de estos tratamientos, así como de las deficiencias metodológicas existentes en los estudios clínicos realizados hasta la fecha sobre el uso de estos medicamentos, como para aceptar su uso en esta indicación (5-7).
El 30 de marzo de 2020, un médico anestesiólogo en Gwatti (India) fallecía por un paro cardíaco secundario al uso de hidroxicloroquina, medicamento que fue aprobado en ese país para profilaxis del personal médico expuesto al SARS-COV2 (8). El 22 mayo se publica un trabajo desarrollado con más de 90 mil pacientes, que muestra la ineficacia de estos medicamentos para tratar la infección y, simultáneamente, la OMS suspende cualquier estudio clínico que se estuviese llevando a cabo con estos medicamentos (9). El 4 de junio, tras múltiples críticas y editoriales sobre dicho trabajo, los autores se retractan y la OMS acepta continuar con los estudios ya iniciados con el medicamento (10).
¿Es posible semejante vaivén de información en tan solo unos meses? No solo fue posible con este tema, sino que también ocurrió con casi todos los demás y tiene que ver en parte con el segundo problema de la MBE: la información científica es abrumadora y la velocidad de aparición sobrepasa cualquier capacidad de síntesis y análisis. Desde la publicación de los primeros casos de COVID-19 hasta el momento de escribir este texto, existen solo en PubMed un total de 19.153 publicaciones, 384 de ellas relacionadas con tratamiento. Para comprender esto, se estima que un médico de urgencias que atiende durante un turno a 18 pacientes, debe revisar en promedio 44 enfermedades, lo que le implicaría leer 3.679 páginas (solamente de guías de práctica clínica) para lo cual tardaría 122 horas, es decir, 5 días para mantenerse al día (11).
Para cuando alguien termine de leer la información publicada en PubMed sobre el SARS-COV2 hasta la fecha, mucha de la información no va a tener relevancia o no será útil. Dirigiéndose a la Conferencia de Seguridad de Múnich el 15 de febrero de 2020, el director general de la OMS, Dr. Tedros Adhanom Ghebreyesus, dijo: “no solo estamos luchando contra una epidemia, estamos luchando contra una infodemia”. La solución para este problema, desde algunas perspectivas, sería la síntesis de la información a través de revisiones sistemáticas de la literatura, la máxima de la MBE. Para realizar una buena revisión sistemática de la literatura se requiere al menos un año (12) y, claramente, no podríamos esperar un año para tomar decisiones clínicas respecto a los pacientes con infección por SARS-COV2. ¿Podrá entonces la MBE, bajo sus métodos tradicionales, dar respuesta a los problemas e interrogantes en tiempos de crisis por la pandemia COVID-19? La respuesta parece obvia y se requiere entonces un reenfoque de la metodología que hoy se utiliza.
Existen múltiples retos de la MBE para enfrentar esta crisis como por ejemplo retos en las estrategias metodológicas para analizar los datos del SARVS-COV2 (13). Los modelos estadísticos podrían jugar un papel fundamental en la “batalla contra el pánico mediante la información” (14) para evitar o, al menos minimizar, el riesgo de sesgos de los estudios clínicos o epidemiológicos.
Algunas de las estrategias sugeridas para que la MBE se adapte a este enorme reto pueden ser (Tabla 1):
Tabla 1. Estrategias para la MBE

- Entender la diversidad y complejidad de los desenlaces clínicos reportados: para la neumonía por SARVS-COV-2 existen algunos llamados desenlaces “duros” como, por ejemplo, la mortalidad, la necesidad de ventilación mecánica o el ingreso a UCI; sin embargo, existen otros menos relevantes como la necesidad de oxígeno suplementario. Analizar estos resultados menos relevantes y saber si son un subrogado de aquellos desenlaces duros es un reto para la MBE, pero también para quien los lee y aplica. Allí, la MBE también se expone a otro de los riesgos mencionados por Greenhalgh sobre beneficios en desenlaces intermedios que no se traducen en resultados clínicos relevantes.
- Identificar y entender sesgos comunes en los estudios: Los datos clínicos son altamente dependientes del tiempo y se requieren métodos de análisis robustos para evitar sesgos comunes como, por ejemplo, sesgos de selección, de tiempo, de duración (length-time bias), de inmortalidad, de competencia, entre otros (15-17).
- Comunicar de manera clara y sencilla los hallazgos estadísticos: en tiempos de pandemia, deben evitarse los complejos modelos matemáticos de difícil reproducción y entendimiento.
- Actualización constante de guías de práctica clínica (GPC) a partir de los estudios observacionales: con una información tan cambiante, la actualización de las GPC durante la pandemia, es una necesidad y una obligación.
- Soporte estadístico para los estudios clínicos aleatorizados: se requiere experticia para entender los potenciales efectos y resultados clínicos. Dos estudios clínicos aleatorizados con tratamientos antivirales para el SARS-COV2 se han realizado con resultados negativos en la población con enfermedad más crítica, lo que constituye un buen ejemplo de obtención rápida de información relevante (18,19).
- Búsqueda de información de fuentes relevantes: Distintos esfuerzos, desde la OMS hasta organizaciones privadas, han establecido repositorios de información muy completos y actualizados. Se requiere, sin embargo, una mayor coordinación entre estos para evitar esfuerzos aislados sobre el mismo aspecto.
- Síntesis rápida de la evidencia: ya se mencionó lo abrumador que resulta la cantidad de información disponible sobre la pandemia. Estrategias como las revisiones rápidas de evidencia pueden permitirle a los tomadores de decisiones, tener la información en corto tiempo que sea aplicable a la práctica clínica. Un estudio piloto mostró, por ejemplo, que durante un brote infeccioso, una revisión rápida de evidencia se pudo realizar en 5 días (20). Es necesario entender que algunos aspectos metodológicos de las revisiones sistemáticas usuales, deben sacrificarse en favor de un menor tiempo y que las revisiones rápidas tienen limitaciones (21,22)
- Asegurar la calidad de lo que se publica: en tiempos de crisis,
la información se requiere de manera
rápida y la velocidad puede ir en contra de la calidad. Los
investigadores deben prestar atención a
la transparencia y la elaboración de un adecuado
reporte de su investigación, para garantizar su reproducibilidad.
- Es necesario el aislamiento social, pero el aislamiento científico es inadmisible: compartir información es la única forma para que el mundo científico brinde respuestas acertadas y guíe a la humanidad hacia la resolución de esta crisis. Ocultar información en favor de intereses personales o de un grupo es y debería ser, en estos tiempos, un delito. Existen iniciativas mundiales para compartir la información en tiempos de crisis. ¿Por qué razón no podría ser igual para combatir otras enfermedades como el cáncer que generan una mayor morbimortalidad que el mismo COVID-19? Quizá, luego de la pandemia, sea oportuno reflexionar sobre este tema.
En definitiva, el mundo está en crisis, lo que implica que la economía, la política, el deporte y, por supuesto, ninguna disciplina científica -como la MBE- ha sido inmune a esto; o tal vez, la MBE no está en crisis, sino que estamos en crisis quienes la practicamos y en ocasiones lo hacemos erróneamente, olvidando sus fundamentos (23,24).
Referencias
1. Greenhalgh T, Howick J, Maskrey N,
Evidence Based
Medicine Renaissance G. Evidence based medicine: a
movement in crisis? Rev BMJ. 2014; 348: g3725.
2. World Health Organization (WHO).
https://www.who.int/.
Accessed 02/Jun/2020.
3. WHO Coronavirus Disease (COVID-19)
Dashboard.
2020. https://covid19.who.int/. Accessed 04/Jun/2020.
4. Rome BN, Avorn J. Drug Evaluation
during the Covid-19
Pandemic. Rev N Engl J Med. 2020.
5. Gautret P, Lagier JC, Parola P, et
al. Hydroxychloroquine
and azithromycin as a treatment of COVID-19: results
of an open-label non-randomized clinical trial. Rev Int J
Antimicrob Agents. 2020:105949.
6. Jankelson L, Karam G, Becker ML,
Chinitz LA, Tsai MC.
QT prolongation, torsades de pointes, and sudden death
with short courses of chloroquine or hydroxychloroquine
as used in COVID-19: A systematic review. Rev Heart
Rhythm. 2020.
7. Alexander PE, Debono VB, Mammen
MJ, et al. COVID-19 coronavirus research has overall low methodological
quality thus far: case in point for chloroquine/hydroxychloroquine. Rev
J Clin Epidemiol. 2020.
8. D’Cruz M. The ICMR bulletin on
targeted hydroxychloroquine prophylaxis for Covid-19: Need to interpret
with
caution. Rev Indian J Med Ethics. 2020; V(2): 100-102.
9. Mehra MR, Desai SS, Ruschitzka F,
Patel AN. Hydroxychloroquine or chloroquine with or without a macrolide
for treatment of COVID-19: a multinational registry
analysis. Rev Lancet. 2020.
10. Mehra MR, Ruschitzka F, Patel AN.
Retractionȁ
4;Hydroxychloroquine or chloroquine with or without a
macrolide for treatment of COVID-19: a multinational registry analysis.
Rev The Lancet.
11. Allen D, Harkins KJ. Too much
guidance? Rev Lancet.
2005; 365(9473): 1768.
12. Runjic E, Behmen D, Pieper D, et
al. Following Cochrane review protocols to completion 10 years
later:
a retrospective cohort study and author survey. Rev
Journal of Clinical Epidemiology. 2019; 111: 41-48.
13. Wolkewitz M, Puljak L.
Methodological challenges of
analysing COVID-19 data during the pandemic. Rev
BMC Medical Research Methodology. 2020; 20(1): 81.
14. The L. COVID-19: fighting panic
with information. Rev
The Lancet. 2020; 395(10224): 537.
15. Wolkewitz M. Avoidable
statistical pitfalls in analyzing
length of stay in intensive care units or hospitals. Crit
Care. 2014; 18(1): 408.
16. Wolkewitz M, Schumacher M.
Survival biases lead to
flawed conclusions in observational treatment studies
of influenza patients. Rev J Clin Epidemiol. 2017; 84:
121-129.
17. Wolkewitz M, Allignol A, Harbarth
S, de Angelis G,
Schumacher M, Beyersmann J. Time-dependent study
entries and exposures in cohort studies can easily be
sources of different and avoidable types of bias. Rev J
Clin Epidemiol. 2012; 65(11): 1171-1180.
18. Wang Y, Zhang D, Du G, et al.
Remdesivir in adults
with severe COVID-19: a randomised, double-blind,
placebo-controlled, multicentre trial. Rev Lancet. 2020;
395(10236): 1569-1578.
19. Cao B, Wang Y, Wen D, et al. A
Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe
Covid-19. Rev
New England Journal of Medicine. 2020; 382(19): 1787-
1799.
20. Sigfrid L, Moore C, Salam AP, et
al. A rapid research
needs appraisal methodology to identify evidence gaps
to inform clinical research priorities in response to outbreaks—results
from the Lassa fever pilot. Rev BMC
Medicine. 2019; 17(1): 107.
21. Garritty C, Stevens A, Hamel C,
Golfam M, Hutton B,
Wolfe D. Knowledge Synthesis in Evidence-Based Medicine. Rev Seminars
in Nuclear Medicine. 2019; 49(2):
136-144.
22. Kelly SE, Moher D, Clifford TJ.
Quality of conduct and
reporting in rapid reviews: an exploration of compliance
with PRISMA and AMSTAR guidelines. Systematic Reviews. 2016; 5(1): 79.
23. Sackett DL, Rosenberg WM, Gray
JA, Haynes RB, Richardson WS. Evidence based medicine: what it is and
what it isn’t. Rev Bmj. 1996; 312(7023): 71-72.
24. Evidence-based medicine. A new
approach to teaching
the practice of medicine. Rev Jama. 1992; 268(17):
2420-2425.
Recibido: : 7 de Junio de
2020
Aceptado: 15 de Junio de 2020
Correspondencia:
Luis Leonardo Rojas Puentes
lrojaspuentes@gmail.com
Aceptado: 15 de Junio de 2020
Correspondencia:
Luis Leonardo Rojas Puentes
lrojaspuentes@gmail.com