Resumen
El
estesiómetro y telémetro láser endoscópico laringofaríngeo (LPEER) es
un dispositivo diagnóstico para medir de forma cuantitativa los
umbrales sensoriales mecánicos del tracto laringofaríngeo. La medición
de estos umbrales tiene utilidad en el diagnóstico y evaluación de la
respuesta al tratamiento de las enfermedades que cursan con
alteraciones en la sensibilidad laringofaríngea, ya sea por hipoestesia
o por hipersensibilidad. Entre las entidades que cursan con hipoestesia
cabe mencionar la disfagia orofaríngea secundaria a enfermedad
cerebrovascular, trauma craneoencefálico, posoperatorio de cirugía de
corazón, diabetes y el síndrome de apnea-hipopnea obstructiva del
sueño. En el otro extremo del espectro se encuentran entidades que
cursan con hiperestesia laringofaríngea, como la laringe hipersensible
o irritable, que es una causa frecuente de tos crónica de difícil
control. El LPEER ha superado de manera satisfactoria las fases de
diseño, calibración, verificación, validación en laboratorio y
validación clínica en términos de precisión y exactitud de la medición
de los umbrales sensoriales (estesiometría) mecánicos del tracto
laringofaríngeo y puede llegar a constituirse en una herramienta útil
para el diagnóstico y seguimiento de las patologías que cursan con
alteraciones sensoriales laringofaríngeas.Palabras clave: Broncoscopia; deglución; endoscopios; estesiómetro; láseres de fibra; laringe; mecanoreceptor; diagnóstico médico; fibras ópticas; faringe; telémetro; reflejo; fiabilidad; repetibilidad y reproducibilidad de los resultados; precisión; exactitud diagnóstica; umbrales sensoriales.

1 MD. Internista.
Neumólogo. Doctor en Investigación Médica Aplicada. Neumología
Intervencionista. Fundación Neumológica Colombiana. Departamento de
Epidemiología, Universidad de La Sabana. Miembro Correspondiente de la
Academia Nacional de Medicina. Bogotá, Colombia.
2 MD. Internista. Neumóloga. Servicio de Neumología, Fundación
Valle del Lili. Docente Departamento de Medicina Interna, Universidad
ICESI. Cali, Colombia.
THE LARYNGOPHARYNGEAL ENDOSCOPIC ESTHESHIOMETER AND RANGEFINDER
(LPEER)
Abstract
The laryngopharyngeal endoscopic esthesiometer and laser rangefinder (LPEER) is a diagnostic device for the quantitative measurement of the mechanical sensory thresholds of the laryngopharyngeal tract. The measurement of these thresholds is useful in the diagnosis and evaluation of the treatment of conditions coursing with alterations in laryngopharyngeal sensitivity, either hypoesthesia or hypersensitivity. Among the conditions that present with hypoesthesia, it is worth mentioning the oropharyngeal dysphagia secondary to cerebrovascular disease, brain trauma, postoperative of heart surgery, diabetes and the obstructive sleep apnea-hypopnea syndrome. At the other end of the spectrum, there are conditions presenting laryngopharyngeal hypersensitivity, such as the hypersensitive or irritable larynx, which is a frequent cause of difficult to control cough. The LPEER has successfully passed the phases of design, calibration, verification, and validation in the laboratory, as well as clinical validation in terms of precision and accuracy of the measurement of the laryngopharyngeal sensory thresholds (esthesiometry) and might become a useful tool for the diagnosis and monitoring of pathologies presenting with laryngopharyngeal sensory alterations.Key words: Bronchoscopy; swallowing; endoscopes; esthesiometer; fiber lasers; larynx; mechanoreceptor; medical diagnosis; optical fibers; pharynx; rangefinder; reflex; reliability; repeatability and reproducibility of results; precision; diagnostic accuracy; sensory thresholds; telemeter.
Introducción
El estesiómetro y telémetro láser endoscópico laringofaríngeo (LPEER, por sus siglas en inglés: Laryngopharyngeal Endoscopic Esthesiometer and Rangefinder) es un dispositivo médico para medir la sensibilidad mecánica del tracto laringofaríngeo, la cual está implicada en funciones tan esenciales y diversas como la permeabilidad y protección de las vías respiratorias, la deglución y la regulación de la voz. Su diseño, fabricación y validación fueron realizadas por un grupo interdisciplinario de investigadores compuesto por Luis Fernando Giraldo Cadavid, médico, internista y neumólogo colombiano, PhD en investigación médica aplicada; Secundino Fernández, médico, otorrinolaringólogo español, PhD; Javier Burguete, físico español, PhD; Mauricio Agudelo, ingeniero colombiano, MSc, y Mario Arbulú, ingeniero peruano, MSc, PhD. El trabajo de este grupo para el diseño y fabricación de este nuevo dispositivo, cuyas publicaciones se resumen en esta revisión, se basó en detección de las fuentes de error y en el control sistemático de las mismas.Rol de la sensibilidad en la
fisiología y patología del tracto laringofaríngeo
Las funciones laringofaríngeas son
ejercidas por un poco más de treinta músculos que se encargan de
regular la respiración, la deglución y la fonación; de igual forma,
protegen las vías respiratorias de la entrada del material nocivo y las
mantienen abiertas durante el sueño para que no haya colapso y no se
presenten problemas como la apnea obstructiva del sueño. Todas estas
funciones, tan distintas, deben ser ejercidas por el mismo grupo de
músculos coordinados por el cerebro usando la información que recibe de
los mecanoreceptores del tracto laringofaríngeo y de allí la
importancia de la sensibilidad mecánica (1). Hay enfermedades que pueden cursar con pérdida de la sensibilidad laringofaríngea o hipoestesia, como la disfagia orofaríngea. El compromiso sensorial laringofaríngeo tiene especial relevancia en la fisiopatología de la disfagia orofaríngea y se correlaciona con la severidad de esta entidad (2-5). Más recientemente se ha descrito el compromiso sensorial mecánico laringofaríngeo en el síndrome de apnea-hipoapnea obstructiva del sueño (SAHOS), en el cual se ha observado que existe un subgrupo de pacientes donde hay una relación lineal entre el grado de compromiso sensorial y la severidad del SAHOS (6). También se ha observado hipoestesia laringofaríngea en otras circunstancias como en los pacientes en el posoperatorio de cirugías de corazón abierto o de trasplante de corazón o pulmón, por la denervación que estas intervenciones producen y que llega a comprometer la sensibilidad mecánica laringofaríngea con las consiguientes alteraciones, entre ellas, la disfagia (3, 7).
En el otro extremo están aquellas enfermedades que cursan con hipersensibilidad laringofaríngea, como la laringe irritable o hipersensible y el síndrome de tos por hipersensibilidad, entidades que se han descrito recientemente, después de la década de los noventas y que probablemente hacen parte de un grupo de entidades nosológicas que se manifiestan por tos crónica refractaria a los tratamientos convencionales para la tos, con hiperestesia e hiperalgesia laringofaríngea (8-10).
Estas entidades tienen una importancia grande en la salud de la población general porque la disfagia afecta del 8 al 10% de la población, la apnea-hipoapnea obstructiva del sueño (SAHOS) afecta un 5%, incluso en estudios más recientes se ha visto que puede llegar hasta el 20% de la población y la tos crónica por hipersensibilidad puede comprometer del 2 al 5% de la población general (11-14).
Todas estas enfermedades tienen tratamientos que se han introducido recientemente, después de haber pensado durante muchos años que las alteraciones sensoriales laringofaríngeas no tenían ningún tratamiento que ofrecer al paciente. La intervención terapéutica sobre la que se ha recogido más evidencia, gracias a las investigaciones sobre la rehabilitación de pacientes con enfermedad cerebrovascular y trauma craneoencefálico, es la de electroestimulación para la hipoestesia y paresia laringofaríngea. Para éstas, la estimulación eléctrica transcutánea logra recuperar funciones motoras o sensoriales perdidas a través de mecanismos de neuroplasticidad. También hay protocolos de rehabilitación laringofaríngea que ayudan a modular estados de hipersensibilidad, consiguiendo un adecuado control de la tos, de los síntomas de disfunción laríngea (disnea y disfonía) y de la hipertonicidad en los músculos laringofaríngeos (15-17).
Así pues, es claro que existe un grupo de entidades que comprometen la sensibilidad laringofaríngea y de igual manera, intervenciones que sirven para tratarlas. No obstante, no se ha contado con métodos precisos para medir esas alteraciones y para evaluar la eficacia de tales intervenciones.
La medición clínica de los umbrales sensoriales laringofaríngeos y el desarrollo del LPEER
Hubo un primer intento de un sistema cuantitativo para evaluar la sensibilidad laringofaríngea que fue diseñado por Aviv en la década de los noventas. Aviv diseñó un generador de pulsos de aire y un sistema electrónico para controlar tales pulsos, aplicándolos sobre la garganta como estímulos de intensidad precisa que permitieran medir los umbrales sensoriales en el tracto laringofaríngeo (18).
Los estudios iniciales de Aviv fueron muy prometedores, pero cuando el dispositivo empezó a usarse masivamente se encontró que el error aleatorio del mismo podía llegar a ser tan alto como del 30%, con coeficientes de correlación intraclase (estadístico que mide la concordancia entre observaciones repetidas por el mismo observador o por diferentes observadores) por debajo del 0,4 (el valor ideal es 1) y con errores sistemáticos también altos, de un 20% o más; es decir, que la prueba tenía pobre reproducibilidad y exactitud(19, 20). Estos niveles de error son demasiado altos para poder aplicar de manera extensa una prueba diagnóstica en la práctica clínica.
Por otra parte, hay pruebas con estímulos químicos para detectar pacientes con tos por hipersensibilidad; sin embargo, estos estímulos químicos lastimosamente pueden generar reacción cruzada con la hipersensibilidad que se ve en el asma y por lo tanto no permiten diferenciar entre tos crónica por hipersensibilidad exclusiva del tracto laringofaríngeo de aquella causada por el asma (14). De acuerdo con lo anterior, era necesario contar con un dispositivo que permitiera medir los umbrales sensoriales laringofaríngeos con mayor precisión y con mayor exactitud y no presentase una reacción cruzada con la hipersensibilidad del árbol bronquial y, por ello, ese fue el objetivo del desarrollo del LPEER.
La meta era tener un dispositivo para medir los umbrales sensoriales laringofaríngeos con un margen de error por debajo del 10%. El método que usamos para diseñarlo fue primero analizar de manera detallada el primer dispositivo que existía e investigar sus fuentes de error y los factores generadores de error en el método de medición de umbrales sensoriales usando tal dispositivo.
Este estesiómetro tendría que servir para medir cuantitativamente los reflejos laríngeo aductor, que consiste en el cierre de los pliegues vocales cuando se estimula la mucosa laringofaríngea, el reflejo tusígeno ante estímulos mecánicos en el tracto respiratorio y el reflejo nauseoso ante estímulos mecánicos faríngeos. Dos de estos tres reflejos, el tusígeno y el nauseoso, hasta ahora no contaban con métodos cuantitativos para medir sus umbrales.
Exploramos los factores que pudieran estar generando error en la medición de los umbrales sensoriales mecánicos incluyendo (21, 22):
- Determinación de la distancia, el ángulo y el lugar del impacto de los pulsos de aire: previamente estas determinaciones dependían de la subjetividad de cada observador y las variaciones en estos factores afectaban significativamente la intensidad de impacto del pulso de aire sobre la superficie que se disparaba.
- Presión del aire a la entrada del dispositivo, con la que se alimentan las válvulas reguladoras y la duración de los pulsos de aire: esta presión no tenía mecanismos que garantizaran su estabilidad, se generaba con un compresor de baja potencia (similar los usados para hacer micronebulizaciones en domicilios), cuyo funcionamiento podía afectarse fácilmente.
- Orden de los pulsos de aire y posible efecto de la histéresis: presiones crecientes vs. decrecientes vs. aleatorio. Si la presión de los pulsos de aire iba aumentando gradualmente, si se administraban de forma decreciente, cada vez con presiones menores, o si se hacían en forma aleatoria, por la histéresis, propia de los sistemas neumáticos, el orden de los pulsos podría generar variabilidad en la intensidad de estos. La histéresis de los sistemas neumáticos lleva a que no siempre se alcance la misma presión cuando uno administra pulsos en orden de intensidad creciente que cuando los administra en orden decreciente.
- El diámetro, longitud y material del tubo conductor de los pulsos: se encontró que había distintos tipos de fundas por las cuales se conducían los pulsos de aire al tracto laringofaríngeo, de diferentes longitudes y materiales, y varias usaban tubos porosos para conducir los pulsos de aire, todo lo cual generaba variaciones grandes en la intensidad del pulso de aire sobre la superficie donde impactaba.
- La duración de los pulsos de aire: una duración menor de 100 milisegundos se asociaba con mayor variabilidad en la intensidad de los pulsos de aire.
- El diámetro de los pulsos de aire frente al sistema calibrador: el sistema calibrador que usaba en el primer dispositivo tenía un orificio para la entrada del pulso de aire de un milímetro de diámetro, mientras que el diámetro promedio de los pulsos de aire medido con diafragmas, en agua y con humo químico era de 4 milímetros (4 veces más grande el pulso de aire que el orificio que se usaba para medirlo y calibrar el equipo).
En total se hicieron 11.576 mediciones explorando todos estos factores; se encontró que estos, cuando se introducían en un modelo de regresión lineal múltiple, se asociaban de manera independiente con la variabilidad de los pulsos.
Una vez detectados los principales factores generadores de error, se procedió a construir un prototipo de investigación (Figura 1), conformado por un generador de pulsos de aire y un sistema laser de fibra óptica que se conecta a un endoscopio convencional delgado -de 3,4 milímetros de diámetro externo-, que es el que se usa habitualmente para broncoscopia pediátrica. Este dispositivo tenía un puerto para la salida de los pulsos de aire, que se conectaba por un tubo al canal de trabajo del endoscopio y un puerto para la salida del láser de fibra óptica adherido al extremo distal del endoscopio (Figura 1) (22).
La imagen endoscópica que se genera con este estesiómetro puede verse en la Figura 2, donde se observa la laringe, los cartílagos cuneiformes y corniculados y el spot del láser. La grilla con círculos ayuda tanto a la estimación de la distancia, como a centrar la imagen para que los círculos se apliquen siempre en las mismas estructuras (22).
Hay un círculo que centra la imagen de la cámara, otro círculo que marca una distancia de 3 milímetros, otro de 6 y otro de 9 milímetros; esto funciona con un sistema de triangulación que calcula la distancia entre el sitio desde donde se emite un rayo láser hasta el sitio donde se proyecta el spot de este, aplicado al endoscopio. Entonces cuando el centro del spot del láser está sobre el círculo de 9 milímetros quiere decir que el orificio de salida del endoscopio está a 9 milímetros de la estructura sobre la que se está proyectando el spot del láser (22).
Hay otra guía a 12 milímetros de distancia y una línea horizontal que pasa por la mitad del cartílago cuneiforme y una línea vertical que pasa por la mitad del cartílago corniculado y los estímulos se aplican a esta zona de la mucosa (pliegues aritenoepiglóticos), que es el área más rica en receptores mecánicos de la laringe.
La validación del LPEER
Una vez diseñado el equipo se
procedió a hacer la verificación experimental en cuanto a la
reproducibilidad del estímulo que se estaba generando y en cuanto a la
capacidad para medir distancias del telémetro endoscópico que se
diseñó. La reproducibilidad de las presiones mostró un
coeficiente de variación de 0,02, lo cual quiere decir que se logró
disminuir el error aleatorio de 30% a 2%. Respecto a la exactitud que
se refería a la diferencia absoluta entre las presiones deseadas y las
observadas se logró una reducción hasta el 2% (22).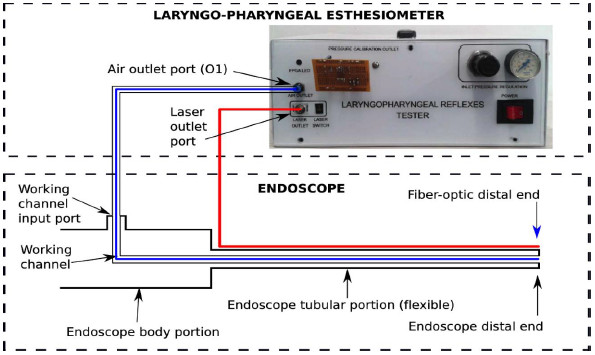
Figura 1. Estesiómetro laringofaríngeo acoplado a fibroscopio.
Tomado de: Giraldo-Cadavid LF, Agudelo-Otálora LM, Burguete J, et al. Design, development
and validation of a new laryngo-pharyngeal endoscopic esthesiometer and range-finder based
on the assessment of air-pulse variability determinants. BioMedical Engineering Online 2016; 15:1-23.
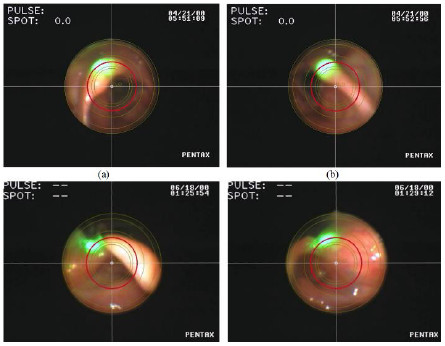
Figura 2. Imagen endoscópica para la medición de los umbrales sensoriales laringofaríngeos
Tomado de: GiraldoCadavid LF. Fiberoptic endoscopic evaluation of swallowing with
sensory test (FEESST) protocol for the validation of a laryngo-pharyngeal Endoscopic esthesiometer
and rangefinder (LPEER). 2013. https://www.upperairwaylfgiraldo.wordpress.com/about/
Adicionalmente, se hizo una evaluación de la capacidad del telémetro para medir las distancias de la laringe comparando la distancia medida por el telémetro frente a la distancia medida por un micrómetro de alta precisión usado en óptica láser. Se encontró una relación lineal entre las dos distancias; el coeficiente de correlación de Pearson entre las dos mediciones fue de 0,99, el valor ideal de este coeficiente es 1, por lo que se considera excelente al igual que el R2 que estuvo en 0,98. El error de medición estaba por debajo de 1 milímetro en la estimación de la distancia (22).
Con lo anterior, se diseñó el protocolo de exploración de los reflejos (23) en el cual se buscó evaluar: el reflejo laríngeo-aductor (24), and patients with impaired cognition may not be able to perform the required task. In the search for an objective measure of laryngeal sensory function, we have observed that the laryngeal adductor reflex (LARque es el cierre de la glotis de las cuerdas bucales cuando se estimula la mucosa de la laringe; el reflejo de la tos (25), que es la salida explosiva de aire de la vía respiratoria inferior ante esta estimulación, y el reflejo nauseoso que es la contractura orofaríngea ante estímulos mecánicos de la mucosa faríngea (26).
Para medir los umbrales de los reflejos laríngeo aductor y de la tos, el endoscopio se acerca a la mucosa de los pliegues aritenoepliglóticos y se dispara el pulso de aire. Cuando se llega a la intensidad del umbral para el reflejo laríngeo aductor, hay un cierre de los pliegues vocales, como un pestañeo: ese es el reflejo laríngeoaductor y se hace bilateralmente (23). Cuando se alcanza la intensidad del reflejo de la tos, se desencadena una tos refleja. El reflejo nauseoso se explora en el sitio de inserción de la epiglotis a las paredes faríngeas y cuando se alcanza la intensidad correspondiente al umbral de este reflejo, se desencadenan náuseas (23).
Una vez hecho esto, fue necesario continuar con la fase de validación clínica a fin de evaluar si estos resultados, en cuanto a precisión del dispositivo como tal en términos de ingeniería, se reflejaban en mejoría también de la concordancia en la medición de la sensibilidad hecha por dos observadores: uno que fuera experto y otro no experto. El coeficiente de correlación intraclase, que es el estadístico que suele usarse para hacer esta comparación, tenía un valor base de 0,4 con el dispositivo previo (19, 20) y la meta propuesta fue tenerlo por encima de 0,6 (27), que son valores aceptables para aplicar la prueba en la práctica clínica. Además, se evaluó la reproducibilidad por medio de los gráficos de acuerdo de Bland-Altman (28) que mostraran que no habían diferencias y que no habían sesgos entre las mediciones de un observador frente al otro; es decir, que la diferencia de las mediciones en promedio fueran cero y que la amplitud del margen de diferencia entre uno y otro fuera aceptable para los niveles de medición que se estaban haciendo.
Para cumplir este objetivo se realizó un primer estudio de reproducibilidad, que fue un estudio prospectivo “cross-over”, en el cual se cruzaron los resultados de un observador con los del otro, en pacientes consecutivos con disfagia por ACV y un grupo individuos sanos. El orden de los observadores se asignaba de manera aleatoria, uno de los observadores era experto, con 9 años de experiencia en la técnica y otro era no experto (un médico que llevaba un mes de entrenamiento en la técnica). Lo anterior con el fin de abarcar el espectro completo de experiencia en el manejo del endoscopio (29).
Cada uno de los observadores hizo dos mediciones durante una prueba endoscópica de la deglución que se conoce con el nombre FEESST, por su sigla en inglés. El paciente se ponía sentado a 90 grados o semisentado, se usaba el broncoscopio pediátrico mencionado previamente, gel hidrosoluble en lugar de anestésico, dado que se trataba de una prueba sensorial y no se podía anestesiar la mucosa laringofaríngea. Posteriormente se exploraron los umbrales de los reflejos laríngeo-aductor, tusígeno y nauseoso (29).
La población del estudio estaba constituida por 67 pacientes, la mitad de ellos controles y la otra con ACV y disfagia. La mitad eran mujeres y la edad promedio era de 53 años. Las comorbilidades más frecuentes fueron tabaquismo en el 37 % de los pacientes, el EPOC y otras enfermedades como insuficiencia renal crónica, enfermedad del colágeno, reflujo gastro-esofágico, etc. (29).
Se midió el coeficiente de correlación intraclase intraobservador, es decir, comparando la medición de un observador con una medición repetida hecha por ese mismo observador en el mismo paciente (27, 30). Se esperaba un valor por encima del 0,6, pero el valor encontrado fue 0,97 en el LART para el observador no experto y 0,98 de coeficiente de correlación intraclase para el observador experto; el valor máximo que puede tener este coeficiente es de 1, es decir, que los resultados fueron bastante buenos en las comparaciones de un observador consigo mismo. En el caso de reflejo de la tos, fueron valores similares por encima de 0,95 y en el caso del reflejo nauseoso fueron un poco inferiores, pero todas formas fueron muy buenos porque estuvieron por encima de 0,90 (29).
Cuando se compararon los resultados del observador experto frente al observador no experto, para ver la concordancia y ver qué tanto se reflejaba la diferencia de experiencia en la técnica en las mediciones, los valores encontrados fueron también bastante buenos: de 0,88 para el reflejo laríngeo-aductor, de 0,8 para el reflejo de la tos y 0,7 para el nauseoso. En todos los casos, el reflejo nauseoso siempre tuvo un poco menos de reproducibilidad tanto intraobservador como entre observadores. Lo anterior es un resultado esperado, dado que el reflejo nauseoso sobre todo en pacientes con ACV no ha sido muy buen predictor de la disfagia (29).
Después de hacer la medición de la reproducibilidad, es decir, del error aleatorio, era necesario evaluar el grado de error absoluto, que corresponde a la exactitud de la prueba sensorial con este dispositivo. Para lo anterior, se hizo una curva ROC y se midió el área bajo la curva con el fin de ver si el dispositivo era capaz o la prueba era capaz de diferenciar aquellos pacientes que tenían el grado más severo de disfagia, es decir, aquellos pacientes que tenían indicación de una vía alternativa a la oral para su alimentación, debido a aspiración del alimento durante la deglución.
Las áreas bajo las curvas ROC fueron interpretadas de acuerdo con la escala propuesta por Hosmer y Lemeshow (31) de la siguiente manera:
- 0,6 a 0,7: pobre la capacidad discriminatoria.
- 0,7 a 0,8: capacidad discriminatoria aceptable.
- 0,8 a 0,9: capacidad discriminatoria excelente.
- Mayor o igual a 0,9: capacidad discriminatoria casi perfecta.
El estudio de exactitud se llevó a cabo en una cohorte de pacientes prospectivos que tenían riesgo de disfagia por distintas enfermedades, la más frecuente el ACV, y en ellos se evaluaron los tres reflejos mencionados y se compararon con las alteraciones en la deglución detectadas en la prueba endoscópica de deglución (FEES), que es una de las dos pruebas de referencia para los trastornos de la deglución (32).
Los desenlaces en la prueba de deglución eran (33):
- Presencia de comida en la faringe después de la deglución: se denomina residuos.
- Entrada de comida en la laringe por encima de los pliegues vocales: corresponde a penetración.
- Aspiración de alimento que pasa por debajo de los pliegues vocales a la tráquea: se denomina aspiración y cuando es mayor al 5% del bolo se considera severa.
- Severidad de la disfagia: se calculó de acuerdo con la escala validada por Rosenbek de penetraciónaspiración en cada paciente, que va de 1 a 8 dependiendo de la gravedad de las alteraciones (34).
En este estudio se incluyeron 118 pacientes. La mitad de ellos eran hombres, la edad promedio era de 56 años y las enfermedades más frecuentes eran enfermedades cerebro-vasculares en el 36%, reflujo gastro-esofágico, enfermedades neurodegenerativas, y otras entidades que tenían una frecuencia inferior. La gravedad de la disfagia en estos pacientes tuvo un rango de 1 a 8, es decir, que hubo pacientes en todo el rango del espectro de la severidad de la disfagia; la mayoría tenían disfagia leve (35).
La capacidad discriminatoria del reflejo laríngeoaductor para detectar disfagia grave, tuvo un área bajo la curva de 0,83 que está en el rango de una capacidad discriminatoria excelente y fue estadísticamente significativa (P<0,0001) (35). Para el reflejo de la tos, el valor fue un poco inferior pero bastante bueno 0,79 (P<0,0001) y para el reflejo nauseoso, el desempeño nuevamente fue menos bueno con un valor de 0,72 (P<0,0001) que se encuentra en el rango de aceptable (35).
Los reflejos que encontramos en los diversos grupos poblacionales fueron (35):
- En aquellos pacientes normales, la sumatoria del reflejo explorado en el lado derecho más el del lado izquierdo fue de 0,28, es decir, que a cada lado hay que dividir esto por 2 para saber el umbral de cada lado, esto es 0,14 mN. El reflejo de la tos fue de 4,5 mN y la del reflejo nauseoso fue de 12 mN.
- En los que tenían hipersensibilidad de la vías respiratorias altas, el reflejo de la tos bajaba su umbral a 6,2 la sumatoria, es decir, 3,1 en cada lado. Además, el reflejo nauseoso bajaba la sumatoria de 24 a 9, es decir, 4,5 a cada lado. Sobre todo, el reflejo nauseoso marcó una diferencia bastante grande entre los que tenían hipersensibilidad laringofaríngea y los normales. Este es un hallazgo que hasta ahora no había sido reportado de manera cuantitativa.
- En cuanto al grupo de pacientes que tenían disfagia, la sumatoria de los reflejos laringo-aductor derecho e izquierdo fue de 0,5mN, es decir, casi el doble del grupo normal; nuevamente para cada lado hay que dividirlo entre dos, esto es 0,25mN. En el caso del reflejo de la tos y el reflejo nauseoso los umbrales fueron iguales, de casi 33 mN para la suma y 16,5 mN para el umbral de estos reflejos en cada lado del tracto laringofaríngeo. Esos son los reflejos que más se alteran en la población con ACV, que es una población que tiene un compromiso sensorial mucho más severo.
Conclusiones
- El método de investigar las fuentes de error fue útil para detectar factores que no habían sido controlados hasta la fecha.
- El control de estos factores con el LPEER, permitió mejorar de manera importante la precisión y exactitud de la prueba sensorial.
- La evaluación de los reflejos aductor laríngeo y de la tos con el LEEPR, mostró excelente reproducibilidad y exactitud.
- La evaluación del reflejo nauseoso con el LPEER mostró buena reproducibilidad y exactitud aceptable.
Fuente de financiación
Este manuscrito no contó con financiación externa.
Conflicto de interés
Luis Fernando Giraldo-Cadavid, primer autor y corresponsal del presente manuscrito tiene una patente otorgada por la Superintendencia de Industria y Comercio de Colombia al Estesiómetro y Telémetro Endoscópico Laringo-faríngeo y (LPEER) (Número: 13121843-00003-0000), un PCT (Solicitud Internacional No.: PCT / IB2014 / 061063) y una patente de EEUU en trámite. La Universidad de La Sabana (Colombia) es propietaria de los derechos financieros de esta patente y Luis Fernando Giraldo-Cadavid, Javier Burguete, Mario Arbulu, Mauricio Agudelo y Secundino Fernández, poseen la propiedad intelectual de esta patente. Esta patente puede constituir un conflicto de intereses con el presente manuscrito.
Consideraciones éticas
Por tratarse de un artículo de revisión en el cual no participaron sujetos de investigación, no aplica la obtención de consentimiento informado. De todas formas, se siguieron los principios éticos contenidos en la Declaración de Helsinki.
Referencias
1. Miyaji H, Hironaga N, Umezaki
T, Hagiwara K, Shigeto H, Sawatsubashi M, Tobimatsu S, Komune S.
Neuromagnetic detection of the laryngeal area: Sensoryevoked fields to
air-puff stimulation. NeuroImage 2014; 88: 162-169.
2. Aviv JE, Kim T, Thomson JE,
Sunshine S, Kaplan S, Close LG. Fiberoptic endoscopic evaluation of
swallowing with sensory testing (FEESST) in healthy controls. Dysphagia
1998; 13: 87-92.
3. Aviv JE, Murry T, Zschommler A,
Cohen M, Gartner C. Flexible endoscopic evaluation of swallowing with
sneosry testing: patient characteristics and analysis of safety in
1,340 consecutive examinations. Ann Otol Rhinol Laryngol 2005; 114:
173-176.
4. Aviv JE, Spitzer J, Cohen M, Ma
G, Belafsky PC, Close LG. Laryngeal adductor reflex and pharyngeal
squeeze as predictors of laryngeal penetration and aspiration. The
Laryngoscope 2002; 112: 338-341.
5. Hammer MJ, Barlow SM. Laryngeal somatosensory deficits in
Parkinson’s disease: implications for speech respiratory and phonatory
control. 2010. p. 401-409.
6. Dedhia RC, Rosen CA, Soose RJ.
What is the role of the larynx in adult obstructive sleep apnea?
Laryngoscope 2014; 124: 1029-1034.
7. Atkins BZ, Trachtenberg MS,
Prince-Petersen R, Vess G, Bush EL, Balsara KR, Lin SS, Davis RD.
Assessing Oropharyngeal Dysphagia After Lung Transplantation: Altered
Swallowing Mechanisms and Increased Morbidity. Journal of Heart and
Lung Transplantation 2007; 26: 1144-1148.
8. Morrison M, Rammage L, Emami
AJ. The irritable larynx syndrome. Journal of Voice 1999; 13: 447-455.
9. Morice AH, Millqvist E, Belvisi
MG, Bieksiene K, Birring SS, Chung KF, Dal Negro RW, Dicpinigaitis P,
Kantar A, McGarvey LP, Pacheco A, Sakalauskas R, Smith JA. Expert
opinion on the cough hypersensitivity syndrome in respiratory medicine.
European Respiratory Journal 2014; 44: 1132-1148.
10. Eccles R, Lee PCL. Cough
induced by airway vibration as a model of airway hyperreactivity in
patients with acute upper respiratory tract infection. Pulmonary
Pharmacology and Therapeutics 2004; 17: 337-342.
11. Kertscher B, Speyer R, Fong E,
Georgiou AM, Smith M. Prevalence of Oropharyngeal Dysphagia in the
Netherlands: A Telephone Survey. Dysphagia 2015; 30: 114120.
12. Jennum P, Riha RL.
Epidemiology of sleep apnoea/hypopnoea syndrome and sleep-disordered
breathing. European Respiratory Journal 2009; 33: 907-914.
13. Chung KF, Pavord ID.
Prevalence, pathogenesis, and causes of chronic cough. Lancet 2008;
371: 1364-1374.
14. Relationship between
Self-Reported Odor Intolerance and Sensitivity to Inhaled Capsaicin.
2014: 1623-1628.
15. Rofes L, Arreola V, López I,
Martin A, Sebastián M, Ciurana A, Clavé P. Effect of surface sensory
and motor electrical stimulation on chronic poststroke oropharyngeal
dysfunction. Neurogastroenterology and Motility 2013; 25: 888-896.
16. Speyer R, Baijens L, Heijnen
M, Zwijnenberg I. Effects of therapy in oropharyngeal dysphagia by
speech and language therapists: A systematic review. Dysphagia 2010;
25: 40-65.
17. L LC. Central nervous system
control of interactions between vocalization and respiration in
mammals. Head & Neck 2011; 33: S21-S25.
18. Aviv JE, Debell M, Keen MS,
Blitzer A, Martin JH. Air pulse quantification of supraglottic and
pharyngeal sensation: A new technique. Annals of Otology, Rhinology
& Laryngology 1993; 102: 777-780.
19. Hammer MJ. Design of a new
somatosensory stimulus delivery device for measuring laryngeal
mechanosensory detection thresholds in humans. IEEE Transactions on
Biomedical Engineering 2009; 56: 1154-1159.
20. Cunningham JJ, Halum SL,
Butler SG, Postma GN. Intraobserver and Interobserver Reliability in
Laryngopharyngeal Sensory Discrimination Thresholds: A Pilot Study.
Annals of Otology, Rhinology & Laryngology 2007; 116: 582-588.
21. Giraldo LF, Agudelo M, Arbulu
M, Ortiz F, Burguete J, Fernández S. Controlling the variability of
air-pulses to determine the thresholds of laryngeal-pharyngeal reflexes
using a novel device. 13th IEEE International Conference on
BioInformatics and BioEngineering, IEEE BIBE 2013 2013: 0-3.
22. Giraldo-Cadavid LF,
Agudelo-Otálora LM, Burguete J, Arbulu M, Moscoso WD, Martínez F, Ortiz
AsF, Díaz J, Pantoja JA, Rueda-Arango AsF, Fernández S. Design,
development and validation of a new laryngo-pharyngeal endoscopic
esthesiometer and range-finder based on the assessment of air-pulse
variability determinants. BioMedical Engineering Online 2016; 15: 1-23.
23. Giraldo-Cadavid LF. Fiberoptic Endoscopic Evaluation of Swallowing
with Sensory Test (FEESST) Protocol for the Validation of a
Laryngo-pharyngeal Endoscopic Esthesiometer and Rangefinder (LPEER).
[Serial online] 2013 Dec. 2013 [cited 22 Aug 2015]. Available from:
https://upperairwaylfgiraldo.wordpress.com/about/.
24. Martin JH, Thomson JE, Aviv
JE, Kim T, Diamond B, Sacco RL, Close LG. Laryngopharyngeal Sensory
Discrimination Testing and the Laryngeal Adductor Reflex. Annals of
Otology, Rhinology & Laryngology 1999; 108: 725-730.
25. McCool FD. Global Physiology
and Pathophysiology of Cough. Chest 2006; 129: 48S-53S.
26. Ansuia Gupta MKSH, Akash D.
The Etiology and Management of Gagging: A Review of Literature \n.
International Journal of Dental Research & Development (IJDRD)
2012; 2: 54-62.
27. Landis JR, Koch GG. The
Measurement of Observer Agreement for Categorical Data. Biometrics
1977; 33: 159-174.
28. Bland JM, Altman DG. Measuring
agreement in method comparison studies. Statistical Methods in Medical
Research 1999; 8: 135-160.
29. Giraldo-Cadavid LF, Burguete J, Rueda F, Galvis AM, Castañeda N,
Agudelo-Otálora LM, Moscoso WD, Páez N, Fernández S. Reliability of a
laryngo-pharyngeal esthesiometer and a method for measuring
laryngopharyngeal mechano-sensitivity in a prospectively recruited
cohort of patients. European Archives of OtoRhino-Laryngology 2017;
274: 2861-2870.
30. Sharrack B, Hughes RAC,
Soudain S, Dunn G. The psychometric properties of clinical rating
scales used in multiple sclerosis. Brain 1999; 122: 141-159.
31. Hosmer DW, Lemeshow S.
Assessing the Fit of the Model. 2013.
32. Giraldo-Cadavid LF, Leal-Leaño
LR, León-Basantes GA, Bastidas AR, García R, Ovalle S,
Abondano-Garavito JE. Accuracy of endoscopic and videofluoroscopic
evaluations of swallowing for oropharyngeal dysphagia. The Laryngoscope
2017; 127: 2002-2010.
33. Giraldo-Cadavid LF, Leal-Leaño
LR, León-Basantes GA, Bastidas AR, García R, Ovalle S,
Abondano-Garavito JE. Accuracy of endoscopic and videofluoroscopic
evaluations of swallowing for oropharyngeal dysphagia. Laryngoscope
2017; 127: 2002-2010.
34. Rosenbek JC, Robbins JA,
Roecker PDEB, Coyle JL, Wood JL. A Penetration-Aspiration Scale.
Dysphagia 1996; 98: 93-98.
35. Giraldo-Cadavid LF, Burguete
J, Rueda F, Galvis AM, Castañeda N, Arbulu M, Balaguera JI, Páez N,
Fernández S. Accuracy of a Laryngopharyngeal Endoscopic Esthesiometer
(LPEER) for Evaluating Laryngopharyngeal Mechanosensitivity: A
Validation Study in a Prospectively Recruited Cohort of Patients.
Dysphagia 2018; 33: 15-25.
Recibido: 16 de julio de 2019
Aceptado: 23 de agosto de 2019
Correspondencia:
Luis Fernando Giraldo-Cadavid
luisf.giraldo@unisabana.edu.co
Aceptado: 23 de agosto de 2019
Correspondencia:
Luis Fernando Giraldo-Cadavid
luisf.giraldo@unisabana.edu.co