Resumen
El síndrome de virus de Zika congénito (VZC) es una entidad compuesta por defectos de nacimiento en fetos y recién nacidos, cuyas madres han sido infectadas durante el periodo prenatal, caracterizado por microcefalia grave, anomalías del tejido cerebral, anomalías oftalmológicas, artrogriposis, deformidad del pie zambo y anomalías del tono muscular; sin embargo, no se ha descrito completamente el fenotipo de estos pacientes durante el periodo posneonatal. Una prueba confirmatoria segura es la reacción en cadena de la polimerasa de transcripción inversa (RT-PCR) pero esta ha demostrado poca sensibilidad en muestras con cargas virales bajas resultando en falsos negativos. Objetivo: Describir el fenotipo de los pacientes con anomalía congénita del sistema nervioso central y diagnóstico o alta sospecha de infección prenatal por el virus del Zika atendidos en una institución de alta complejidad de Bogotá-Colombia durante los años 2016-2017. Métodos: Estudio observacional descriptivo de una cohorte de sujetos con sospecha y/o diagnóstico de síndrome de Zika congénito a los cuales se les realizó dos seguimientos clínicos caracterizando así su fenotipo a través del algoritmo de abordaje para anomalías congénitas y medición de la escala abreviada del desarrollo (Ministerio de Salud - Nelson Ortiz, 1999). Resultados: Se encontraron características aún no descritas en el fenotipo de sujetos mayores de 30 días de vida, como orejas en pantalla, microstomía y labios pequeños, entre otras. En el neurodesarrollo todos los pacientes tuvieron resultado de “Alerta”. Conclusiones: Se necesita continuar con la descripción del fenotipo de los pacientes que padecieron infección por virus del Zika prenatal que superaron la etapa neonatal (mayores a 30 días de vida), con el fin de que estas descripciones orienten a los profesionales hacia un diagnóstico oportuno y permitan generar pautas de intervención y manejo multidisciplinario.Palabras clave: Virus del Zika; Fenotipo; Trastornos del neurodesarrollo; Anomalías congénitas; Reacción en cadena de la Polimerasa.

1 Médico Genetista.
Magíster en Genética Humana. Especialista en Epidemiología.
Departamento de Genética Médica, Sociedad de Cirugía de Bogotá,
Hospital de San José. Bogotá, Colombia.
2 MD. Especialista en Cuidado Intensivo Pediátrico y
Neuropediatría. Unidad De Cuidado Intensivo Pediátrico, Sociedad de
Cirugía de Bogotá, Hospital de San José. Bogotá, Colombia.
3 MD. Especialista en Psiquiatría. Docente especialización de
Epidemiologia Clínica, Fundación Universitaria de Ciencias de La Salud.
Bogotá, Colombia.
4 Médico General. Especialista en Epidemiología Clínica. Fundación
Universitaria de Ciencias de la Salud. Bogotá, Colombia.
5 Estudiante de VIII semestre de Medicina, Fundación Universitaria
de Ciencias de la Salud. Bogotá, Colombia.
6 Odontóloga. Especialista en Auditoría garantía de Calidad en
Salud. Especialista en Epidemiología Clínica. Fundación Universitaria
de Ciencias de la Salud. Bogotá, Colombia.
CHARACTERIZATION OF POSTNEONATAL COHORT WITH SUSPECTED CONGENITAL
ZIKA SYNDROME, IN A HIGHLY COMPLEX INSTITUTION IN COLOMBIA (2016-2017)
Abstract
Congenital Zika virus syndrome (CZV) is an entity composed of birth defects in fetuses and newborns whose mothers have been infected during the prenatal period characterized by severe microcephaly, brain tissue abnormalities, ophthalmological abnormalities, arthrogryposis, club foot deformity and abnormal muscle tone; however, the phenotype of these patients during the postneonatal period has not been fully described. The reverse transcription polymerase chain reaction (RT-PCR) is a safe confirmatory test but it has shown little sensitivity in samples with low viral loads resulting in false negatives. Objective: To describe the phenotype of patients with central nervous system congenital anomaly and diagnosis or high suspicion of Zika virus prenatal infection treated in a highly complex health institution in Bogotá Colombia during the years 2016-2017. Methods: Descriptive observational study of a cohort of subjects with suspicion and / or diagnosis of CZV who underwent two clinical follow-ups thus characterizing their phenotype through the approach algorithm for congenital anomalies and measurement of the abbreviated scale of development (Ministry of Health - Nelson Ortiz 1999). Results: Characteristics not yet described were found in the phenotype of subjects older than 30 days of age such as large ears, microstomia and small lips among others. In neurodevelopment all patients had a “Warning” result. Conclusions: It is necessary to continue with the description of the phenotype of patients who suffered from infection with prenatal Zika virus that exceeded the neonatal stage (over 30 days of life) in order that these descriptions guide professionals towards a timely diagnosis and allow the generation of multidisciplinary intervention and management guidelines.Key words: Zika Virus; Phenotype; Neurodevelopmental Disorders; Congenital Abnormalities; polymerase chain reaction.
Introducción
El Virus Zika (VZ), arbovirus del género flavivirus, familia Flaviviridae (1) origina el Síndrome de Zika Congénito (SZC) caracterizado por malformaciones en recién nacidos de madres infectadas (2) y trasmitido, principalmente, por picadura de hembras de mosquitos Aedes infectadas (vector), por contacto sexual, saliva, orina, leche, hemoderivados contaminados y transmisión vertical (3,4). La infección en adultos conlleva fiebre, cefalea, fatiga, dolor retro-orbitario, conjuntivitis y exantema (5); en el caso del feto se presenta microcefalia, alteraciones neurológicas (6) y de otros sistemas (7). Se reporta muerte fetal después de la semana 30 de gestación desconociéndose el trimestre de infección (8,9). Algunos neonatos con infección congénita no presentan microcefalia al nacer, luego pueden experimentar crecimiento tardío de la cabeza y desarrollar microcefalia postneonatal (periodo posterior a los 30 días de vida) (8,10).Se ha descubierto que el virus tiene un tropismo especial por los receptores de superficie AXL los cuales se expresan en células neuronales en desarrollo (11,12). Se cree que en las células infectadas el virus afecta la transcripción, causando una alteración en la neurogénesis y finalmente llevando a las diferentes alteraciones neurológicas características del síndrome (11,13).
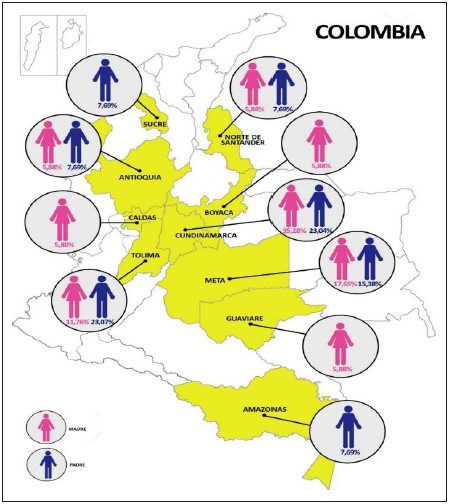
En Colombia, según el Ministerio de Salud (Minsalud), el primer caso autóctono se detectó en octubre de 2015 en el departamento de Bolívar, con posterior diseminación de la epidemia a todas las regiones del país ubicadas por debajo de 2.200 metros sobre el nivel del mar, donde se encuentra el vector con 11.944 mujeres embarazadas con infección por VZ, de las cuales 1.484 (12%) fueron casos confirmados para 2017 (8,14,15). En cuanto a enfermedades congénitas y lesiones en Sistema Nervioso Central (SNC) a nivel nacional secundarios a infección prenatal por VZ, se reportaron 247 casos por clínica y uno confirmado por laboratorio. La incidencia nacional es 0,96 casos por 100.000 personas en riesgo y cero letalidades, con 19,6% de casos de Zika en gestantes que finalizaron el embarazo (11 casos) (16). Según la Organización Panamericana de la Salud se han reportado más de 98.803 casos autóctonos sospechosos, 9.927 autóctonos confirmados, una tasa de incidencia de 22.349 por 100.000 personas año y cero muertes (14).
La Organización Mundial de la Salud (OMS) generó emergencia sanitaria por VZ en noviembre de 2016 convirtiéndolo en un importante problema para la salud pública mundial que afecta actualmente más de 80 países. Con respecto al VZC, Estados Unidos informó tasa de 2,86 defectos del nacimiento por 1.000 nacimientos vivos [IC = 2,65 -3,07]) que cumplían con la definición de VZ según el Center for Disease Control. No existe vacuna y por ello, prevenir, diagnosticar y manejar clínicamente es prioridad en esta condición (7,17). Dado el riesgo de lesiones pre y posnatales es necesario caracterizar sus presentaciones fenotípicas en las diferentes etapas de la vida para generar pautas que permitan detección temprana y diseño de estrategias preventivas y terapéuticas oportunas. La siguiente investigación tiene como objetivo describir el fenotipo de los pacientes mayores a 30 días de vida con anomalía congénita del sistema nervioso central y diagnóstico o alta sospecha de infección prenatal del virus del Zika, atendidos en una institución de alta complejidad de Bogotá (2.600 metros sobre nivel del mar) Colombia durante los años 2016 y 2017.
Métodos
Tipo de estudio: Estudio observacional descriptivo tipo serie de casos de una cohorte de pacientes en etapa posneonatal con anomalía congénita del SNC, con diagnóstico o sospecha de síndrome de Zika congénito (Figura 1).
Participantes
Criterios de inclusión: Sujetos en etapa posneonatal notificados como sospechosos para el evento zika (código 895) y/o defecto congénito en SNC – microcefalia (código 215), según protocolo del Instituto Nacional de Salud (INS) atendidos en el Hospital de San José de Bogotá (HSJ) durante 2016 y 2017; recién nacidos con diagnóstico confirmado de infección por VZ prenatal, recién nacidos que cumplan los criterios para diagnóstico clínico de VZ congénito, de acuerdo con la circular 007 INS de 2016, sospecha clínica de VZ según autopsia verbal del protocolo para microcefalia (versión 2017).
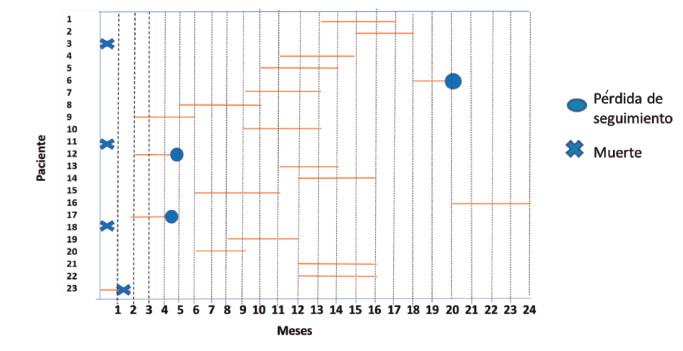
Figura 1. Cohorte de pacientes del estudio.
Las líneas rojas se refieren al tiempo aportado por cada paciente de la cohorte (edad en meses)
desde el primer control y finaliza al momento del segundo control.
Criterios de exclusión: Storch positivo u otro tipo de patología o causa que explique la malformación presentada.
Procedimiento: Los padres de los sujetos fueron contactados telefónicamente a partir de los registros de las fichas de notificación del evento en salud y se les programó la primera cita de reclutamiento. Allí se explicó la investigación y sus procedimientos, se expuso y entregó el consentimiento informado para lectura, aprobación y firma de los padres, previa comprobación de todos los criterios de inclusión y ninguno de exclusión. Una vez obtenida, el genetista y el neuropediatra valoraron a cada paciente, diligenciando el instrumento de recolección de datos y teniendo en cuenta para la evaluación, la escala abreviada del neurodesarrollo versión 1 durante la valoración de neuropediatría y el examen físico sistemático, descrito en la guía de práctica clínica para detección de anomalías congénitas del Ministerio de Salud durante la valoración por genética médica, registrando los hallazgos encontrados en la evaluación de cada paciente. Luego de esta evaluación, los sujetos de investigación fueron divididos en tres subgrupos, según cumplimiento de criterios diagnósticos clínicos y paraclínicos confirmatorios para síndrome de Zika congénito, así: a. Confirmados para Zika congénito (aquellos que cumplieron diagnóstico clínico y confirmación por RT-PCR positiva), b. Alta probabilidad para síndrome de Zika congénito (diagnóstico clínico pero sin confirmación de paraclínicos por RT-PCR para VZ) y c. Poca probabilidad para síndrome de Zika congénito (no cumplimiento de criterios diagnósticos clínicos o paraclínicos para síndrome de Zika congénito, de acuerdo con lo descrito en la literatura, pero que cumplieron criterios de inclusión para ser elegibles dentro del estudio como sospechosos dentro del síndrome de Zika congénito). En un plazo no menor a 4 meses, todos los sujetos fueron reevaluados usando los mismos procedimientos tanto por el médico genetista como el neuropediatra, y se registró el avance de cada uno de los pacientes teniendo en cuenta las diferentes escalas utilizadas durante la valoración.
Variables: Las variables fueron agrupadas en demográficas, clínicas, epidemiológicas, imagenológicas prenatales y posnatales, gestacionales y cada uno de los ítems de la escala abreviada del desarrollo. En cuanto a las variables de los criterios de diagnóstico clínico de síndrome congénito de Zika, se registraron según el fenotipo presentado por cada paciente.
Estadístico: Se utilizó el programa STATA 15. Previa evaluación de cumplimiento de parámetros de normalidad (Shapiro-wilk), para las variables cuantitativas se construyeron tablas de frecuencia, obteniendo los respectivos estadísticos descriptivos para variables cualitativas y cuantitativas (medidas de tendencia central, medidas de dispersión y frecuencias y porcentajes). Se construyeron tablas y gráficos para la presentación de los resultados. Se obtuvieron tasas de letalidad usando, como numerador, todos los pacientes fallecidos con diagnóstico confirmado de Zika (uno) y en el denominador, el total del tiempo aportado por los pacientes con zika confirmado (85 meses).
Resultados
Por las fichas de notificación del evento en salud se encontraron 47 sujetos elegibles, de los cuales 26 aceptaron participar en el estudio, 15 no pudieron ser contactados y 6 no aceptaron participar. Para el primer control asistieron 26 sujetos a los cuales se les realizaron las valoraciones por genética y neuropediatría; sin embargo, por criterios de inclusión y exclusión se descartaron 3, quedando así 23 sujetos dentro del estudio (Figura 2).
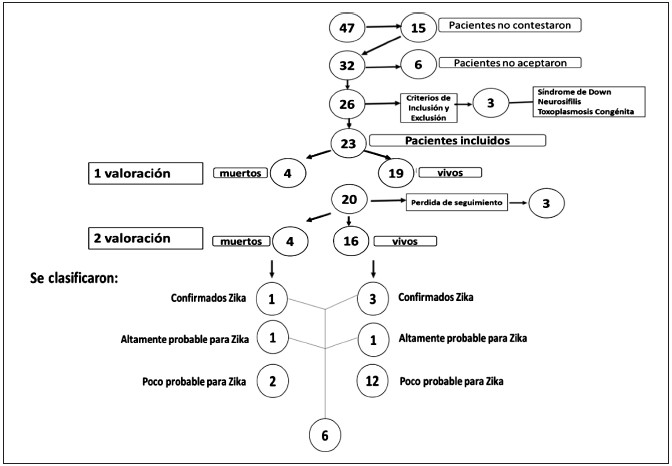
Figura 2. Flujograma
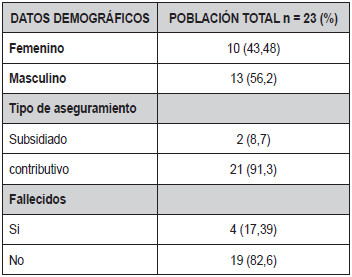
De los 23 pacientes, 56,52% eran de género masculino, con edad promedio en la primera valoración de 8 meses ± 5,86 meses, 4 pacientes fallecidos con resultado de necropsia clínica y asesoramiento de los padres y el 91,3% pertenecían al régimen contributivo (Tabla 1).
Tabla
1. Datos demográficos

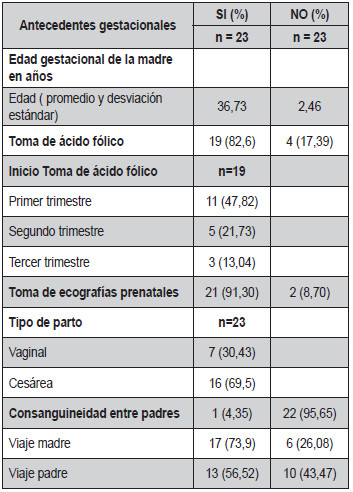
La edad gestacional de la madre fue en promedio de 36,73 semanas ± 2,46 semanas; así también, 19 madres (82,61%) recibieron ácido fólico y de ellas, 11 (55%) durante el primer trimestre de embarazo; además, 15 madres (65,22%) presentaron síntomas durante el embarazo y solo 4 padres refirieron presentar síntomas (Tabla 2).
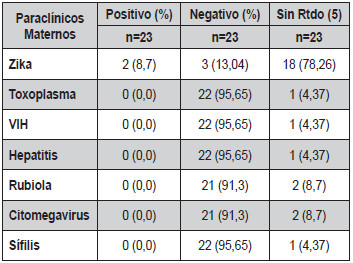
En cuanto a los paraclínicos de la madre se evidenció que 2 madres tuvieron prueba positiva para el virus del Zika, mientras que para las enfermedades teratógenos tales como sífilis, toxoplasmosis congénita, rubeola, citomegalovirus y VIH, los resultados fueron negativos; una madre presentó IgM positivo para dengue en el primer trimestre. Todos los recién nacidos tuvieron TSH normal en sangre de cordón umbilical (Tabla 3).
Tabla
2. Antecedentes gestacionales de la madre

Tabla
3. Paraclínicos maternos

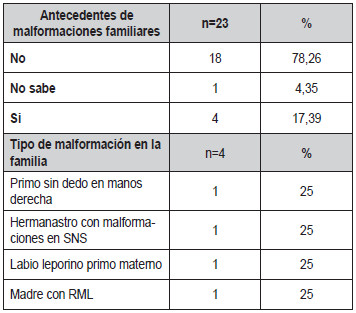
También se encontró que 4 (17,39%) de los sujetos valorados presentaron antecedentes positivos de malformación en por lo menos un miembro de la familia, así: primo con agenesia dactilar, hermanastro con malformación en SNC, labio fisurado en primo y madre con retraso mental leve (Tabla 4).
Tabla
4. Antecedentes de malformaciones familiares.

El promedio de diferencia en la edad del primer y segundo control de los pacientes fue de 4 meses. Para el segundo control, que se realizó 4 meses después, se contó solo con 20 sujetos (4 fallecidos y 16 vivos) debido a que 3 decidieron no continuar en el estudio. Para los resultados se decidió agrupar a los sujetos en tres grupos diferentes: 4 (17,39%) confirmados con infección por VZ, 2 (8,7%) con alta probabilidad para infección congénita por VZ y 14 (73,91%) poco probable, los que se muestran a continuación:
Sujetos confirmados para síndrome de Zika congénito n=4
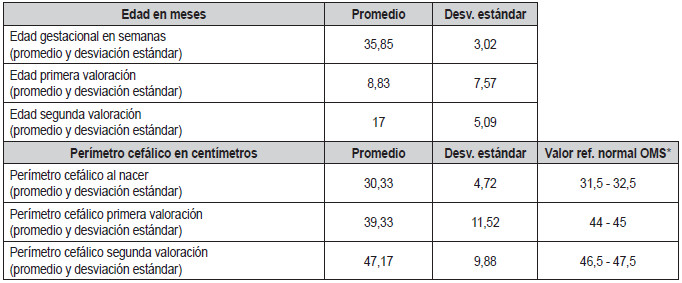
En este grupo se evidenció edad promedio de la madre 22,75 años ± 11,50, edad gestacional al nacer 35,85 semanas ± 3,02 edad promedio de los pacientes en la primera y segunda valoración según lo descrito en la Tabla 5. También se evidenció un valor de perímetro cefálico de <1 DE al momento de nacer y en la primera valoración, mientras que para la segunda valoración se obtuvo un promedio normal (Tabla 5).
En el 75% de los casos, ambos padres viajaron a zona endémica en el primer trimestre. Se presentó parto vaginal en el 75% de los casos, micronutrientes gestacionales (75%), iniciando utilización a partir del segundo trimestre gestacional. El 75% de las madres presentó sintomatología compatible con infección VZ, dos de ellas en el primer trimestre (mialgias, exantema y cefaleas 50%, conjuntivitis e inflamación articular 25%).
Un padre del subgrupo presentó síntomas de diarrea y cefalea. En los paraclínicos de este grupo cabe destacar que 75% tuvieron resultado positivo para Zika. En potenciales auditivos, 75% registró alteración auditiva y 50% presentó anormalidad en los potenciales visuales. En resonancia magnética, 75% presentó anormalidad y 100% presentó anormalidad en TAC de cráneo. En este subgrupo se presentó un paciente fallecido (Tabla 6).
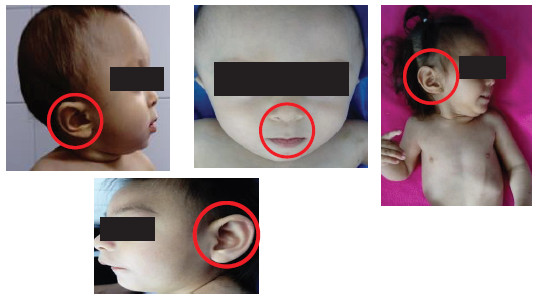
Con respecto al fenotipo de estos pacientes, la microcefalia al igual que otras malformaciones craneales como dolicocefalia y abombamiento frontal se presentaron en un 40%. Las anomalías faciales más frecuentes fueron: microstomía con una desviación estándar <2 (60%), paladar ojival, labios pequeños y retrognatia (40%), estrabismo (40%), orejas puntiformes en pantalla (60%) y narinas antevertidas (Figuras 4 y 5).
Tabla 6. Paraclínicos de pacientes
confirmados
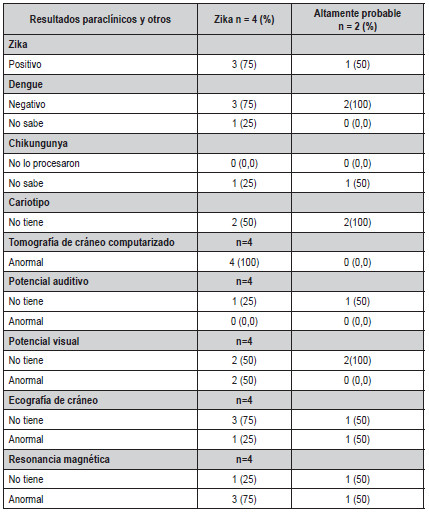

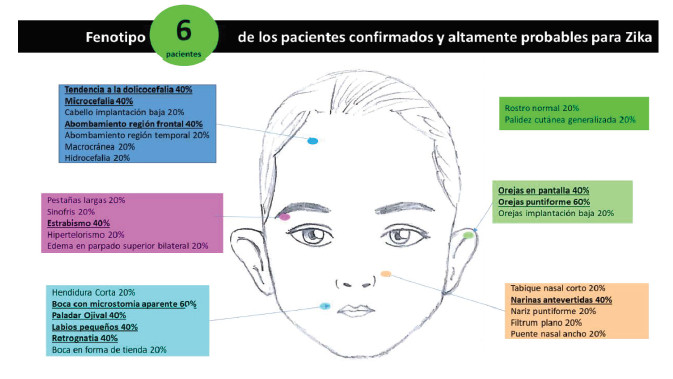
Figura 4. Anomalías faciales
En cuanto a los hallazgos corporales: clinodactilia de dedos en pies y manos (80%), artrogriposis (40%), y por último, el 20% presentó mielomeningocele (Figu
ras 6 y 7). La tasa de letalidad en el grupo de pacientes con síndrome de Zika congénito confirmado es de 1 por cada 100 niños–año.
Figura 6. Anomalías cuerpo
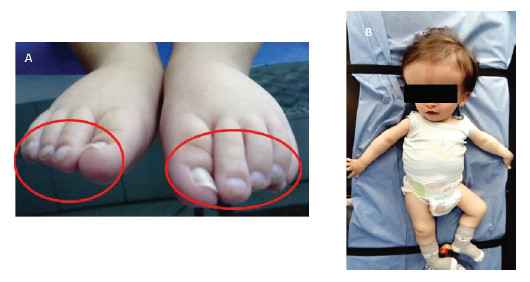
Figura 7. Hallazgos fenotípicos corporales:
A. clinodactilias, sindactilia, B. macrocránea
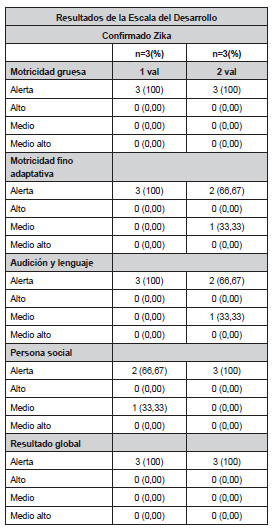
El examen neurológico encontró en un 66,67% espasticidad e hiperflexia, y un paciente presentó temblores. La valoración por neuropediatría constató ventriculomegalia en un 100%; microcefalia, atrofia cerebral y anomalías en cuerpo calloso (66,67%), hidrocefalia e hidrancefalia y migración celular (33,3%). La evaluación del desarrollo (escala abreviada del desarrollo) evidenció el total de los sujetos en nivel de alerta en sus cuatro ítems (motricidad gruesa, motricidad fino-adaptativa, audición-lenguaje y personal-social) (Tabla 7) y clasificó los sujetos dentro con retardo del neurodesarrollo severo (Figuras 8 y 9).
Tabla 7. Resultados de la Escala
Abreviada del Desarrollo para confirmados Zika

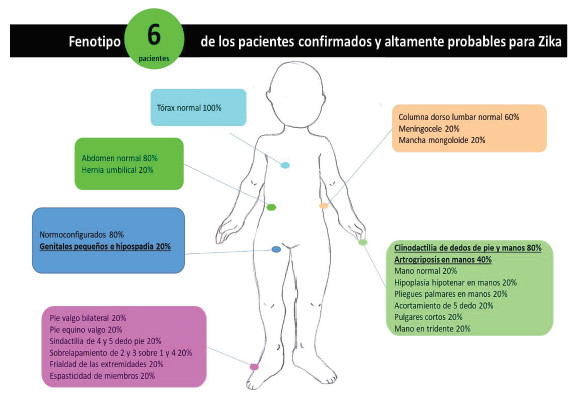
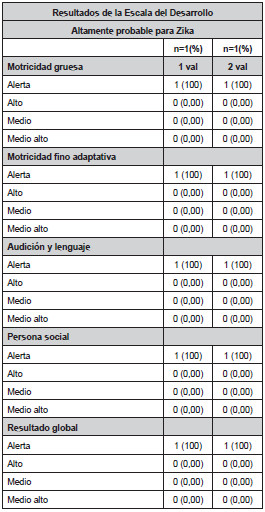
Sujetos altamente probables para síndrome de Zika congénito n=2
En este caso, todos los pacientes fueron de sexo masculino, uno fallecido (antecedente de alta sospecha para Zika materno positivo, los hallazgos de la necropsia están descritos dentro de la teratogénesis del síndrome de Zika congénito, no se pudo confirmar con RT-PCR). La edad gestacional fue de 28 semanas para uno y el otro 34, con parto por cesárea en ambos casos. Las medidas antropométricas al nacimiento, fueron: promedio de peso 2.757 gramos ± 802,5, talla 47cm ± 4,2 y perímetro cefálico 33cm ± 4,24. Entre los fenotipos encontrados, uno presentó anomalías craneales como macrocráneo e hidrocefalia a tensión. Además, uno de ellos, orejas de implantación baja, narinas antevertidas, nariz puntiforme y puente nasal ancho; en este sujeto se encontró hernia umbilical y mielomeningocele corregido, en las extremidades pulgares cortos, pie equino valgo derecho, sindactilia 4 y 5 dedo pie izquierdo, y sobrelapamiento del segundo y el tercero sobre el primero y el cuarto dedo. Ambos sujetos presentaron genitales normoconfigurados. En relación con el examen neurológico, uno de los pacientes presentó hiperreflexia, hipertonía distal e hipertrofia generalizada, hidrocefalia, ventriculomegalia, anomalías del cuerpo calloso y atrofia cerebral. El resultado en cuanto al desarrollo en ambas valoraciones realizadas, arrojó el resultado de “alerta” (Tabla 8, Figuras 5 y 7).Sujetos poco probables para síndrome de Zika congénito n=14
Una paciente cuya madre presentó infección positiva confirmada por RT-PCR con resultado negativo en la recién nacida, no tenía evidencia de anomalías congénitas fenotípicas aparentes al examen físico, por lo cual y según criterios clínicos, se clasificó como poco probable; sin embargo, presentó resultado medio en la escala del desarrollo en la primera evaluación, y de medio alto en la segunda evaluación.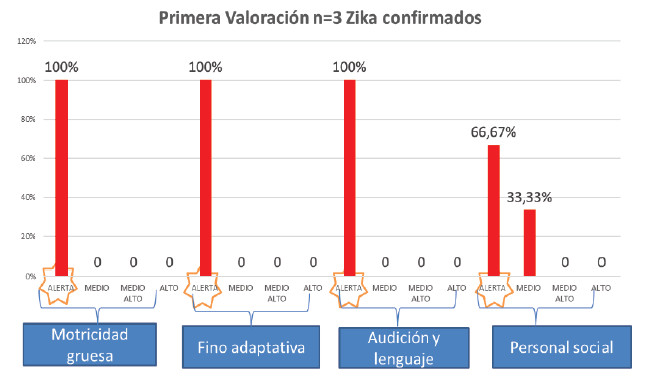
Figura 8. Resultados Escala del desarrollo, primera valoración pacientes zika confi rmado n= 3
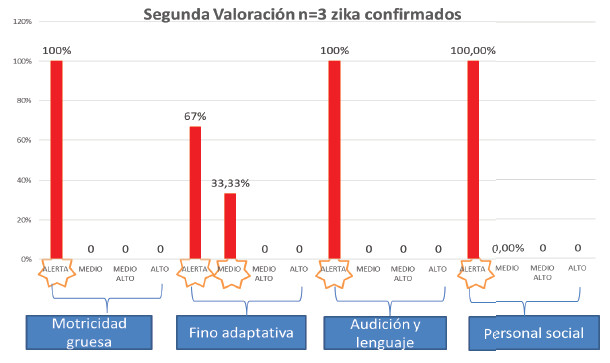
Figura 9. Resultados Escala del desarrollo, segunda valoración pacientes zika confi rmado n=3
Tabla 8. Resultados de la Escala
Abreviada del Desarrollo, altamente probables para Zika

Discusión
La infección por VZ, luego de su introducción en las Américas ha permitido avances significativos frente al conocimiento. Luego de esta epidemia en el año 2015 (18) han surgido varias hipótesis acerca de los tipos de VZ circulantes en las Américas; así, estudios filogenéticos establecieron que la cepa asiática predominó durante los brotes en Colombia (6,19). Varias series de caso y revisiones a nivel mundial han demostrado el alto poder teratogénico del VZ en el período prenatal, produciendo en el feto varias malformaciones del tipo disruptivo (2,20). El VZ tiene tropismo especial por receptores de superficie AXL que se expresan en células neuronales en desarrollo (11,12). Se cree que en las células infectadas el virus afecta la transcripción causando alteraciones en la neurogénesis y las diferentes alteraciones neurológicas características del síndrome (11,13) y como se evidenció en esta cohorte, generando a los sobrevivientes un coeficiente de desarrollo cerebral bajo.Lo anterior puede estar relacionado con el tipo de población a la que pertenecen los pacientes (Colombiana), los polimorfismos en cada grupo poblacional, así como sus relaciones epigenéticas, lo que puede generar respuestas diferentes en la expresividad de ciertos genes relacionados en la neurogénesis (como por ejemplo, los descritos para la vía del ácido retinoico y la vía del Mtor) afectados por un mismo agente teratogénico como el VZ (21), evidenciando el alto grado de expresividad y heterogeneidad entre los hallazgos fenotípicos del VZ congénito a nivel mundial (22-24). También se encuentra la hipótesis de la posible alteración en la vía del ácido retinoico esencial para procesos biológicos como crecimiento, reproducción y diferenciación celular en las células del SNC embrionario (11), ya que sus funciones están reguladas a través de los receptores RAR (receptores de ácido retinoico) y RXR (receptores de rexinoides) que regularizan la expresión de varios genes reguladores en los ejes del desarrollo del tubo neural en esta vía (gen NODAL, factor de crecimiento fibroblástico y otros) (11). Modelajes en ratones han demostrado que el VZ puede infectar y destruir nichos de células progenitoras neuronales adultas (25) que son importantes para plasticidad y aprendizaje de los nervios, lo que implica que la infección podría afectar también a cerebros en desarrollo que no hayan tenido infección prenatal. Por lo tanto, creemos que es importante hacer seguimiento a los niños posiblemente expuestos al VZ (con residencia en zonas endémicas) los cinco primeros años de vida.
La literatura mundial ha descrito la presencia de malformaciones disruptivas derivadas del tubo neural en las infecciones congénitas por VZ: migración neuronal alterada, agenesia del cuerpo calloso, anencefalia, microcefalia, hidranencefalia, alteraciones en otros órganos y sistemas como el sistema cardiaco (20). Dichos mecanismos sugieren que el síndrome del VZ congénito cursa con alto pleiotropismo asociado a expresividad variable en sus fenotipos por probable heterogeneidad genética (22). Estos hallazgos también se presentaron en la cohorte del presente estudio (sujetos mayores de 30 días de vida). Igualmente se presentaron otras anomalías menores probablemente características del fenotipo secundario al síndrome de Zika congénito aún no descritas en la literatura (20), tales como hernia umbilical, malformaciones en manos y pies (clinodactilias) e hipospadias asociado a un fenotipo característico dado por alteraciones en SNC y facies con orejas en pantalla puntiformes, microstomía, paladar ojival y labios pequeños (Figuras 4, 5, 6, 7). Este estudio propone que el fenotipo secundario al síndrome del Zika congénito es cambiante a medida que el paciente crece. Se encontraron hallazgos faciales en estos sujetos que podrían ser características fenotípicas relacionadas con el dismorfismo producido por el síndrome de Zika congénito en mayores de 30 días de vida sobrevivientes a infección prenatal, lo que podría orientar hacia su diagnóstico clínico cuando no se cuenta con otro tipo de herramientas diagnósticas y se haya descartado otro tipo de causas disruptivas o malformativas diferentes al Zika que explique este fenotipo, algo no descrito previamente; sin embargo, se requieren cohortes mayores para probar esta hipótesis.
En Neurodesarrollo, aparece claro compromiso en maduración cerebral con alteraciones marcadas en los coeficientes de desarrollo en todos los pacientes estudiados. La evaluación de las cuatro principales habilidades neurocognitivas mostró resultados por debajo de lo esperado para la edad, lo que significa retardo global del desarrollo con compromiso funcional en nivel de alerta neurológica, que conlleva necesidad de intervenciones especializadas específicas, continuadas y dirigidas en cada uno de estos pacientes, por alto riesgo de compromiso neurológico futuro permanente. Este estudio evidenció un paciente con exposición prenatal al virus del Zika, cuya única manifestación fue la alteración en la escala abreviada del desarrollo, quizás por el alto grado de expresividad variable que tiene el síndrome por virus del Zika congénito (22).
La infección por VZ puede sospecharse a partir de los síntomas y los antecedentes de residencia o viajes a zona endémica (26), puesto que la enfermedad por VZ suele ser leve, los síntomas iniciales pasan desapercibidos disminuyendo la oportunidad para toma de muestras oportunamente para detectarla (23,27). Según el protocolo para la vigilancia intensificada de microcefalia y otros defectos del sistema nervioso central por VZ versión 02 del 22/12/2017 del INS Colombiano, la vigilancia rutinaria del zika y de sus defectos congénitos se basa en la presencia de hallazgos clínicos sospechosos en recién nacidos y confirmación de la infección a través de RT-PCR o serología para el VZ en líquido cefalorraquídeo, plasma o líquido amniótico, y/o confirmación a través de autopsia verbal en casos que no tengan resultados confirmatorios (1,28). A la fecha, Minsalud no contempla la vigilancia epidemiológica rutinaria en otros tipos de hallazgos diferentes a los descritos en la literatura para los recién nacidos, por lo que pacientes que hayan pasado su periodo neonatal, pero expuestos al VZ de manera prenatal y no diagnosticados podrían pasar desapercibidos (23,27). Recomendamos continuar con la recolección de datos en cohortes expuestas con más sujetos, a fin de actualizar los protocolos de vigilancia para el síndrome del Zika congénito con hallazgos fenotípicos en mayores de 30 días de vida sobrevivientes, como los descritos en el presente trabajo (28).
Adicionalmente, la toma de RT-PCR para Zika no se encuentra disponible en muchos centros rurales, lo que dificulta el diagnóstico oportuno. Por ello, el diagnóstico clínico del síndrome con hallazgos fenotípicos específicos en diferentes edades, tiene un espacio importante. Existe evidencia de que la sensibilidad de esta prueba en LCR puede ser baja en muestras con carga viral reducida (29). Dado lo anterior, se recomienda optimizar el diagnóstico confirmatorio, el cual se basa en la toma de pruebas moleculares (reacción en cadena de polimerasa-transcripción inversa en tiempo real [RT-PCR]) y pruebas serológicas (inmunoglobulina M [IgM] 23) (7,29,30). En este caso, la RT- PCR es la prueba de elección con una buena anamnesis e historia clínica detallada, utilizando un examen físico sistemático dirigido al fenotipo del síndrome.
Nuestras limitaciones: tamaño de muestra reducido y no acceso a los resultados paraclínicos de algunos pacientes.
Conclusiones
El síndrome de Zika congénito tiene un fenotipo clínico característico en proceso de construcción, razón por la cual se debe continuar el estudio de esta cohorte, mínimo durante 10 años, admitiendo nuevos sujetos que se vayan presentando en esta entidad de salud. Igualmente, hacer estudios moleculares y seguimiento clínico permanente al neurodesarrollo de los pacientes con diagnóstico VZ congénito con exposición prenatal y a aquellos menores de 5 años que, aunque no hayan tenido diagnóstico prenatal, tengan infección posnatal antes de 5 años.
Sugerimos profundizar en la interpretación y análisis de los resultados de las pruebas de RT-PCR negativas, dado que los resultados negativos en las mismas no excluyen la presencia de infección prenatal (3,5,29,30); los resultados positivos en líquido amniótico pueden confirmar el diagnóstico de infección congénita por
VZ, pero un resultado negativo no la excluye. Proponemos considerar un diagnóstico clínico basado en el fenotipo aquí descrito en mayores de 30 días de vida, en quienes se haya descartado otras causas de microcefalia, con diagnóstico de infección VZ confirmado en la madre; ajustar las recomendaciones para intervenir y seguir a los pacientes con diagnóstico confirmado de Zika o con fenotipo de riesgo (incluyendo hallazgos nuevos encontrados en el seguimiento) y también en sujetos con paraclínicos negativos, pero con alta sospecha clínica de síndrome de Zika congénito, de manera multidisciplinaria. Con ello, se asegura su acceso a valoraciones del neurodesarrollo de manera permanente, lo cual será un importante paso en el control de este tipo de secuelas de VZ. Es necesario realizar mayores seguimientos a largo plazo con cohortes más grandes en diferentes zonas del país y del mundo.
Aspectos éticos
La investigación cumple con los principios éticos para las investigaciones en seres humanos (15) definidos en la Declaración de Helsinki y la Resolución 8430 de 1993. Así mismo, se define como de Riesgo Mínimo, y fue aprobada por el Comité de Investigación de la Facultad de Medicina de la Fundación Universitaria de Ciencias de la Salud (FUCS) y por los comités de investigación y de ética del Hospital San José (HSJ).
Agradecimientos
A los padres de nuestros sujetos de estudio. Especial Agradecimiento al Hospital San José por prestarnos sus instalaciones para realizar el seguimiento a los pacientes.
Conflicto de interés
Los autores declaran no tener ningún conflicto de interés.
Referencias
1. Toloza Pérez N. Protocolo de
Vigilancia en Salud Pública: Enfermedad por Virus Zika Instituto
Nacional de Salud, Equipo de Vigilancia ETV Instituto Nacional de Salud
INS2016 [Available from: http://bvs.minsa.gob.pe/local/MINSA/3449.pdf.
2. Fontaina A, de Laval F,
Belleoud D, Briolant S, Matheus S. Duration of Zika viremia in serum.
Clinical Infect. 2018.
3. Smithburn K. Neutralizing
antibodies against certain recently isolated viruses in the sera of
human beings residing in East Africa. J Immunol. 1952; 69(2): 223-34.
4. Dick G, Kitchen S, Haddow A.
Zika Virus Isolations and serological specificity. Trans R Soc Trop Med
Hyg 1952; 46(5): 509-20.
5. Faizan M, Abdullah M, Naqvi I,
Ahmed A, Parveen S. Zika Virus-Induced Microcephaly and Its Possible
Molecular Mechanism. Intervirology 2016; 59:152- 8.
6. Costello A, Dua T, Duran P,
Gülmezoglu M, Oladapo OT, Perea W, et al. Defining the syndrome
associated with congenital Zika virus infection. Bull World Health
Organ. 2016; 94(6): 406-A.
7. Who.int. Ginebra: World Health
Organization; [updated 23 Mar 2016; cited 2017 23 Mar]. Available from:
http://apps.who.int/iris/bitstream/handle/10665/204671/WHO_ZIKV_LAB_16.1_eng.pdf.
8. Pacheco O, Beltrán M, Nelson
CA, Valencia D, Tolosa N, Farr SL, et al. Zika Virus Disease in
Colombia - Preliminary Report. N Engl J Med. 2016.
9. Social MdSyP. Plan de respuesta
frente a la fiebre por el virus Zika: Dirección de promoción y
prevención subdirección de enfermedades transmisibles; 2016 [20].
Available from: https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/VS/PP/ET/plan-respuesta-fiebrezika-colombia.pdf.
10. Paho.org. Washington, DC:
Organización Panamericana de la Salud y Organización Mundial de la
Salud; [updated 17 Ene 2016; cited 2017 15 May]. Available from:
https://www.paho.org/hq/dmdocuments/2016/2016-ene17-cha-actualizacion-epi-virus-zika.pdf.
11. Kumar A, Singh H, Pareek V,
Raza K, Dantham S, Kumar P, et al. A Possible Mechanism of Zika Virus
Associated Microcephaly: Imperative Role of Retinoic Acid Response
Element (RARE) Consensus Sequence Repeats in the Viral Genome. Front
Hum Neurosci 2016; 10.
12. Group MER. Microcephaly in
Infants, Pernambuco State, Brazil, 2015. Emerg Infect Dis. 2016; 22(6):
1090-3.
13. Weaver SC, Costa F,
García-Blanco MA, Ko AI, Ribeiro GS, Saade G, et al. Zika virus:
History, emergence, biology, and prospects for control. Antiviral Res.
2016; 130: 69-80.
14. Paho.org. Washington, DC:
Organización Panamericana de la Salud y Organización Mundial de la
Salud; [updated 1 Dic 2015; cited 2017 4 Abr]. Available from:
https://www.paho.org/hq/dmdocuments/2015/2015-dic1-cha-alerta-epi-zika-sindrome-neuro.pdf.
15. Minsalud.gov.co. Colombia: Min
Salud Gobierno en Línea; [updated 15 Oct 2015; cited 2017 5 abr].
Available from:
https://www.minsalud.gov.co/Paginas/Confirmados-primeros-casos-de-virus-del-zika-en-Colombia.aspx.
16. Ins.gov.co. Bogotá, DC:
Instituto Nacional de Salud; [updated 18 May 2018; cited 2018 25 May].
Available from:
https://www.ins.gov.co/buscador-eventos/Informesdeevento/ZIKA%20PE%20IV%202018.pdf.
17. Who.int. Ginebra [updated 27
May 2016; cited 2017 20 Mar]. Available from:
http://www.who.int/iris/handle/10665/207474.
18. Theel E, Hata D. Diagnostic
Testing for Zika Virus: a Postouthbreak Update. J Clin Microbiol. 2018;
26(56): 4.
19. Malkar J, Korva M, Tul N,
Popovic M, Poljsak-Prijatelj. M, Mraz J, et al. Zika Virus Associated
with Microcephaly. N Eng J Med. 2016; 374(10): 951-8.
20. Hendrixon DT,
Newland JG. Zika virus infection in childrens. Infect Dis Clin N Am.
2018; 32: 215–24.
21. Jiménez Y, Carreño E. El ácido
retinoico en el desarrollo embrionario Universidad Pedagógica y
Tecnológica de Colombia: 2014; 2014 [67-75]. Available from:
https://revistas.uptc.edu.co/index.php/salud_sociedad/article/view/3504.
22. Turnpenny P, Ellard S. EMERY
Elementos de genética médica. 13, editor. España: Elsevier España; 2009.
23. França GV, Schuler-Faccini L,
Oliveira WK, Henriques CM, Carmo EH, Pedi VD, et al. Congenital Zika
virus syndrome in Brazil: a case series of the first 1501 livebirths
with complete investigation. Lancet. 2016; 388(10047): 891-7.
24. Cragan J, Mai T, Petersen E,
Liberman R NE, Forestieri N, Stevens A, et al. Baseline Prevalence of
Birth Defects Associated with Congenital Zika Virus Infection.
Massachusetts, North Carolina, and Atlanta, Georgia, 2013–2014. Weecky.
2017; 66(8): 219–22.
25. Li H, Saucedo-Cuevas L, Regla
Nava JA, Chai G, Sheets N, Tang W, et al. Zika Virus Infects Neural
Progenitors in the Adult Mouse Brain and Alters Proliferation. Cell
Stem Cell. 2016; 19(5): 593-8.
26. Salud. Md. Guía para la
vigilancia integrada de la infección por el virus del Zika y
recomendaciones para el equipo de salud. Anexo 12016 [cited 2017 24
noviembre]: [72 p.]. Available from:
https://dtoepidemiologia.files.wordpress.com/2017/02/2017-337929955-legislacionleg84401-anx-anexo-resolucion-117-e2017-pdf.pdf
27. Maierovitch C. Microcephaly
and Zika Epidemiological situation and Management Brasilia2015
[Available from:
https://www.un.org/ecosoc/sites/www.un.org.ecosoc/files/files/en/zikavirus/brazil-presentation-on-zika.pdf.
28. Cuevas E. Protocolo de
Vigilancia en Salud Pública: Vigilancia intensificada en salud pública
de la microcefalia y otros defectos congénitos del Sistema Nervioso
Central por virus Zika 2017 [Available from:
http://www.ins.gov.co/lineas-de-accion/Subdireccion-Vigilancia/sivigila/Protocolos%20SIVIGILA/PRO%20Microcefalia,%20defectos%20congenitos%20SNC%20por%20zika.pdf.
29. Paiva M, Guedes D, Leal W,
Ayres C. Sensitivity of RTPCR method in samples shown to be positive
for Zika virus by RT-qPCR in vector competence studies. Genetics and
Molecular Biology. 2017; 40(3): 597-9.
30. Gueneret M, Jolivet E, Adenet
C, Volumenie J, de Gynécologie Obstétrique Schaub S, Monthieux A, et
al. Analysis of blood from Zika virus-infected fetuses: a prospective
case series. Lancet Infect Dis 2017.
Recibido: 16 de junio de 2019
Aceptado: 1 de agosto de 2019
Correspondencia:
Michael Alexander Vallejo Urrego
mvallejo@hospitaldesanjose.org.co
Aceptado: 1 de agosto de 2019
Correspondencia:
Michael Alexander Vallejo Urrego
mvallejo@hospitaldesanjose.org.co