Resumen
Las náuseas y el vómito inducidos por la quimioterapia (CINV), constituyen un efecto colateral ampliamente estudiado por su alto impacto sobre la calidad de vida de los pacientes que reciben este tratamiento oncológico. Actualmente están disponibles protocolos para el manejo farmacológico de CINV y adicionalmente, muchos pacientes utilizan de forma empírica alternativas fitoterapéuticas para manejar estos síntomas, entre ellas, el jengibre. Objetivo: La presente revisión tuvo como objetivo responder a la pregunta: ¿Es el jengibre un tratamiento eficaz contra las náuseas y el vómito inducidos por quimioterapia para el cáncer? Método: Se revisaron 14 ensayos aleatorizados con doble ciego y placebo controlado, publicados entre 2012 y 2018, en las bases de datos EMBASE y PubMed. Conclusión: La evidencia clínica disponible es insuficiente para determinar la eficacia del jengibre en la reducción de CINV. Así pues, el uso de jengibre mejora las náuseas y los vómitos en varios pacientes, probablemente debido al efecto placebo.
Palabras Clave: Jengibre; Náusea; Vómito; Efecto Placebo; Antineoplásicos.

1 Psicóloga. Magíster en
Psicología Clínica y de la Salud. Doctora en Psicología Social.
Profesora titular Universidad del Rosario.
Bogotá, Colombia.
2 Psicóloga. Magíster en Psicología. Profesora titular Universidad
del Rosario. Bogotá, Colombia.
3 MD. Profesor, Departamento de Neurociencias, Universidad del
Rosario. Bogotá, Colombia.
4 Especialista en neurología. Profesor, Escuela de Medicina y
Ciencias
de la Salud, Universidad del Rosario. Bogotá, Colombia.
IS GINGER AN EFFECTIVE TREATMENT FOR CHEMOTHERAPY-INDUCED NAUSEA AND VOMITING (CINV)?
Abstract
Nausea and vomiting induced by chemotherapy (CINV) are a side effect widely studied for its high impact on the quality of life of patients receiving this cancer treatment. Currently, protocols for the pharmacological management of CINV are available and, in addition, many patients empirically use phytotherapeutic alternatives to manage these symptoms; among these, ginger. Objective: The objective of this review was to answer the question: Is ginger an effective treatment for nausea and vomiting induced by chemotherapy for cancer? Method: We reviewed 14 randomized double-blind and placebo-controlled trials, published between 2012 and 2018, in the EMBASE and PubMed databases. Conclusion: The available clinical evidence is insufficient to determine the efficacy of ginger in the reduction of CINV. Thus, the use of ginger improves nausea and vomiting in several patients, probably due to the placebo effect.
Key words: Ginger; Nausea; Vomiting; Placebo Effect; Antineoplastic Agents.
Introducción
En la actualidad, se conoce el uso de Medicina Complementaria y Alternativa por parte de pacientes (1, 2) y de médicos (3, 4) en el manejo de los efectos producidos por la quimioterapia para el cáncer, entre ellos, la emesis. Algunos pacientes recurren a preparaciones basadas en plantas y alimentos, como es el caso del jengibre. Esta raíz, una vez que es consumida, desencadena una actividad biológica que, entre otros, puede aliviar las náuseas (5). Estas y el vómito son respuestas típicas en las personas con cáncer, específicamente entre quienes reciben quimioterapia como tratamiento, afectan de manera significativa su calidad de vida y representan un alto costo emocional y físico para ellas (6).La respuesta de las náuseas y del vómito es multifactorial desde el punto de vista del sistema nervioso periférico y central. Poco se ha entendido sobre los mecanismos neurales y las vías de señalización que producen esta respuesta y particularmente en pacientes en tratamiento con quimioterapia, la desregulación de los mecanismos y de las vías involucradas en el reflejo nauseoso se alteran de manera diversa (7). No obstante, alguna evidencia sugiere que las náuseas y el vómito inducidos por quimioterapia (CINV, por sus siglas en inglés), encuentran explicación en la presencia de ciertos factores de riesgo que pueden ser genéticos y comportamentales. Polimorfismos en genes relacionados con el receptor NK-1, D2 de dopamina y de la catecol-O-metiltransferasa (COMT), pueden alterar la forma como se produce la activación de áreas relacionadas con el vómito. Por otra parte, la historia de consumo de alcohol, episodios de vértigo, e incluso el sexo femenino y la juventud, representan factores de riesgo para el desarrollo de CINV (8).
El concepto del umbral dinámico planteado en 2002, muestra cómo cada individuo tiene una respuesta dinámica de producción de náuseas que cambia minuto a minuto (9) dependiendo del balance entre sus características y el cambio en los estímulos psicológicos como la sensación de ansiedad, suspenso y anticipación.
El origen de los estímulos que producen náuseas proviene de aferencias viscerales, vestibulares y del estímulo de quimiorreceptores a través de sustancias en sangre. Existen, entonces, procesos a nivel del sistema nervioso periférico y central que modulan la generación de las náuseas y del vómito (7). El reconocimiento de la presencia de sustancias emetizantes, que pueden ser toxinas, fármacos y otras sustancias en la sangre, se hace en el área postrema, también conocida como “centro del vómito”, ubicada en la cara dorsal del bulbo raquídeo en el tallo cerebral, cerca del núcleo del tracto solitario en la parte más caudal del cuarto ventrículo. El tejido del área postrema se caracteriza por estar muy vascularizado y tener escasas uniones intercelulares estrechas. El endotelio más “abierto” de esta región permite la detección de sustancias emetizantes y la producción del vómito, en respuesta a los estímulos provenientes de múltiples aferencias (10, 11).
A nivel central, se estimula la secreción de neurotransmisores, serotonina/dopamina, histamina/acetilcolina, en regiones específicas, asociadas con el reflejo nauseoso.
Los estímulos orgánicos y de tipo psicológico son reconocidos por los quimiorreceptores periféricos, así como por los receptores de los sentidos especiales, en la medida que, la generación de las náuseas depende de estímulos polimodales de tipo: visual, olfatorio, vestibular, psicógeno y situacional. Estos estímulos se integran en el área postrema (12).
Diversos estudios concluyen que la experiencia de las náuseas y el vómito inducidos por quimioterapia genera franco malestar a los pacientes oncológicos y compromete su calidad de vida relacionada con la salud (6, 13). A pesar de ser un efecto predecible de la quimioterapia intravenosa, no es inofensivo; al contrario, y de acuerdo con Dikken y Wildman (14), es un efecto adverso serio que amerita ser controlado (14).
Teniendo en cuenta lo anterior, la importancia de encontrar un tratamiento para las CINV se ha hecho evidente (15), con el fin de poder mejorar la calidad de vida de los pacientes y disminuir las molestias e incomodidades experimentadas por ellos. Fármacos como metoclopramida, dexametasona, palonosetrón, ondansetrón, aprepitant, entre otros, han sido ampliamente estudiados (16-21). Otras sustancias, aún no farmacológicas, como el extracto de la raíz de jengibre Zingiber officinale, utilizado desde hace mucho tiempo como especia y como parte de diversas preparaciones en la Medicina Tradicional, ha sido estudiado como antiemético en varios cuadros clínicos, entre ellos, la emesis gravídica (22), la emesis postoperatoria (23) y las CINV (24).
El jengibre tiene diversos componentes químicos, aunque los dos principales son Shokyo y Kakyo. El primero de ellos, contiene propiedades antieméticas; sin embargo, en las preparaciones se utilizan los dos (25). Sus principales componentes químicos son los gingeroles y el shogaol (26). De acuerdo con Giacosa et al. (26), los efectos antieméticos de esta sustancia, se explican por su acción sobre receptores colinérgicos y serotoninérgicos. Durante las últimas dos décadas, se ha sostenido el interés por estudiar el efecto del jengibre en CINV. El rigor metodológico de los estudios ha incrementado, dando lugar a ensayos controlados aleatorizados, que consolidan cada vez más la evidencia científica al respecto.
Con este tipo de diseño, la Medicina moderna pudo establecer que los cambios experimentados con una determinada sustancia o procedimiento se debieron a sus propiedades físico-químicas y no a las expectativas, esperanzas y otro tipo de procesos psicológicos del paciente (27). En consecuencia, este tipo de diseños de investigación, permiten determinar si el jengibre es eficaz para controlar CINV y descartar que se trate de un efecto placebo. El placebo ha sido utilizado desde hace más de tres siglos en diferentes circunstancias, ejerciendo efecto positivo en un porcentaje significativo de los sujetos que lo reciben (28). El poder de la sugestión, la empatía y confianza con el terapeuta, y las condiciones del entorno en el momento que se prescribe la sustancia o se realiza el procedimiento, tienen un papel muy importante en la respuesta, por eso las condiciones que rodean el encuentro y el acto terapéutico forman parte del denominado efecto placebo (29).
Una vez logrado este efecto, la administración de una sustancia o algún otro tipo de intervención, puede tener un impacto positivo en los síntomas y signos que presenta el paciente (30). El beneficio del placebo como tratamiento, ha sido poco cuestionado desde la publicación de Beecher (31), titulada “The powerfull placebo”, donde concluyó que se podía presentar mejoría subjetiva y objetiva, en una amplia gama de condiciones médicas en 1.082 pacientes en alrededor del 35% de los casos (32). Su efecto está mediado por condiciones individuales del paciente, como su personalidad (33) y condiciones genéticas (34). Su mecanismo de acción está mediado, entre otros, por efecto sobre el sistema opioide endógeno y el circuito de gratificación dopaminérgico (35, 36). La presente revisión tuvo como objetivo buscar evidencia sobre la eficacia del jengibre como tratamiento contra CINV.
Método
Se revisaron las bases de datos de información biomédica, EMBASE y PubMed, buscando los ensayos aleatorizados controlados con placebo, que permiten identificar la eficacia del uso del jengibre para CINV. Se incluyeron artículos publicados entre enero de 2012 y septiembre de 2018, realizados con pacientes adultos de ambos sexos, con diagnóstico de cualquier tipo de cáncer. Se excluyeron artículos en donde se observaron pacientes sometidos a tratamientos antineoplásicos distintos a la quimioterapia intravenosa, y publicados en idiomas diferentes al inglés. La búsqueda se realizó utilizando palabras clave Chemotherapy Induced Nausea and Vomiting and Ginger. La búsqueda inicial arrojó un total de 125 artículos (64 en EMBASE y 61 en PubMed). Al aplicar los criterios de selección, quedaron 32 artículos (18 en EMBASE y 14 en PubMed). Hubo 8 artículos repetidos y 10 artículos sobre los que hubo dudas. Estos últimos se leyeron completos y se decidió rechazarlos por no cumplir con los criterios de inclusión. Finalmente, se incluyeron en esta revisión, 14 artículos.
Resultados
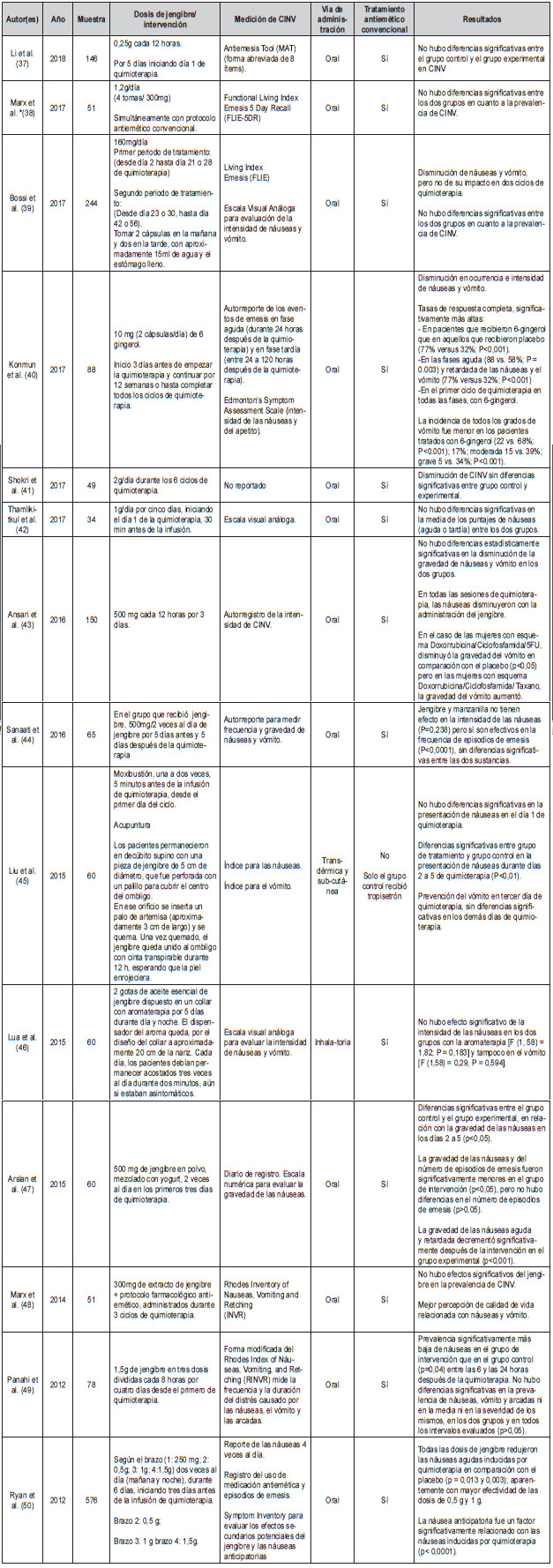
La Tabla 1 muestra una síntesis de los artículos seleccionados, enfatizando en la dosis de jengibre administrada, la vía de administración, el uso de tratamiento farmacológico antiemético, los instrumentos utilizados para medir las náuseas y el vómito, y los resultados en relación con la respuesta terapéutica.
Discusión y Conclusiones
Entre enero de 2012 y septiembre de 2018, se publicaron en las bases de datos EMBASE y PubMed, 14 ensayos clínicos controlados sobre el uso de jengibre para el control de CINV en pacientes oncológicos. Las publicaciones de estudios que utilizaron este diseño de investigación son escasas, con leve tendencia al aumento en 2018.
Desde octubre de 2017, Marx et al., desarrollan un estudio multicéntrico, aleatorizado doble ciego controlado con placebo con dos brazos paralelos y asignación 1: 1, basado en el protocolo SPICE (Supplemental Prophylactic Intervention for Chemotherapy-Induced Nausea and Emesis). En este se administran 60 mg/día de jengibre, distribuidos en 4 cápsulas de 15mg para 4 tomas diarias regulares. El estudio finalizó en abril-mayo de 2019. Si bien los resultados reportados en 2018 con base en 33 pacientes no son concluyentes, las expectativas de los investigadores están centradas en el prometedor efecto del suplemento de jengibre para mejorar CINV, así como la percepción de fatiga y el compromiso nutricional (51).
Tabla
1.
Ensayos controlados que han evaluado el efecto del jengibre sobre las
náuseas y el vómito inducidos por quimioterapia (2012-2018) – PubMed y
EMBASE

Nota. *
El estudio de Marx et al., buscó reclutar a abril de 2019, una muestra
de 300 pacientes. En 2018, publicaron los resultados obtenidos a partir
de una muestra de
tan solo 33 pacientes.
Los resultados de esta revisión demuestran que en tres estudios (40, 47, 50) (ver Tabla 1), hay alguna evidencia de la eficacia del jengibre para disminuir las náuseas y/o el vómito inducidos por quimioterapia, en diversos parámetros (frecuencia, intensidad, gravedad). Estos estudios respaldan la afirmación de Giacosa et al. (26) en relación con la eficacia del jengibre para el tratamiento de las náuseas, el vómito e incluso de la motilidad intestinal disminuida. No obstante, once estudios muestran que esta sustancia no tuvo un efecto mayor que el tratamiento antiemético convencional sobre CINV. Incluso, en el estudio de Liu et al., en el cual no se administró tratamiento antiemético estándar de manera simultánea con la moxibustión y la acupuntura, las náuseas fueron las mismas entre los dos grupos en el día 1 de la quimioterapia (45). Dos estudios reportaron que el jengibre parece actuar mejor sobre las náuseas (40, 43) que sobre la emesis (44, 47). Es pertinente tener presente la heterogeneidad de los pacientes incluidos en los estudios así como de los esquemas de quimioterapia utilizados, que variaron desde levemente emetizantes hasta altamente emetizantes.
Con excepción del estudio de Liu et al., basado en los principios de la moxibustión y la acupuntura, procedimientos propios de la Medicina China, en ninguno de los estudios se administró el jengibre como única sustancia antiemética (45). En trece de los catorce estudios, el jengibre se administró además del tratamiento farmacológico antiemético convencional, que se administra por protocolo a los pacientes que se encuentran en quimioterapia. Sin embargo, la tendencia mostró que no hay diferencias estadísticamente significativas entre estos dos tratamientos en CINV.
En cuanto a las vías de administración, en 12 de los 14 estudios revisados, se utilizó la vía oral, con presentación en cápsulas o polvo. En un estudio se reportó el uso de aceite de Jengibre administrado en forma de aromaterapia (46) y en otro, la moxibustión y la acupuntura (45).
En ninguno de los estudios revisados se reporta el uso de infusiones herbales o té. Probablemente, esto se deba a la necesidad de medir la dosis de una manera precisa, lo que en las preparaciones mencionadas resultaría francamente inviable. El uso del jengibre como remedio casero antiemético, típicamente administrado a través de infusiones, no tendría respaldo científico con base en esta revisión.
Los estudios revisados no coinciden aún en una dosis diaria específica o mínima de jengibre, para lograr el efecto antiemético; estas variaron entre 0,5 hasta 3,5 g (52), y en el caso de la aromaterapia, con dos gotas se esperaba obtener resultados terapéuticos. Esta limitación relacionada con la estabilidad química de las preparaciones con jengibre, ya había sido enunciada hace prácticamente dos décadas por Ernst y Pittler (53).
Con excepción de uno (45) de los 14 estudios revisados, en ningún otro se reportaron efectos colaterales con el uso del jengibre. Este hallazgo es coherente con la conclusión de Ali et al., según la cual el jengibre es una medicina herbal segura con pocos efectos adversos tras su administración (54). Este es un dato relevante que amerita mayor investigación y análisis debido a que la inocuidad de su administración, podría representar una alternativa prometedora si se hallara un mayor efecto antiemético en esta sustancia.
En el estudio de Marx et al. (48) publicado recientemente y en el de Ryan et al. (50), el efecto antiemético del jengibre produjo una mayor percepción de calidad de vida entre los pacientes. Y además, en otro de los estudios (38) se encontró una menor percepción de astenia relacionada con el cáncer. Estos son hallazgos relevantes, en tanto el mayor desenlace que puede esperarse de una intervención en el contexto de la enfermedad crónica, es el bienestar subjetivo que se traduce en mejor calidad de vida.
De acuerdo con los resultados de los estudios revisados, la evidencia del efecto antiemético del jengibre (en uno o más de sus componentes) sobre CINV es insuficiente, con una tendencia a indicar que esta raíz tiene algún efecto antiemético que no supera al del tratamiento farmacológico convencional. Se requiere de mayor investigación al respecto que permita determinar la dosificación del jengibre para que su acción sea antiemética en CINV y estudiar de manera rigurosa los efectos colaterales del mismo.
En conclusión, con base en la evidencia publicada entre 2012 y 2018, no es posible afirmar que el jengibre sea eficaz para controlar CINV.
Conflicto de interés
Los autores declaran no tener ningún conflicto de interés.
Consideraciones éticas
Los autores declaran, de acuerdo con los principios establecidos en la Declaración de Helsinki, el Reporte Belmont, las Pautas CIOMS, GPC/ICH y la Resolución 8430 de Octubre 4 de 1993, que esta investigación se consideró “sin Riesgo”.
Referencias
1. Sánchez R, Venegas
M. Aproximaciones complementarias y alternativas al cuidado de la salud
en el Instituto Nacional de Cancerología: estudio de prevalencia.
Alternative and Complementary Medicine at the National Cancer Institute
of Colombia: A Prevalence Survey
(English). 2010; 14: 135-43.
2. Anestin AS, Duouis G, Lanctôt D, Bali M. The Effects
of the Bali Yoga Program for Breast Cancer Patients on
Chemotherapy-Induced Nausea and Vomiting: Results
of a Partially Randomized and Blinded Controlled Trial. J
Evid Based Complementary Altern Med. 2017.
3. Satija A, Bhatnagar S. Complementary Therapies for
Symptom Management in Cancer Patients. Indian Journal of Palliative
Care. 2017; 23(4): 468-79.
4. Frączek P, Kilian-Kita A, Püsküllüoglu M, Krzemieniecki
K. Acupuncture as anticancer treatment? Contemporary
Oncology. 2017(20):453 - 457.
5. Singletary K. Ginger. Nutrition Today. 2010; 45(4): 171–
83.
6. Sommariva S, Pongiglione B, Tarricone R. Impact of
chemotherapy-induced nausea and vomiting on healthrelated quality of
life and resource utilization: A systematic review. Critical Reviews in
Oncology / Hematology.
2016; 99: 13-36.
7. Singh P, Yoon SS, Kuo B. Nausea: A Review of pathophysiology and
therapeutics. Therap Adv Gastroenterol.
2016; 9(1): 98-112.
8. Mukoyama N, Yoshimi A, Goto A, Kotani H, Miyazaki M,
Noda Y, et al. An analysis of behavioral and genetic risk
factors for chemotherapy-induced nausea and vomiting
in Japanese subjects. Biological and Pharmaceutical
Bulletin. 2016; 39(11): 1852-8.
9. Stern R. The psychophysiology of nausea. Acta Biol
Hung. 2002; 53: 589-99.
10. Gatzoulis MA, Standring S, Borley NR, Collins P,
Crossman AR. Gray’s Anatomy: The anatomical basis
of clinical practice. Edimburgo: Churchill LivingstoneElsevier; 2008.
11. Miller AD, Leslie RA. The area postrema and vomiting.
Front Neuroendocrinol. 1994; 15(4): 301.
12. Kowalski A, Rapps N, Enck P. Functional cortical imaging of
nausea and vomiting: A possible approach. Autonomic Neuroscience: Basic
and Clinical. 2006; 129:
28-35.
13. Farrell C, Brearley SG, Pilling M, Molassiotis A. The impact of
chemotherapy-related nausea on patients’ nutritional status,
psychological distress and quality of life.
Supportive Care in Cancer. 2013; 21(1): 59-66.
14. Dikken C, Wildman K. Control of nausea and vomiting
caused by chemotherapy. Cancer Nursing Practice.
2013; 12(8): 24.
15. Janicki PK. Management of acute and delayed
chemotherapy-induced nausea and vomiting: role of
netupitant–palonosetron combination. Therapeutics and Clinical Risk
Management. 2016(1): 693-699.16. Tamura K, Aiba K, Saeki T, Nakanishi
Y, Kamura T, Baba
H, et al. Breakthrough chemotherapy-induced nausea
and vomiting: report of a nationwide survey by the CINV
Study Group of Japan. International Journal of Clinical
Oncology. 2017; 22(2): 405-12.
17. Navari RM, Nagy CK, Gray SE. The use of olanzapine
versus metoclopramide for the treatment of breakthrough
chemotherapy-induced nausea and vomiting in patients
receiving highly emetogenic chemotherapy. Supportive
Care in Cancer. 2013; 21(6): 1655-63.
18. Stieler JM, Reichardt P, Riess H, Oettle H. Treatment
Options for Chemotherapy-Induced Nauseas and Vomiting: Current and
Future. American Journal of Cancer.
2003; 2(1): 15-26.
19. Spartinou A, Nyktari V, Papaioannou A. Granisetron: A
review of pharmacokinetics and clinical experience in
chemotherapy induced - nausea and vomiting. Expert
Opin Drug Metab Toxicol. 2017; 13(12): 1289-97.
20. Adel N. Overview of chemotherapy-induced nausea and
vomiting and evidence-based therapies. Am J Manag
Care. 2017; 23(14): 259-65.
21. Jordan K, Jahn F, Aapro M. Recent developments in the
prevention of chemotherapy-induced nausea and vomiting (CINV): a
comprehensive review. Annals of Oncology. 2015; 26(6): 1081-90.
22. Viljoen E, Visser J, Koen N, Musekiwa A. A systematic
review and meta-analysis of the effect and safety of ginger in the
treatment of pregnancy-associated nausea
and vomiting. Nutrition Journal. 2014; 13(1).
23. Koçak İ, Yücepur C, Gökler O. Is Ginger Effective in
Reducing Post-tonsillectomy Morbidity? A Prospective
Randomised Clinical Trial. Clin Exp Otorhinolaryngol.
2017.
24. Sontakke S, Thawani V, Naik MS. Ginger as an antiemetic in
nausea and vomiting induced by chemotherapy: A
randomized, cross-over, double blind study. Indian Journal of
Pharmacology. 2003; 35(1): 32-6.
25. Hori Y, Miura T, Hirai Y, Fukumura M, Nemoto Y, Toriizuka K, et
al. Pharmacognostic studies on ginger and
related drugs—part 1: five sulfonated compounds from
Zingiberis rhizome (Shokyo). Phytochemistry. 2003; 62:
613-617.
26. Giacosa A, Morazzoni P, Bombardelli E, Riva A, Porro
GB, Rondanelli M. Can nausea and vomiting be treated
with ginger extract? European Review for Medical and
Pharmacological Sciences. 2015; 19(7): 1291-6.
27. Wampold BE, Frost ND, Yulish NE. (2016). Placebo
Effects in Psychotherapy: A Flawed Concept and a Contorted History.
Psychology of Consciousness: Theory,
Research, and Practice. 2016; 3(2): 108–120
28. Wampold BE, Minami T, Tierney SC, Baskin TW, Bhati
KS. The placebo is powerful: Estimating placebo effects
in medicine and psychotherapy from randomized clinical
trials. Journal of Clinical Psychology. 2005; 61(7): 835-
54.
29. Haug M. Explaining the placebo effect: Aliefs, beliefs,
and conditioning. Philosophical Psychology. 2011; 24(5):
679-98.
30. Kirsch I. Placebos Handbook of Psychology - Health and
Medicine. New York: Cambridge University Press; 2007.
31. Beecher HK. The powerfull placebo. JAMA. 1955;
159(17): 1602 - 6.
32. Kienle GS, Kiene H. The powerful placebo effect: Fact or
fiction? Journal of Clinical Epidemiology. 1997; 50(12):
1311-8.
33. Darragh M, Booth RJ, Consedine NS. Who responds
to placebos? Considering the “placebo personality” via
a transactional model. Psychology, Health & Medicine.
2015; 20(3): 287-95.
34. Hall KT, Lembo AJ, Kirsch I, Ziogas DC, Douaiher J, Jensen KB,
et al. Catechol-O-Methyltransferase val158met
Polymorphism Predicts Placebo Effect in Irritable Bowel
Syndrome. PLoS ONE. 2012; 7(10): 1-6.
35. Dodd S, Dean OM, Vian J, Berk M. Review: A Review of
the Theoretical and Biological Understanding of the Nocebo and Placebo
Phenomena. Clinical Therapeutics.
2017; 39: 469-76.
36. Meyer B, Yuen KSL, Büchel C, Kalisch R, Ertl M, Polomac N, et
al. Neural mechanisms of placebo anxiolysis.
Journal of Neuroscience. 2015; 35(19): 7365-73.
37. Li X, Qin Y, Liu W, Zhou XY, Li YN, Wang LY. Efficacy of Ginger
in Ameliorating Acute and Delayed Chemotherapy-Induced Nausea and
Vomiting Among Patients with Lung Cancer Receiving Cisplatin-Based
Regimens: A Randomized Controlled Trial. Integrative Cancer Therapies.
2018; 17(3): 747-754. doi:
10.1177/1534735417753541.
38. Marx W, McCarthy A, Ried K, McKavanagh D, Vitetta L,
Sali A, Lohning A, Isenring E. The Effect of a Standardized Ginger
Extract on Chemotherapy-Induced NauseaRelated Quality of Life in
Patients Undergoing Moderately or Highly Emetogenic Chemotherapy: A
Double
Blind, Randomized, Placebo Controlled Trial. Nutrients.
2017; 9: 867. doi:10.3390/nu9080867
39. Bossi P, Alfieri S, Granata R, Bergamini C, Cortinovis
D, Bidoli P, et al. A randomized, double-blind, placebocontrolled,
multicenter study of a ginger extract in the
management of chemotherapy-induced nausea and vomiting (CINV) in
patients receiving high-dose cisplatin.
Annals of Oncology. 2017; 28(10): 2547-51.
40. Konmun J, Danwilai K, Ngamphaiboon N, Sookprasert
A, Sripanidkulchai B, Subongkot S. A phase II randomized double-blind
placebo-controlled study of 6-gingerol
as an anti-emetic in solid tumor patients receiving moderately to
highly emetogenic chemotherapy. Medical
Oncology. 2017; 34(4).41. Shokri F, Gharebaghi PM, Esfahani A,
Sayyah-Melli, M.,
Shobeiri MJ, et al. Comparison of the complications of
platinum-based adjuvant chemotherapy with and without
ginger in a pilot study on ovarian cancer patients. International
Journal of Women’s Health and Reproduction
Sciences. 2017; 5(4): 324-31.
42. Thamlikitkul L, Srimuninnimit V, Akewanlop C, Ithimakin
S, Techawathanawanna S, Korphaisarn K, et al. Efficacy of ginger for
prophylaxis of chemotherapy-induced
nausea and vomiting in breast cancer patients receiving
adriamycin–cyclophosphamide regimen: a randomized,
double-blind, placebo-controlled, crossover study. Supportive Care in
Cancer. 2017; 25(2): 459-64.
43. Ansari M, Porouhan P, Omidvari S, Ahmadloo N, Nasrollahi H,
Hamedi SH, et al. Efficacy of ginger in control
of chemotherapy induced nausea and vomiting in breast
cancer patients receiving doxorubicin- based chemotherapy. Asian
Pacific Journal of Cancer Prevention. 2016;
17(8): 3875-8.
44. Sanaati F, Najafi S, Kashaninia Z, Sadeghi M. Effect of
ginger and chamomile on nausea and vomiting caused
by chemotherapy in Iranian women with breast cancer.
Asian Pacific Journal of Cancer Prevention. 2016; 17(8):
4127-31.
45. Liu YQ, Sun S, Dong HJ, Zhai DX, Zhang DY, Shen W, et
al. Wrist-ankle acupuncture and ginger moxibustion for
preventing gastrointestinal reactions to chemotherapy: A
randomized controlled trial. Chinese Journal of Integrative Medicine.
2015; 21(9): 697-702.
46. Lua PL, Salihah N, Mazlan N. Effects of inhaled ginger
aromatherapy on chemotherapy-induced nausea and
vomiting and health-related quality of life in women with
breast cancer. Complementary Therapies in Medicine.
2015; 23: 396-404.
47. Arslan M, Ozdemir L. Oral Intake of Ginger for
Chemotherapy-Induced Nausea and Vomiting Among Women with Breast
Cancer. Clinical Journal of Oncology
Nursing. 2015; 19(5): E92-E7.
48. Marx W, Isenring L, Ried K, Sali A, McCarthy AL, Vitetta
L, et al. Can ginger ameliorate chemotherapy-induced
nausea? Protocol of a randomized double blind, placebo-controlled
trial. BMC Complementary and Alternative
Medicine. 2014; 14.
49. Panahi Y, Saadat A, Sahebkar A, Hashemian F,
Taghikhani M, Abolhasani E. Effect of ginger on acute
and delayed chemotherapy-induced nausea and vomiting: A pilot,
randomized, open-label clinical trial. Integrative Cancer Therapies.
2012; 11(3): 204-11.
50. Ryan JL, Heckler CE, Roscoe JA, Hickok JT, Morrow
GR, Dakhil SR, et al. Ginger (Zingiber officinale) reduces
acute chemotherapy-induced nausea: a URCC CCOP
study of 576 patients. Supportive Care in Cancer. 2012;
20(7): 1479-89.
51. Marx W, McCarthy A, Marshall S, Crichton M, Molassiotis A, Ried
K, Bird R, Lohning A, Isenring E. Supplemental prophylactic
intervention for chemotherapy-induced
nausea and emesis (SPICE) trial: Protocol for a multicentre
double-blind placebo controlled randomised
trial. Nutrition & Dietetics. 2018. DOI: 10.1111/1747-
0080.12446
52. Lee J, Oh H. Ginger as an Antiemetic Modality for
Chemotherapy-Induced Nausea and Vomiting: A Systematic
Review and Meta-Analysis. Oncology Nursing Forum.
2013; 40(2): 163-70.
53. Ernst E, Pittler MH. Efficacy of ginger for nausea and
vomiting: A systematic review of randomized clinical trials.
British Journal of Anaesthesia. 2000; 84(3): 367-71.
54. Ali BH, Blunden G, Tanira MO, Nemmar A. Some phytochemical,
pharmacological and toxicological properties
of ginger (Zingiber officinale Roscoe): A review of recent
research. Food and Chemical Toxicology. 2008. 46:
409–420.
Recibido: 20 de noviembre de 2018
Aceptado: 29 de marzo de 2019
Correspondencia:
Juan Sebastián Botero-Meneses
juans.botero@urosario.edu.co