Resumen
El cáncer de vesícula biliar (CVB), es la neoplasia más frecuente del tracto biliar y la quinta más común del tracto gastrointestinal. Es considerada poco frecuente, pero muy grave, debido a que en un alto porcentaje de casos se diagnostica en forma tardía, quizás debido a su localización anatómica y a lo poco específico de los síntomas. Tiene una incidencia de entre el 0,8 y el 1,2% de la población en general y una sobrevida global a 5 años en el 5%. Solo el 30% del CVB se diagnostica prequirúrgicamente, con un promedio de supervivencia de 9,2 meses, en tanto que el 70% de los casos corresponde a cáncer insospechado de vesícula biliar (CIVB), con una supervivencia media de 26,5 meses. Con el objetivo de determinar la incidencia de CIVB en Compensar EPS, realizamos un estudio descriptivo, de una cohorte retrospectiva, de pacientes sometidos a colecistectomía laparoscópica, electiva y ambulatoria. Se revisó el informe de patología de todos los pacientes, así como la historia clínica de aquellos pacientes con informe histopatológico de cáncer de vesícula biliar. En un periodo de dos años comprendido entre enero de 2016 y diciembre de 2017, se realizaron 2562 colecistectomías. En ninguno de los pacientes programados, se sospechó previamente cáncer de vesícula biliar. Se encontraron solo dos pacientes con CIVB, ambas mujeres, de 62 y 65 años, con estadios T1a y T3, para una incidencia de 0,078 %, cifra muy por debajo de lo encontrado en algunos estudios nacionales y de lo mencionado en la literatura mundial. Como limitantes del estudio, se considera el hecho de ser un estudio retrospectivo y de no incluir pacientes llevados a colecistectomía de urgencias. Sin embargo, se debe plantear, si los protocolos de estudio de las piezas quirúrgicas corresponden a los recomendados en búsqueda de CVB.
Palabras clave: Cáncer; Insospechado; Vesícula biliar; Colelitiasis.
_______________________
1 MD. Especialista en Cirugía General, Compensar EPS. Bogotá, Colombia.
_______________________
GALLBLADDER CANCER IN A COHORT OF LAPAROSCOPIC CHOLECYSTECTOMY PATIENTS
Abstract
Gallbladder cancer (GC) is the most common neoplasm of the biliary tract and the fifth most common in the gastrointestinal tract. It is considered infrequent, but very serious, because in a high percentage of cases it is diagnosed late, perhaps due to its anatomical location and to the little specific of the symptoms. It has an incidence of between 0,8 and 1,2% of the general population and a global 5-year survival of 5%. Only 30% of the GB is diagnosed preoperatively, with an average survival of 9,2 months, while 70% of the cases correspond to unsuspected gallbladder cancer (UGC), with an average survival of 26,5 months. With the objective of determining the incidence of UGC in Compensar EPS, we conducted a descriptive study of a retrospective cohort of patients undergoing elective and ambulatory laparoscopic cholecystectomy, reviewing the pathology report of all patients. And the clinical history of those patients, with a histopathological report of gallbladder cancer. In a period of two years, between January 2016 and December 2017, 2562 cholecystectomies were performed. In none of the scheduled patients, gallbladder cancer was previously suspected. We found only two patients with GC, both women, 62 and 65 years old, with stages T1a and T3, for an incidence of 0,078%, a figure well below what was found in some national studies, and what is mentioned in the world literature. As a limitation of the study, it is considered to be a retrospective study and not to include patients taken to emergency cholecystectomy. However, it should be considered if the study protocols for the surgical specimens correspond to those recommended in the GC search.
Key words: Cancer; Unsuspected; Gallbladder; Cholelithiasis.
Introducción
El cáncer de vesícula biliar (CVB) fue descrito por primera vez en 1777 por Maximiliano de Stoll (1). Es la neoplasia más frecuente del tracto biliar y la quinta más común del tracto gastrointestinal, y es considerada una patología muy agresiva y con una alta mortalidad (2,3). La incidencia del CVB está entre el 0,8 y el 1,2 % de la población en general y la sobrevida global a 5 años es del 5%. Solo el 30% del CVB se diagnostica prequirúrgicamente, con un promedio de supervivencia de 9,2 meses, en tanto que el 70% de los casos corresponde a
cáncer insospechado de vesícula biliar (CIVB) con una supervivencia media de 26,5 meses (4,5).
Epidemiológicamente se han definido grupos étnicos y zonas geográficas con mayor riesgo de CVB. En los indígenas americanos, los habitantes del sudeste asiático y norte de la India, y también en países como Chile y Japón, se han descrito mayores incidencias. Igualmente, se han mencionado factores de riesgo como la colecistitis crónica e infecciones crónicas por salmonella (6,7,8).
Justificación del estudio
En Colombia son pocos los trabajos que se han hecho para determinar la incidencia del CVB (9), y aún menos los que han tratado de determinar la incidencia del CIVB, el cual se define como el diagnosticado intraoperatoriamente o al momento del estudio histopatológico, cuando se realizó extirpación de la vesícula con diagnóstico de patología benigna (10). En un estudio realizado en Buga, Colombia, se encontraron 6 casos de CVB, de los cuales 5 correspondieron a CIVB, número que porcentualmente concuerda con lo descrito en la literatura universal (11). En 2009 se publicó un estudio realizado en Medellín, Colombia, donde en un periodo de cuatro años y medio se realizó diagnóstico de CVB en 40 pacientes; en el 37,5% (n=15) de los casos, se realizó diagnóstico de CIVB y, en el restante, el diagnóstico se realizó de forma preoperatoria. Cifras inversas a las mencionadas en la literatura mundial (12).
Surge entonces la pregunta: ¿Cuál es la incidencia de cáncer insospechado de vesícula biliar y sus características clínicas, en un grupo poblacional de pacientes de Compensar EPS, en un periodo de 24 meses? La respuesta a esta pregunta, es el objetivo principal de este estudio.
Marco conceptual
En Estados Unidos de América se diagnostican cada año hasta 5000 nuevos casos de CVB, enfermedad que es considerada poco frecuente, pero muy grave debido a que en un alto porcentaje de casos se diagnostica en forma tardía, quizás debido a su localización anatómica y a lo poco específico de los síntomas. La mayoría de los casos se diagnostican de forma insospechada, en pacientes llevados a cirugía con diagnóstico de patología benigna (13,14).
El CVB es la neoplasia más común del tracto biliar en los Estados Unidos y tiene una baja incidencia, que corresponde a 2 casos por cada 100000 habitantes. En países como Pakistán, Japón, Corea, e India, se han informado altas tasas de CVB. En América del sur, las tasas más altas se presentan en Bolivia, Ecuador y, especialmente, Chile. Son diversos los factores asociados con el desarrollo del CVB (Tabla 1) (15-18).
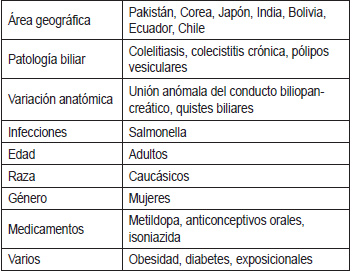
Tabla 1. Factores de riesgo asociados a CVB.
Aunque en diversos estudios se ha encontrado el antecedente de colelitiasis en relación con CVB (19,20), solo del 0,5 al 3% de aquellos que tienen colelitiasis, tienen riesgo de desarrollar CVB. También se ha relacionado la presencia de vesícula en porcelana, la cual puede considerarse un tipo de colecistitis crónica, como factor de riesgo (21).
Los pólipos vesiculares han sido mencionados como factor de riesgo para CVB. Histológicamente se pueden clasificar en pseudopólipos (de colesterol o inflamatorios), y en pólipos verdaderos (adenomas, leiomiomas, adenomiomas). Sin embargo, no es claro que los pólipos sean una lesión premaligna y se desconoce la frecuencia con que puedan degenerar en neoplasia. Se ha mencionado también, que el mayor tamaño de los mismos, representa mayor riesgo de transformación maligna (22).
A diferencia del desarrollo progresivo y las etapas o pasos secuenciales que ocurren en la patología neoplásica que involucra otros órganos, en el CVB no se han observado en detalle las progresiones de metaplasia o displasia, aunque algunos autores mencionan la secuencia displasia-carcinoma. Se estima que el tiempo que puede transcurrir entre la displasia y la aparición del CVB puede ser de 10 a 15 años (23). Se ha determinado la correlación entre mutaciones en beta-catenina (CTNNB1) y los adenomas, y entre las mutaciones del gen K-ras con el carcinoma. Esto sugiere que los adenomas de vesícula biliar representan un proceso biológico distinto con un bajo potencial maligno, mientras que las lesiones displásicas con mutación de K-ras tienen un alto potencial maligno (24).
El 60% del CVB se localiza en el fondo de la vesícula, el 30% se localiza en el cuerpo y solo un 10% en el cuello. La gran mayoría del CVB (85-90%) corresponde a adenocarcinomas. Aproximadamente un 10 % corresponden a carcinoma de células escamosas, y un bajo porcentaje de casos corresponde a diagnósticos inusuales como carcinomas indiferenciados, de células pequeñas, de células claras, neuroendocrinos, sarcoma, melanoma y linfoma (25).
El síntoma más común es el dolor abdominal, que puede presentarse hasta en un 73% de los casos, seguido de náuseas y vómito en un 43% de los casos, ictericia en un 37%, anorexia en un 35% y pérdida de peso en un 35%. En casos avanzados y de mal pronóstico, la enfermedad puede manifestarse con obstrucción intestinal, hemorragia digestiva, hematobilia, masa palpable o ascitis (26,27).
La mayoría de los casos se diagnostican de forma insospechada y ocurre como un hallazgo histopatológico incidental, en especímenes quirúrgicos de pacientes llevados a cirugía con sospecha de patología benigna. Ocasionalmente, el diagnóstico se puede realizar en forma intraoperatoria también de forma incidental, y en un porcentaje de casos similar, el hallazgo se puede realizar preoperatoriamente por sospecha clínica
o como hallazgo incidental durante la realización de exámenes radiológicos, como una ecografía o una tomografía computarizada (28).
Cuando el diagnóstico se realiza por primera vez mediante el informe de patología, se deben realizar estudios como tomografía computarizada (TC), Resonancia nuclear magnética (RNM), o PET SCAN, para establecer el estadio de la enfermedad y el posible compromiso del hígado, del peritoneo y de los puertos quirúrgicos. El método inicialmente más utilizado para el diagnóstico del CVB es la ultrasonografía, aunque en etapas tempranas se hace difícil la diferenciación entre enfermedad benigna y maligna. La sensibilidad de la ecografía para el diagnóstico del CVB es de alrededor del 44 %, pero puede ser mayor en estadios avanzados, cuando se puede observar incluso compromiso hepático. La TC, es una herramienta muy útil, que no solo permite establecer el estadio T de la enfermedad, sino que además, permite determinar el compromiso de ganglios linfáticos, invasión local hepática o de otros órganos adyacentes. La especificidad de la TC se ha estimado hasta en un 71% (29,30).
Actualmente aparece otra importante herramienta diagnóstica como es la ultrasonografía endoscópica (USE), mediante la cual, el CVB se identifica como una masa hipoecoica, con o sin calcificaciones de la pared vesicular. Este método permite, además, la toma de muestras para estudio histológico, y también posibilita determinar la presencia de ganglios linfáticos. Tiene una sensibilidad de entre el 74 y 90%. Otro método importante es el uso de la colangiopancreatografía retrógrada endoscópica (CPRE), que además de permitir la obtención de muestras para estudio histológico, facilita mapear el árbol biliar y establecer la presencia o no de compresiones extrínsecas (31).
Los estudios de laboratorio tienen poca utilidad y su alteración puede deberse más a procesos obstructivos que a la enfermedad misma. Puede verse elevación en la fosfatasa alcalina, o en los niveles de bilirrubinas. Los marcadores tumorales séricos, tales como el antígeno carcinoembrionario (ACE) o el CA 19-9, carecen de especificidad o adecuada sensibilidad, y por eso también carecen de utilidad en el estudio del CVB (32,33).
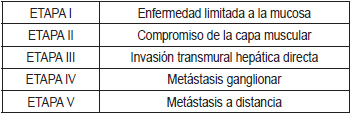
Existen varios sistemas de clasificación o estadificación en CVB, sin embargo, quizás son dos los más utilizados: Por una parte, el sistema de estadificación modificado de Nevin, que clasifica el CVB en 5 etapas, de acuerdo a la penetración, el compromiso de los ganglios linfáticos, y la presencia de metástasis (Tabla 2). Algunos autores consideran que esta clasificación es más útil tanto para la determinación del pronóstico, como para definir el uso de terapia adyuvante (34).
Tabla 2. Clasificación modificada de Nevin, para la estadificación del CVB.
Por otra parte, el sistema de clasificación TNM definido por el American Joint Committee on Cancer (AJCC), es el más aceptado a nivel mundial. Se basa en la profundidad de la invasión del tumor primario, la extensión local del tumor, la presencia de metástasis a los ganglios linfáticos y metástasis a distancia. Una de sus utilidades radica en definir la tasa de supervivencia a 5 años (Tabla 3), (35).
Tabla 3. Estadificación del CVB y sobrevida, según el American Joint Committee on Cancer (AJCC).

Aproximadamente el 60% de los pacientes con CVB se diagnostican en forma tardía, lo que hace inviable la resección quirúrgica. En estos casos, los estudios imagenológicos muestran compromiso de órganos circundantes, ya sean intestino, estómago o estructuras vasculares, o compromiso metastásico hepático. Algunos autores indican la realización de laparoscopia de estadiaje, ya que un gran porcentaje de pacientes pueden presentar altas tasas de metástasis ocultas (36,37).
El tratamiento ideal es la resección quirúrgica, pero solo es posible en cerca del 30% de los casos. Cuando se identifica CIVB, si el compromiso solo involucra la mucosa, la submucosa o la muscular de la mucosa (estado T1), la simple colecistectomía realizada, es considera terapéutica y no requiere tratamientos adicionales. Aunque hay controversia respecto a los estados T1b, algunos autores consideran que requieren reintervención quirúrgica. En los casos estadificados como T2, se debe hacer una colecistectomía radical, incluso con linfadenectomía y resección del área de los puertos de acceso. Si el CVB se identifica durante la laparoscopia, la cirugía debe ser convertida a técnica abierta, y se debe además resecar el tejido de los puertos para evitar recurrencias (38,39,40).
Estado del arte
En un reciente estudio retrospectivo, Yuan-Hu Tian, evaluó un periodo de 10 años entre 2002 y 2012, durante los cuales, se analizaron 7582 pacientes que fueron llevados a colecistectomía laparoscópica con sospecha de enfermedad benigna. De ellos, 61 pacientes (0,91%) fueron diagnosticados con CIVB. Se realizó seguimiento de los pacientes y de acuerdo con el estado TNM, se identificó una supervivencia a 5 años de la siguiente forma: T1a (95,5%), T1b (93,8), T2 (69,2%), y T3 (44,4%), (41). Kui Sun Choi, realizó un metanálisis que incluyó 26 artículos, encontrando 2145 pacientes con CIVB, lo que correspondió al 0,7% de los pacientes llevados a cirugía con sospecha de patología benigna. De ellos, el 23% estaban en estadio T1, el 47% en estadio T2 y el 25% en estadio T3. En un 40,9% de los casos se pudo realizar cirugía de reintervención con intención curativa, pero en un 23% las lesiones fueron irresecables (42).
En 2010 se publicó un estudio retrospectivo realizado en Chile, revisando un periodo de 8 años (2000 a 2008) y en el que se identificaron 49 casos de CIVB (38 mujeres, 11 hombres, con edad promedio de 58 años). Los informes de patología de la colecistectomía mostraron que 32 pacientes tenían un tumor T2, y 12 pacientes tenían márgenes de resección positivos. 36 pacientes fueron sometidos a re-exploración quirúrgica y 20 fueron levados a Cirugía radical, con una supervivencia mayor en los estadios más tempranos (43).
En Colombia, el estudio más reciente fue publicado en 2010, y en él se presentó una revisión del servicio de cirugía general del Hospital Universitario del Caribe, en Cartagena, entre el 1 de enero del 2007 y el 30 de marzo del 2010. Dicho estudio identificó 10 casos de CIVB en un grupo de 538 pacientes. 9 mujeres y 1 hombre, con edad promedio de 50,2 años. El 70% de los pacientes consultó por dolor abdominal inespecífico y, de éstos, el 90% con un tiempo de evolución inferior a 2 meses.
El diagnóstico se sospechó en el momento del acto operatorio en el 60% de los casos y fue hallazgo incidental en el 30% de las colecistectomías. El tipo histológico más frecuentemente encontrado fue el adenocarcinoma, bien y moderadamente diferenciado (90%). La estadificación tumoral fue considerada predominantemente en estadios avanzados, IV y V , con compromiso del lecho hepático en el 50% de los casos (9).
Material y métodos
Se realizó una búsqueda en la base de datos de Compensar EPS, en la que se reconocieron los pacientes llevados a colecistectomía laparoscópica, electiva y ambulatoria, en un periodo de 2 años, comprendido entre enero de 2016 y diciembre de 2017. Este es un estudio descriptivo, de una cohorte retrospectiva, en
el que se revisaron los informes de patología de todos los pacientes, identificando aquellos con diagnóstico de cáncer de vesícula biliar.
Mediante la revisión de la historia clínica, se determinó el estadio tumoral de acuerdo con la clasificación TNM del American Joint Committee on Cancer (AJCC) y el tratamiento recibido según el estadio de la enfermedad.
Este trabajo cumplió con las normas de Helsinki, siendo además una investigación sin riesgo, por emplear técnicas y métodos de investigación documental retrospectivos, como es la revisión de los informes de patología y de la historia clínica del paciente. No se realizaron intervenciones o modificaciones intencionadas de las variables biológicas, fisiológicas, psicológicas o sociales de los individuos, y contó con la aprobación del comité pertinente de Compensar EPS.
Resultados
Los pacientes llevados a colecistectomía laparoscópica ambulatoria en Compensar EPS, se ciñen a un protocolo, que excluye pacientes con sospecha o diagnóstico de cáncer de vesícula biliar, sospecha de vesícula en porcelana o colecistitis aguda, coledocolitiasis o antecedente de peritonitis, y no se incluyen pacientes asintomáticos. Durante el periodo de estudio, se realizaron 2562 colecistectomías (Tabla 4), en pacientes con edades comprendidas entre los 16 y los 76 años. Todos los pacientes fueron evaluados previamente por un Cirujano del grupo de colecistectomía laparoscópica, revisando los resultados del perfil hepático que incluían: Fosfatasa alcalina, bilirrubinas, transaminasas y ecografía de hígado y vías biliares. En ninguno de los pacientes programados, se sospechó previamente cáncer de vesícula biliar.
Se revisó la totalidad de los informes de patología y se encontró solo un caso por cada año, para un total de dos casos de CIVB. El primer caso, identificado en 2016, correspondió a una mujer de 62 años, que presentaba 4 meses de evolución y como única sintomatología, dolor en hipocondrio derecho. El perfil hepático fue normal y la ecografía informó colelitiasis sin signos de colecistitis. El diagnóstico operatorio fue colecistis aguda, y el estudio histopatológico encontró, neoplasia intraepitelial de bajo grado. Fue estadificado como un T1a, por lo cual se consideró la colecistectomía como tratamiento curativo, sin requerir estudios o tratamientos adicionales. Tras 24 meses de seguimiento, la paciente no ha presentado otras alteraciones.
Tabla 4. Pacientes llevados a colecistectomía.
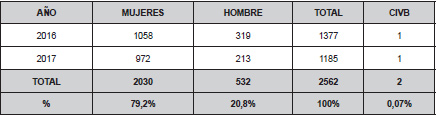
El segundo caso, identificado en 2017, correspondió a una mujer de 65 años, con síntomas de un año de evolución, relacionados con dolor abdominal, náuseas e intolerancia a alimentos grasos. Como único antecedente, refirió enfermedad ácido-péptica. El perfil hepático fue normal y la ecografía informó colelitiasis con colecistitis crónica. El diagnóstico quirúrgico fue el mismo y el informe de histopatología concluyó que se trataba de un adenocarcinoma infiltrante hasta la serosa, con borde sección positivo. Se consideró como un estadio T3 y por parte de cirugía oncológica, se le planteó a la paciente la realización de estudios complementarios, para una reintervención quirúrgica, los cuales no fueron aceptados por la paciente, quien falleció 3 meses después.
Discusión
En el estudio encontramos solo dos casos de CIVB, en un total de 2562 pacientes llevados a colecistectomía,
durante un periodo de 2 años, para una incidencia de 0,078 %, cifra muy por debajo de lo encontrado en algunos estudios nacionales y de lo mencionado en la literatura mundial.
Como limitantes del estudio, se considera el hecho de ser un estudio retrospectivo y de no incluir pacientes llevados a colecistectomía de urgencias. Sin embargo, se debe plantear, si los protocolos de estudio de las piezas quirúrgicas corresponden a los recomendados en búsqueda de CVB.
Se sugiere la realización de estudios prospectivos, que además incluyan tanto pacientes de cirugía programada, como pacientes de urgencias.
Conflicto de intereses
El autor declara no tener ningún conflicto de interés.
Financiación
Este trabajo fue financiado por el autor.
Agradecimientos
A los pacientes; a la Dra. Claudia Santos, Directora de Patología; al Dr. Hernán Castellanos, y a Compensar EPS.
Referencias
1. Tian YH, Meng XF, Huang ZO, Ji X, Liu B, Xia HT, Dong JH, Yang GY, Wang J. Surgical Treatment of Incidental Gallbladder Cancer Discovered During or Following Laparoscopic Cholecystectomy. World J Surg. 2015; 39: 746–752.
2. Boutros C, Gary M, Baldwin K. Gallbladder cancer: past, present and an uncertain future. Surg Oncol. 2012; 21(4): e183–e191.
3. Siegel R, Zou Z, Ma J.Cancer statistics. CA Cancer J Clin. 2014; 64(1): 9–29.
4. Gourgiotis S, Kocher HM, Solaini L. Gallbladder cancer. Am J Surg. 2008; 196(2): 252–264.
5. Goetze T, Paolucci V. Does laparoscopy worsen the prognosis for incidental gallbladder cancer? Surg Endosc. 2006; 20(2): 286–293.
6. Hundal R, Shaffer EA. Gallbladder cancer: epidemiology and outcome. Clin Epidemiol. 2014; 6: 99-109.
7. Duffy A, Capanu M, Abou-Alfa GK, et al. Gallbladder cancer (GBC): 10-year experience at Memorial SloanKettering Cancer Centre (MSKCC). J Surg Oncol. 2008; 98: 485-9.
8. Zhu AX, Hong TS, Hezel AF, et al. Current management of gallbladder carcinoma. Oncologist. 2010; 15: 168-81.
9. Redondo de Oro K, Redondo C, Payares M. Carcinoma de vesícula biliar en el “Hospital Universitario del Caribe”. Cartagena - Colombia (2007 – 2010). Rev. cienc. Biomed. 2010; 1(1): 40-46.
10. Kapoor VK. Incidental gallbladder cancer. Am J Gastroenterol. 2001; 96(3): 627–629.
11. Cortes A, Botero MP, Carrascal E, Bustamante F. Carcinoma insospechado de la vesícula biliar. Colombia Médica. 2004; 35 (1).
12. Jaramillo P, Hoyos S. Carcinoma de vesícula biliar en el Hospital Pablo Tobón Uribe de Medellín. Rev Colomb Cir. 2009; 24: 250-7.
13. A prospective analysis of 1518 laparoscopic cholecystectomies. The Southern Surgeons Club. N Engl J Med. 1991; 324: 1073.
14. Yamaguchi K, Chijiiwa K, Ichimiya H, et al. Gallbladder carcinoma in the era of laparoscopic cholecystectomy. Arch Surg. 1996; 131: 981.
15. Randi G, Franceschi S, La Vecchia C. Gallbladder cancer worldwide: geographical distribution and risk factors. Int J Cancer. 2006; 118: 1591.
16. Miquel JF, Covarrubias C, Villaroel L, et al. Genetic epidemiology of cholesterol cholelithiasis among Chilean Hispanics, Amerindians, and Maoris. Gastroenterology. 1998; 115: 937.
17. Zatonski W, La Vecchia C, Levi F, Negri E, Lucchini F. Descriptive epidemiology of gall-bladder cancer in Europe. J Cancer Res Clin Oncol. 1993; 119: 165–71.
18. Calvo A, Báez S, et al. Risk factors for gallbladder cancer. An international collaborative case-control study. Cancer. 1996; 78: 1515.
19. Scott TE, Carroll M, Cogliano FD, et al. A case-control assessment of risk factors for gallbladder carcinoma. Dig Dis Sci. 1999; 44: 1619.
20. Hsing AW, Gao YT, Han TQ, et al. Gallstones and the risk of biliary tract cancer: a population-based study in China. Br J Cancer. 2007 Dec; 97 (11): 1577-1582.
21. Paraskevopoulos JA, Dennison AR, Ross B, Johnson AG. Primary carcinoma of the gallbladder: a 10-year experience. Ann R Coll Surg Engl. 1992 May; 74 (3): 222-4.
22. McCain RS, Diamond A, Jones C, Coleman HG. Current practices and future prospects for the management of gallbladder polyps: A topical review. World J Gastroenterol. 2018; 24(26): 2844-52.
23. Wistuba II, Miquel JF, Gazdar AF, Albores-Saavedra J. Gallbladder adenomas have molecular abnormalities different from those present in gallbladder carcinomas. Hum Pathol. 1999 Jan; 30 (1): 21-5.
24. Roa I, de Aretxabala X, Araya JC, Roa J. Preneoplastic lesions in gallbladder cancer. J Surg Oncol. 2006 Jun 15; 93 (8): 615-23.
25. Buckles DC, Lindor KD, Larusso NF, Petrovic LM, Gores GJ. In primary sclerosing cholangitis, gallbladder polyps are frequently malignant. American Journal of Gastroenterology. 2002; 97(5): 1138–1142.
26. Roa I, Araya JC, Villaseca M, De Aretxabala X, Riedemann P, Endoh K, et al. Preneoplastic lesions and gall bladder cancer: an estimate of the period required for progression. Gastroenterology. 1996; 111: 232–236.
27. Taner CB, Nagorney DM, Donohue JH. Surgical treatment of gallbladder cancer. Journal of Gastrointestinal Surgery. 2004; 8(1): 83–89.
28. Donohue JH. Present status of the diagnosis and treatment of gallbladder cancer. Journal of Hepato-biliary-pancreatic Surgery. 2001; 8: 530–534.
29. Misra S, Chaturvedi A, Misra NC, Sharma ID. Carcinoma of the gallbladder. Lancet Oncol. 2003; 4:167. Hederstrom E, Forsberg L. Ultrasonography in carcinoma of the gallbladder. Diagnostic difficulties and pitfalls. Acta Radiológica. 1987; 28(6): 715–718.
30. Kim BS, Ha HK, Lee IJ, Kim JH, Eun HW, Bae IY, et al. Accuracy of CT in local staging of GBC. Acta Radiológica. 2002; 43(1): 71–76.
31. Pandey M, Sood BP, Shukla RC, Aryya NC, Singh S, Shukla VK. Carcinoma of the gallbladder: role of sonography in diagnosis and staging. Journal of Clinical Ultrasound 2000; 28(5): 227–232.
32. Strom BL, Maislin G, West SL, Atkinson B, Herlyn M, Saul S, et al. Serum CEA and CA 19-9: potential future diagnostic or screening tests for gallbladder cancer? Int J Cancer. 1990 May 15; 45 (5): 821-4.
33. Ritts RE Jr, Nagorney DM, Jacobsen DJ, Talbot RW, Zurawski VR Jr. Comparison of preoperative serum CA199 levels with results of diagnostic imaging modalities in patients undergoing laparotomy for suspected pancreatic or gallbladder disease. Pancreas 1994 Nov; 9 (6): 707-16.
34. Fong Y, Jarnagin W, Blumgart LH. Gall bladder cancer: comparison of patients presenting initially for definitive operation with those presenting after prior noncurative intervention. Annals of Surgery. 2000 Oct; 232 (4): 557–569.
35. Donohue JH, Stewart AK, Menck HR. The national cancer data base report on carcinoma of the gallbladder, 1989–1995. Cancer. 1998; 83: 2618–2628.
36. Reid K, Ramos A, Donohue J. Diagnosis and Surgical Management of Gallbladder Cancer: A Review. J Gastrointest Surg. 2007; 11: 671–681. 37. Weber SM, DeMatteo RP, Fong Y, Blumgart LH, Jarnagin WR. Staging laparoscopy in patients with extrahepatic biliary carcinoma. Analysis of 100 patients. Annals of Surgery. 2002; 235 (3): 392–399.
38. Butte JM, Matsuo K, Gönen M, D’Angelica MI, Waugh E, Allen PJ, et al. Gallbladder cancer: differences in presentation, surgical treatment, and survival in patients treated at centers in three countries. J Am Coll Surg. 2011 Jan; 212 (1): 50-61.
39. Downing SR, Cadogan KA, Ortega G, Oyetunji TA, Siram SM, et al. Early-stage gallbladder cancer in the Surveillance, Epidemiology, and End Results database: effect of extended surgical resection. Arch Surg. 2011 Jun; 146 (6): 734-8.
40. Chan SY, Poon RTP, Lo CM, Ng KK, Fan ST. Management of Carcinoma of Gallbladder: A Single-Institution Experience in 16 years. J Surg Oncol. 2008; 97: 156-64.
41. Chijiiwa K, Noshiro H, Nakano K, Okido M, Sugitani A, Yamaguchi K, et al. Role of surgery for gallbladder carcinoma with special reference to lymph node metastasis and stage using western and Japanese classification systems. World J Surg. 2000; 24: 1271-6.
42. Tian YH1, Ji X, Liu B, Yang GY, Meng XF, Xia HT, et al. Surgical Treatment of Incidental Gallbladder Cancer Discovered During or Following Laparoscopic Cholecystectomy. World J Surg. 2015 Mar; 39 (3): 746–752.
43. Ferrarese AG, Solej M, Enrico S, Falcone A, Catalano S, Pozzi G, et al. Diagnosis of incidental gallbladder cancer after laparoscopic cholecystectomy: our experience. BMC Surgery. 2013; 13 (2): S20.
Recibido: 4 de octubre de 2018
Aceptado: 9 de noviembre de 2018
Correspondencia: Robin Germán Prieto Ortiz rgprietoo@hotmail.com