MARCADORES ELECTROENCEFALOGRÁFICOS Y FENOTIPO COGNITIVO EN LA ENFERMEDAD DE PARKINSON. UNA REVISIÓN SISTEMÁTICA
Jairo Alexander Carmona Arroyave1, Carlos Andrés Tobón Quintero2, David Antonio Pineda Salazar3
Resumen
Contexto: La Enfermedad de Parkinson (EP) se caracteriza por un conjunto heterogéneo de síntomas no motores que afectan la calidad de vida de pacientes y cuidadores. El deterioro cognitivo se presenta desde etapas tempranas y constituye un factor de riesgo de demencia. Múltiples estudios electroencefalográficos (EEG) apuntan a cambios específicos en la actividad cerebral relacionados con la progresión y el fenotipo cognitivo de la enfermedad. Sin embargo, no está claro qué medidas electrofisiológicas son más útiles como marcadores biológicos. Objetivo: Sintetizar la evidencia científica que determina las relaciones entre el EEG en reposo y el perfil cognitivo en la EP. Métodos: Se desarrolló una revisión sistemática mediante una búsqueda en las bases de datos MEDLINE y Embase. Se incluyeron estudios en humanos con EP, en los que se especificase el estatus cognitivo, y se hubiese efectuado el análisis cuantitativo del EEG (qEEG) en reposo. Resultados: Se seleccionaron 36 artículos originales, encontrando tres grupos de medidas: análisis espectrales, conectividad funcional (CF), y métodos no-lineales. Todas las medidas diferenciaron los pacientes de los controles sanos (CS), indicando una relación directa con características fisiopatológicas y clínicas de la EP. Las medidas de análisis espectral mostraron correlaciones con el perfil neuropsicológico y/o capacidad predictiva para el pronóstico cognitivo de la enfermedad. Las medidas de conectividad demostraron sensibilidad a diversas intervenciones terapéuticas, aunque se encontró evidencia escasa acerca de su relación con variables cognitivas. Conclusiones: Las medidas obtenidas del qEEG en reposo configuran instrumentos costo-efectivos útiles como potenciales biomarcadores de la EP y sus manifestaciones cognitivas.
Palabras clave: Biomarcadores; Cognición; Electroencefalografía; Electrofi siología; Enfermedad de Parkinson; Revisión sistemática.
_______________________
1 MD, Cirujano, Maestría en Neurociencias. Grupo de Neurociencias de Antioquia, Grupo de Neuropsicología y Conducta, Facultad de Medicina, Universidad de Antioquia. Medellín, Colombia.
2 MD, Cirujano, PhD en Neurociencias. Grupo de Neurociencias de Antioquia, Grupo de Neuropsicología y Conducta, Facultad de Medicina, Universidad de Antioquia. Medellín, Colombia.
3 MD, Cirujano, PhD Honoris causa en Neurociencias Cognitivas. Grupo de Neurociencias de Antioquia, Facultad de Medicina, Universidad de Antioquia. Grupo de Neuropsicología y Conducta, Facultad de Psicología, Universidad de San Buenaventura. Medellín, Colombia.
________________________
ELECTROENCEPHALOGRAPHIC MARKERS AND COGNITIVE PHENOTYPE IN PARKINSON’S DISEASE. A SYSTEMATIC REVIEW
Abstract
Background: Parkinson’s disease (PD) is characterized by a combination of no motor symptoms that affect quality of life of patients and caregivers. Cognitive impairment show up since early stages of disease and constitute a risk factor for dementia. Several electroencephalographic studies point to specific changes in brain activity related to PD progression and cognitive phenotype. Nevertheless, it is not clear what electrophysiological measures are more useful as biological markers. Objectives: To synthesize the scientific evidence determining relations between the resting-state qEEG and the cognitive profile in PD. Methods: A systematic review was conducted by the means of searches in databases MEDLINE and EMBASE. Inclusion criteria comprise studies carried out in humans with PD in which the cognitive status of participant was clearly specified, and a quantitative analysis of the EEG (qEEG) in restingstate was performed. Results: 36 original articles was selected showing three general types of connectivity measures: spectral analysis, functional connectivity, and no-linear methods. All measures differentiated patients from healthy controls, suggesting a direct association between EEG dynamics and the physiopathological and clinical characteristics of PD. Spectral analysis measures showed correlations with neuropsychological profile features, and had significant predictive values for cognitive prognosis of disease. Connectivity measures presented consistency in sensibility to therapeutic interventions, but there was a lack of evidence regarding relations with cognitive variables. Conclusions: Measures obtained from qEEG can be considered cost-effective instruments useful as potential biomarkers of Parkinson’s disease cognitive manifestations.
Keywords: Biomarkers; Cognition; Electroencephalography; Electrophysiology; Parkinson’s disease; Systematic revie
Introducción
La EP es la segunda causa de trastornos neurodegenerativos en la población mundial mayor de 55 años (1,2). En la fisiopatología de la EP, la lesión en la substancia nigra resulta en una disfunción de los ganglios basales (GB) (3), y esto en la actividad anormal de diversos circuitos fronto-subcorticales (4), manifestándose en un perfil clínico heterogéneo de síntomas no motores (5), que afectan significativamente la calidad de vida de pacientes (6) y cuidadores (7), con repercusiones socioeconómicas significativas (8). El deterioro cognitivo en la EP se presenta desde etapas tempranas (9,10), constituyendo un factor de riesgo para la ocurrencia de demencia (11), que puede presentarse en un 80% de los pacientes en el largo plazo (12). No obstante, no hay claridad sobre los marcadores biológicos que puedan asistir el diagnóstico, las intervenciones, y/o el pronóstico de la enfermedad, particularmente en la esfera cognitiva (13).
La perspectiva neurocientífica actual considera los fenómenos cognitivos como dependientes de la integración funcional de regiones cerebrales especializadas (14), de cuya interacción en red emergerían los procesos cognitivos globales (15,16). La actividad acoplada de la corteza cerebral refleja la integridad de redes específicas (16), y su análisis puede advertir sobre alteraciones con significado clínico (17), incluso en mediciones realizadas en estado de reposo (18). En este sentido, técnicas de registro sensibles, con resolución temporal adecuada para las interacciones neurales (17), y que requieren poca cooperación de los sujetos, como la EEG en reposo, tienen el potencial de identificar variaciones en patrones de activación cortical asociados a trastornos neurológicos (19).
El qEEG se ha posicionado como una herramienta eficiente, que puede aportar elementos objetivos a la toma de decisiones de profesionales de la salud mental (17,19). Sin embargo, en patologías como la EP no se ha precisado qué marcadores EEG son más útiles, cuál es su relación con el perfil cognitivo de los pacientes, ni cuál es la evidencia que sustentaría su uso como estándares de referencia.
La presente revisión se realizó con base en la pregunta: ¿cuál es la evidencia científica sobre la correlación entre el estado cognitivo y las medidas del qEEG en reposo, en sujetos adultos con diagnóstico de EP? Véase Tabla 1.
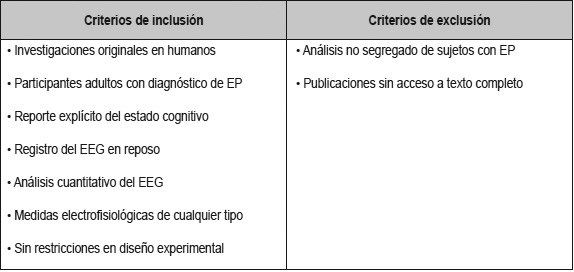 |
Tabla 1. Criterios de selección de referencias bibliográficas |
Métodos
Criterios de elegibilidad de estudios
Se elaboró previamente un protocolo especificando la metodología y los criterios de selección de estudios (Tabla 1), siguiendo los lineamientos Cochrane para revisiones sistemáticas (20). Los resultados se reportaron con base en la guía PRISMA (21).
Fuentes de información y estrategia de búsqueda
Se efectuaron búsquedas en bases de datos electrónicas (MEDLINE, desde 1966; EMBASE, desde 1974) y rastreo en listas de referencias, sin restricciones por idioma, fecha, ni estado de publicación, hasta diciembre de 2015. La estrategia implementada siguió los siguientes parámetros:
#1: Parkinson*
#2: Eeg OR electroencephalogram OR electroencephalography OR electroencepha* OR quantitative eeg (EMBASE: quantitative AND eeg) OR qeeg OR quantitative electroencephalogram OR q electroencephalogram OR quantitative electroencephalography OR q electroencephalography OR qeeg OR q eeg OR q electroencephalogram OR cortical activity
#3: Connectivity OR brain connectivity (EMBASE: brain AND connectivity) OR synchronization OR coherence OR oscillations OR power OR coupling OR spectral analysis OR spectrum analysis OR oscillatory activity OR oscillatory dynamics
#4: cogni* OR executive OR dementia OR neurocognitive OR neuropsycho*
#5: 2 OR 3
#6: 1 AND 4 AND 5
Procedimientos de selección de estudios
El proceso de selección tuvo tres etapas: 1) tamización por títulos y resúmenes; 2) revisión completa de los artículos filtrados; y 3) extracción de datos y valoración de la calidad de las publicaciones. Las dos etapas iniciales se efectuaron independientemente por dos revisores formados en neurociencias (CT, JC). Para la última etapa, un revisor extrajo la información (JC), y un segundo la verificó (CT). Las discrepancias se resolvieron por consenso y/o por un revisor adicional (DP).
Recolección de la información
La extracción de datos se realizó en un formato prediseñado que incluyó: 1) caracterización de estudios y participantes (primer autor, año, localización geográfica, diseño, tamaño de muestra y tipo de población, edad, genero/sexo, escolaridad, duración y/o progresión de la enfermedad, y tratamientos); 2) criterio de intervención (parámetro de evaluación cognitiva); 3) medidas de resultados (marcador electrofisiológico,
técnica del EEG, efectos del tratamiento); 4) hallazgos (factores de confusión, análisis estadísticos, resultados principales, correlaciones clínicas, conclusiones).
Riesgo de sesgo en los estudios Debido a la falta de homogeneidad de criterios para valorar estudios observacionales, se adaptaron las guía Cochrane (22), la escala de calidad de Downsy-Black para estudios no-aleatorizados (23), y las fichas de lectura crítica del servicio de evaluación de tecnologías sanitarias del departamento de salud del país Vasco (24).
Medidas de resumen y síntesis de datos
Los estudios de marcadores EEG en la EP, son heterogéneos con respecto a las características clínicas de las poblaciones, al procedimiento para determinar el estado cognitivo, y a las medidas electrofisiológicas empleadas. En consecuencia, en esta revisión no se intentó una síntesis cuantitativa de los resultados.
Resultados
Selección de estudios
Se identificaron inicialmente 2246 registros, 1269 en Medline y 977 en Embase. Se descartaron 2178 referencias por criterios de selección y duplicación. Se examinaron de forma completa 74 artículos, de los cuales, 36 fueron incluidos en la revisión final (Figura 1).
Características de los estudios
Diseño y localizaciónLas investigaciones presentaron diseños transversales en su mayoría, encontrándose sólo 4 reportes longitudinales, con seguimiento promedio de 3,3 años. Los estudios incluidos se originaron en Finlandia (25), España (26), Francia (27), Italia (28-33), Israel (34-35), Holanda (36-38), Brasil (39-41), Alemania (42), Japón (43-46), República Checa (47), Canadá (48), Inglaterra (49), Estados Unidos (50-54), Suiza (55–58) y China (59,60).
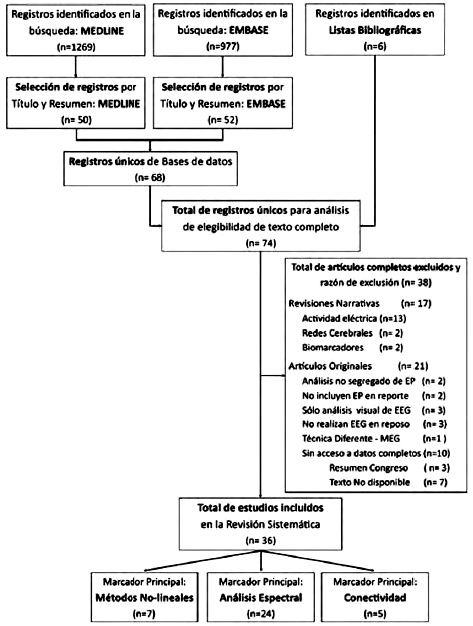 |
Figura 1. Algoritmo para la aproximación diagnóstica de un paciente con Leucocitosis y neutrofilia. Fuente: Elaboración propia. |
Participantes
Todos los sujetos fueron seleccionados por conveniencia a partir de clínicas especializadas, o de programas estatales de investigación. La mediana de pacientes por estudio fue de 24 (límites= 9 – 106), la mediana de participación de mujeres de 44,5% (20,8 – 69,2), y la mediana de promedios de edad fue 68,9 años (54,3 – 77,7).
Factor de Intervención
En 21 artículos se evaluaron exclusivamente sujetos con EP sin demencia (EP-ND) (26, 28, 29, 33, 36-39, 42, 44, 45, 47-49, 51-56, 58, 59), mientras que en 3 publicaciones se examinaron pacientes con demencia asociada a la EP (EP-D) (30,32,35), y en 7 investigaciones se analizaron ambos grupos (25, 27, 31, 34, 41, 43, 46). El deterioro cognitivo leve en EP (EP-DCL), se empleó como categoría de grupo en 5 trabajos (40, 50, 56, 57, 60), comparándose con individuos con EP y cognición normal (EP-CogNL) (56), EP-D (57, 60), y con ambas condiciones (40, 50).
Los instrumentos de valoración cognitiva fueron heterogéneos. El Mini-Mental State Examination (MMSE) fue usado como parámetro exclusivo en 11 estudios (26,28,31,43,44,46–48,53,59,60), y conjuntamente con otras pruebas o baterías neuropsicológicas en 13 artículos más (30,32,33,35,40,41,45,50–52,54,56,57). Igualmente, se utilizaron otros instrumentos de evaluación global de la cognición en 4 publicaciones (27,29,34,58).
La estimación del estado cognitivo se efectuó sin test neuropsicológicos en 6 estudios (25, 36-39, 55), mediante escalas clínicas (25), criterios convencionales de demencia (36–39), o únicamente por el examen clínico (55). Cinco investigaciones no especificaron los procedimientos para la clasificación cognitiva (25, 41, 42, 49, 56).
Los resultados electrofisiológicos revisados se agrupan en tres grandes grupos: medidas de análisis espectral (MAE), estimaciones de CF, y métodos no-lineales (Figura 1). 24 publicaciones utilizaron las MAE (actividad por bandas de frecuencia), cuyos marcadores específicos incluyeron la potencia espectral (25, 27-30, 32, 33, 35, 36, 40, 41, 43, 47, 48, 50, 51, 54-57, 59, 60), índices espectrales (26, 27, 44-46, 60), y otros basados en la frecuencia dominante (media, mediana, y pico de frecuencia) (25, 27, 30, 39, 48, 50, 51, 54, 57, 58, 60). Las medidas de CF se emplearon en 5 artículos (31, 41, 49, 52, 55), usando la coherencia espectral en 4 de ellos (41, 49, 52, 55). Los métodos no-lineales comprendieron 7 investigaciones con medidas variadas (36-38, 42, 47, 53, 59), como la dimensión de correlación (36, 37, 42), el exponente de Lyapunov (37), entropía de Kolmogorov (37), aceleración del espectro de entropía (38), entropía local (47), paquete de entropía Wavelet (59) y otros modelos no-lineales (53).
Riesgo de sesgos
Los resultados electrofisiológicos revisados se agrupan en tres grandes grupos: medidas de análisis espectral (MAE), estimaciones de CF, y métodos no-lineales (Figura 1). 24 publicaciones utilizaron las MAE (actividad por bandas de frecuencia), cuyos marcadores específicos incluyeron la potencia espectral (25, 27-30, 32, 33, 35, 36, 40, 41, 43, 47, 48, 50, 51, 54-57, 59, 60), índices espectrales (26, 27, 44-46, 60), y otros basados en la frecuencia dominante (media, mediana, y pico de frecuencia) (25, 27, 30, 39, 48, 50, 51, 54, 57, 58, 60). Las medidas de CF se emplearon en 5 artículos (31, 41, 49, 52, 55), usando la coherencia espectral en 4 de ellos (41, 49, 52, 55). Los métodos no-lineales comprendieron 7 investigaciones con medidas variadas (36-38, 42, 47, 53, 59), como la dimensión de correlación (36, 37, 42), el exponente de Lyapunov (37), entropía de Kolmogorov (37), aceleración del espectro de entropía (38), entropía local (47), paquete de entropía Wavelet (59) y otros modelos no-lineales (53).
Resultados de estudios individuales
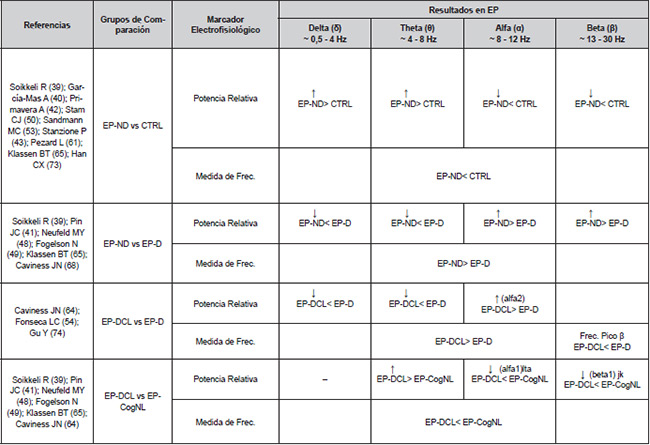
La signatura electrofisiológica de la EP presenta divergencias cualitativas y/o cuantitativas respecto a CS (25,26,28,30,31,34,36–38,40–44,47,48,55,57,59), y a poblaciones con demencia tipo Alzheimer (EA) (27,28,30,36–39,41,57), demencia por cuerpos de Lewy (30,61), depresión (28,39), y trastornos del sueño (48). De hecho, las MAE mostraron capacidad discriminativa entre grupos con EP-CogNL (40,50,56), EP-DCL (40,45,50,56,57,60) y EP-D (25,27,30,34,4 0,41,43,46,50,51,54,57,60,61) (Tabla 2; material suplementario 2). La relación entre marcadores qEEG y el estado cognitivo en EP, se confirmó por análisis de correlación entre las MAE y diversas pruebas cognitivas (30–32,37,40,43,45,46,50,51,54,56,58,60) (Material suplementario 3). Además, varios estudios señalan la sensibilidad de algunas medidas a los efectos de intervenciones terapéuticas (29,33,35,49,52,53). El material suplementario 2, y las tablas 3 y 4, muestran los hallazgos con nivel significativo (p >0,05) en los estudios individuales con MAE, CF, y métodos nolineales, respectivamente.
Análisis espectral: En la EP-ND se presentaron incrementos significativos en la potencia relativa en bandas de frecuencia delta (~0,5-4 Hz) (26,29,59) y theta (~48 Hz) (25,26,28,36,39,51,59), y disminución en alfa (~8-12 Hz) (25,26,28,29,44,59) y beta (~12-30 Hz) (25,26,29,36,47,59), al compararse con CS (Tabla 2). Este realce en bandas “lentas” se reflejó en frecuencias medias más bajas (25,39), y se caracterizó por una localización difusa (25,47), con una tendencia hacia regiones fronto-centrales (26–29,59). La EP-D mostró un patrón similar, con un reforzamiento en la potencia relativa en delta (27,30,32,40), una acentuada reducción en alfa (30,32,40,46), y una ralentización más profunda en las medidas de frecuencia (25,30). Estos hallazgos, se registraron de forma más difusa, con predominio en regiones parieto-occipitales (30,40) (Material suplementario 2).
La EP-DCL se diferenció de la EP-CogNL, por una mayor potencia relativa en theta (40,45,50) y menor actividad en alfa1 (~8-10 Hz) (45,56) y beta1 (~12-20 Hz)
(45,50), involucrando regiones fronto-centrales (45,50), temporales (56) y parieto-occipitales (40). Las medidas de frecuencia fueron más bajas en la EP-DCL (50,57) que en la EP-CogNL (50) y en CS (57) (Tabla 2).
Es importante destacar que el tratamiento dopaminérgico demostró influencia sobre las potencias espectrales, aunque con resultados conflictivos con respecto a las bandas involucradas (29, 33).
Las correlaciones entre las MAE y el desempeño cognitivo se reportaron explícitamente en 14 estudios (27-30, 32, 44 ,45, 50, 51, 54, 57, 58, 60) (Material suplementario 3). El MMSE presentó correlaciones negativas con la potencia relativa en bandas delta (46, 50, 54, 56) y theta (28, 46, 50, 51, 56, 60), y positivas con la actividad en alfa (32, 35, 46, 50, 54, 60), beta (46, 50, 54, 56), y algunas medidas de frecuencia (50, 51, 54, 58). Resultados equivalentes se observaron en la EP-D con la escala de evaluación rápida de las funciones cognitivas (ERFC) (27). Asimismo, se encontró una correlación positiva entre la prueba de valoración comportamental del síndrome “dis-ejecutivo” (BADS en inglés) con el índice espectral (alfa+beta / delta+theta) en electrodos frontales (45).
En estudios de seguimiento, los cambios en la actividad delta se correlacionaron negativamente con los cambios neuropsicológicos en la EP, especialmente en pruebas de memoria de largo plazo y funciones ejecutivas (54). De igual modo, la frecuencia mediana presentó una correlación positiva con test de cognición global, memoria episódica, atención dividida, funciones ejecutivas, y fluidez semántica y de figuras (58). En efecto, se encontró un mayor riesgo de demencia en pacientes con EP-ND que mostraban una frecuencia de base menor, y una potencia relativa en theta mayor, al inicio de la observación (51). Análogamente, la evolución de la EP-DCL a la EP-D, se asoció a una potencia relativa en alfa y a un índice alfa/theta más bajos (60) (Material suplementario 3).
CTRL: Controles; EP-ND: EP sin demencia; EP-D: EP con demencia; EP-DCL: EP con deterioro cognitivo leve; EP-CogNL: EP con cognición normal; alfa1: ~8-10 Hz; alfa2: ~10-12 Hz; beta1: ~13-20 Hz |
Tabla 2. Medidas de análisis espectral: síntesis de resultados significativos (p<0,05) para comparaciones entre grupos |
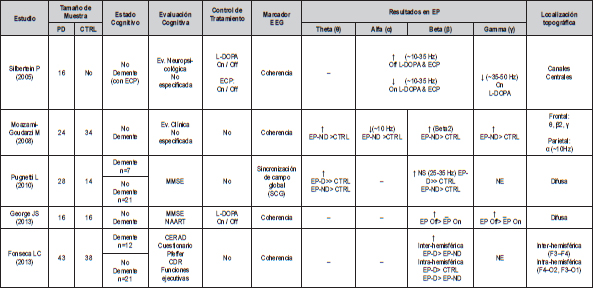
Medidas de conectividad: Los estudios de CF sugieren una sincronización cortical anormal en la EP-ND, caracterizada por incrementos en la coherencia en bandas theta (55), alfa2 (49), beta (49,52,55) y gamma (49,52,55). No obstante, una comparación clara con CS, sólo se realizó en 1 estudio exploratorio (55). En la EP-D se reportó mayor coherencia inter (fronto-frontal) e intrahemisférica (fronto-occipital) en frecuencias beta, comparada con pacientes sin demencia y CS (41) (Tabla 3). Además, intervenciones farmacológicas (49,52) y de estimulación intracerebral (49) en la EP-ND, demostraron atenuaciones de la coherencia en alfa2, beta y gama, asociadas
con mejoría en síntomas motores (49,52). Sin embargo, ningún estudio de CF informó sobre la relación entre los resultados EEG y el desempeño cognitivo.
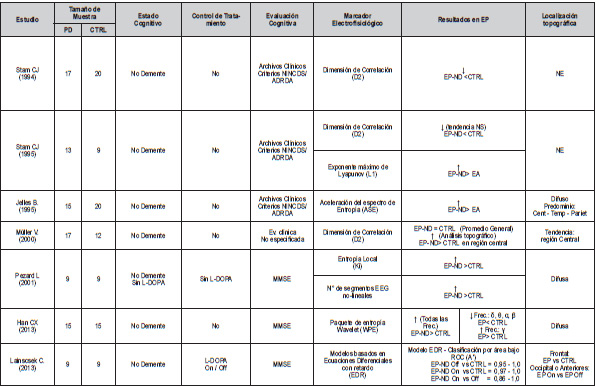
Medidas No-lineales. Los estudios indican que las medidas no-lineales pueden distinguir la EP-ND de CS (36–38,42,47,53,59) y de la EA (36-38). Un tipo de metodología no-lineal reportó sensibilidad al efecto de la levodopa en la EP-ND (53). Los estudios con métodos no-lineales no evaluaron el estatus cognitivo, ni efectuaron análisis de correlación con pruebas cognitivas en la EP (Tabla 4).
L-DOPA: Levodopa; ECP: estimulación cerebral profunda; "On": bajo efecto de tratamiento; "Off": sin efecto de tratamiento; CTRL: controles EP-ND: EP sin demencia; EP-D: EP con demencia; Beta2: ~ 12 - 20 Hz; NS: sin significación estadística; NE: no evaluado; NAART: North American Reading Test; NAART; CDR: Clinical Dementia Rating; Pfeffer: functional activities questionnaire; CERAD: consortium to establish a registry for Alzheimer’s Disease; F3-F4: electrodos frontales; O1-O2: electrodos occipitales |
Tabla 3. Estudios de conectividad: síntesis de resultados significativos (p>0,05) para comparaciones entre grupos. |
L-DOPA: Levodopa; "On": bajo efecto de tratamiento; "Off": sin efecto de tratamiento; δ, θ, α, β, γ: bandas delta, theta, alfa, beta y gamma, respectivamente. EP-ND: EP sin demencia; EA: enfermedad de Alzheimer; ROC: característica operativa del receptor (del inglés Receiver Operating Characteristic); NE: no evaluado; NINCDS/ ADRDA: National Institute of Neurological and Communicative Disorders and Stroke / Alzheimer’s Disease and Related Disorders Association criteria to clinical diagnosis of Alzheimer’s disease |
Tabla 4. Métodos No-lineales: síntesis de resultados significativos (p>0,05) para comparaciones entre grupos |
Discusión
La evidencia sobre la relación entre el fenotipo cognitivo y los marcadores EEG en reposo en la EP, es limitada y heterogénea en cuanto a la determinación de ambas variables. Los parámetros basados en análisis lineales en el dominio de la frecuencia, son los más numerosos, correspondiendo a las MAE clásicas (medidas de frecuencia, potencias e índices espectrales), y las estimaciones de CF (coherencia principalmente). Los estudios enfocados en métodos no-lineales son pocos, y con importante variabilidad metodológica, restringiendo la factibilidad de una síntesis de marcadores. Por otro lado, los instrumentos para la valoración cognitiva fueron también heterogéneos, oscilando entre el uso exclusivo de criterios clínicos, y la aplicación de pruebas neuropsicológicas de dominio específico. Estas variaciones introducen confusión en el examen de especificidad de las medidas EEG en la EP, pudiendo generar solapamiento y/o anulación de diferencias electrofisiológicas relevantes entre grupos con dinámicas corticales presumiblemente distintas.
Análisis espectrales. El patrón espectral en la EP se caracteriza de forma general por un incremento en la actividad en bandas de frecuencia lentas (delta/theta), y una disminución comparativa en bandas rápidas (alfa/beta). Dentro de la población con EP-ND, el grupo con EP-DCL contrasta con la EP-CogNL, por una actividad mayor en theta, y menor en alfa1 y beta1 (Tabla 2). A pesar de que se asume una dinámica espectral similar en la EP-CogNL y en CS, esto fue explorado explícitamente solo por un estudio (40), en el que se aprecian modificaciones EEG coherentes con el patrón general descrito para la EP, pero que no alcanzaron significación estadística.
Las medidas de frecuencia mostraron una relación inversa con el desempeño cognitivo en la EP, discriminando entre los subgrupos cognitivos (EP-D< EPDCL< EP-CogNL< Control), y señalando un riesgo de demencia 13 veces mayor para pacientes con frecuencias más bajas que la mediana poblacional en la EP-ND (51). Estos hallazgos confirman, extienden y precisan los resultados de investigaciones previas realizadas por análisis visual del EEG en la EP (62–66), y se asemejan a observaciones magnetoencefalográficas (MEG), reportadas incluso desde el diagnóstico de la enfermedad (67–70).
Una importante investigación reciente, correlacionó los cambios EEG con hallazgos neuropatológicos postmortem en la EP. Se incluyeron en el estudio sujetos con enfermedad por cuerpos de Lewy de tipo incidental (ECLI), y se los comparó con los subgrupos cognitivos de la EP (71). El análisis espectral demostró una reducción progresiva de la frecuencia EEG entre todos los grupos, iniciando desde aquellos con ECLI, lo que sugiriere una relación entre la frecuencia de base y la sinucleinopatía. De la misma manera, la potencia relativa theta fue significativamente más alta en la EP-CogNL, con respecto a la ECLI, sugiriendo la anormalidad en theta como un marcador de la etapa clínica de la EP, independiente de la presencia de DCL (71).
El patrón de modificaciones espectrales y los rasgos cognitivos en la EP, tienen correspondencia con aspectos funcionales de los ritmos cerebrales. Por ejemplo, se ha considerado que la actividad anormal en bandas delta y theta expresaría una patología intrínseca y difusa en las interacciones corticales (72,73). De hecho, la actividad creciente en frecuencias delta en la EP, aparece como coincidente con el deterioro cognitivo, en lugar de predecir su aparición (54,71).
Por otra parte, mientras que el ritmo alfa está asociado con la actividad cerebral espontánea (74), y con procesos sensoriales (75), atencionales (76), y de memoria de trabajo (77), el contenido funcional en beta se relaciona con las conductas motoras (78), operaciones de control por retroalimentación (Top-Down) (79), atención selectiva (80), memoria de trabajo (81), búsqueda guiada (82), percepción del movimiento (83) e integración sensitivo-motora (84).
Con base en lo anterior, la oscilación anormal en alfa observada en la EP, constituiría un marcador de alteraciones en el procesamiento e integración cortical de la información, sugiriéndose como correlato temprano de las manifestaciones cognitivas. Asimismo, las alteraciones en frecuencias beta, se asociarían a perturbaciones de procesos de integración sensorial, y de la regulación de conductas motoras y cognitivas observadas en la enfermedad.
Medidas de conectividad: La evidencia indica una sincronización anormal en bandas theta, alfa, beta y gama en la EP-ND. Sin embargo, las modificaciones con respecto a CS, se especifican solo en un estudio exploratorio, advirtiendo una tendencia al aumento de la coherencia en rangos theta, beta2 y gama, y a una disminución parietal alrededor de los ~10 Hz en la EPND (55). La incidencia de demencia estaría relacionada con incrementos localizados de la coherencia inter e intrahemisférica en rangos beta (41).
Estudios de CF por MEG, usando la probabilidad de sincronización (PS) como medida, han mostrado también un acoplamiento cortico-cortical incrementado en la EP-ND, comprometiendo inicialmente alfa1, y progresivamente theta, alfa2 y beta (85). En la EP-D se reportaron reducciones de la PS intra e interhemisférica anterior en delta, theta, y bandas alfa, así como incrementos intrahemisféricos posteriores en alfa2 y frecuencias beta, al compararse con la EP-ND (86). Estos datos apuntan a que los cambios en la CF en el curso de la EP, tendrían una relación consistente con la progresión de la patología y cierta especificidad espacial (86,87).
En síntesis, los estudios disponibles sugieren que el acoplamiento de la actividad oscilatoria en reposo está alterada desde etapas tempranas de la EP, cuando se supone que la neo-corteza estaría preservada de lesión patológica (87). Por lo tanto, las anormalidades en la sincronización cortico-cortical en la EP, se asociarían
a alteraciones funcionales de los componentes de redes específicas, causados esencialmente por la desregulación GB-tálamo-cortical propia de la enfermedad (88). No obstante, los defectos específicos en las redes implicadas en el deterioro cognitivo, y su relación con la fisiopatología de la EP en varios niveles de organización, son aún materia de debate (88,89). En este sentido, el análisis formal de redes con base en mediciones de CF por EEG, y sus correspondientes medidas específicas de red, representan un prometedor tipo de bio-marcador (90).
Medidas no-lineales: Las metodologías no-lineales permitieron identificar sujetos con EP-ND, diferenciándolos de CS, pero no hay evidencias sobre su capacidad de discriminar entre subgrupos dentro del espectro cognitivo de la enfermedad. En esta dirección, los análisis espectrales han demostrado mayor eficiencia clínica, en términos de sensibilidad y especificidad. Esta disparidad radica en que las medidas no-lineales han sido menos utilizadas, principalmente debido a un mayor costo computacional, y a que sus métodos están menos desarrollados y/o depurados.
La importancia de los marcadores no-lineales está en que captarían información que no puede percibirse a través de análisis convencionales (91). Así, siendo la EP una enfermedad compleja, que afecta la organización cerebral en diferentes escalas (88), se presume una gran cantidad de información en la actividad neural a la que aún no se tiene acceso y de ahí la necesidad de esclarecer un perfil de las dinámicas no-lineales del EEG.
Cada uno de los tres tipos generales de medidas EEG, reflejarían aspectos distintos de la fisiología cortical (72,92), por lo que la valoración integrada de múltiples marcadores, permitiría una definición más completa del “perfil EEG” de la EP (93), con aplicaciones importantes en la investigación y la clínica. Futuros estudios deberán incorporar estas medidas como referencias comparativas en muestras poblacionales más grandes, y con una caracterización cognitiva adecuada para el fenotipo de la EP. Particularmente, deben considerarse metodologías de localización de fuentes EEG, y profundizar en las correlaciones entre marcadores específicos y el funcionamiento cognitivo.
Esta revisión tiene algunas limitaciones. En primer lugar, el vocabulario controlado de las bases de datos, carece de entradas específicas para términos correspondientes al qEEG. En consecuencia, suponemos una posible recuperación sub-óptima de referencias relevantes. En segundo término, no existen marcadores estándar relacionados con el deterioro cognitivo en la EP, que puedan servir de referencia para la síntesis interpretativa que reportamos en esta revisión. Un tercer elemento, es la falta de clasificación cognitiva precisa de los pacientes en la mayor parte de los estudios revisados. Específicamente, el concepto de DCL es aún poco aplicado en estudios electrofisiológicos y ha estado sujeto a modificaciones en sus criterios específicos para la EP (94).
Otros factores metodológicos, como la heterogeneidad en variables clínicas y sociodemográficas, las diferencias técnicas en el registro y la falta de control de tratamientos con influencia en la señal EEG, son elementos que complican la formulación de conclusiones exhaustivas. Finalmente, se podría haber incurrido en sesgo de publicación al no consultar fuentes de literatura gris, trabajos presentados en eventos, o directamente a los autores, para obtener referencias sin acceso a texto completo.
En conclusión, los resultados de esta revisión indican que diferentes marcadores obtenidos a partir del qEEG en reposo, tienen la capacidad de distinguir sujetos con EP de individuos sanos, así como entre pacientes con distintos grados de menoscabo cognitivo, incluso desde etapas iniciales de la enfermedad. En este sentido, las alteraciones en medidas espectrales asociadas al deterioro cognitivo en EP, podrían detectarse antes que sus manifestaciones clínicas. Igualmente, las medidas de conectividad muestran sensibilidad consistente a varios tipos de intervenciones terapéuticas.
La evidencia disponible sustenta la aplicabilidad y utilidad de las medidas qEEG en el diagnóstico, seguimiento y pronóstico cognitivo en la EP. De esta manera, los marcadores electrofisiológicos se presentan como una herramienta costo-efectiva que vincula la investigación básica y la práctica clínica, en la intención de trasladar los avances científicos a una asistencia más integral y actualizada de los pacientes y sus familias.
Conflicto de intereses
No se declaran conflictos de interés para este artículo.
Financiamiento
Este estudio fue financiado por el comité para el desarrollo de la investigación (CODI) de la Universidad de Antioquia. Proyecto PRG-2014-768: “Procesamiento del lenguaje de acción en pacientes con enfermedad ganglio-basal desde una perspectiva neuropsicológica y neurofisiológica”. La entidad financiadora no tuvo influencia en el diseño, recolección, análisis ni interpretación de los datos de este estudio, ni la preparación o revisión del presente manuscrito.
Referencias
1. Lee A, Gilbert RM. Epidemiology of Parkinson Disease. Neurol Clin. 2016; 34(4): 955–65.
2. Kalia L V, Lang AE. Parkinson’s disease. Lancet. 2015; 386(9996): 896–912.
3. Obeso JA, Rodriguez-Oroz MC, Stamelou M, Bhatia KP, Burn DJ. The expanding universe of disorders of the basal ganglia. Lancet. 2014; 384(9942): 523–31.
4. DeLong MR, Wichmann T. Circuits and circuit disorders of the basal ganglia. Arch Neurol. 2007; 64(1): 20–4.
5. Jankovic J. Parkinson’s disease: clinical features and diagnosis. J Neurol Neurosurg Psychiatry. 2008; 79(4): 368–76.
6. Martinez-Martin P, Rodriguez-Blazquez C, Kurtis MM, Chaudhuri KR. The impact of non-motor symptoms on health-related quality of life of patients with Parkinson’s disease. Mov Disord. 2011; 26(3): 399–406.
7. Grun D, Pieri V, Vaillant M, Diederich NJ. Contributory Factors to Caregiver Burden in Parkinson Disease. J Am Med Dir Assoc. 2016; 17(7): 626–32.
8. Vossius C, Larsen JP, Janvin C, Aarsland D. The economic impact of cognitive impairment in Parkinson’s disease. Mov Disord. 2011; 26(8): 1541–4.
9. Aarsland D, Creese B, Politis M, Chaudhuri KR, Ffytche DH, Weintraub D, et al. Cognitive decline in Parkinson disease. Nat Rev Neurol. 2017; 13(4): 217–31.
10. Muslimovic D, Post B, Speelman JD, Schmand B. Cognitive profile of patients with newly diagnosed Parkinson disease. Neurology. 2005; 65(8): 1239–45.
11. Domellof ME, Ekman U, Forsgren L, Elgh E. Cognitive function in the early phase of Parkinson’s disease, a fiveyear follow-up. Acta Neurol Scand. 2015; 132(2): 79–88.
12. Hely MA, Reid WGJ, Adena MA, Halliday GM, Morris JGL. The Sydney multicenter study of Parkinson’s disease: the inevitability of dementia at 20 years. Mov Disord. 2008; 23(6): 837–44.
13. Algarni MA, Stoessl AJ. The role of biomarkers and imaging in Parkinson’s disease. Expert Rev Neurother. 2016; 16(2): 187–203.
14. Sporns O, Tononi G, Edelman GM. Connectivity and complexity: the relationship between neuroanatomy and brain dynamics. Neural Netw. 2000; 13(8–9): 909–22.
15. Bassett DS, Sporns O. Network neuroscience. Nat Neurosci. 2017; 20(3): 353–64.
16. Bressler SL, Menon V. Large-scale brain networks in cognition: emerging methods and principles. Trends Cogn Sci. 2010; 14(6): 277–90.
17. Lopes da Silva F. EEG and MEG: Relevance to Neuroscience. Neuron. 2017; 80(5): 1112–28.
18. Raichle ME. The restless brain: how intrinsic activity organizes brain function. Philos Trans R Soc Lond B Biol Sci. 2015; 370(1668).
19. Kanda PA de M, Anghinah R, Smidth MT, Silva JM. The clinical use of quantitative EEG in cognitive disorders. Dement Neuropsychol; 2009; 3: 195–203.
20. Higgins J, Green S, (editors). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. Cochrane Collab. 2011.
21. Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gotzsche PC, Ioannidis JPA, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. J Clin Epidemiol. 2009; 62(10): e1-34.
22. Reeves B, Deeks J, Higgins J, Wells G. Chapter 13: Including non-randomized studies. In: Higgins JPT, Green S (editors), Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. Cochrane Collab. 2011.
23. Downs SH, Black N. The feasibility of creating a checklist for the assessment of the methodological quality both of randomised and non-randomised studies of health care interventions. J Epidemiol Community Health. 1998; 52(6): 377–84.
24. Lopez de Argumedo M, Reviriego E, Rico R, Sobradillo N, Hurtado de Saracho I. Revisión externa y validación de instrumentos metodológicos para la Lectura Crítica y la síntesis de la evidencia científica. Madrid Serv Evaluación Tecnol Sanit del País Vasco. 2006; Report No.2.
25. Soikkeli R, Partanen J, Soininen H, Pääkkönen A, Riekkinen P. Slowing of EEG in Parkinson’s disease. Electroencephalogr Clin Neurophysiol. 1991; 79(3): 159–65.
26. Garcia-Mas A, Rosinol-Far A, Roca-Bennasar M, Llinas J, Rossello-Mir J. Frontal lobe involvement and cortical and subcortical deterioration in Parkinson’s disease evaluated using quantified electroencephalography. Arch Neurobiol (Madr). 1991; 54(6): 303–10.
27. Pin JC, Neau JP, Paquereau J, Rostykus C, Guehl D, Aubert I, et al. [Comparative study by computerized EEG of dementia of the ALzheimer type and Parkinson’s disease with dementia]. NeurophysiolClin. 1992; 22(0987–7053): 301–12.
28. Primavera A, Novello P. Quantitative electroencephalography in Parkinson’s disease, dementia, depression and normal aging. Neuropsychobiology. 1992; 25(2): 102–5.
29. Stanzione P, Marciani MG, Maschio M, Bassetti MA, Spanedda F, Pierantozzi M, et al. Quantitative EEG changes in non-demented Parkinson’s disease patients before and during L-dopa therapy. Eur J Neurol. 1996; 3(4): 354–62.
30. Bonanni L, Thomas A, Tiraboschi P, Perfetti B, Varanese S, Onofrj M, et al. EEG comparisons in early Alzheimer’s disease, dementia with Lewy bodies and Parkinson’s disease with dementia patients with a 2-year follow-up. Brain. 2008 Mar; 131(3): 690–705.
31. Pugnetti L, Baglio F, Farina E, Alberoni M, Calabrese E, Gambini A, et al. EEG evidence of posterior cortical disconnection in PD and related dementias. Int J Neurosci. 2010; 120(2): 88–98.
32. Babiloni C, De Pandis MF, Vecchio F, Buffo P, Sorpresi F, Frisoni GB, et al. Cortical sources of resting state electroencephalographic rhythms in Parkinson’s disease related dementia and Alzheimer’s disease. Clin Neurophysiol. 2011; 122(12): 2355–64.
33. Melgari JM, Curcio G, Mastrolilli F, Salomone G, Trotta L, Tombini M, et al. Alpha and beta EEG power reflects L-dopa acute administration in Parkinsonian patients. Front Aging Neurosci. 2014; 6(Oct).
34. Neufeld MY, Blumen S, Aitkin I, Parmet Y, Korczyn AD. EEG frequency analysis in demented and nondemented Parkinsonian patients. Dement Geriatr Cogn Disord. 1994; 5(1): 23–8.
35. Fogelson N, Kogan E, Korczyn A, Giladi N, Shabtai H, Neufeld M. Effects of rivastigmine on the quantitative EEG in demented Parkinsonian patients. Acta Neurol Scand. 2003; 107(4): 252–5.
36. Stam KJ, Tavy DL, Jelles B, Achtereekte HA, Slaets JP, Keunen RW. Non-linear dynamical analysis of multichannel EEG: clinical applications in dementia and Parkinson’s disease. Brain Topogr. 1994; 7(2): 141–50.
37. Stam C, Jelles B, Achtereekte H, Rombouts S, Slaets J, Keunen R. Investigation of EEG non-linearity in dementia and Parkinson’s disease. Electroencephalogr Clin Neurophysiol. 1995; 95(5): 309–17.
38. Jelles B, Achtereekte HA, Slaets JP, Stam CJ. Specific patterns of cortical dysfunction in dementia and Parkinson’s disease demonstrated by the acceleration spectrum entropy of the EEG. ClinElectroencephalogr. 1995; 26(0009–9155): 188–92.
39. Sandmann M, Piana E, Sousa D, De Bittencourt P. Digital EEG with brain mapping in Alzheimer’s dementia and Parkinson’s disease. A prospective controlled study. Arq Neuropsiquiatr. 1996; 54(1): 50–6.
40. Fonseca L, Tedrus G, Letro G, Bossoni A. Dementia, mild cognitive impairment and quantitative EEG in patients with Parkinson’s disease. Clin EEG Neurosci. 2009; 40(3): 168–72.
41. Fonseca L, Tedrus G, Carvas P, Machado E. Comparison of quantitative EEG between patients with Alzheimer’s disease and those with Parkinson’s disease dementia. Clin Neurophysiol. 2013; 124(10): 1970–4.
42. Muller V, Lutzenberger W, Pulvermuller F, Mohr B, Birbaumer N. Investigation of brain dynamics in Parkinson’s disease by methods derived from nonlinear dynamics. Exp brain Res. 2001; 137(1): 103–10.
43. Tanaka H, Koenig T, Pascual-Marqui RD, Hirata K, Kochi K, Lehmann D. Event-related potential and EEG Parkinson’s disease without and with dementia. Dement Geriatr Cogn Disord. 2000; 11(1): 39–45.
44. Serizawa K, Kamei S, Morita A, Hara M, Mizutani T, Yoshihashi H, et al. Comparison of quantitative EEGs between Parkinson disease and age-adjusted normal controls. J Clin Neurophysiol 2008; 25(6): 361–6.
45. Kamei S, Morita A, Serizawa K, Mizutani T, Hirayanagi K. Quantitative EEG analysis of executive dysfunction in Parkinson disease. J Clin Neurophysiol. 2010; 27(3): 193–7.
46. Morita A, Kamei S, Mizutani T. Relationship between slowing of the EEG and cognitive impairment in Parkinson disease. J Clin Neurophysiol. 2011; 28(4): 384–7.
47. Pezard L, Jech R, Růžička E. Investigation of non-linear properties of multichannel EEG in the early stages of Parkinson’s disease. Clin Neurophysiol. 2001; 112(1): 38.
48. Gagnon J-F, Fantini ML, Bédard M, Petit D, Carrier J, Rompré S, et al. Association between waking EEG slowing and REM sleep behavior disorder in PD without dementia. Neurology. 2004; 62(3): 401–6.
49. Silberstein P, Pogosyan A, Kuhn AA, Hotton G, Tisch S, Kupsch A, et al. Cortico-cortical coupling in Parkinson’s disease and its modulation by therapy. Brain. 2005; 128(Pt 6): 1277–91.
50. Caviness JN, Hentz JG, Evidente VG, Driver-Dunckley E, Samanta J, Mahant P, et al. Both early and late cognitive dysfunction affects the electroencephalogram in Parkinson’s disease. Park Relat Disord. 2007; 13(6): 348–54.
51. Klassen BT, Hentz JG, Shill HA, Driver-Dunckley E, Evidente VGH, Sabbagh MN, et al. Quantitative EEG as a predictive biomarker for Parkinson disease dementia. Neurology. 2011; 77(2): 118–24.
52. George JS, Strunk J, Mak-Mccully R, Houser M, Poizner H, Aron AR. Dopaminergic therapy in Parkinson’s disease decreases cortical beta band coherence in the resting state and increases cortical beta band power during executive control. NeuroImage Clin. 2013; 3: 261–70.
53. Lainscsek C, Hernandez ME, Weyhenmeyer J, Sejnowski TJ, Poizner H. Non-linear dynamical analysis of EEG time series distinguishes patients with Parkinson’s disease from healthy individuals. Front Neurol. 2013; 4(Dec): 1–8.
54. Caviness JN, Hentz JG, Belden CM, Shill HA, DriverDunckley ED, Sabbagh MN, et al. Longitudinal EEG changes correlate with cognitive measure deterioration in Parkinson’s disease. J Parkinsons Dis. 2015; 5(1): 117–24.
55. Moazami-Goudarzi M, Sarnthein J, Michels L, Moukhtieva R, Jeanmonod D. Enhanced frontal low and high frequency power and synchronization in the resting EEG of Parkinsonian patients. Neuroimage. 2008; 41(3): 985–97.
56. Bousleiman H, Zimmermann R, Ahmed S, Hardmeier M, Hatz F, Schindler C, et al. Power spectra for screening Parkinsonian patients for mild cognitive impairment. Ann Clin Transl Neurol. 2014; 1(11): 884–90.
57. Benz N, Hatz F, Bousleiman H, Ehrensperger MM, Gschwandtner U, Hardmeier M, et al. Slowing of EEG background activity in Parkinson’s and Alzheimer’s disease with early cognitive dysfunction. Front Aging Neurosci. 2014; 6(Nov): 314.
58. Zimmermann R, Gschwandtner U, Hatz F, Schindler C, Bousleiman H, Ahmed S, et al. Correlation of EEG slowing with cognitive domains in nondemented patients with Parkinson’s disease. Dement Geriatr Cogn Disord. 2015; 39(3–4): 207–14.
59. Han CX, Wang J, Yi GS, Che YQ. Investigation of EEG abnormalities in the early stage of Parkinson’s disease. Cogn Neurodyn. 2013; 7(4): 351–9.
60. Gu Y, Chen J, Lu Y, Pan S. Integrative Frequency Power of EEG Correlates with Progression of Mild Cognitive Impairment to Dementia in Parkinson’s Disease. Clin EEG Neurosci. 2014; (1838).
61. Pugnetti L, Baglio F, Farina E, Alberoni M, Calabrese E, Gambini A, et al. EEG evidence of posterior cortical disconnection in PD and related dementias. Int J Neurosci. 2010; 120(2): 88–98.
62. England A, Schwab R, Peterson E. The electroencephalogram in Parkinson’s syndrome. Electroencephalogr Clin Neurophysiol. 1959; 11: 723–31.
63. Sirakov A, Mezan I. EEG findings in Parkinsonism. Electroencephalogr Clin Neurophysiol. 1963; 15: 321–2.
64. Yeager C, Alberts W, Denature L. Effect of stereotaxic surgery upon electroencephalographic status of Parkinsonian patients. Neurology. 1966; 16: 904–910.
65. De Weerd A, Perquin W, Jonkman E. Role of the EEG in the prediction of dementia in Parkinson’s disease. Dementia. 1990; 1(2): 115–8.
66. Neufeld MY, Inzelberg R, Korczyn AD. EEG in demented and non-demented Parkinsonian patients. Acta Neurol Scand. 1988; 78(1): 1–5.
67. Kotini A, Anninos P, Adamopoulos A, Prassopoulos P. Low-frequency MEG activity and MRI evaluation in Parkinson’s disease. Brain Topogr. 2005; 18(1): 59–63.
68. Bosboom JLW, Stoffers D, Stam CJ, van Dijk BW, Verbunt J, Berendse HW, et al. Resting state oscillatory brain dynamics in Parkinson’s disease: An MEG study. Clin Neurophysiol. 2006; 117(11): 2521–31.
69. Stoffers D, Bosboom JLW, Deijen JB, Wolters EC, Berendse HW, Stam CJ. Slowing of oscillatory brain activity is a stable characteristic of Parkinson’s disease without dementia. Brain. 2007; 130(7): 1847–60.
70. Olde Dubbelink KTE, Stoffers D, Deijen JB, Twisk JWR, Stam CJ, Berendse HW. Cognitive decline in Parkinson’s disease is associated with slowing of resting-state brain activity: A longitudinal study. Neurobiol Aging. 2013; 34(2): 408–18.
71. Caviness JN, Utianski RL, Hentz JG, Beach TG, Dugger BN, Shill HA, et al. Differential spectral quantitative electroencephalography patterns between control and Parkinson’s disease cohorts. Eur J Neurol. 2016; 23(2): 387–92.
72. Amzica F, Lopes Da Silva F. Cellular substrates of brain rhythms. In: Shomer D, Lopes Da Silva F E, editor. Electroencephalography. 6th edn. New York: Lippincott, Williams-and-Wilkins. 2009; p. 33–63.
73. Colgin LL. Mechanisms and functions of theta rhythms. Annu Rev Neurosci. 2013; 36: 295–312.
74. Klimesch W. alpha-band oscillations, attention, and controlled access to stored information. Trends Cogn Sci. 2012; 16(12): 606–17.
75. Schurmann M, Basar E. Functional aspects of alpha oscillations in the EEG. Int J Psychophysiol. 2001; 39(2–3): 151–8.
76. Capilla A, Schoffelen J-M, Paterson G, Thut G, Gross J. Dissociated alpha-band modulations in the dorsal and ventral visual pathways in visuospatial attention and perception. Cereb Cortex. 2014; 24(2): 550–61.
77. Jensen O, Gelfand J, Kounios J, Lisman JE. Oscillations in the alpha band (9-12 Hz) increase with memory load during retention in a short-term memory task. Cereb Cortex. 2002; 12(8): 877–82.
78. Zhang Y, Chen Y, Bressler SL, Ding M. Response preparation and inhibition: the role of the cortical sensorimotor beta rhythm. Neuroscience. 2008; 156(1): 238–46.
79. Grossberg S, Versace M. Spikes, synchrony, and attentive learning by laminar thalamocortical circuits. Brain Res. 2008; 1218: 278–312.
80. Gross J, Pollok B, Dirks M, Timmermann L, Butz M, Schnitzler A. Task-dependent oscillations during unimanual and bimanual movements in the human primary motor cortex and SMA studied with magnetoencephalography. Neuroimage. 2005; 26(1): 91–8.
81. Tallon-Baudry C, Bertrand O, Fischer C. Oscillatory synchrony between human extrastriate areas during visual short-term memory maintenance. J Neurosci. 2001; 21(20): RC177.
82. Sehatpour P, Molholm S, Schwartz TH, Mahoney JR, Mehta AD, Javitt DC, et al. A human intracranial study of long-range oscillatory coherence across a frontaloccipital-hippocampal brain network during visual object processing. Proc Natl Acad Sci USA. 2008; 105(11): 4399–404.
83. Donner TH, Siegel M, Oostenveld R, Fries P, Bauer M, Engel AK. Population activity in the human dorsal pathway predicts the accuracy of visual motion detection. J Neurophysiol. 2007; 98(1): 345–59.
84. Brovelli A, Ding M, Ledberg A, Chen Y, Nakamura R, Bressler SL. Beta oscillations in a large-scale sensorimotor cortical network: directional influences revealed by Granger causality. Proc Natl Acad Sci USA. 2004; 101(26): 9849–54.
85. Stoffers D, Bosboom JLW, Deijen JB, Wolters EC, Stam CJ, Berendse HW. Increased cortico-cortical functional connectivity in early-stage Parkinson’s disease: an MEG study. Neuroimage. 2008; 41(2): 212–22.
86. Bosboom JLW, Stoffers D, Wolters EC, Stam CJ, Berendse HW. MEG resting state functional connectivity in Parkinson’s disease related dementia. J Neural Transm. 2009; 116(2): 193–202.
87. Braak H, Del Tredici K, Rub U, de Vos R, Jansen-Steur E, Braak E. Staging of brain pathology related to sporadic Parkinson’s disease. Neurobiol Aging. 2003; 24(2): 197–211.
88. Caviness JN. Pathophysiology of Parkinson’s disease behavior--a view from the network. Parkinsonism Relat Disord. 2014; 20 Suppl 1: S39-43.
89. Gratwicke J, Jahanshahi M, Foltynie T. Parkinson’s disease dementia: a neural networks perspective. Brain. 2015; 138(Pt 6): 1454–76.
90. Utianski RL, Caviness JN, van Straaten ECW, Beach TG, Dugger BN, Shill HA, et al. Graph theory network function in Parkinson’s disease assessed with electroencephalography. Clin Neurophysiol. 2016; 127(5): 2228–36.
91. Stam CJ. Nonlinear dynamical analysis of EEG and MEG: review of an emerging field. Clin Neurophysiol. 2005; 116(10): 2266–301.
92. Nunez PL, Wingeier BM, Silberstein RB. Spatial-temporal structures of human alpha rhythms: theory, micro current sources, multiscale measurements, and global binding of local networks. Hum Brain Mapp. 2001; 13(3): 125–64.
93. Engedal K, Snaedal J, Hoegh P, Jelic V, Bo Andersen B, Naik M, et al. Quantitative EEG Applying the Statistical Recognition Pattern Method: A Useful Tool in Dementia Diagnostic Workup. Dement Geriatr Cogn Disord. 2015; 40(1–2): 1–12.
94. Bocanegra Y, Trujillo-Orrego N, Pineda D. [Dementia and mild cognitive impairment in Parkinson’s disease: a review]. Rev Neurol. 2014; 59(12): 555–69.
Recibido: 24 de enero de 2018
Aceptado: 10 de mayo de 2018
Correspondencia: Jairo Carmona jairo.carmona@udea.edu.co