NUTRICIÓN Y METABOLISMO EN EL PACIENTE ONCOLÓGICO
Patricia Savino Lloreda1
Resumen
El cáncer afecta seriamente el estado nutricional del paciente. La pérdida de peso, y principalmente de masa libre de grasa, puede ser de gran magnitud, como sucede cuando afecta órganos sólidos. Asimismo, se producen anormalidades metabólicas que impiden la adecuada utilización de los nutrientes, por lo cual es necesario ajustar, en forma individual, el plan de alimentación. Los efectos secundarios generados por los medicamentos anticancerosos dificultan aún más una alimentación adecuada. Un pobre estado nutricional limita el tratamiento, sea de quimioterapia o de radioterapia, pues aumenta la intolerancia, lo cual impide la administración de las dosis usuales o su aumento en magnitud o frecuencia. También el estado de desnutrición significa un mayor reconocido riesgo cuando se emprende un tratamiento quirúrgico.
La implementación del tratamiento médico nutricional (evaluación, diagnóstico, intervención, vigilancia y seguimiento) es fundamental para el manejo multimodal que requieren estos pacientes. La selección del tipo de soporte nutricional debe ser personalizada y su principal objetivo también debe estar encaminado a mejorar la calidad de vida. En muchos casos la fortificación de los alimentos, especialmente con proteína de alto valor biológico, logra mejorar el estado nutricional. Cuando esta no es suficiente, o sea aquella que cubre menos del 60% del requisito proteico-calórico diario, se deben considerar alternativas, como la nutrición entérica por sonda o la parenteral suplementaria.
Cuando el pronóstico de supervivencia es mayor de tres meses o cuando la localización del tumor o las alteraciones gastrointestinales impiden el empleo de la vía entérica, se sugiere la nutrición parenteral total, la cual, idealmente, debería ser ambulatoria. Hoy en día se considera que la nutrición y el ejercicio son factores fundamentales en el manejo de estos pacientes, y que no hay bases para considerar que alimentar al individuo es alimentar el tumor.
Palabras clave: cáncer, estado nutricional, terapia médica nutricional, tumor, caquexia, fortificación, nutrición entérica, nutrición parenteral
_______________________
1 ND, MBA. Miembro Asociado Academia Nacional de Medicina, Bogotá, D.C. Colombia
________________________
NUTRITION AND METABOLISM IN CANCER PATIENTS
Abstract
Cancer has profound effects on the nutritional status of patients. Depending on the location of the neoplasm, weight loss -mainly of fat-free mass- can be of great magnitude. This is the case when tumors are present in solid organs. In this type of cancer, there are metabolic abnormalities that prevent the proper utilization of nutrients, making it necessary to adjust the feeding plan. Furthermore, the side effects generated by anticancer drugs make it even more difficult to eat properly. Poor nutritional status limits the treatment of both chemo and radiotherapy as it increases the intolerance to appropriate feeding. Malnutrition makes the administration of adequate doses difficult, as well as increases their concentration or frequency. Malnutrition increases the risk of surgical treatment. The implementation of nutritional medical therapy (evaluation, diagnosis, intervention, monitoring and follow-up) is fundamental for the multimodal management required by these patients. The selection of the type of nutritional support should be personalized and its main objective should be aimed at improving the quality of life. Food fortification, especially with protein of high biological value, improves the adequacy of the nutritional management. When this is not enough (meaning when it covers less than 60% of the daily caloric protein requirement), alternative routes such as enteral feeding by tube or supplementary parenteral nutrition should be considered. In some cases, with prognosis greater than three months of survival and in whom the location of the tumor or the presence of gastrointestinal disorders prevent the use of the enteral route, total parenteral nutrition is suggested, which ideally should be ambulatory. Currently it is considered that both nutrition and exercise constitute a fundamental and integral part in the management of oncology patients and that there is no solid base to think that “feeding the patient is feeding the tumor”.
Keywords: Cancer, nutritional status, medical nutritional therapy, tumor, cachexia, fortification, enteral nutrition, parenteral nutrition
Introducción
El término ‘cáncer’ incluye varios tipos de tumores malignos que se desarrollan en diferentes partes del organismo, con consecuencias y manifestaciones clínicas diversas. La detección temprana y las diferentes modalidades de tratamiento incrementan tanto las posibilidades de curación como el tiempo de supervivencia.
La desnutrición asociada al cáncer tiende a evolucionar a caquexia por causas propias de la enfermedad,
por la edad, por la falta de una adecuada nutrición o por los efectos secundarios del tratamiento médico o quirúrgico. La desnutrición afecta desde 20% hasta más de 70% de los pacientes con cáncer (1).
En los pacientes con cáncer, el síndrome de inflamación sistémica se activa en grados diversos e impacta todas las vías metabólicas relevantes, incluyendo las de las proteínas, las grasas y los carbohidratos (2). Todos los tipos de tratamiento para esta enfermedad, como la cirugía, la radioterapia, la quimioterapia o los fármacos, afectan el estado nutricional y, a su vez, alteran la tolerancia a la alimentación o impiden una nutrición adecuada (3).
Investigaciones recientes, han demostrado que el estado nutricional, particularmente el de la masa celular corporal y, especialmente, el de la masa muscular, es un factor determinante de la toxicidad derivada del tratamiento para el cáncer (4-6). Cuando la intervención nutricional es temprana, los resultados pueden ser mejores, debido a que contribuye más a prevenir que a tratar la toxicidad del tratamiento (3).
Según la Organización Mundial de la Salud (OMS), en el 2015 murieron 8,8 millones de personas por cáncer en el mundo, siendo la segunda causa global de mortalidad (7). Los tipos de cáncer más comunes en los hombres son el de pulmón, el de próstata, el colorrectal, el hepático y el gástrico, mientras que, en la mujer, son el de seno, el colorrectal, el pulmonar, el de cuello uterino y el gástrico.
En Colombia, la mortalidad general por cáncer tiende a aumentar. La OMS calcula que, en nuestro país, el
17 % de todas las muertes en ambos sexos y a cualquier edad, se deben a cáncer (8). Con base en los registros de cáncer en la población y el informe de mortalidad proveniente del Instituto Nacional de Cancerología, la Organización Panamericana de la Salud (OPS) estima que anualmente se presentan 63.000 casos nuevos y se registran 33.000 muertes por cáncer (9). El mayor número de muertes se debe al cáncer de estómago (14,9 %), seguido por el de pulmón (12,3 %), el de próstata (7,3 %) y el de seno (6,2 %) (10).
Entre el 30 y el 50 % de las muertes por cáncer pueden prevenirse modificando los factores de riesgo con acciones tales como abolir el tabaquismo, reducir el consumo de alcohol, mantener un peso saludable, implementar un programa de ejercicio físico y abordar los factores de riesgo relacionados con la infección (7).
Anormalidades metabólicas
El cáncer afecta la bioquímica y las funciones metabólicas. Los tumores malignos pueden producir cambios en el gasto energético, en el metabolismo basal, en la preferencia por los alimentos como combustible, alteraciones en el sistema inmunológico y en la acción enzimática general o específica.
Tales anormalidades afectan el metabolismo de las proteínas, las grasas y los carbohidratos, y pueden generar desequilibrios de líquidos y electrolitos, alteraciones ácido-básicas y cambios en las concentraciones de vitaminas o minerales. Estas alteraciones pueden comprometer el estado nutricional, lo cual puede manifestarse inicialmente como pérdida de peso y avanzar con diferentes grados de intensidad hasta llegar a la caquexia.
El incremento en el gasto energético es leve, del orden de 100 a 300 kcal/día, lo cual significa una pérdida mensual de 0,5 a 1 kg de grasa o de masa muscular, y hasta 1 a 2,3 kg en caso de no compensarse en forma adecuada (11).
Existen diferentes mecanismos que desencadenan este estado hipermetabólico, entre los cuales el más importante es la actividad exagerada del ciclo de Cori. Otras alteraciones metabólicas son las de los macronutrientes, por ejemplo, el incremento del recambio proteico o la derivación de productos intermediarios de carbohidratos hacia vías lipogénicas (11).
Cambios en el metabolismo de los carbohidratos
La glucosa es la principal fuente energética del tumor y su mayor demanda puede llevar a un incremento de la glucosa hepática. Por ello, algunos pacientes con cáncer pueden presentar un incremento en la actividad del ciclo de Cori y mayor producción de glucosa, causada por la inhabilidad de oxidarla en forma efectiva (11,12).
Existen otras anormalidades en el metabolismo de los carbohidratos, como son:
- incremento en la gluconeogénesis a partir de aminoácidos, lactato y glicerol,
- incremento de la síntesis de glucosa,
- incremento en la degradación y el reciclado de la glucosa,
- disminución en el recambio y en la tolerancia a la glucosa y
- resistencia a la insulina
Cambios en el metabolismo de los lípidos
Los pacientes que presentan caquexia relacionada con el cáncer pierden cantidades importantes de tejido adiposo. Esto se atribuye más a un incremento en la lipólisis que a una disminución en la lipogénesis.
La pérdida de tejido adiposo puede ser causada por incremento en el recambio del glicerol y de los ácidos grasos. El factor de necrosis tumoral (Tumor Necrosis Factor, TNF), la interleucina 1 (IL-1) y el interferón gamma (IFN-γ) son las citocinas responsables de la disminución de la actividad de la lipasa de lipoproteínas y de la lipogénesis. El factor de movilización de lípidos (Lipid-Mobilising Factor, LMF) se encuentra en la sangre de los pacientes con la caquexia relacionada con cáncer, pero no en individuos sanos, n siquiera en aquellos sin cáncer, pero con inanición. Este factor puede inducir lipólisis mediante una mayor producción de adenosina monofosfato cíclica (12).
El perfil de lípidos de los pacientes con cáncer presenta las siguientes características:
- disminución de las lipoproteínas de alta densidad (High-Density Lipoprotein, HDL),
- disminución de las lipoproteínas de baja densidad (Low-Density Lipoproteins, LDL) y
- triglicéridos séricos relativamente elevados.
La hipertrigliceridemia se produce por disminución de la actividad de la lipasa de las lipoproteínas y por la acción de las citocinas (12).
Cambios en el metabolismo de las proteínas
En la atrofia muscular, la disminución de la síntesis proteica es un factor de relativa importancia, aunque influye más el aumento de la proteólisis.
En los pacientes con cáncer existe un cambio de prioridades: en lugar de favorecerse la síntesis de proteína muscular y la de otros tejidos para incrementar la síntesis hepática, se prioriza la producción de las proteínas de la fase aguda. Además, existen alteraciones del patrón sanguíneo de los aminoácidos y depleción de nitrógeno. El balance negativo de nitrógeno se debe a un mayor recambio de la proteína corporal total y de los aminoácidos.
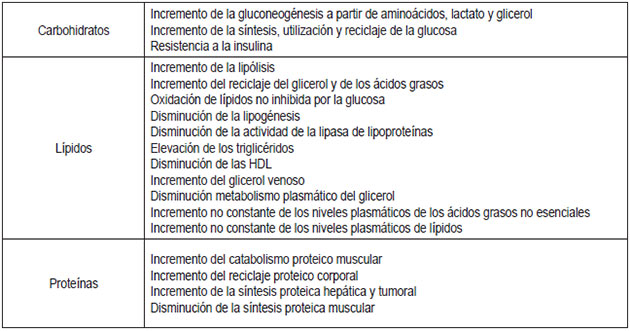
El TNF parece ser responsable de varios de los cambios proteicos relacionados con la desnutrición asociada al cáncer. En la Tabla 1 se resumen los efectos del cáncer sobre el metabolismo de los macronutrientes (11,12).
Efectos de las citocinas
Las citocinas son glucoproteínas solubles y péptidos de bajo peso molecular. Son mediadoras de interacciones entre las células, y regulan funciones tisulares y celulares. Contribuyen al crecimiento y a la dispersión del cáncer, haciendo que las células normales produzcan nuevas citocinas que continúan los procesos malignos. Las citocinas se han descrito como mediadoras de varias alteraciones metabólicas y son, en gran parte, responsables de la desnutrición que acompaña al cáncer (11,12) .
Sin embargo, es necesario tener en cuenta que el tratamiento antineoplásico también genera una serie de efectos secundarios que contribuyen al deterioro nutricional.
Tabla 1. Cambios metabólicos en el cáncer. |
Modificado de: Bozzetti F. Basics in clinical nutrition: Nutritional support in cancer. e-SPEN, the European e-Journal of Clinical Nutrition and Metabolism. 2010;5:e148-52. http://www.clinicalnutritionespen.com/article/S1751-4991(09)00065-1/pdf. Corresponde a la cita 11. Modificado de: Trujillo E, Nebeling L. Changes in carbohydrate, lipid,and protein metabolism in cancer. In: Elliot L, Molseed L, McCallum D, Grant B. editors. The Clinical Guide to Oncology Nutrition. Washington DC, Unite States of America: American Dietetic Association; 2006. p.17-27. Corresponde a la cita 12. |
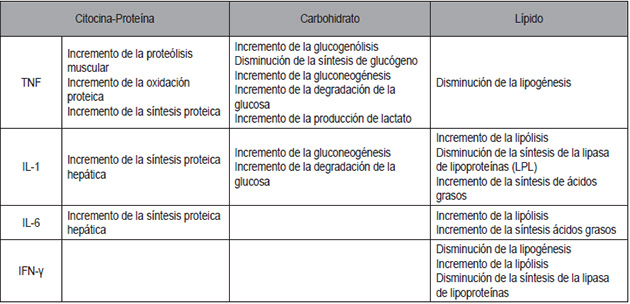
En la caquexia relacionada con el cáncer, las citocinas afectan la motilidad y el vaciamiento gástrico, debido a que alteran la percepción de saciedad. El TNF, la IL-6 y el IFN-γ disminuyen el apetito. En la Tabla 2 se resumen los efectos mediadores de las citocinas.
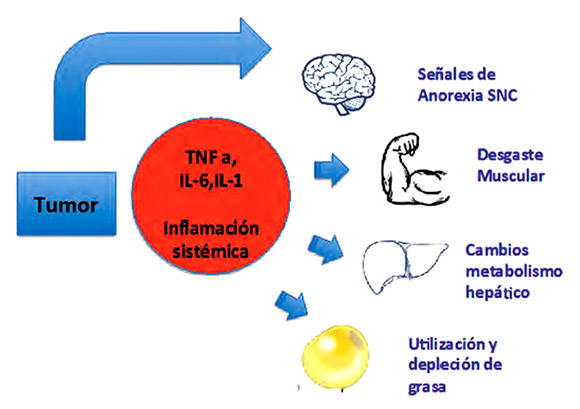
El tumor maligno secreta varios factores, algunos inflamatorios, que afectan las funciones del cerebro, el músculo, el hígado y el tejido graso. Se alteran las señales del sistema nervioso central y se produce anorexia, lo cual implica una menor ingestión energética. Se presenta atrofia muscular por el desequilibrio entre el anabolismo y el catabolismo, que se manifiesta por disminución de la masa y la fuerza muscular, y aumento de la fatiga. Se estimula la producción de las proteínas de la fase aguda en el hígado, por lo cual se reduce el metabolismo de los medicamentos (1) y se incrementa el riesgo de toxicidad secundaria al tratamiento por cáncer. Debido a que las citocinas estimulan el incremento de la lipólisis y causan lipogénesis defectuosa, hay agotamiento de las grasas en la reserva energética; se trata de una reacción mal adaptada y poco eficiente ante la escasa ingestión de alimentos (Figura 1) (1).
Caquexia relacionada con el cáncer
La caquexia es un síndrome multifactorial de desgaste que se asocia a diversas enfermedades, con pérdida involuntaria de peso y pérdida continua de masa muscular esquelética, con disminución del tejido graso o sin ella. Esta pérdida no es reversible con la nutrición convencional y puede llevar a deterioro funcional.
Cuando se compara con otras enfermedades, el cáncer presenta más probabilidades de producir desnutrición. La prevalencia global de la desnutrición se encuentra entre 8% y 84 %, según factores como el tipo de cáncer, la edad, el estadio de la enfermedad y el tratamiento (13). La localización del cáncer es un factor determinante del estado nutricional; por ejemplo, el 80 % de los casos de cáncer gastrointestinal y el 70% de los de cáncer de cabeza y cuello, se acompañan de algún tipo de desnutrición (14-17). La pérdida de peso es la manifestación más frecuente del desgaste nutricional y, cuando excede el 10 %, es de especial interés clínico e importancia pronóstica debido a que una pérdida de esta magnitud en cualquier enfermedad conduce a un aumento significativo de la morbimortalidad (13). La desnutrición es más frecuente en pacientes de la tercera edad que en los jóvenes que padecen la enfermedad.
Tabla 2. Efectos mediadores de las citocinas en los macronutrientes |
Modificado de: Bozzetti F. Basics in clinical nutrition: Nutritional support in cancer. e-SPEN, the European e-Journal of Clinical Nutrition and Metabolism. 2010;5:e148-52. http://www.clinicalnutritionespen.com/article/S1751-4991(09)00065-1/pdf. Corresponde a la cita 11. Modificado de: Trujillo E, Nebeling L. Changes in carbohydrate, lipid,and protein metabolism in cancer. In: Elliot L, Molseed L, McCallum D, Grant B. editors. The Clinical Guide to Oncology Nutrition. Washington DC, Unite States of America: American Dietetic Association; 2006. p.17-27. Corresponde a la cita 12. |
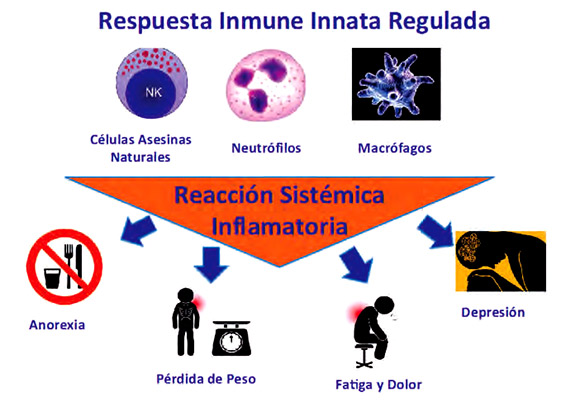
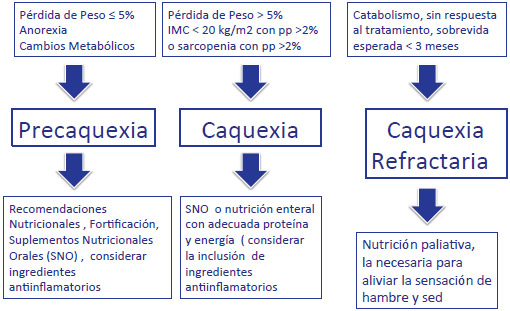
La desnutrición relacionada con el cáncer es un proceso multimodal, puesto que son diversos los factores que actúan en conjunto para disminuir la ingestión energética, incrementar las necesidades proteicocalóricas, disminuir varios estímulos anabólicos y alterar el metabolismo en los diferentes tejidos y órganos (1). La reacción inmunológica innata se encuentra regulada por las células asesinas naturales, los neutrófilos y los macrófagos que influyen en la reacción sistémica inflamatoria, la cual, a su vez, puede desencadenar anorexia, pérdida de peso y funcionalidad, dolor, fatiga y depresión (Figura 2). La combinación de la pérdida de peso con la anorexia y cualquiera de los otros factores (disminución de la ingesta, pérdida de masa muscular, disminución de la fuerza, alteraciones de los parámetros bioquímicos) son desencadenantes de la caquexia. Un abordaje multimodal es la mejor opción para el manejo de las múltiples facetas de la caquexia. Esto se hace a través de la colaboración interdisciplinaria del oncólogo, el nutricionista clínico, los equipos de cuidado paliativo y algún especialista de referencia, como puede ser el gastroenterólogo. Es importante tener en cuenta, que las fuerzas impulsoras del crecimiento tumoral y de las metástasis son las mismas que subyacen en la caquexia; por lo tanto el tratamiento debe ser concomitante. En la fase final de la caquexia, esta se vuelve refractaria a la intervención terapéutica y se encuentra impulsada por una enfermedad progresiva que ya no responde a la terapia antineoplásica; los pacientes con frecuencia se encuentran emaciados y la muerte se vuelve inminente. En la caquexia refractaria, la intervenciones médicas pueden ser fútiles o inapropiadas (Figura 3). Por ejemplo, la intervención nutricional con nutrición parenteral debe hacerse en aquellos pacientes en quienes se espere una sobrevida mayor a dos meses. Por lo tanto, es necesario establecer, indicadores pronósticos firmes de cuando el paciente entra a una fase terminal, para de esta manera limitar el daño potencial de terapias agresivas anticancerosas o anti-caquécticas (18).
Figura 1. Efectos del tumor en los diferentes órganos. |
Modificado: Arends J, Baracos V, Bertz H, Bozzetti F, Deutz N, Erickson N , et al. ESPEN expert group recommendations for action against cancer-related malnutrition. Clin Nutr. 2017;36:1187-96. http://dx.doi.org/10,1016/j.clnu,2017,06,017. |
Figura 2. Reacción inflamatoria sistémica: causas y efectos del tumor |
Modificado: Arends J, Baracos V, Bertz H, Bozzetti F, Deutz N, Erickson N , et al. ESPEN expert group recommendations for action against cancer-related malnutrition. Clin Nutr. 2017;36:1187-96. http://dx.doi.org/10.1016/j.clnu.2017.06.017. Corresponde a la cita 1. |
Atención nutricional y tratamiento médico nutricional
El proceso de atención nutricional (Nutrition Care Process) fue desarrollado por la American Dietetic Association (ADA) en el 2002, con el objeto de proporcionar un método sistemático de pensamiento crítico y tomar decisiones que proporcionen una atención nutricional segura y efectiva (19).
El proceso de atención nutricional consta de las siguientes cuatro etapas:
- evaluación nutricional,
- diagnóstico nutricional,
- intervención nutricional y
- vigilancia y seguimiento.
La ADA define el tratamiento médico nutricional como una serie de actividades planeadas y desarrolladas mediante un proceso consultivo que incorpora el conocimiento actual del profesional y la investigación disponible, y que establece el nivel, el contenido y la frecuencia del proceso de atención nutricional para una enfermedad o condición (20).
Evaluación nutricional
La identificación de los pacientes en riesgo nutricional se basa inicialmente en la disminución del índice de masa corporal (IMC) y una historia de pérdida de peso. Un enfoque basado únicamente en el peso es cada vez menos efectivo ante la epidemia global de obesidad y el nuevo conocimiento sobre alteraciones metabólicas que se presentan antes que los cambios de peso corporal.
La valoración global subjetiva con adición del puntaje generado por el paciente (Patient-Generated Subjective Global Assessment, PG-SGA), es el método ideal para evaluar el estado nutricional del paciente (21).
En este formato del PG-SGA, se puede observar que los cuadros del 1 al 4 deben ser diligenciados por el paciente o la información debe provenir directamente de él. Esta se encuentra relacionada de la siguiente manera:
- Información del peso corporal: se evalúa el peso actual y usual, 15 días, un mes o seis meses atrás.
- Ingestión de alimentos: cambios en la cantidad, la consistencia o la vía de administración (oral, entérica o parenteral).
- Sintomatología relacionada principalmente con el sistema digestivo y con alteraciones secundarias al tratamiento del cáncer, como vómito, diarrea, estreñimiento, mucositis, disgeusia, disfagia, xerostomía, alteraciones en el olor y el sabor de los alimentos y fatiga, entre otros.
- Actividad y funcionalidad: cambios evaluados en el mes anterior con respecto a la actividad diaria. Se evalúa si el paciente presenta limitaciones para realizar las actividades diarias y si se encuentra limitado a estar en una silla o en la cama. Los cuadros del 5 al 7 son elaborados por el profesional de la salud, quien debe contar con un entrenamiento previo para poder anotar con precisión las características del paciente. Una explicación breve de cada cuadro se encuentra a continuación.
- Enfermedades y relación con las necesidades nutricionales
- Demandas metabólicas que dependen de variables conocidas que incrementan las necesidades proteico-calóricas, como fiebre y uso de corticoides.
- Examen físico: incluye los tres aspectos de la composición corporal, grasa, músculo y estado de los líquidos corporales.
Figura 3. La Terapia Médica Nutricional depende de los requerimientos metabólicos y nutricionales de los pacientes, según la etapa del cáncer y el estado nutricional. |
Modificado: Arends J, Baracos V, Bertz H, Bozzetti F, Deutz N, Erickson N , et al. ESPEN expert group recommendations for action against cancer-related malnutrition. Clin Nutr. 2017;36:1187-96. http://dx.doi.org/10.1016/j.clnu.2017.06.017. Corresponde a la cita 1 |
El puntaje resultante se emplea para determinar la intervención nutricional específica, que incluye educación para el paciente y sus familiares, y manejo de la sintomatología. Para esto se requieren intervenciones farmacológicas y una intervención nutricional específica, que incluye modificaciones en la alimentación, fortificación, empleo de suplementos nutricionales, e indicaciones de nutrición entérica por sonda, nutrición parenteral o ambas.
La PG-SGA es un método de evaluación nutricional empleado a nivel internacional para tamización nutri
cional, evaluación, seguimiento y triage en los pacientes con cáncer. Como todo método, tiene ventajas y desventajas. Sus ventajas son: permitir la participación del paciente, agilizar la recolección de datos, incluir una lista de síntomas, identificarlos y calificarlos con base en el impacto nutricional; es fácil de usar y la clasificación permite el seguimiento de los resultados. Entre sus desventajas se encuentran la resistencia del profesional a practicar el examen físico, la percepción de que es un trabajo adicional y que, a veces, los pacientes no quieren llenar más formas (22).
Necesidades nutricionales
Por cuanto el cáncer y su tratamiento influyen profundamente en el estado nutricional del paciente, la desnutrición proteico-calórica aparece como el segundo diagnóstico más común (23,24). Hoy en día muchos de los pacientes con cáncer pueden presentar sobrepeso y obesidad, pero pueden sufrir sarcopenia, lo cual influye en la tolerancia de la dosis límite de la quimioterapia (25).
Estimación energética
La determinación de la necesidad calórica depende del gasto energético total, que incluye el basal y el asociado con la actividad diaria. Aunque se pueden emplear diferentes ecuaciones para predecir el gasto calórico, idealmente, la calorimetría indirecta debería ser el método de elección. Las fórmulas estándar, como la ecuación de Harris-Benedict y la de Mifflin-St. Jeor, son imprecisas debido a las alteraciones metabólicas y energéticas que se presentan según el tipo o el estadio del cáncer. En el cáncer avanzado, aunque el gasto energético basal se encuentra elevado, la fatiga y la inactividad física disminuyen el gasto energético total. Como la calorimetría indirecta es un método de difícil acceso en nuestro medio, puede hacerse un cálculo rápido del gasto energético total: entre 25 y 30 kcal por kg de peso. Cuando la actividad física es importante, se pueden utilizar los dispositivos portátiles para estimar la adición requerida por el ejercicio, a fin de evitar el déficit calórico.
La ingestión insuficiente de alimentos produce desnutrición crónica e inanición. Por otro lado, la sobrealimentación no es recomendable pues genera efectos metabólicos indeseables (2).
Según Bozzetti, et al., Bossola, et al., y las guías para los pacientes con cáncer de la ESPEN (European Society for Clinical Nutrition and Metabolism), no existe evidencia científica de que un soporte nutricional adecuado incremente el crecimiento del tumor en los seres humanos (2,26,27).
Necesidades proteicas
Diversos factores afectan las necesidades proteicas en casos de cáncer, entre ellos la menor reacción de la síntesis proteica al estímulo anabólico debido a la inflamación sistémica, la edad avanzada y la limitación de la actividad física; considerándolos, se recomiendan entre 1,2 g y 1,5 g diarios por kg de peso ideal o, si el paciente está desnutrido, por kg de peso actual (1,2,28,29). En los pacientes con cáncer de pulmón y caquexia mode
rada, la hiperaminoacidemia podría establecer una reacción proteica anabólica, a pesar de la resistencia a la insulina con intolerancia a la utilización de la glucosa y anabolismo proteico corporal (30). En cambio, el aporte diario de proteínas no debe ser mayor de 1,0 g/kg en casos de falla renal aguda, ni de 1,2 g/kg en los de falla renal crónica (31). En todos los casos, se debe indicar la necesidad de hacer ejercicio o de terapia física para mantener o generar masa muscular.
No existen estudios clínicos en pacientes con cáncer sobre la calidad de la proteína ni sobre aminoácidos específicos. Se ha dicho que el β-hidroxi-β-metilbutirato (HMB) en dosis diarias de 3 g puede disminuir el catabolismo proteico; sin embargo, este efecto es más claro en los jóvenes que no han tenido entrenamiento físico que en los adultos mayores (2).
El suplemento de glutamina está muy controvertido y solo se han reportado beneficios clínicos en un tercio de los estudios con glutamina por vía entérica y en la mitad de aquellos con glutamina por vía parenteral (32). En 11 de 15 estudios prospectivos o retrospectivos se observaron efectos positivos de este aminoácido en la mucositis de pacientes sometidos a quimioterapia, radioterapia o a ambas. Según la ESPEN, los estudios clínicos son insuficientes para recomendar el suplemento de glutamina durante la terapia convencional citotóxica, y algunos estudios clínicos aleatorios doble ciego muestran que dicho suplemento puede incrementar la tasa de recaída tumoral en pacientes con trasplante autólogo (2,33,34).
Necesidades de carbohidratos y grasas
La oxidación de los lípidos se mantiene o, incluso, se incrementa en aquellos pacientes con pérdida de peso y cáncer. En cambio, la resistencia a la insulina y la consecuente hiperglucemia hacen que los carbohidratos no sean la fuente energética de elección. Incluso, se ha recomendado cambiar la relación calórica, aumentando la proporción de calorías provenientes de la grasa, y reducir las de carbohidratos como se hace en una dieta cetogénica (35). A esto se le puede sumar el concepto de que muchos de los tumores dependen de la glucosa como su principal fuente de energía (36-38). En varios estudios sobre el metabolismo energético en pacientes con sarcoma y carcinoma, también se ha confirmado que el metabolismo energético de las células cancerosas depende de la glucosa, sin que las calorías derivadas de la grasa tengan contribución alguna (39-42). Además, se ha reportado un menor tiempo de supervivencia asociado a la elevación de los niveles de glucosa en pacientes con cáncer cerebral (43), y un peor pronóstico en casos de cáncer de cabeza y cuello (44), de cáncer de ovario (45) y de cáncer rectal (46).
Recordemos que, en la dieta cetogénica, entre el 60 y el 90 % de las calorías totales provienen de la grasa y, entre el 2 y el 15 %, de los carbohidratos. En teoría, esta dieta puede ser muy buena, pero llevarla a la práctica es difícil; en términos prácticos, la cantidad de carbohidratos correspondería solo a una tostada de pan con mermelada por día. La implementación de la dieta cetogénica requiere un equipo multidisciplinario para su seguimiento, el cual debe incluir, como mínimo, un médico, un nutricionista clínico especializado y la colaboración de la familia. La dieta alta en grasa tiene muchas restricciones y poca palatabilidad. Si se le ofrece al paciente que ya presenta rechazo a los alimentos; lo limita aún más socialmente y su implementación rutinaria es compleja, lo cual conlleva mayor pérdida de peso.
Este tipo de alimentación limita aún más la selección de alimentos, incrementa las complicaciones gastrointestinales y lleva a un mayor nivel de saciedad temprana. Se considera nutricionalmente inadecuada y requiere suplemento de multivitamínicos libres de carbohidratos, de oligoelementos, incluyendo calcio y selenio y, especialmente, de vitamina D. Finalmente, no existe evidencia científica de que la dieta cetogénica funcione en todos los pacientes con cáncer (47).
En 1914, Rous fue el primero en sugerir la restricción de alimentos para disminuir el crecimiento tumoral mediante la disminución del flujo sanguíneo al tumor (48). El concepto se extendió, en parte, debido a que el metabolismo en un individuo sano es diferente al de aquel que padece cáncer. Posteriormente se pudo determinar que el beneficio de restringir alimentos provenía de un menor aporte de carbohidratos, más que de un menor aporte energético total (35).
En casos de cáncer avanzado, cuando el paciente recibe quimioterapia y se encuentra malnutrido o en riesgo de perder peso, se recomienda el ácido ecoisapentaenoico (EPA), proveniente del aceite de pescado. Con su administración como suplemento, en dosis de 4 a
6 g diarios, se pretende estabilizar o mejorar el apetito, la ingestión de alimentos, la masa muscular magra y el peso corporal (2). En estudios clínicos aleatorizados, se estableció que se necesitaban, por lo menos, 2 g diarios para obtener beneficios clínicos (49). Esta última cantidad es más razonable, debido al sabor residual y a la intolerancia que produce el aceite de pescado.
Además, es necesario tener en cuenta que muchos de los pacientes con cáncer requieren una provisión calórica lenta y progresiva, con supervisión de los niveles sanguíneos de electrolitos, incluyendo el fósforo, para prevenir el síndrome de realimentación temprana (1,2).
Necesidades de vitaminas y minerales
En cualquier situación, de salud o de enfermedad, el principio que se debe seguir es que todas las personas deben recibir una alimentación balanceada, con la administración de todos los macronutrientes y micronutrientes necesarios. Se pueden presentar deficiencias de micronutrientes en diversas circunstancias, por ejemplo, cuando los aportes calóricos recomendados no se alcanzan, cuando los nutrientes no están balanceados o cuando las demandas nutricionales se encuentran aumentadas. Estas deficiencias se pueden observar tempranamente cuando un paciente se encuentra malnutrido. La American Cancer Society emitió la siguiente declaración: “en vista de la restricción dietética que presentan los pacientes con cáncer, el suplemento de multivitaminas y multiminerales que cubran la ingestión dietética de referencia (Dietary Reference Intakes, RDI) se considera como una medida segura y útil. Esto también se aplica a los pacientes con cáncer durante la quimioterapia o la radioterapia” (50). Se debe evitar suplir cantidades mayores de la recomendación diaria permitida de vitamina A en forma de β-caroteno, vitamina E y selenio.
En la nutrición entérica (por vía oral o por sonda) y en la parenteral se deben administrar todos los micronutrientes. Si la administración es por vía oral, se deben dar los suplementos necesarios según las deficiencias de micronutrientes detectadas en la anamnesis alimentaria. La mayoría de las fórmulas utilizadas en la nutrición entérica contienen las vitaminas y minerales requeridos en determinado volumen; debe evaluarse si se cumple el RDI en la alimentación ingerida. Si no es así, se debe agregar el suplemento de micronutrientes según las necesidades. En el caso de la nutrición parenteral, los viales de vitaminas y minerales se deben agregar diariamente, como sucede con otros pacientes bajo este régimen alimenticio (2).
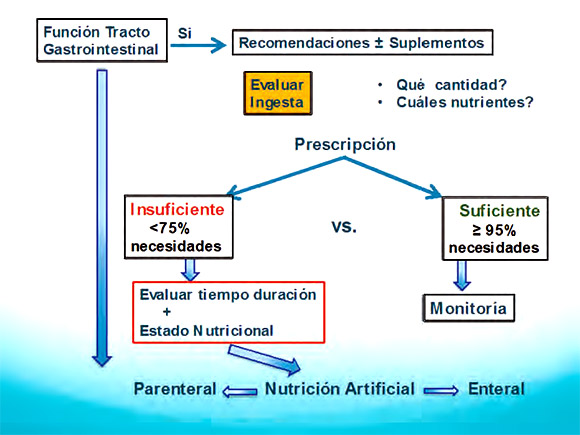
Formas de soporte nutricional Los pacientes con cáncer presentan diferentes dificultades para consumir los alimentos. Algunas se relacionan con la enfermedad y otras se deben al tratamiento anticanceroso o a las complicaciones derivadas de los dos anteriores. En la Figura 4, se presenta un algoritmo para la toma de decisiones basadas en la información disponible para seleccionar el tipo de soporte nutricional (13).
Soporte nutricional entérico
La alimentación con comida normal debe ser el método de elección para este tipo de pacientes. Una buena anamnesis alimentaria nos puede indicar las deficiencias nutricionales que se presentan. Inicialmente, se les debe brindar un régimen individualizado en el cual se sugieran las sustituciones de alimentos pertinentes, dependiendo de la tolerancia. La alimentación juega también un papel fundamental en la integración familiar y social, disminuyendo el aislamiento y la depresión. El fraccionamiento de la dieta, entre cinco y seis tomas por día, mejora la tolerancia. El consejo que se les puede dar es que coman cuando tengan hambre y se sientan bien, lo cual ocurre con mayor frecuencia en las horas de la mañana. Los alimentos deben seleccionarse escogiendo primero las fuentes proteicas y las fuentes calóricas más densas, para poder mejorar la cantidad y la calidad de la comida. Esta evaluación y las recomendaciones deben ser hechas por nutricionistas clínicos con experiencia en este tema.
Fortificación
Cuando el paciente no esté consumiendo la cantidad o la calidad requeridas, se debe tratar de comenzar con la fortificación de los nutrientes faltantes (2). El déficit más común es el de proteína. Esta puede agregarse mediante módulos, preferiblemente los de alto valor biológico, como el aislado de proteína de suero y el caseinato. En segundo término, se recomienda evaluar el consumo de micronutrientes, muchos de los cuales pueden estar en déficit por el bajo consumo proteico y por una dieta pobre durante un mediano o un largo plazo. Se debe determinar si es necesario el suplemento de vitaminas y minerales en su totalidad o en forma individual, para alcanzar la ingestión dietética de referencia.
Finalmente, si se presenta un déficit calórico pueden agregarse aceites vegetales, como el de oliva, el de canola o, incluso, triglicéridos de cadena media.
Como se había mencionado anteriormente, las fuentes de ácidos grasos omega-3 son una excelente alternativa, tanto energética como metabólica, pues, además de proveer calorías, tienen efectos antiinflamatorios y contribuyen a la ganancia de masa magra (51).
Suplemento con fórmulas entéricas orales
Las fórmulas nutricionalmente balanceadas también son una opción, pues contienen un aporte de calorías y nutrientes que puede contribuir con la nutrición del paciente. Generalmente, aportan 1 kcal/ml; sin embargo, existen fórmulas entéricas con mayor densidad calórica. Los suplementos por vía oral deben administrarse con la comida o entre las comidas, para evitar la disminución de ingestión de los alimentos normales (2). En su selección se deben contemplar las características y necesidades del paciente, el estadio del tumor y su localización. Muchos pacientes rechazan las fórmulas entéricas porque les parecen muy dulces y, otros, debido a la intolerancia gastrointestinal (distensión, diarrea, sensación de plenitud). Todo esto se debe tener en cuenta en el momento de seleccionar una fórmula entérica.
Nutrición entérica por sonda
Cuando el paciente continúe perdiendo peso o ingiera menos del 60 % (incluso, con suplementos orales) y su tubo digestivo sea funcional parcialmente o totalmente, se puede optar por emplear una sonda nasogástrica, nasoyeyunal o una gastroyeyunostomía, para poder alimentarlo apropiadamente (2). En términos generales, se pueden emplear fórmulas poliméricas, ricas en proteína, libres de lactosa, bajas en carbohidratos, y preferiblemente bajas en oligosacáridos, disacáridos, monosacáridos y polioles fermentables (Fermentable Oligosaccharides, Disaccharides, Monosaccharides and Polyols, FODMAP), y que correspondan a la ingestión dietética de referencia en volúmenes no tan altos (52). Las fórmulas deben variar y personalizarse según el grado de la lesión o la tolerancia gastrointestinal, y las alteraciones que dificulten la alimentación, como mucositis, úlceras, náuseas, vómito o diarrea
.
Nutrición parenteral
La nutrición parenteral debe reservarse para quienes no toleran el aporte de sus necesidades total o parcialmente por la vía entérica o cuyo pronóstico de supervivencia sea de dos meses o más (2). En algunos pacientes, se empleará la nutrición parenteral por lo que les resta de vida. La nutrición parenteral requiere un manejo cuidadoso para reducir el riesgo de complicaciones y es inapropiada cuando su riesgo es mayor que sus beneficios, o cuando el paciente o sus familiares no la desean. Se encuentra limitada cuando no existe un acceso venoso apropiado. Los accesos temporales pueden hacerse en una vena central, como la subclavia, la yugular interna o la femoral. Los accesos permanentes pueden ser un catéter ‘tunelizado’, un puerto o un catéter central con inserción periférica (Peripherally Inserted Central Catheter, PICC). La nutrición parenteral puede ser total o parcial. La nutrición parenteral total debe proveer aminoácidos a razón de 1,2 a 2 g/kg de peso corporal, emulsiones de lípidos con mezcla de grasas con aceite de pescado a razón de 0,5 a 1 g/kg de peso, y el aporte de glucosa puede iniciarse en 100 g diarios e irse incrementando según la tolerancia. El suplemento de vitaminas y minerales debe administrarse en viales, en forma diaria y cotidiana. La administración de nutrición parenteral total debe ser lenta y progresiva, para evitar el síndrome de realimentación (53).
La nutrición parenteral periférica puede ser una solución a corto plazo, mientras se decide sobre el mejor manejo. Sin embargo, en pacientes con tan mal estado nutricional, las características de la nutrición parenteral periférica, por ejemplo, su osmolaridad (600 a 900 mOsm/L), limitan el aporte de macronutrientes y contraindican la adición de micronutrientes, haciendo que este tipo de terapia sea costoso, riesgoso y poco eficiente.
Programa integrado de ejercicio físico
El ejercicio es parte de la terapia multimodal para el paciente con cáncer. Es una estrategia efectiva para mejorar la capacidad aeróbica, el patrón metabólico, la buena función y el estado físico. Infortunadamente, en los pacientes con cáncer hay inactividad o poca actividad física, lo cual disminuye aún más la masa muscular magra (54).
En diferentes estadios del cáncer, se sabe que el ejercicio físico es seguro y bien tolerado (55). El programa consiste en un entrenamiento de moderada intensidad en casa, de tres sesiones por semana, cada una con una duración entre 10 y 60 minutos. Sin embargo, el tipo y la intensidad del ejercicio deben indicarse según el paciente; para algunos consiste en motivarlos a hacer una caminata diaria con el objeto de reducir la atrofia muscular por inactividad física. Otros se benefician del entrenamiento con expertos y alcanzan una intensidad moderada, equivalente a 50 a 75 % de la frecuencia cardíaca máxima basal o de la capacidad aeróbica. Se recomienda agregar ejercicios de resistencia a los aeróbicos, para mantener la fuerza y la masa muscular.
Un estilo de vida saludable es fundamental para tratar de alcanzar un peso ideal. Ni la obesidad ni la subnutrición son recomendables. En los sobrevivientes de cáncer de seno o colorrectal, la obesidad puede ser un factor de riesgo para recurrencia de la enfermedad y reducción del tiempo de supervivencia. Por lo tanto, una vez terminado el tratamiento con quimioterapia o radioterapia, y tan pronto como sea posible, se debe iniciar un programa de ejercicio, aumentándolo en forma paulatina.
Soporte nutricional en el cáncer avanzado
El beneficio del soporte nutricional en casos de cáncer avanzado debe evaluarse considerando el pronóstico de la enfermedad, los potenciales beneficios del tratamiento anticanceroso disponible, el estado nutricional, los efectos de la terapia nutricional, y los deseos del paciente y sus familiares (56-58).
Los factores que se deben tener en cuenta son: el pronóstico del tiempo de supervivencia, la actividad tumoral y el estado inflamatorio (59). Si el tiempo de supervivencia alcanza meses o años, la actividad tumoral es baja y no hay reacción inflamatoria (proteína C reactiva menor de 10 mg/dl), el paciente debe
recibir un soporte nutricional que cumpla con las recomendaciones nutricionales proteicas y calóricas mediante los diferentes métodos disponibles (60). De esta manera, se disminuyen las alteraciones metabólicas y las complicaciones relacionadas con la desnutrición, y se mantienen un nivel de actividad adecuado y una buena calidad de vida. Se deben alcanzar las metas nutricionales dando el soporte por la vía que sea posible, sea entérica, con suplementos, por sonda nasogástrica o, incluso, con nutrición parenteral o mixta.
Cuando el tiempo de supervivencia sea menor de tres meses, o el paciente presente una enfermedad progresiva o exista una actividad inflamatoria sistémica, la intervención nutricional no debe ser invasiva y su objetivo primario es el soporte psicológico. Bajo estas circunstancias, la conducta es adecuar la alimentación diaria y los suplementos nutricionales, evitando causar efectos secundarios.
En los pacientes en estado terminal, se recomienda propender por su bienestar, y respetar sus creencias religiosas y culturales, lo cual incluye la decisión de evitar o retirar la nutrición artificial. No existe sensación de hambre cuando la persona está al borde de la muerte, y en caso de que se presente, se deben reevaluar las condiciones clínicas del paciente. La hidratación rutinaria no produce mejoría significativa (61-63). La deshidratación y los desequilibrios electrolíticos pueden producir estados de delirio, sin que esto dependa de la enfermedad actual. La nutrición artificial no debe emplearse para manejar la sed o la resequedad de la boca causada, generalmente, por los medicamentos o por la respiración bucal. Las medidas paliativas, como pequeños sorbos de agua y algodón humedecido, pueden ser buenas alternativas. Algunas veces, la presión de los familiares para proveer nutrición se puede disminuir mediante la administración de una solución de dextrosa al 5 % con un vial de vitaminas del complejo B para darle color y con ello tranquilizar a sus allegados.
Conclusión
El tratamiento médico nutricional del paciente con cáncer se requiere desde el mismo momento del diagnóstico de la enfermedad y puede extenderse desde meses hasta años. La evaluación nutricional temprana y detallada mejora la prescripción nutricional y las posibilidades de un tratamiento con mejores resultados.
El estado nutricional se encuentra retado por las alteraciones metabólicas generadas por la enfermedad, por los efectos secundarios del tratamiento anticanceroso, y por las dificultades para brindar una alimentación completa y balanceada. Alcanzar las necesidades proteicocalóricas es clave para obtener resultados positivos relevantes, aunque este objetivo no es fácil de lograr.
El aporte de vitaminas y minerales debe cumplir con el requisito mínimo diario y, en caso de que la dieta
sea insuficiente, se debe dar un suplemento. Las dietas cetogénicas, aunque están de moda en casos de cáncer, producen intolerancia grave y son poco aceptadas y cumplidas. El empleo de algunos nutrientes específicos, como la glutamina y los ácidos grasos omega 3 provenientes de aceites marinos, requiere de un mayor número de estudios clínicos que confirmen sus beneficios.
Los pacientes con cáncer deben tratarse tempranamente para evitar una desnutrición que evolucione a la caquexia y empeore su situación clínica. El cáncer, como otras enfermedades crónicas, requiere un tratamiento multimodal.
Conflicto de interés
La autora declara ser Asesor Científico de Boydorr Nutrition.
Figura 4. Toma de decisiones para seleccionar el tipo de soporte nutricional. |
Modificado : Ravasco P. Nutrition in cancer. In: Soeters P, Meir R, editors. The importance of nutrition as an integral part of disease management. Nestlé Nutr Inst Workshop Ser., vol 82, p. 91-102 (doi:10.1159/000382004) Nestec Ltd., Vevey/S.KargerAG, Basel, 2015. Ver: https://www.nestlenutrition-institute.org/docs/default-source/global-dcoument-library/publications/secured/e67b25a1e53b9b715d25e313de3d3070.pdf?sfvrsn=0 |
Referencias
1. 1. Arends J, Baracos V, Bertz H, Bozzetti F, Calder PC, Deutz N, Erickson N, et al. ESPEN expert group recommendations for action against cancer-related malnutrition. Clin Nutr. 2017;36:1187-96. http://dx.doi.org/10.1016/j.clnu.2017.06.017.
2. Arends J, Bachman P, Baracos V, Barthelemy N, Bertz H, Bozzetti F, et al. ESPEN guidelines on nutrition in cancer patients. Clin Nutr. 2017;36(1): 11-48.
3. Laviano A, Molfino A, Rossi F. Cancer-treatment toxicity: can nutrition help? Nat Rev Clin Oncol. 2012;9: doi: 10.1038/nrclinonc.2012.99-c1. Epub 2012 Sep 25.
4. Laviano A, Rossi F. Toxicity in chemotherapy--when less is more. N Engl J Med. 2012;366:2319-20.
5. Prado C, Baracos V, McCargar L, Reiman T, Mourtzakis M, Tonkin K, et al. Sarcopenia as a determinant of chemotherapy toxicity and time to tumor progression in metastatic breast cancer patients receiving capecitabine treatment. Clin Cancer Res. 2009;15:2920-6.
6. Mir O, Coriat R, Blanchet B, Durand J, Boudou-Rouquetee P, Michels J, et al. Sarcopenia predicts early dose-limiting toxicities and pharmacokinetics of sorafenib in patients with hepatocellular carcinoma. PLoS One. 2012; 7: e37563.
7. World Health Organization. Cancer. WHO, 2017. Fecha de consulta: 17 de septiembre de 2017. Disponible en: http://www.who.int/cancer/en/.
8. World Health Organization. Colombia. WHO, 2014. Fecha de consulta: 17 de septiembre de 2017. Disponible en: https://www.google.com.co/url?sa=t&rct=j&q=&esrc=s&source=web&cd=2&cad=rja&uact=8&ved=0ahUKEwjVnP 3qnqzWAhXDNiYKHQ7fDBAQFggzMAE&url=http%3A%2F%2Fwww.who.int%2Fnmh%2Fcountries%2Fcol_en.p df&usg=AFQjCNGN4MjjzjXTQzPvGZj3YbC2mkFwdQ.
9. PAHO. Colombia Cancer Profile. Colombia. Sociodemographic indicators. Fecha de consulta: 17 de septiembre de 2017. Disponible en: http://www.paho.org/hq/index.php?option=com_docman&task=doc_view&gid=22994 &Itemid=270&lang=en.
10. Ospina M, Huertas JA, Montaño J, Rivillas JC. Observatorio Nacional de Cancer Colombia. Rev Fac Nac SaludPública. 2015;33:262-76.
11. Bozzetti F. Basics in clinical nutrition: Nutritional support in cancer. e-SPEN, the European e-Journal of Clinical Nutrition and Metabolism. 2010;5:e148-52. http://www.clinicalnutritionespen.com/article/S17514991(09)00065-1/pdf
12. Trujillo E, Nebeling L. Changes in carbohydrate, lipid, and protein metabolism in cancer. In: Elliot L, Molseed L, McCallum D, Grant B. editors. The Clinical Guide to Oncology Nutrition. Washington DC, Unite States of America: American Dietetic Association; 2006. p.17-27.
13. Ravasco P. Nutrition in cancer. In: Soeters P, Meir R, editors. The importance of nutrition as an integral part of disease management. Nestlé Nutr Inst Workshop Ser., vol 82, p. 91-102 (doi:10.1159/000382004. Nestec Ltd., Vevey/S.KargerAG, Basel, 2015. Ver: https://www.nestlenutrition-institute.org/docs/default-source/global-dcoument-library/publications/secured/e67b25a1e53b9b715d25e313de3d3070.pdf?sfvrsn=0
14. Dewys WD, Begg C, Lavin PT, Bennett JM, Band PR, Bertino JR, et al. Prognostic effect of weight loss prior to chemotherapy in cancer patients. Eastern Cooperative Oncology Group. Am J Med. 1980:69: 491-7.
15. Bozzetti F. Rationale and indications for preoperative feeding of malnourished surgical patients. Nutrition. 2002;18:953-9.
16. Huhmann M, August D. Surgical oncology. In Marian MS, Roberts S, editors. Clinical Nutrition for Oncology Patients. Sudbury, MA: Jones and Barlett Publishers; 2010. p.101-36.
17. Goodwin WJ Jr, Torres J, The value of the prognostic nutritional index in the management of patients with advance carcinoma of the head and neck. Head Neck Surg. 1984;6:932-7.
18. Baracos V, Martin L, Korc M, Guttridge D, Fearon K. Cancer-associated cachexia. Nat Rev Dis Primers. 2018; 4:17105. doi:10.1038/nrdp.2017.105.Review. PMID:29345251.
19. Lacey K, Pritchett E. Nutrition Care Process and model: ADA adopts road map to quality care and outcomes management. J Am Diet Assoc. 2003;103:1061-72.
20. Splett P. Developing and validating evidence-bases guides for practice: A tool kit for dietetics professionals. Chicago, III: American Dietetic Association; 1999.
21. Jager-Wittenaar H, Ottery FD. Assessing nutritional status in cancer: Role of the Patient-Generated Subjective Global Assessment. Curr Opin Clin Nutr Metab Care. 2017;20:322-9.
22. Davis P. Nutrition screening and assessment in oncology. . In: Elliot L, Molseed L, McCallum D, Grant B. editors. The Clinical Guide to Oncology Nutrition. Washington DC, Unite States of America: American Dietetic Association; 2006. p.44-53.
23. Planas M, Álvarez-Hernández J, León-Sanz M, CelayaPérez S, Araújo K, García A, et al. Prevalence of hospital malnutrition in cancer patients: A sub-analysis of the PREDyCES® study. Support Care Cancer. 2016; 24:429-35.
24. Gyan E, Raynard B, Durand JP, Lacau Saint Guily J, Gouy S, Movschin ML, et al. Malnutrition in patients with cancer: Comparison of perceptions by patients, relatives, and physicians-Results of the NutriCancer 2012 J Parenter Enteral Nutr. 2018: 42(1):255-60.
25. Anandavadivelan P, Brismar TB, Nilsson M, Johar AM, Martin L. Sarcopenic obesity: A probable risk factor for dose limiting toxicity during neo-adjuvant chemotherapy in oesophageal cancer patients. Clin Nutr. 2016;35:72430.
26. Bozzetti F, Mori V. Nutritional support and tumor growth in humans: A narrative review of the literature. Clin Nutr. 2009;28:226-30.
27. Bossola M, Pacelli F, Rosa F, Tortorelli A, Doglietto GB. Does nutrition support stimulate tumor growth in humans? Nutr Clin Pract. 2011;26:174-80.
28. Bauer J, Biolo G, Cederholm T, Cesari M, Cruz-Jentoft AJ, Morley JE, et al. Evidence-based recommendations for optimal dietary protein intake in older people: A position paper from the PROT-AGE Study Group. J Am Med Dir Assoc. 2013;14:542- 59.
29. Bozzetti F. Tailoring the nutritional regimen in the elderly cancer patient. Nutrition. 2015;31:612-4.
30. Winter A, Macadams J, Chevalier S. Normal protein anabolic response to hyperaminoacidemia in insulinresistant patients with lung cancer caquexia. Clin Nutr. 2012;31:765-73.
31. Cano N, Fiaccadori E, Tesinky P, Toigo G, Druml W, DGEM (German Society for Nutritional Medicine), et al. ESPEN guidelines on enteral nutrition: Adult renal failure. Clin Nutr. 2006;25:295-310.
32. Kuhn K, Muscaritoli M, Wischmeyer P, Stehle P. Glutamine as indispensable nutrient in oncology: experimental and clinical evidence. Eur J Nutr. 2010;49:197-210.
33. Pytlyck R, Bebes P, Patorková, Chocenska E, Gregora E, Procházka B, et al. Stantardized parenteral alanylglutamine dipeptide supplementation is not beneficial in autologous transplant patients: a randomized, doubleblind, placebo controlled study. Bone Marrow Transplant. 2002;30:953-61.
34. Sykorova A, Horacek J, Zak P, Kmonicek M, Bucak J, Maly J. A randomized, double blind comparative study of
prophylactic parenteral nutrition support with or without glutamine in autologous stem cell transplantation for hematological malignancies --three years’ follow up. Neoplasma. 2005;52:476-82.
35. Bozzetti F, Zupec-Kania B. Toward a cancer-specific diet. Clin Nutr. 2016;35:1188-95.
36. Seyfried TN, Shelton LM, Mukherjee P. Does the existing standard of care increase glioblastoma energy metabolism? Lancet Oncol. 2010;11:811-3.
37. Seyfried TN. Cancer as a metabolic disease: on the origin, management, and prevention of cancer. Hoboken, NJ: Wiley; 2012. pp. 57-60
38. Klein S, Wolfe RR. Carbohydrate restriction regulates the adaptive response to fasting. Am J Physiol. 1992;262(5 Pt. 1):E631-6.
39. Burt ME, Norton JA, Brennan MF. The human tumorbearing limb: An ex vivo model. Surgery. 1980;87:12832.
40. Norton JA, Burt ME, Brennan MF. In vivo utilization of substrate by human sarcoma-bearing limbs. Cancer. 1980;45:2934-9.
41. Greschner M, Saeger HD, Barth H, Leweling H, Holm E. Balances of energy yielding substrates across malignant gastric tumours in man. Clin Nutr. 1991;10(Suppl.):12.
42. Holm E, Hagmüller E, Staedt U, Schlickeiser G, Günther HJ, Leweling H, et al. Substrate balances across colonic carcinomas in humans. Cancer Res. 1995;55:1373-8.
43. Derr RL, Ye X, Islas MU, Desideri S, Saudek CD, Grossman SA. Association between hyperglycemia and survival in patients with newly diagnosed glioblastoma. J Clin Oncol. 2009;27:1082-6. http://dx.doi.org/10.1200/JCO.2008.19.1098 [Epub 2009 Jan 12].
44. Kubicek GJ, Champ C, Fogh S, Wang F, Reddy E, Intenzo C, et al. FDG-PET staging and importance of lymph node SUV in head and neck cancer. Head Neck Oncol. 2010; 2:19. doi: 10.1186/1758-3284-2-19
45. Chung HH, Kwon HW, Kang KW, Park NH, Song YS, Chung JK, et al. Prognostic value of preoperative metabolic tumor volume and total lesion glycolysis in patients with epithelial ovarian cancer. Ann Surg Oncol. 2012;19:1966-72.
46. Saigusa S, Toiyama Y, Tanaka K, Okugawa Y, Fujikawa H, Matsushita K, et al. Prognostic significance of glucose transporter-1 (GLUT1. gene expression in rectal cancer after preoperative chemoradiotherapy. Surg Today. 2012;42:460-9.
47. Erickson N,Boscheri A, Linke B, Huebner J. Systematic review: Isocaloric ketogenic dietary regimes for cancer patients. Med Oncol. 2017;34:72.
48. Rous P. The influence of diet on transplanted and spontaneous mouse tumors. J Exp Med. 1914;20:433-51.
49. Fearon K, von Meyenfeldt MF, Mose AG, van Greene R, Roy A, Gouma DJ, et al. Effect of a protein and energy dense N-3 fatty acid enriched oral supplement on loss of weight and lean tissue in cancer cachexia: A randomised double blind trial. Gut. 2003;52:1479-86.
50. Norman HA, Butrum RR, Feldman E, Heber D, Nixon D, Picciano MF, et al. The role of dietary supplements during cancer therapy. J Nutr. 2003;133(Suppl.1):3794-9S.
51. Thompson K, Elliot L, Fuchs-Tarlovsky V, Levin RM, Voss AC, Piemonte T. Oncology evidence-based nutrition practice guideline for adults. J Acad Nutr Diet. 2017;117:297-310.
52. Savino P. Knowledge of constituent ingredients in enteral nutrition formulas can make a difference in patient response to enteral feeding Nut Clin Pract 2018; 33(1): 90 -98.
53. Stanga Z, Brunner A, Leuenberger M, Grimble RF, Shenkin A, Allison SP, et al. Nutrition in clinical practice-the refeeding syndrome: Illustrative cases and guidelines for prevention and treatment. Eur J Clin Nutr. 2008;62:68794.
54. Ferriolli E. Physical activity monitoring: A responsive and meaningful patient-centered outcome for surgery, chemotherapy, or radiotherapy? J Pain Symptom Manage. 2012;43:1025-35.
55. Jones LW, Alfano CM. Exercise-oncology research: Past, present, and future. Acta Oncol. 2013;52:195-215.
56. Bozzetti F, Santarpia L, Pironi L, Thul P, Klek S, Gavazzi C, et al. The prognosis of incurable cachectic cancer patients on home parenteral nutrition: A multi-centre observational study with prospective follow-up of 414 patients. Ann Oncol. 2014;25:487-93.
57. Druml C, Ballmer PE, Druml W, Oehmichen F, Shenkin A, Singer P, et al. ESPEN guideline on ethical aspects of artificial nutrition and hydration. Clin Nutr. 2016;35:54556. http://dx.doi.org/10.1016/j.clnu.2016.02.006
58. Fan BG. Parenteral nutrition prolongs the survival of patients associated with malignant gastrointestinal obstruction. J Parenter Enter Nutr. 2007;31:508-10.
59. Martin L, Watanabe S, Fainsinger R, Lau F, Ghosh S, Quan H, et al. Prognostic factors in patients with advanced cancer: Use of the patient-generated subjective global assessment in survival prediction. J Clin Oncol. 2010;28:4376-83.
60. Laird BJ, Kaasa S, McMillan DC, Fallon MT, Hjermstad MJ, Fayers P, et al. Prognostic factors in patients with advanced cancer: A comparison of clinicopathological factors and the development of an inflammation-based prognostic system. Clin Cancer Res. 2013;19:5456-64.
61. Bruera E, Hui D, Dalal S, Torres-Vigil I, Trumble J, Roosth J, et al. Parenteral hydration in patients with advanced cancer: A multicenter, double-blind, placebo-controlled randomized trial. J Clin Oncol. 2013;31:111-8.
62. Raijmakers NJ, van Zuylen L, Costantini M, Caraceni A, Clark J, Lundquist G, et al. Artificial nutrition and hydration in the last week of life in cancer patients. A systematic literature review of practices and effects. Ann Oncol. 2011;22:1478-86.
63. Good P, Cavenagh J, Mather M, Ravenscroft P. Medically assisted hydration for palliative care patients. Cochrane Database Syst Rev. 2008 Apr 16;(2):CD006273. doi: 10.1002/14651858.CD006273.pub2 .
Recibido:13 de diciembre de 2017
Aceptado: 9 de mayo de 2018
Correspondencia: Patricia Savino Lloreda • patricia.savino@gmail.com