RESPUESTA AUTOINMUNE EN INDIVIDUOS INFECTADOS POR EL VIRUS ZIKA (RAIZ)
Juan-Manuel Anaya1, Yhojan Rodríguez2, Carolina Ramírez-Santana3, Diana M. Monsalve3, Daniel Vega4, Ernesto Ojeda5, Mónica Rodríguez-Jiménez2, Yovana Pacheco3, Nicolás Molano-González6, Yeny Acosta-Ampudia3
Resumen
En el presente artículo se presenta una revisión de los principales resultados del proyecto RAIZ, acrónimo de “Respuesta autoinmune en individuos infectados por el virus Zika”, originado por dos eventos mutuamente relacionados, la asociación entre un virus emergente en el continente, el virus Zika (vZika), y una enfermedad neuromuscular poco prevalente en Colombia, el síndrome de Guillain-Barré. Después de la llegada del virus al país se observó que las zonas donde se reportaban brotes del virus, se documentaba un aumento en los casos de síndrome de Guillain-Barré y otros síndromes neurológicos, que generó un gran interés para entender los mecanismos subyacentes de la infección asociados con autoinmunidad neurológica. Mediante la realización del primer estudio de casos y controles de Zika, Guillain-Barré y otros síndromes neurológicos, se comprobó dicha asociación en Colombia. A lo largo del proyecto, además, se investigaron los principales mecanismos asociados, mediante estudios de seroprevalencia de otras infecciones, inmunológicos y genéticos
Palabras clave: Virus Zika, Síndrome de Guillain-Barré, Autoinmunidad, Mielitis transversa, Encefalitis, Purpura trombocitopenica autoinmune, Genética.
_______________________
1 MD, PhD, Centro de Estudio de Enfermedades Autoinmunes (CREA), Escuela de Medicina y Ciencias de la Salud, Universidad del Rosario. Miembro Correspondiente, Academia Nacional de Medicina, Bogotá, Colombia.
2 MD, Centro de Estudio de Enfermedades Autoinmunes (CREA), Escuela de Medicina y Ciencias de la Salud, Universidad del Rosario, Bogotá, Colombia.
3 MSc, PhD, Centro de Estudio de Enfermedades Autoinmunes (CREA), Escuela de Medicina y Ciencias de la Salud, Universidad del Rosario, Bogotá, Colombia.
4 MD, Unidad de Cuidado Intensivo, Méderi – Hospital Universitario Mayor, Bogotá, Colombia.
5 MD, Departamento de Neurologia, Méderi – Hospital Universitario Mayor, Bogotá, Colombia.
6 MSc, Centro de Estudio de Enfermedades Autoinmunes (CREA), Escuela de Medicina Ciencias de la Salud, Universidad del Rosario, Bogotá, Colombia.
________________________
AUTOINMUNE RESPONSE IN PEOPLE INFECTED WITH ZIKA VIRUS (RAIZ)
Abstract
This article presents a review of the main results of the RAIZ project, acronym of “Autoimmune response in individuals infected with the Zika virus”, originated by two mutually related events: the association between an emerging virus on the continent, the Zika virus (vZika), and a neuromuscular disease not very prevalent in Colombia, the Guillain-Barré syndrome. After the arrival of the virus in the country it was observed that in the areas of outbreaks an increase of cases of Guillain-Barré syndrome and other neurological syndromes was documented, which generated a great interest in the understanding of the underlying mechanisms of the infection associated with neurological autoimmunity. By conducting the first case-control study on Zika, Guillain-Barré and other neurological syndromes in Colombia, the association was verified. Throughout the project, the main associated mechanisms were addressed through analyses of other infections, immunological analysis and the first genome-wide association study.
Keywords: Zika virus, Guillain-Barré síndrome, autoimmunity, transverse mielitis, encephalitis, autoimmune thrombocytopenic purpura, genetics.
“Ich probiere”
Paul Ehrlich
Introduccion
En el año 2015 el mundo se vio enfrentado al renacer de una nueva epidemia por el virus del Zika (vZika), identificado inicialmente a mediados del siglo pasado en Uganda (1). El vZika pertenece al género Flavivirus, de la familia Flaviviridae, y transmitido por la picadura de mosquitos del género Aedes (los mismos que trasmiten la fiebre amarilla, el Dengue y el Chikungunya) (2). Pocos previeron lo que ocurriría durante el año siguiente.
La mayoría de las infecciones por el vZika son asintomáticas (75-80%) y aquellas con síntomas muestran una enfermedad leve después de un período de
incubación de 3 a 12 días (3,4). Los síntomas incluyen principalmente fiebre, conjuntivitis, exantema, artralgia y mialgias (3) (Figura 1). Sin embargo, el aumento inesperado de alteraciones y malformaciones neurológicas en fetos de madres gestantes e infectadas, así como el incremento del número de pacientes con síndrome de Guillain-Barré (SGB) (5), una enfermedad autoinmune (EAI) de los nervios periféricos, condujo, en febrero de 2016, a la Organización Mundial de la Salud a declarar la epidemia como una “emergencia de salud pública de importancia internacional”. Dicha declaratoria terminó el 18 de noviembre de 2016.
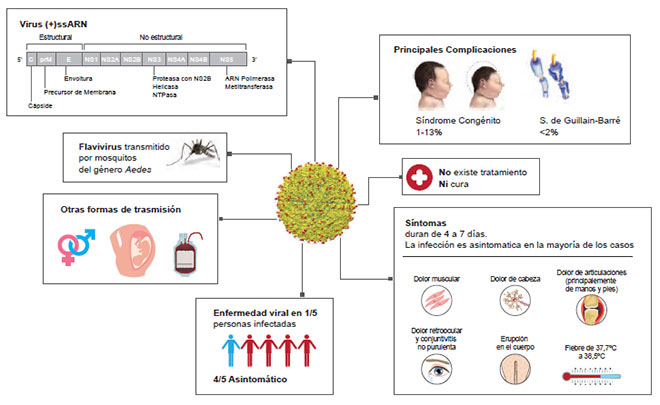 |
| Figura 1. Características del virus Zika y sus principales manifestaciones clínicas (3). |
Además del SGB (6), se han documentado asociaciones entre el vZika y otras EAI, como la purpura trombocitopenica idiopática (PTI) (7), y síndromes neurológicos diferentes al SGB, entre ellos encefalitis, y mielitis transversa (MT) (6,8). Estos últimos asociados con disfunción autonómica (hipertensión paroxística, disfunción de la vejiga y el intestino y anomalías de sudoración) la cual suele ser incapacitante, requiriendo estrecha vigilancia y manejo (9).
El aumento de los pacientes con SGB nos condujo a realizar un estudio multidisciplinario en Cúcuta, Norte de Santander, una de las ciudades más afectadas por todas las enfermedades que trasmiten los mosquitos Aedes, con el fin de evaluar la respuesta autoinmune en aquellos individuos infectados por el vZika (Proyecto RAIZ) (6), cuyos principales resultados son resumidos a continuación.
Proyecto RAIZ – estado del arte
Síndrome de Guillain BarréEl SGB es una enfermedad neurológica descrita hace más de 100 años, caracterizada por debilidad en las extremidades, generalmente en las piernas y luego en los brazos. Esta debilidad se debe a una afectación de los nervios periféricos, mediada por el sistema inmune. Por eso se considera una enfermedad autoinmune, que cumple con las premisas de tautología autoinmune (10). Muchos de los pacientes requieren estar hospitalizados en cuidados intensivos (11).
La etiología y la patogénesis permanecen en gran medida enigmáticas. En términos de etiología, a pesar de que el SGB esté relacionado con una infección previa, principalmente por Campylobacter jejuni, menos del 0,1% de las infecciones resultan en el síndrome (12).
En términos de patogénesis, se observan macrófagos activados y células T y anticuerpos séricos contra gangliósidos, pero su significado no está claro. Esta es una condición heterogénea con numerosos subtipos. Datos recientes apuntan hacia el papel de los epítopos gangliósidos. En última instancia, el síndrome resulta de un fondo genético permisivo sobre el cual los factores ambientales, incluyendo las infecciones, entre otros, conducen a la enfermedad (13,14).
Características del SGB como EAI en el marco de la tautología autoinmune
Las EAI hacen parte del grupo de enfermedades crónicas no transmisibles. Las características clínicas de las EAI varían en función del órgano afectado. Sin embargo, los factores de riesgo (genéticos y medioambientales) son similares entre ellas, como lo son también los
mecanismos mediante los cuales el sistema inmune genera daño al propio organismo. Esta teoría se conoce como la tautología autoinmune (15), de la cual hace parte el efecto que tiene el medioambiente en el desarrollo de las mismas (i.e., ecología autoinmune) (16).
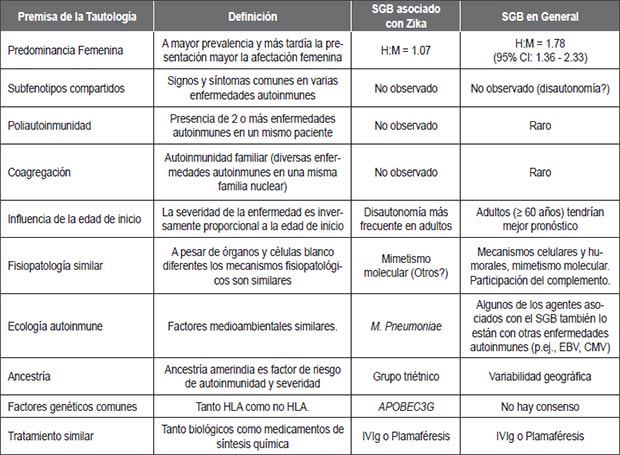
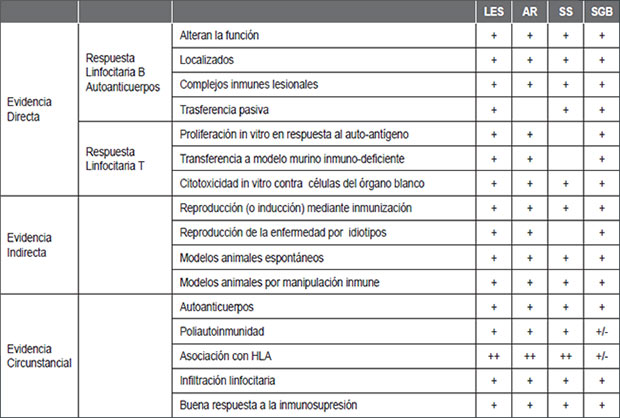
Cerca del 35% de los pacientes con una EAI puede presentar una segunda y hasta una tercera EAI, fenómeno conocido como “poliautoinmunidad”; es decir, varias EAI pueden presentarse en un mismo paciente. A pesar de que el SGB pueda ser desencadenado por una infección previa, evaluamos sus características autoinmunes a la luz de los postulados de autoinmunidad (Tabla 1) como de las premisas de la tautología (Tabla 2), confirmando dichos postulados tanto en pacientes con infección por el vZika como en aquellos sin evidencia de infección (10) (Tablas 1 y 2).
|
| Tabla 1. Características autoinmunes del síndrome de Guillain-Barré (10). |
Abreviaciones: SGB: síndrome de Guillain-Barré, EBV: virus de Epstein-Barr, CMV: citomegalovirus, IVIg: inmunoglobulinas intravenosas |
| Tabla 2. Tautología autoinmune en el SGB. |
Virus Zika
El vZika pertenece al género Flavivirus, familia Flaviviridae. Es considerado un arbovirus al ser transmitido principalmente por artrópodos, en especial por mosquitos del genero Aedes (17). Sin embargo, se han observado otros mecanismos de transmisión como orina, sangre, saliva, contacto sexual, lactancia y transmisión vertical (18,19).
Durante los brotes en las Islas del Pacífico entre 2007 y 2013, se observó la primera asociación entre el vZika y el GBS (3,5,20–24). En septiembre de 2015, el virus llegó a las Américas y desde entonces, se ha extendido por casi todo el continente (25), asociándose con el
aumento de casos de microcefalia, SGB y otros síndromes neurológicos.
vZika y SGB
Dado el aumento de complicaciones neurológicas asociadas con el vZika, principalmente SGB y microcefalia, se hizo necesario establecer hipótesis que permitieran determinar las causas de dicha asociación, siendo las más plausibles el mimetismo molecular y la toxicidad directa del vZika sobre el sistema nervioso. Por un lado, se propone que el mimetismo molecular entre glucolípidos, presentes en las capas de mielina y en el axolemma, y moléculas de superficie de agentes infecciosos puede explicar la mayoría de los casos de SGB precedidos por una infección, mientras que la toxicidad directa de vZika sobre las células neuronales se ha planteado como un mecanismo por el cual vZika induce la microcefalia. Sin embargo no se descarta que dicho mecanismo pueda estar también relacionado con el SGB (26).
VZika y retos en el diagnóstico
Un reto importante en relación con la infección tiene que ver con el diagnostico, ya que la mayoría de los casos reportados han sido diagnosticados por sospecha clínico-epidemiológica y no por laboratorio. Adicional a esto, varios protocolos de reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) han sido descritos y pueden generar resultados diversos y hasta contradictorios. Así mismo, existen varias pruebas serológicas comerciales para la detección de anticuerpos contra el virus que deben ser utilizadas con precaución dada la alta reactividad cruzada con otros arbovirus. En este sentido, no hay que olvidar que en Colombia, existe la circulación simultánea de otros arbovirus que también pueden causar SGB y que deben ser considerados en el diagnóstico diferencial (27,28).
vZika y trombocitopenia
La evidencia de trombocitopenia autoinmune ha sido confirmada en varios reportes de caso y estudios descriptivos (7). Sin embargo, los mecanismos fisiopatológicos se desconocen. No obstante, esta observación permitió realizar una revisión de la literatura. Se encontraron 14 artículos que evidenciaron la presencia de trombocitopenia relacionada con la infección por vZika. A partir de estos estudios, se describieron menos de 25 casos (al menos dos casos se informaron dos veces). En todos los casos excepto en uno, los niveles de trombocitopenia fueron inferiores a 100.000/uL. Aunque se reportaron algunos casos fatales, la mayoría de los pacientes respondieron bien al tratamiento inmunomodulador (29).
vZika y SGB en Colombia
Una revisión sistemática sobre la situación del SGB en Colombia, previo a la epidemia del vZika, evidenció que la mayoría de los pacientes fueron hombres (67%). Adicionalmente, se encontró que un gran porcentaje de los casos fueron pacientes menores de 50 años (94%), y cerca del 70% tenían menos de 20 años. Igualmente, se documentó que el subfenotipo más frecuente de GBS en Colombia corresponde a la polineuropatía desmielinizante aguda idiopática (AIDP). Por otro lado, el antecedente de infección previa al inicio del SGB se obtuvo en el 31% de los casos reportados. Finalmente, en relación con los manejos instaurados, los artículos publicados antes de 1980 describieron enfoques de tratamiento que incluían asistencia respiratoria y tratamiento sintomático, hormona adrenocorticotrópica intravenosa o corticoides. Artículos posteriores describieron el tratamiento con inmunoglobulinas intravenosas o plasmaféresis, junto con asistencia respiratoria (30).
Conociendo la situación del SGB en Colombia y observando un aumento de los casos de este síndrome en el país (Figura 2), se decidió realizar un estudio multidisciplinario en Cúcuta, Norte de Santander, una de las ciudades más afectadas por infecciones transmitidas por arbovirus (6), con el fin de evaluar la respuesta autoinmune en aquellos individuos infectados por vZika (13,14).
Se utilizaron datos de pacientes con enfermedad de vZika notificados al sistema de vigilancia poblacional nacional para calcular el número de reproducción básica (Ro) y las tasas de ataque, es decir el número de personas que presentaron la enfermedad por vZika en relación con el número de personas expuestas al riesgo de sufrir dicha enfermedad en un período limitado de tiempo durante la epidemia. Los pacientes con síndromes neurológicos fueron contactados y sus diagnósticos fueron confirmados (6).
El valor estimado del Ro osciló entre 2,68 (IC del 95%: 2,54-2,67) a 4,57 (IC del 95%: 4,18-5,01). La tasa de ataque fue 1306 por 100.000 mujeres y 552 por 100.000 hombres. Se observó una interacción no lineal entre la edad y el sexo en las tasas de ataque (6).
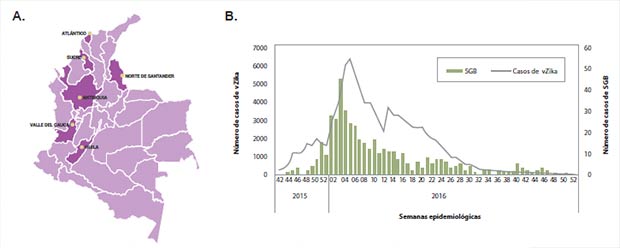
|
| Figura 2. A. Departamentos mayormente afectados por la epidemia de vZika y de donde se han publicado casos de SGB B. Número de casos con síndromes neurológicos reportados en Colombia durante la epidemia de Zika.
ATLÁNTICO |
Se realizó un estudio de asociación basado en casos y controles en el que se incluyeron 29 pacientes con SGB asociado con vZika que fueron comparados con 74 controles pareados por género, edad y barrio, con antecedente de infección por vZika, sin manifestaciones neurológicas. Se evaluaron anticuerpos contra arbovirus y otras infecciones que pudieran desencadenar SGB (6).
Los resultados del estudio mostraron durante la epidemia ocasionada por el vZika en Cúcuta, el SGB aumentó más de 4 veces, y que el bajo nivel socioeconómico, vivir cerca de zonas de alta contaminación e infecciones previas favorecieron el desarrollo del síndrome. En particular, el antecedente de haber cursado con M. pneumoniae aumentó cerca de cuatro veces el riesgo de desarrollar SGB en personas infectadas por vZika; un hallazgo que está siendo confirmando en otras ciudades. Además del SGB, el vZika puede ocasionar compromiso de la médula espinal (mielitis), del cerebro (encefalitis) y de nervios craneales (parálisis facial) (6).
El subfenotipo AIDP fue diagnosticado en el 70% de los pacientes. El 40% de los nervios de pacientes con AIDP mostraron una participación desmielinizante distal prevalente, pero este patrón no es específico de la AIDP asociaciada al vZika (31).
Adicionalmente, se observó que la presencia de disautonomía en el GBS asociado a vZika fue el principal indicador de mal pronóstico. Se encontró que los pacientes con SGB asociado al vZika tuvieron una mayor frecuencia de disautonomía (75,9%) en comparación con el SGB asociacado a otras infecciones. Estos hallazgos motivaron la realización de un estudio de asociación en el que se pudo observar que los pacientes con el antecedente de infección por vZika sin compromiso neurológico evidente presentaron puntajes más altos de disautonomía (medidos por medio del COMPASS-31, instrumento validado para la evaluación de síntomas asociados a disfunción autonómica), que aquellos controles sin antecedente de infección por vZika (9).
vZika y otros síndromes neurológicos en Colombia
Trece pacientes fueron diagnosticados con otros síndromes neurológicos diferentes al SGB (6 con MT, 3 con encefalitis, 3 con parálisis facial periférica y uno con mielopatía toraco-lumbosacra) (6). Los datos confirmaron una mayor transmisión del vZika en Cúcuta, y mostraron la asociación entre síndromes neurológicos severos relacionados con la infección por vZika. Las formas complejas por las cuales las infecciones previas y el estatus socioeconómico interactúan para aumentar el riesgo de SGB en las personas infectadas por vZika deben ser investigadas más a fondo.
VZika y autoinmunidad tiroidea y reumatológica
Se realizó un análisis de autoinmunidad tiroidea y reumatológica mediante un estudio de asociación basado en casos y controles en el que se evaluó, mediante inmunoensayo, la presencia de un panel de 14 autoanticuerpos en los pacientes con SGB (Figura 3). Aunque algunos pacientes presentaron autoinmunidad reumatológica y tiroidea, no se observaron diferencias entre los pacientes con SGB-vZika y los pacientes con infección por vZika sin síndromes neurológicos. Además, no se encontraron diferencias entre la presencia de auto-anticuerpos en pacientes con enfermedad por vZika y controles sanos (29).
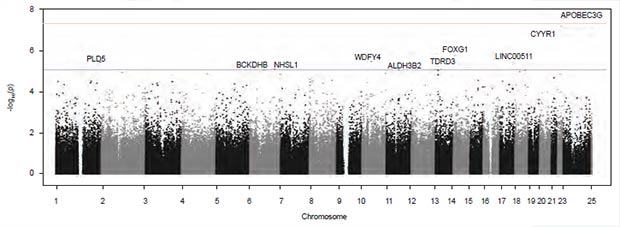
Plausibilidad genética
El proyecto RAIZ permitió la realización del primer análisis del genoma completo en pacientes con infección por vZika que desarrollaron SGB post-viral, mediante un estudio de asociación en el que se examinó la cohorte de 116 pacientes con infección por vZika y 1.536 controles no afectados (32). La confirmación de la infección por vZika se realizó mediante la prueba de neutralización por reducción en placas, ELISA e inmunofluorescencia, tal como descrito (31). Las muestras fueron genotipificadas mediante el “Affymetrix Axioma Genoma-Wide LAT 1 Array 4”. Después del control de calidad, 380.599 polimorfismos de nucleótido simple fueron evaluados en 95 casos y 1.366 controles. Los análisis estadísticos se realizaron en el programa PLINK (http://pngu.mgh.harvard.edu/ purcell/plink/). El análisis de componentes principales se utilizó para detectar y cuantificar la estructura genética de las poblaciones. La imputación se realizó utilizando IMPUTE2 (33). Los datos fueron ajustados mediante control genético y la tasa de falsos descubrimientos. Para cada polimorfismo se calcularon las razones de disparidad (OR) y los intervalos de confianza del 95% (IC95%). El nivel de significancia establecido fue 5.0E-08.
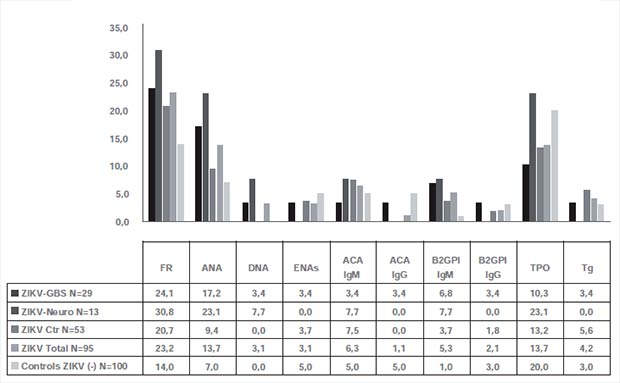
|
| Figura 3. Autoinmunidad tiroidea y reumatológica en pacientes con infección por vZika e individuos sanos. Abreviaciones: FR: factor reumatoide, ANA: anticuerpos antinucleares, DNA: anticuerpos anti-DNA, ENAs: anticuerpos anti antígenos extractables (Ro, La, Sm, RNP), ACA: anticuerpos anticardiolipinas, B2GPI: anticuerpos anti-β2-glicoproteinas, TPO: anticuerpos antitopoisomerasa, Tg: anticuerpos anti-tiroglobulina. |
Conclusiones y perspectivas
A pesar de que en el SGB predomine una respuesta humoral sobre aquella mediada por células T, al menos en la fase progresiva de la lesión del nervio y en las formas axonales, los mecanismos de interacción entre los factores infecciosos y del hospedero que conducen a una respuesta autoinmune no son completamente conocidos. Por lo tanto, en los casos de SGB será importante distinguir entre la neurotoxicidad del vZIKA, demostrada desde su descubrimiento, y la generación de respuesta autoinmune por mimetismo molecular (u otro).
Es posible que la inmunidad poblacional proteja contra una nueva epidemia por cerca de una década. Sin embargo, dadas las secuelas a largo plazo de este y otros arbovirus, así como la posibilidad de nuevas epidemias trasmitidas por el mismo vector, la investigación traslacional y la colaboración nacional e internacional deben ser una prioridad permanente de las entidades académicas y gubernamentales, con el fin de mejorar la calidad de la misma y ofrecer respuestas a problemas nacionales con repercusión regional y mundial.
|
| Figura 4. Diagrama de Manhattan de los resultados de asociación genética del SGB en pacientes infectados con vZika. |
Los resultados aquí resumidos del proyecto RAIZ son, por lo tanto, de utilidad para el diseño de políticas públicas, medidas de prevención y predicción de patologías asociadas al vZika, así como para el desarrollo de estrategias científicas ante futuras epidemias.
Conflicto de intereses
Ninguno
Financiación
Este proyecto fue financiado por la Universidad del Rosario (ABN011), y Colciencias (747-2016), Bogotá, Colombia.
Agradecimientos
Los autores expresan su gratitud y reconocimiento a todos los miembros del Centro de Estudio de Enfermedades Autoinmunes (CREA), a los colegas que han participado en el desarrollo de los estudios sobre autoinmunidad asociada al vZika y a la Alcaldía de Cúcuta por su apoyo y contribuciones al presente trabajo. Los autores declaran no tener ningún conflicto de interés.
Referencias
1. Dick GWA, Kitchen SF HA. Zika virus. I. Isolations and serological specificity. Trans R Soc Trop Med Hyg 195. 1952;46(5):509–20.
2. ICTV. International comittee on taxonomy of viruses. Virus taxonomy. 2014. Release 2015.
3. Duffy M. Chen T.Hancock T. Powers A. Kool J. Lanciotti R. Pretrick M. Zika Virus Outbreak on Yap Island, Federated States of Micronesia. N Engl J Med. 2009;360:2536–43.
4. Lessler J, Chaisson LH, Kucirka LM, et al. Assessing the global threat from Zika virus. Science. 2016 Aug;353(6300):aaf8160.
5. Cao-Lormeau V-M, Blake A, Mons S, Lastère S, Roche C, Vanhomwegen J, et al. Guillain-Barré Syndrome outbreak associated with Zika virus infection in French Polynesia: a case-control study. Lancet. 2016 Apr;387(10027):1531–9.
6. Anaya J-M, Rodríguez Y, Monsalve DM, Vega D, Ojeda E, Gonz Alez-Bravo D, et al. A comprehensive analysis and immunobiology of autoimmune neurological syndromes during the Zika virus outbreak in Cúcuta, Colombia. J Autoimmun. 2016;77:123–38.
7. Karimi O, Goorhuis A, Schinkel J, Codrington J, Vreden SGS, Vermaat JS, et al. Thrombocytopenia and subcutaneous bleedings in a patient with Zika virus infection. Vol. 387, Lancet. England; 2016. p. 939–40.
8. Carteaux G, Maquart M, Bedet A, Contou D, Brugières P, Fourati S, et al. Zika Virus Associated with Meningoencephalitis. N Engl J Med. 2016 Apr;374(16):1595–6.
9. Rodriguez Y, Monsalve D, Acosta-Ampudia Y, Molano-González N, Ramírez-Santana C, Anaya JM. Disautonomia en pacientes con infección por virus Zika. VII Simp Nac y III Congr Latinoam Virol. 2017; DOI: 10.16925/greylit.2097 (enviado a publicación)
10. Pinto-Diaz CA, Rodriguez Y, Monsalve DM, Acosta-Ampudia Y, Molano-Gonzalez N, Anaya J-M, et al. Autoimmunity in Guillain-Barre syndrome associated with Zika virus infection and beyond. Autoimmun Rev. 2017 Apr;16(4):327–34.
11. Chalela JA. Pearls and pitfalls in the intensive care management of Guillain-Barré syndrome. Semin Neurol. 2001;21(4):399–405.
12. Willison HJ, Jacobs BC, van Doorn PA. Guillain-Barre syndrome. Lancet. 2016 Aug;388(10045):717–27.
13. Jasti AK, Selmi C, Sarmiento-Monroy JC, Vega DA, Anaya J-M, Gershwin ME. Guillain-Barre syndrome: causes, immunopathogenic mechanisms and treatment. Expert Rev Clin Immunol. 2016 Nov;12(11):1175–89.
14. Anaya J, Ramirez-Santana C, Salgado-Castaneda I, Chang C, Ansari A, Gershwin M. Zika virus and neurologic autoimmunity: the putative role of gangliosides. BMC Med. 2016;14.
15. Anaya J-M. The autoimmune tautology. A summary of evidence. Joint, bone, spine.2017;84: 251–3.
16. Anaya J-M, Ramirez-Santana C, Alzate MA, Molano-Gonzalez N, Rojas-Villarraga A. The Autoimmune Ecology. Front Immunol. 2016;7:139.
17. Paixao ES, Barreto F, Teixeira M da G, Costa M da CN, Rodrigues LC. History, Epidemiology, and Clinical Manifestations of Zika: A Systematic Review. Am J Public Health. 2016 Apr;106(4):606–12.
18. Mesci P, Macia A, Moore SM, Shiryaev SA, Pinto A, Huang C-T, et al. Blocking Zika virus vertical transmission. Sci Rep. 2018;8(1):1218.
19. Zanluca C, de Noronha L, Duarte Dos Santos CN. Maternal-fetal transmission of the zika virus: An intriguing interplay. Tissue barriers. 2017 Nov;e1402143.
20. Musso D, Nilles EJ, Cao-Lormeau VM. Rapid spread of emerging Zika virus in the Pacific area. Clin Microbiol Infect. 2014;20(10):595–6.
21. Dupont-Rouzeyrol M, O ’connor O, Calvez E, Daures M, John M, Grangeon J-P, et al. Co-infection with Zika and Dengue Viruses in 2 Patients, New Caledonia, 2014. Emerg Infect Dis. 2015;21:381–2.
22. Pyke AT, Daly MT, Cameron JN, Moore PR, Taylor CT, Hewitson GR, et al. Imported zika virus infection from the cook islands into australia, 2014. PLoS Curr. 2014;6:1–7.
23. Wæhre T, Maagard A, Tappe D, Cadar D, Schmidt-Chanasit J. Zika Virus Infection after Travel to Tahiti , December 2013. Emerg Infect Dis. 2014;20(8):8–10.
24. Tognarelli J, Ulloa S, Villagra E, Lagos J, Aguayo C, Fasce R, et al. A report on the outbreak of Zika virus on Easter Island, South Pacific, 2014. Arch Virol. 2016;161(3):665–8.
25. Zanluca C, Melo VC, Mosimann AL, Santos GI, Santos CN, Luz K. First report of autochthonous transmission of Zika virus in Brazil. Mem Inst Oswaldo Cruz. 2015;110(4):569–72.
26. Bukrinsky M. Yeast help identify cytopathic factors of Zika virus. Cell Biosci. 2017;7:12.
27. Acosta-Ampudia Y, Monsalve DM, Rodríguez Y, Gunturiz ML, Ramirez-Santana C, González-Bravo DC, et al. Autoinmunidad Neurológica En Los Tiempos Del Zika. Rev Med. 2016;38(2):187–200.
28. Acosta-Ampudia Y, Monsalve D, León-Ramos C, Anaya JM, Ramírez-González JD. Diagnóstico de la infección por el virus Zika: retos y dificultades. VII Simp Nac y III Congr Latinoam Virol. 2017; DOI: 10.16925/greylit.2097
29. Monsalve DM, Pacheco Y, Acosta-Ampudia Y, Rodriguez Y, Ramirez-Santana C, Anaya J-M. Zika virus and autoimmunity. One-step forward. Autoimmun Rev. 2017 Dec;16(12):1237–45.
30. Mahecha MP, Ojeda E, Vega DA, Sarmiento-Monroy JC, Anaya J-M. Guillain-Barre syndrome in Colombia: where do we stand now? Immunol Res. 2017 Feb;65(1):72–81.
31. Uncini A, González-Bravo DC, Acosta-Ampudia YY, Ojeda EC, Rodríguez Y, Monsalve DM, et al. Clinical and nerve conduction features in Guillain-Barré syndrome associated with Zika virus infection in Cúcuta, Colombia. Eur J Neurol [Internet]. [cited 2017 Dec 21]; Available from: http://onlinelibrary.wiley.com/doi/10.1111/ ene.13552/full/#.WjvHYZQeVss.mendeley
32. Anaya JM, Sun C, Acosta-Ampudia Y, Monsalve DM, Rodríguez Y, Ramírez-Santana C, Nath S. Plausibilidad genética de la infección por el virus del Zika y el síndrome de Guillain-Barré. VII Simp Nac y III Congr Latinoam Virol. 2017; DOI: 10.16925/greylit.2097 (enviado a publicación).
33. Howie BN, Donnelly P, Marchini J. A flexible and accurate genotype imputation method for the next generation of genome-wide association studies. PLoS Genet. 2009 Jun;5(6):e1000529.
2. ICTV. International comittee on taxonomy of viruses. Virus taxonomy. 2014. Release 2015.
3. Duffy M. Chen T.Hancock T. Powers A. Kool J. Lanciotti R. Pretrick M. Zika Virus Outbreak on Yap Island, Federated States of Micronesia. N Engl J Med. 2009;360:2536–43.
4. Lessler J, Chaisson LH, Kucirka LM, et al. Assessing the global threat from Zika virus. Science. 2016 Aug;353(6300):aaf8160.
5. Cao-Lormeau V-M, Blake A, Mons S, Lastère S, Roche C, Vanhomwegen J, et al. Guillain-Barré Syndrome outbreak associated with Zika virus infection in French Polynesia: a case-control study. Lancet. 2016 Apr;387(10027):1531–9.
6. Anaya J-M, Rodríguez Y, Monsalve DM, Vega D, Ojeda E, Gonz Alez-Bravo D, et al. A comprehensive analysis and immunobiology of autoimmune neurological syndromes during the Zika virus outbreak in Cúcuta, Colombia. J Autoimmun. 2016;77:123–38.
7. Karimi O, Goorhuis A, Schinkel J, Codrington J, Vreden SGS, Vermaat JS, et al. Thrombocytopenia and subcutaneous bleedings in a patient with Zika virus infection. Vol. 387, Lancet. England; 2016. p. 939–40.
8. Carteaux G, Maquart M, Bedet A, Contou D, Brugières P, Fourati S, et al. Zika Virus Associated with Meningoencephalitis. N Engl J Med. 2016 Apr;374(16):1595–6.
9. Rodriguez Y, Monsalve D, Acosta-Ampudia Y, Molano-González N, Ramírez-Santana C, Anaya JM. Disautonomia en pacientes con infección por virus Zika. VII Simp Nac y III Congr Latinoam Virol. 2017; DOI: 10.16925/greylit.2097 (enviado a publicación)
10. Pinto-Diaz CA, Rodriguez Y, Monsalve DM, Acosta-Ampudia Y, Molano-Gonzalez N, Anaya J-M, et al. Autoimmunity in Guillain-Barre syndrome associated with Zika virus infection and beyond. Autoimmun Rev. 2017 Apr;16(4):327–34.
11. Chalela JA. Pearls and pitfalls in the intensive care management of Guillain-Barré syndrome. Semin Neurol. 2001;21(4):399–405.
12. Willison HJ, Jacobs BC, van Doorn PA. Guillain-Barre syndrome. Lancet. 2016 Aug;388(10045):717–27.
13. Jasti AK, Selmi C, Sarmiento-Monroy JC, Vega DA, Anaya J-M, Gershwin ME. Guillain-Barre syndrome: causes, immunopathogenic mechanisms and treatment. Expert Rev Clin Immunol. 2016 Nov;12(11):1175–89.
14. Anaya J, Ramirez-Santana C, Salgado-Castaneda I, Chang C, Ansari A, Gershwin M. Zika virus and neurologic autoimmunity: the putative role of gangliosides. BMC Med. 2016;14.
15. Anaya J-M. The autoimmune tautology. A summary of evidence. Joint, bone, spine.2017;84: 251–3.
16. Anaya J-M, Ramirez-Santana C, Alzate MA, Molano-Gonzalez N, Rojas-Villarraga A. The Autoimmune Ecology. Front Immunol. 2016;7:139.
17. Paixao ES, Barreto F, Teixeira M da G, Costa M da CN, Rodrigues LC. History, Epidemiology, and Clinical Manifestations of Zika: A Systematic Review. Am J Public Health. 2016 Apr;106(4):606–12.
18. Mesci P, Macia A, Moore SM, Shiryaev SA, Pinto A, Huang C-T, et al. Blocking Zika virus vertical transmission. Sci Rep. 2018;8(1):1218.
19. Zanluca C, de Noronha L, Duarte Dos Santos CN. Maternal-fetal transmission of the zika virus: An intriguing interplay. Tissue barriers. 2017 Nov;e1402143.
20. Musso D, Nilles EJ, Cao-Lormeau VM. Rapid spread of emerging Zika virus in the Pacific area. Clin Microbiol Infect. 2014;20(10):595–6.
21. Dupont-Rouzeyrol M, O ’connor O, Calvez E, Daures M, John M, Grangeon J-P, et al. Co-infection with Zika and Dengue Viruses in 2 Patients, New Caledonia, 2014. Emerg Infect Dis. 2015;21:381–2.
22. Pyke AT, Daly MT, Cameron JN, Moore PR, Taylor CT, Hewitson GR, et al. Imported zika virus infection from the cook islands into australia, 2014. PLoS Curr. 2014;6:1–7.
23. Wæhre T, Maagard A, Tappe D, Cadar D, Schmidt-Chanasit J. Zika Virus Infection after Travel to Tahiti , December 2013. Emerg Infect Dis. 2014;20(8):8–10.
24. Tognarelli J, Ulloa S, Villagra E, Lagos J, Aguayo C, Fasce R, et al. A report on the outbreak of Zika virus on Easter Island, South Pacific, 2014. Arch Virol. 2016;161(3):665–8.
25. Zanluca C, Melo VC, Mosimann AL, Santos GI, Santos CN, Luz K. First report of autochthonous transmission of Zika virus in Brazil. Mem Inst Oswaldo Cruz. 2015;110(4):569–72.
26. Bukrinsky M. Yeast help identify cytopathic factors of Zika virus. Cell Biosci. 2017;7:12.
27. Acosta-Ampudia Y, Monsalve DM, Rodríguez Y, Gunturiz ML, Ramirez-Santana C, González-Bravo DC, et al. Autoinmunidad Neurológica En Los Tiempos Del Zika. Rev Med. 2016;38(2):187–200.
28. Acosta-Ampudia Y, Monsalve D, León-Ramos C, Anaya JM, Ramírez-González JD. Diagnóstico de la infección por el virus Zika: retos y dificultades. VII Simp Nac y III Congr Latinoam Virol. 2017; DOI: 10.16925/greylit.2097
29. Monsalve DM, Pacheco Y, Acosta-Ampudia Y, Rodriguez Y, Ramirez-Santana C, Anaya J-M. Zika virus and autoimmunity. One-step forward. Autoimmun Rev. 2017 Dec;16(12):1237–45.
30. Mahecha MP, Ojeda E, Vega DA, Sarmiento-Monroy JC, Anaya J-M. Guillain-Barre syndrome in Colombia: where do we stand now? Immunol Res. 2017 Feb;65(1):72–81.
31. Uncini A, González-Bravo DC, Acosta-Ampudia YY, Ojeda EC, Rodríguez Y, Monsalve DM, et al. Clinical and nerve conduction features in Guillain-Barré syndrome associated with Zika virus infection in Cúcuta, Colombia. Eur J Neurol [Internet]. [cited 2017 Dec 21]; Available from: http://onlinelibrary.wiley.com/doi/10.1111/ ene.13552/full/#.WjvHYZQeVss.mendeley
32. Anaya JM, Sun C, Acosta-Ampudia Y, Monsalve DM, Rodríguez Y, Ramírez-Santana C, Nath S. Plausibilidad genética de la infección por el virus del Zika y el síndrome de Guillain-Barré. VII Simp Nac y III Congr Latinoam Virol. 2017; DOI: 10.16925/greylit.2097 (enviado a publicación).
33. Howie BN, Donnelly P, Marchini J. A flexible and accurate genotype imputation method for the next generation of genome-wide association studies. PLoS Genet. 2009 Jun;5(6):e1000529.