DECISIONES INFORMADAS EN MEDICAMENTOS DE ALTO IMPACTO FINANCIERO (DIME). UN EJEMPLO DE TRANSFERENCIA DE CONOCIMIENTO A NIVEL REGIONAL
Hernando G. Gaitán-Duarte1, Claudia Vaca2
Resumen
Introducción: Las decisiones de inclusión de medicamentos en planes de beneficios deben estar basadas en Evaluaciones de Tecnología –ET– en metodologías transparentes, robustas y válidas, deben considerar los precios comparados a los que se compran los medicamentos, su estatus de competencia y deben considerar la información de decisiones de cobertura en otros países y las estrategias de uso racional que permitan modular los impactos de las decisiones sobre el consumo. Objetivo: Describir cómo se diseñó y puso en marcha un bien público regional consistente en una plataforma web basada en la gestión del conocimiento de países de Latinoamérica y el Caribe como respuesta a la presión impuesta por los fabricantes globales de medicamentos y tecnologías médicas sobre los presupuestos públicos del sector salud. Metodología: Se describen los antecedentes que motivaron la creación de una plataforma web de información sobre medicamentos de alto impacto financiero, la metodología para su desarrollo y los resultados y productos diseñados gracias a una comunidad de expertos de organismos gubernamentales y universidades de distintos países de América Latina, para facilitar la trasferencia del conocimiento a los tomadores de decisiones en la región. Resultados: Los tomadores de decisiones farmacéuticas de la región cuentan con información comparada de precios, competencia, decisiones de cobertura, uso racional de medicamentos para 35 medicamentos. Se realizaron acciones de capacitación local en ET en los países participantes. En la actualidad se dispone de 25 informes de evaluación de tecnología regionales y modelos metodológicos para su desarrollo. La región latinoamericana y del Caribe cuenta con un importante grupo de investigadores con capacidad de trabajar en equipo para realizar actividades de transferencia del conocimiento. Conclusiones: Es posible desarrollar estrategias de transferencia y gestión del conocimiento a nivel regional, con el fin de lograr una mejor gestión en medicamentos y tecnologías en beneficio de la salud de la población de la región.
Palabras clave: Servicios de Información sobre Medicamentos, Evaluación de la Tecnología Biomédica, efectividad, seguridad, Evaluación de Costo-Efectividad.
_______________________
1 MD. MSc. Profesor titular Departamento de Obstetricia y Ginecología, Instituto de Investigaciones Clínicas. Director del Grupo de Evaluación de Tecnologías y Políticas en Salud. Universidad Nacional de Colombia.
2 QF. MSc. Profesora asistente. Departamento de Farmacia. Directora del Centro de Pensamiento Medicamentos Información y Poder Universidad Nacional de Colombia.
________________________
INFORMED DECISIONS IN HIGH-FINANCIAL IMPACT MEDICINES (DIME). AN EXAMPLE OF KNOWLEDGE TRANSFER AT THE REGIONAL LEVEL.
Abstract
Introduction: Drug inclusion decisions in benefit plans should be based on technology assessments (ET) based as well on robust and valid transparent methodologies; they should consider prices as compared to market value, their competitive status and the information of coverage decisions in other countries, rational use strategies that modulate the impacts of decisions on consumption. Objective: To describe how a regional public good was designed and implemented; it consists in a web platform based on knowledge management in Latin American and Caribbean countries, done in response to the pressure imposed by global pharma and medical technologies manufacturers on public health sector budgets. Methodology: We describe the background that motivated the creation of a web platform for information on high financial impact medicines, the methodology for its development and results, and products designed thanks to a community of experts from government agencies and universities in different Latin American countries. This was done to facilitate the transfer of knowledge to decision makers in the region. Results: Pharmaceutical decision makers in the region have comparative information on prices, competence, coverage decisions, and rational use of medicines for 35 products. Local training actions were carried out in ET in participating countries. Currently, there are 25 regional technology assessment reports and methodological models for their development. The Latin American and Caribbean region has an important group of researchers with the ability to work as a team to carry out knowledge transfer activities. Conclusions: It is possible to develop knowledge transfer and management strategies at a regional level in order to achieve better management of medicines and technologies for the health of the population of the region.
Keywords: Drug Information Services, Biomedical Technology Assessment, effectiveness, safety, Cost-Effectiveness Evaluation.
Introducción
Se han definido como medicamentos de alto costo aquellos medicamentos que conllevan a un gasto desproporcionado por actividad y que son producidos por pequeño número de proveedores (1). Estos medicamentos entre los que se encuentran los medicamentos biológicos, los medicamentos de la terapia génica o los medicamentos para enfermedades huérfanas (2) conllevan un importante consumo de recursos para los sistemas de salud a nivel global, que afecta tanto a los países de altos ingresos (3) como también, y en mayor medida, a los países de medios y bajo ingresos que disponen de menos recursos para cubrir las necesidades en salud de sus poblaciones (4). Según el Banco Interamericano de Desarrollo –BID– en Colombia, para el año 2011, veinte medicamentos consumieron el 50% de los recursos públicos asignados a cubrir productos farmacológicos y estos productos farmacéuticos representaban para ese año entre el 15% y el 30% de los gastos sanitarios en los países con economías en transición y entre el 25% y el 66% en los países en desarrollo (5). Por esta razón han sido denominados también medicamentos de alto impacto financiero. El alto costo de estos medicamentos no solo deriva de la alta inversión que conllevan para la industria farmacéutica las actividades de investigación y desarrollo de nuevas moléculas, sino también del efecto de las patentes, limitadas alternativas terapéuticas y estrategias eficaces de mercadeo que conllevan a un incremento en el número de usuarios y modificación de los patrones de formulación en el gremio médico impulsadas por esta industria y las casas de innovación tecnológica de mercadeo en un intento por incrementar sus ganancias (6).
Esta presión tecnológica afecta de manera más importante a los países de los mercados de medios y bajos ingresos, denominados farmacoemergentes en la industria de los medicamentos, en donde se incrementaron las ventas en un 35% en los últimos 5 años comparado con el 2% en los países de altos ingresos. Dentro de los países farmacoemergentes se encuentran Rusia, India China, Turquía Sudáfrica, y, de la región latinoamericana, Brasil, Argentina, Venezuela y Colombia. Por otra parte es importante considerar que la industria farmacéutica ha tenido desde el 2011 un incremento en el número de productos introducidos en el mercado que se espera continuará hasta el 2021. Estos nuevos fármacos están dirigidos al tratamiento del cáncer, enfermedades del sistema nervioso central, anti infecciosos y antivirales, cardiovasculares, hormonas y medicamentos para enfermedades huérfanas (7). Sin embargo, en muchas ocasiones estos «nuevos» medicamentos no son nuevas moléculas sino cambios menores de moléculas ya desarrolladas con una efectividad y seguridad similar a la forma previa o tienen un muy limitado beneficio sobre la salud de los usuarios, es decir el valor terapéutico agregado es muy discutible. Este podría ser el caso de las insulinas análogas que ocupan el segundo lugar en ventas a nivel mundial que tiene ventajas muy discutibles sobre la insulina clásica de liberación lenta –NPH– pero que incrementó el precio del tratamiento de manera muy importante en los Estados Unidos (8). Este gasto, no siempre justificado en los nuevos medicamentos, podría llevar a un incremento de las desigualdades a nivel global y en especial en la región latinoamericana escenario de profundas inequidades (9).
Los países de medios ingresos se encuentran sometidos a una presión tecnológica de medicamentos y dispositivos médicos que no siempre se acompaña de los beneficios reclamados por los fabricantes, que podrían ser menos seguras y que podrían tener un impacto negativo desde los puntos de vista económico, ético, organizacional y social en la región. Se requieren por lo tanto estrategias que permitan distinguir lo que es efectivo y seguro, qué es eficiente, qué va en favor de la equidad, en consonancia con nuestra cultura y nuestro contexto.
La transferencia de conocimiento como instrumento de toma de decisiones informadas a nivel gubernamental
La transferencia del conocimiento ha sido definida como «el intercambio, la síntesis y la aplicación ética del conocimiento, en el marco de un sistema complejo de interacciones entre los investigadores y los usuarios de la investigación, para que los beneficios de ésta lleguen de manera más rápida a la población, a través de una mejor salud, servicios y productos más efectivos y un fortalecimiento del sistema de salud» (10). De esta manera es un puente entre los problemas que tienen que resolver los políticos, gerentes o clínicos, quienes deben tomar decisiones en el campo de la salud para beneficio de las poblaciones o las personas y los investigadores que producen el conocimiento para la solución de los problemas que enfrentan los primeros.
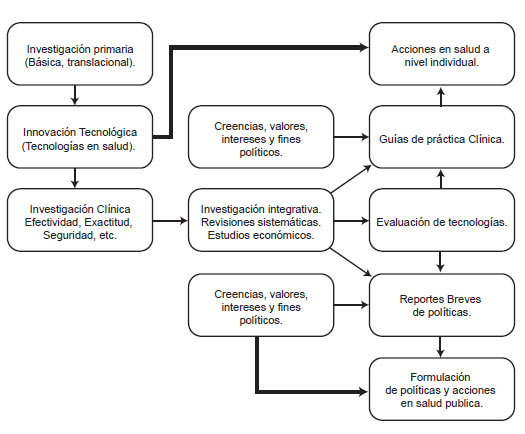
La transferencia del conocimiento tiene varios tipos de instrumentos que consolidan el conocimiento producto de la investigación primaria en documentos útiles para la toma de decisiones informadas; éstos son: las Guías de práctica clínica dirigidas para los trabajadores de salud que atienden problemas individuales, las evaluaciones de tecnologías –ET– sanitaras dirigidas a soportar a quienes tienen que tomar decisiones sobre la cobertura de medicamentos con recursos públicos (planes de beneficios) o a quienes desean ofrecer servicios o programas de atención colectiva o individual y por último los reportes breves de política dirigidos a los directores de los programas de salud pública a nivel nacional o regional. Todos éstos se basan en documentos integrativos tipo Revisiones Sistemáticas de la Literatura y las Evaluaciones Económicas Completas, que buscan resumir de una manera robusta, repetible, trasparente y no sesgada todo el conocimiento sobre los resultados deseados (efectividad) y no deseados (seguridad) de aplicar una tecnología o medicamento (en comparación con otras alternativas) a unos sujetos con una condición o un subgrupo de una población con una enfermedad los primeros (11) y el impacto económico de aplicar esta tecnología para la sociedad, los pagadores (aseguradoras) una institución o el paciente en los segundos (12) (figura 1).
Los documentos de trasferencia del conocimiento de esta manera se convierten en un instrumento para incrementar la validez de la toma de decisiones en salud, permiten discernir entre lo que es beneficioso o dañino para los individuos o las poblaciones y la magnitud del beneficio esperado o del daño inherente a su uso (relación riesgo beneficio), además permite evaluar cuál es el valor que se debería pagar por el real beneficio terapéutico que aporta la nueva tecnología (si lo hay) en comparación con las mejores alternativas terapéuticas disponibles (costo efectividad) (12). De modo que permiten hacer una aproximación al impacto ético en la persona y la sociedad y en las organizaciones de la implementación de estas tecnologías. En últimas se convierte en un instrumento de control social contra los otros elementos que cuentan para la toma de decisiones en salud como son los intereses políticos, las creencias y los intereses particulares (corrupción) que pueden tener cabida tanto en la política pública como en la empresa privada. Por otra parte está la gestión del conocimiento definido como un proceso continuo por el cual el conocimiento de todos los campos se gestiona a través de una estrategia corporativa que comprende: tener una política definida, una implementación, seguimiento y evaluación. La política debe asegurar que el conocimiento está disponible cuando y donde sea necesario y puede ser adquirido de fuentes externas e internas. (13).
Existe pues una disyuntiva de poder reconocer, que de todo lo que nos están ofreciendo las casas de innovación tecnológica y la industria farmacéutica, realmente es útil (efectivo y seguro), para no invertir en lo que no aporta valor terapéutico y de los que tienen valor cuál es la real magnitud del beneficio y cuánto es lo justo a pagar por este nuevo producto, además de considerar si su uso va en beneficio de toda la sociedad (para incrementar la equidad) y de los individuos que lo usan (14).
¿Cómo responder a este desafío?
En una sociedad dominada por el libre mercado, con una fuerte influencia de las redes sociales y en donde el uso de la información se orienta principalmente en beneficio de quienes detentan el poder (ya sea económico o político) (15), en la que se utilizan formas de mercadeo que vulneran la moral y la ética de los profesionales (16) y los investigadores (17) y se utilizan las necesidades de los pacientes para hacer presión social para el logro de beneficios de grupos particulares (18), es importante que los grupos académicos y las sociedades científicas realicen una evaluación crítica del conocimiento (19) (evidence en inglés) sobre la efectividad y seguridad de los nuevos medicamentos y la hagan disponible a los decisores en los gobiernos y a los prescriptores para enfrentar las estrategias corporativas globales de posicionamiento de las tecnologías en salud. Así mismo, dado que el efecto de estas estrategias se refleja en el gasto público en salud de los países, es importante considerar el trabajo colaborativo e interdisciplinario entre países que tienen proximidad geográfica, cultural y problemas comunes para compartir la información relacionada con el uso, los precios y las decisiones de cobertura con dineros públicos y lograr: una mayor eficiencia en el uso de los recursos destinados a la compra de los medicamentos, mejorar el control de la corrupción en el manejo de los recursos de la salud y lograr una mayor equidad en el acceso a la salud.
|
Figura 1. Esquema que representa el flujo del conocimiento desde su producción, síntesis y consolidación como elemento clave para la toma de decisiones informadas y los otros elementos que inciden en la toma de decisiones en salud. (Fuente H. Gaitán). |
Este documento tiene como objetivo describir cómo se construyó un proceso regional exitoso de colaboración para la búsqueda y disponibilidad de información y evidencia para una mejor gestión de los medicamentos de alto impacto financiero y de presentar resultados de esta colaboración, los cuales se encuentran dispuestos en una plataforma web, de manera que faciliten la toma de decisiones informadas en beneficio de las poblaciones de los países del proyecto.
Metodología
A partir del reconocimiento que hacen el Grupo de salud del Banco Interamericano de Desarrollo (BID) y los Ministerios de Salud de Colombia, Ecuador y México de la problemática del crecimiento acelerado del gasto en medicamentos, sus efectos sobre la sostenibilidad y el logro de equidad y eficiencia de los sistemas de salud de la región latinoamericana y la insuficiencia de información comparada para tomar decisiones sobre los precios y la cobertura de medicamentos pagados con recursos públicos, se desarrolla la «iniciativa para la Promoción de Bienes Públicos Regionales para la Generación de Información para el mejoramiento de la eficiencia en la gestión de medicamentos de alto impacto financiero» (5), con el objetivo de construir y disponer evidencia acerca de la seguridad y efectividad de los nuevos medicamentos y sus implicaciones económicas, sociales, éticas y
organizacionales de su uso en los países de la región y contar con información internacional de referencia sobre precios de medicamentos comparables en diferentes países, sobre decisiones de cobertura, patentes y disponibilidad de medicamentos que facilitaran la negociación y compra.
Para desarrollar el proyecto, se conformó un equipo de trabajo formado por representantes del Ministerio de Salud del Ecuador, del Ministerio de Salud y Seguridad Social de Colombia y Consultores de los tres países, el Consejo de Salubridad General de México, el Grupo de Salud del BID, Ifarma –una organización no gubernamental (ONG) ubicada en Colombia– y consultores expertos en el tema de Evaluaciones de Tecnología y Gestión Farmacéutica de los tres países. Este grupo de trabajo se amplió en una segunda fase con la vinculación de los Ministerios de Salud de República de Dominicana, Chile, El Salvador y Perú y por Costa Rica, La Caja Costarricense del Seguro Social.
El proyecto incluía, inicialmente, como producto la consolidación de la información de una plataforma web de fácil consulta cuyo nombre originario fue Observatorio de Medicamentos de Alto Impacto Financiero (OMAIF) y que posteriormente se denominó Decisiones Informadas de Medicamentos de Alto Impacto Financiero (DIME). La segunda fase se orientó al fortalecimiento de la plataforma con el enfoque de gestión de conocimiento, mediante la creación de una comunidad de práctica regional constituida por expertos locales de gobierno y de universidades mediante la selección de casos de decisión (negociación de precios, decisión de cobertura, establecimiento de una guía de práctica clínica, etc.) usando la información de la plataforma para la presentación de reportes breves de política (conocidos en inglés como policy brief) (20). El mecanismo de funcionamiento de la iniciativa se encuentra en la Figura 2, en la que se ilustra tanto el papel de la comunidad de práctica regional de expertos, como el comité editorial de la plataforma constituido por los líderes de la iniciativa: la Universidad Nacional de Colombia, Ifarma y el BID.
Para el levantamiento de la información se priorizaron 35 medicamentos tomando en cuenta los siguientes criterios: a) Presencia de alternativas para la misma condición con el fin de establecer comparaciones; b) controversias en relación con la eficacia y seguridad de los medicamentos y las tecnologías; c) carga de la enfermedad: tecnologías que cubran el tratamiento de las patologías más prevalentes; d) disponibilidad de evidencia para la tecnología; e) la potencial demanda del medicamento. Los criterios de inclusión de los países para la referenciación internacional en decisiones de cobertura y referenciación de precios están disponibles en la página de la plataforma (21).
En cuanto al componente de Evaluación de Tecnologías para definir la metodología a seguir, se decidió primeramente hacer una revisión sistemática de: 1) Manuales, modelos de ET, búsqueda, evaluación y síntesis de la evidencia, análisis económico, tipos de reporte centrados en medicamentos; y 2) documentos de experiencias de uso o adaptación de un manual o un modelo. La búsqueda se realizó en las páginas web de las Agencias de ET adscritas a Health Technology Assessment International (HTAi) y International Network for Health Technology assessment (INAHTA) y región LA: Medline, Cochrane, DARE, HTA, NHS, EED a través del buscador OVID, durante el periodo 2000 – 2014. En idiomas inglés y español. Para el proceso de selección de documento dos evaluadores revisaron de manera independiente los documentos. Como resultados se encontraron 98 documentos que fueron examinados provenientes de 15 agencias de ET, de éstos se seleccionaron 26 para evaluación completa que correspondían a documentos con metodologías para el desarrollo de ET: 15 documentos relacionados con la búsqueda y evaluación de evidencia: 7 y evaluaciones económicas: 4. Se encontró además que 13 de ellas enfocaban en HTA desde un punto de vista local, por lo cual tenían poca transferibilidad, no estaban centradas en medicamentos, había gran variabilidad en los contenidos. Se concluyó que no era clara la necesidad de un nuevo manual y que el modelo debería tener una aproximación regional por ser más eficiente al compartir recursos y disponer el mayor número de ET a los tomadores de decisiones de los países de la región; esto también debía permitir la creación de una red regional de gestión de conocimiento, fortalecer los procesos locales de ET, estar disponible una metodología regional de alta calidad y validada, que da trasparencia de los procesos, permite la transferencia de conocimiento y facilita los consensos entre países. De esta manera se decidió adaptar el modelo de la Red Europea de ET (del Inglés European network for Health Technology Assessment – EUnetHTA) (22).
|
| Figura 2. Modelo de funcionamiento DIME. (Fuente DIME). |
De manera breve, el modelo de EUnetHTA se basa en tres grandes componentes: un sistema de preguntas a contestar en la ET y las relaciones entre ellas, una metodología que guía a los desarrolladores del informe de ET a responder estas preguntas de manera adecuada y un método de síntesis y las preguntas reporte del informe. Las preguntas están organizadas según el tipo de informe, informe rápido (4 dominios) e informe completo (8 dominios). Los informes rápidos contienen información sobre: 1) la condición objeto de la tecnología; 2) la tecnología misma; 3) la efectividad; 4) la seguridad. Los informes completos además de estos dominios contienen información sobre las implicaciones: 5) económicas 6) éticas, 7) organizacionales y
8) sociales de la persona. Las preguntas también denominadas elementos de evaluación fueron consideradas como centrales para la región europea de acuerdo con su relevancia y transferibilidad. Respecto a la relevancia solo aquellas consideradas críticas o importantes fueron incluidas. Desde el punto de vista de la transferibilidad solo se incluyeron aquellas consideradas muy transferibles y parcialmente transferibles.
Para hacer la adaptación para la región latinoamericana y del caribe se hizo traducción de uno de los elementos de evaluación (preguntas) del modelo europeo y se presentaron al equipo de consultores de los países participantes con experiencia en ET y los miembros de la dirección técnica del proyecto. Estos calificaron la relevancia de la preguntas para la región (en una escala de 1 a 3 siendo 1 no importante, 2 importante y 3 crítico) y la transferibilidad (en una escala de 1 a 3 siendo 1 no transferible, 2 parcialmente transferible y 3 totalmente transferible) entre los países tomando en cuenta el contexto de cada uno, y además si la pregunta debía ser incluida o no en el modelo regional. Aquellas preguntas que fueron calificadas como importantes y críticas de manera parcial o total por más del 60% de los evaluadores y consideradas pertinentes fueron incluidas, las que no lograron esta calificación en los dos criterios y fueron consideradas no aptas para inclusión, fueron excluidas y aquellas que mostraron discrepancia entre los tres parámetros fueron sometidas a sesiones de consenso informal vía web hasta que se logró el consenso sobre su inclusión o exclusión. Finalmente se incluyeron en los informes rápidos: 4 dominios, 95% de las preguntas de la condición, el 66% de las preguntas de la tecnología y el 85% en los dominios de seguridad y efectividad. En cuanto a las completas se incluyeron el 100% de las preguntas de impacto económico, el 25% de las de impacto ético, el 35% de las de impacto organizacional y el 25% de las de impacto social. Para responder las preguntas se siguió la recomendación del modelo EUnetHTA para la búsqueda de la evidencia y la información para contestar las preguntas.
En cuanto al sistema de resumen se decidió aplicar la herramienta para decisiones de cobertura del proyecto para Desarrollo y Evaluación de Estrategias de Comunicación para soportar decisiones informadas y la práctica basada en la evidencia (en inglés Developing and Evaluating Communication strategies to support Informes Decisions and practice based on Evidence –DECIDE) (23). Esta herramienta permite resumir de manera corta, sencilla y trasparente, los juicios de valor que soportan la evaluación comparada de una tecnología en cuanto a su prioridad, efectos deseados, efectos indeseados, la calidad de la evidencia, el balance riesgo beneficio en los informes cortos y además aspectos sobre el valor que dan los pacientes a los desenlaces evaluados, los recursos utilizados para administrar la tecnología, el costo efectividad, la accesibilidad a la tecnología y factibilidad de aplicarla en los informes completos para terminar con una recomendación sobre su cobertura o no con recursos públicos. Para soportar la calificación de la evidencia se utilizó la aproximación de grupo Grade.
Resultados
Se dispone de una plataforma que a través de gráficas, videos tutoriales y reportes que facilita la consulta y la toma de decisiones. La plataforma contiene información comparada, para la toma de decisiones en materia farmacéutica, la cual incluye los precios más bajos de compra pública, cobertura, competencia, uso racional en 8 países de América Latina. Además incluye las políticas de medicamentos de los países participantes. La plataforma permite realizar un análisis de contexto a la información farmacéutica que contiene gracias a que para cada país incluye información del sistema de salud de cada país y de los procesos cobertura, de esta manera se presentan reportes de política pública donde se presentan casos donde se han tomado decisiones de adecuada gestión de estos medicamentos partir de la información disponible (ver en: http://www.proyectodime.info/)
Además se dispone de los modelos metodológicos para el desarrollo del protocolo e informes regionales rápidos y completos de ET, como también del manual para la búsqueda evaluación y síntesis de evidencia en ET (ver en: http://www.proyectodime.info/ets/lineamientos-y-herramientas/) y de 16 informes regionales rápidos y 9 informes regionales completos de ET (ver en: http://www.proyectodime.info/ets/informe-ets-regionales/).
A la par se realizaron seis talleres regionales para capacitación en: a) cómo obtener información comparada de precios y decisiones de cobertura y uso racional de medicamentos; b) metodología GRADE; c) evaluación del impacto económico; y d) un taller sobre el impacto ético del uso de los medicamentos de alto costo dictado por la oficina de Bioética de la Organización Panamericana de la Salud. El levantamiento de información y las evaluaciones de tecnologías se desarrollaron mediante estrategias de formación y creación de capacidades (en inglés learning by doing) a la medida y personalizada. De esta manera se cuenta en la región con masa crítica de investigadores con capacidad de trabajar en equipo para realizar actividades de transferencia del conocimiento.
Lecciones aprendidas
El trabajo colaborativo de la comunidad de práctica puso en evidencia por un lado las dificultades de disponibilidad y levantamiento de información y por otro los retos de la estandarización de la misma para hacerla comparable. Esto denota las debilidades del monitoreo de la forma como compran, negocian, consumen y se usan los medicamentos y las dificultades de la gestión del gasto público. En todo caso existe un margen amplio de aprendizaje y una oportunidad creciente de promover políticas públicas y medidas regulatorias orientadas a la promoción del gasto eficiente y el uso racional de medicamentos tanto desde los entes rectores, como desde los prescriptores.
El levantamiento de información de patentes y su disponibilidad es complejo por la propia opacidad de las bases de datos de patentes, a su vez la información de precios en países de referencia requiere un conocimiento de las bases de datos internacionales y de su transformación a unidades comparables. Los tutoriales de búsqueda de patentes y precios, dispuestos en la plataforma DIME, son una herramienta valiosa para construir estas capacidades y superar la falta de transparencia de esta información considerada fundamental para tomar decisiones en materia farmacéutica en los países.
Las decisiones de cobertura deben estar basadas en información comparada y basadas en evaluaciones de tecnología regionales, que debe ser procesada y transferida a los decisores. Se requiere sin embargo que esté actualizada, enriquecida y ampliada para lograr un mayor impacto en las decisiones. No se conoce en qué medida está siendo utilizada la información de la plataforma por los decisores de los gobiernos de la región, sin embargo se tiene la percepción que aún se toman decisiones sin contar con toda la información y el conocimiento disponible y sin aprovechar el trabajo regional adelantado para lograr negociaciones en bloque de la región para una mejor gestión.
En la producción de informes de ET regionales es posible la adaptación al contexto de la región de herramientas para la trasferencia del conocimiento desarrolladas en otros lugares, sin embargo es importante que estas describan de manera sólida la metodología empleada para su desarrollo y para su adaptación. En la creación de capacidades locales se requiere que los grupos de los países con poca experiencia trabajen con grupo más consolidados de otros países para lograr productos de alta calidad y de interés regional y así fortalecer la cultura del trabajo en equipo regional
Referencias
1. National Health System (NHS). United Kindom. High cost drugs, devices and chemotherapy portals; 2015. [Internet]. [Consultado el 28 de Noviembre de 2107]. Disponible en: https://www.england.nhs.uk/resources/pay-syst/future-payment-systems/drugs-and-devices/
2. NHS National Tariff Payment System 2016/17. 2017. [Internet]. [Consultado el 28 de Noviembre de 2107]. Disponible en: https://www.gov.uk/government/publications/nhs-national-tariff-payment-system-201617
3. Godman B, Malmström RE, Diogene E, Gray A, Jayathissa S, Timoney A, et al. Are new models needed to optimize the utilization of new medicines to sustain healthcare systems? Expert Rev Clin Pharmacol. 2015; 8(1):77-94.
4. Organizacion Panamericana de la Salud: El acceso a los medicamentos de alto costo en las Américas: contexto, desafios y perspectivas. 2009. [Internet]. [28 de noviembre de 2017]. Disponible en: http://www1.paho.org/hq/dmdocuments/2009/Alto%20Costo%20Americas.pdf
5. Banco Interamericano de Desarrollo. Generación de información para el mejoramiento de la eficiencia en la gestión de medicamentos de alto impacto financiero. 2012.
6. Kantarjian H, Rajkumar SV. Why Are Cancer Drugs So Expensive in the United States, and What Are the Solutions? Mayo Clinic Proceedings. 2015; 90(4):500-504.
7. Institute, Quintiles IMS. Outlook for Global Medicines through 2021 Balancing Cost and Value. 2016; 5-7. [Internet]. [Consultado 28 de noviembre de 2017]. Disponible en: http://static.correofarmaceutico.com/docs/2016/12/12/qiihi_outlook_for_global_medicines_through_2021.pdf.
8. Lipska K. Break Up the Insulin Racket. New York Times. 2016. [Internet]. [Consultado28 de noviembre de 2017]. Disponible en: https://www.nytimes.com/2016/02/21/opinion/sunday/break-up-the-insulin-racket.html
9. Banco Mundial. Índice de Gini: 2017. [Internet] [Consultado 28 de noviembre de 2017] Disponible en: https://datos.bancomundial.org/indicador/SI.POV.GINI?view=map
10. Canadian Institutes of Health Research. Knowledge translation strategy 2004—2009: Innovation in action. 2004. [Internet]. [Consultado 28 de noviembre de 2017]. Disponible en: http://www.cihr-irsc.gc.ca/e/documents/kt_strategy_2004-2009_e.pdf.
11. Oxman, A. D., Cook, D. J., & Guyatt, G. H. Users' guides to the medical literature. VI. How to use an overview. Evidence-Based Medicine Working Group. Journal of the American Medical Association, 1994; 272(17), 1367-1371.
12. Simoens S Health economic assessment: a methodological primer. Int J Environ Res Public Health. 2009; 6(12):2950-66.
13. Quintas P, Lefere P, Jones G. Knowledge management: a strategic agenda. Long Range Planning. 1997; 30(3):385-391.
14. Tugwell P, Robinson V, Grimshaw J, Santesso N Systematic reviews and knowledge translation. Bull World Health Organ. 2006; 84(8):643-51.
15. Schulten K, Christy Brown A. Valuating Sources in a ‘Post-Truth’ World: Ideas for Teaching and Learning About Fake News. New York Times 2017. [Internet]. [Consultado 28 de noviembre de 2017]. Disponible en: https://www.nytimes.com/2017/01/19/learning/lesson-plans/evaluating-sources-in-a-post-truth-world-ideas-for-teaching-and-learning-about-fake-news.html.
16. Makowska M. Polish physicians' cooperation with the pharmaceutical industry and its potential impact on public health. PLoS One. 2017 Sep 19; 12(9):e0184862.
17. Moliner J, Mozota J, Abad JM, Casaña L, Júdez D, Rabanaque MJ. Is it pertinent to investigate the relations between physicians and the drug industry. Rev Calid Asist. 2009; 24(2):72-9.
18. Rothman SM, Raveis VH, Friedman A, Rothman DJ. Health advocacy organizations and the pharmaceutical industry: an analysis of disclosure practices. Am J Public Health. 2011; 101(4):602-9.
19. Banks D: Misinformation as a Starting Point for Critical Thinking. Informing Science 2003:905- 911. [Internet]. [Consultado 28 de noviembre de 2017]. Disponible en:
https://pdfs.semanticscholar.org/5bda/626ea064fd093c3677c1c69656a1ea73190a.pdf
20. Decisiones informadas en medicamentos de alto costo. DIME. Qué es DIME. [Internet] [Consultado28 de noviembre de 2017] Disponible en: http://www.proyectodime.info/dime/que-es-dime/
21. Decisiones informadas en medicamentos de alto costo. DIME. Medicamentos observados. [Internet]. [Consultado 28 de noviembre de 2017]. Disponible en: http://www.omaif.org/medicamentos-observados
22. EUnetHTA Joint Action 2, Work Package 8. HTA Core Model ® version 3.0 (Pdf); 2016. Available from www.htacoremodel.info/BrowseModel.aspx.
23. Treweek, S., Oxman, A. D., Alderson, P., Bossuyt, P. M., Brandt, L., Brożek, J.,et al. Developing and evaluating communication strategies to support informed decisions and practice based on evidence (DECIDE): protocol and preliminary results. Implementation Science: IS, 8, 6. 2013. Disponible en: http://doi.org/10.1186/1748-5908-8-6.
Recibido:5 de diciembre de 2017
Aceptado: 19 de diciembre de 2017
Correspondencia: Hernando Gaitán Duarte • hggaitand@unal.edu.co