Efectividad de la premedicación con N-acetil cisteína más dimetilpolisiloxano versus un placebo para mejorar la visibilidad en la endoscopia digestiva: estudio prospectivo, ciego, controlado aleatorizado
Martín Alonso Gómez-Zuleta1, Oscar Fernando Ruíz-Morales2, William Otero-Regino3
Resumen
Introducción: el cáncer gástrico es el tumor maligno que genera mayor mortalidad en Colombia. Para su tratamiento es fundamental detectarlo en un estadio temprano de desarrollo. Infortunadamente en Colombia, más del 90 % de los casos se diagnostican en estado avanzado a diferencia de Japón donde menos del 50 % tienen esta característica. Esto se debe a que, en ese país, se practican endoscopias (EVDA) de tamización y porque todas se preparan con una solución que permite limpiar el moco y la saliva. Objetivo: evaluar si la preparación con una solución antes de la EVDA permite mejorar la visibilidad del estómago. Diseño: se trata de un estudio prospectivo, ciego controlado y aleatorio, que se realizó entre enero y junio de 2016. Métodos: los pacientes provenientes de consulta externa y a quienes se les realizó endoscopia EVDA fueron asignados al azar en dos grupos. Al Grupo A, se le administraron 100 ml de agua mezclada con 400 mg de N-acetil cisteína (NAC) y 200 mg (3 cm3, solución a 66 mg/cm3) de dimetilpolisiloxano (DMPS) media hora antes del examen; mientras que al Grupo B, solo se le administraron 100 ml de agua media hora antes. Todas las soluciones se prepararon en frascos tapados para que ni el paciente, ni el médico vieran el contenido. Después de la endoscopia, se evaluó la preparación en una escala visual previamente validada y se compararon los resultados obtenidos en los dos grupos. Resultados: En total, se incluyeron 203 pacientes con un promedio de edad de 57 años de los cuales el 62,2 % eran mujeres. El Grupo A estaba integrado por 98 pacientes y el Grupo B, por 105. No se presentaron diferencias significativas en cuanto a edad o sexo en ninguno de los dos grupos. Al evaluar la visibilidad de la mucosa se detecta que el Índice de visibilidad total (IVT) fue de 4,8 ± 2,2 en el Grupo A versus 7,4 ± 2,9 en el Grupo B, con una p<0,00. En cuanto a los hallazgos endoscópicos, se encontró que: en tres pacientes del Grupo A se diagnosticó cáncer temprano versus ninguno en el Grupo B; en ocho pacientes del Grupo A se encontraron pólipos versus cuatro del Grupo B; en el 71,4 % de los casos el médico sugirió una pangastritis en el Grupo A versus el 53,2 % del Grupo B. Conclusiones: la preparación con una solución de 100 ml de agua que contiene NAC más DMPS suministrada media hora antes de la endoscopia, es factible y mejora significativamente la visibilidad de la mucosa del estómago, lo cual propicia que se puedan detectar más lesiones estructurales de la mucosa gástrica.
Palabras clave: endoscopia digestiva alta, dimetilpolisiloxano, N-acetilcisteína, cáncer de estómago, tamizaje._______________________
1. MD., Esp. Medicina interna, Esp. Gastroenterología. Profesor Asociado Universidad Nacional de Colombia. Servicio de Gastroenterología
Hospital Nacional Universitario. UGEC. Gastroenterólogo, Hospital Universitario Fundación Santa Fe de Bogotá. Bogotá, Colombia.
2 MD., Esp. Medicina interna, Esp. Gastroenterología. Hospital Nacional Universitario y Hospital de Kennedy. Bogotá, Colombia.
3 MD., Esp. Medicina interna, Esp. Gastroenterología. Profesor titular de Gastroenterología, Universidad Nacional de Colombia.
Hospital Nacional Universitario. Bogotá, Colombia.
________________________
Effectiveness of pre-medication with N-acetyl-cysteine plus dimethylpolysiloxane versus placebo to improve visibility in digestive endoscopy: prospective, blind, controlled, randomized study
Abstract
Introduction: Gastric cancer is the most prevalent malignant tumor in Colombia, its treatment is essential to detect it at an early stage. Unfortunately in Colombia, more than 90 % of the cases are diagnosed in an advanced stage; unlike in Japan where less than 50 % are advanced, this is because screening upper digestive-tract endoscopies (UDTE) are done and because all are premedicated with a solution that cleans mucus and saliva. The main objective of this paper is to evaluate if the preparation with a solution before UDTE improves gastric visibility. Design: This is a prospective, double-blind, randomized, and controlled study conducted between January and June 2016. Material and methods: Outpatients receiving UDTE were randomized into two groups. Group A was given 100 ml of water mixed with 400 mg of N-acetyl cysteine (NAC) and 200 mg (3 cm3, 66 mg / cm3 solution) of DMPS half an hour before the test. For those in Group B, only 100 ml of water were administered half an hour earlier. All the solutions were prepared in capped bottles so that their contents were seen neither by the patient nor the doctor. After endoscopy, preparation was evaluated on a previously validated visual scale and the results were compared between the two groups. Results: In total we included 203 patients with a mean age of 57 years, of which 62.2 % were women. In group A we included 98 patients and 105 in group B. There were no differences in age or sex in either group. When assessing the visibility of the mucosa we found that the total visibility index or IVT was 4.8 ± 2.2 in group A versus 7.4 ± 2.9 in group B with a p<0.00. As for the endoscopic findings, we found that in 3 patients in group A, an early cancer was diagnosed vs none in group B; in 8 patients of Group A, polyps were found vs 4 in group B; in 71.4 % of the cases the physician suggested a pangastritis in Group A versus 53.2 % of group B. Conclusions: A preparation with a 100 ml solution of water containing NAC plus DMPS half an hour before endoscopy is feasible and significantly improves the visibility of the stomach mucosa, which makes possible to detect more cases of structural lesions.
Key words: Upper digestive tract endoscopy, dimethypolisyloxane, N-acetyl-cysteine, gastric cancer, screening.
Introducción
El cáncer gástrico (CG) es un tumor que tiene una alta prevalencia y mortalidad a nivel mundial. En el año 2012, se produjeron 952.000 casos nuevos de CG en el mundo, convirtiéndolo en el quinto cáncer más frecuente después del cáncer de pulmón, seno, próstata y colorrectal; además conllevó 738.000 muertes, constituyendo la segunda causa principal de muerte por cáncer (1). En Colombia, el CG representa la primera causa de muerte por cáncer en hombres y la tercera en mujeres. El país se encuentra entre los que presentan la más alta tasa de incidencia (17,4 a 48,2 por 100.000 habitantes) (2). Esta situación es similar a la encontrada en países asiáticos como Japón, Corea y China, los cuales contribuyen con el 73% de todos estos cánceres (3).
Por otra parte, el cáncer gástrico temprano (CGT) puede definirse como aquel que solo invade la submucosa con o sin compromiso ganglionar. La importancia de la detección de la enfermedad en esta etapa consiste en que el pronóstico temprano en el paciente contribuye a la sobrevida a 5 años, lo cual representa casi el 100%, comparado con el sombrío pronóstico del cáncer gástrico avanzado (CGA) (compromiso más allá de la zona muscular propia) en el que la sobrevida a 5 años apenas llega al 10% (4).
La endoscopia digestiva alta constituye el método diagnóstico de elección para detectar el CGT, pues demuestra una exactitud en los resultados del 90 al 96%. Infortunadamente en el medio, menos del 5% de los pacientes con CG se diagnostican en estado temprano a diferencia de Japón donde este porcentaje es superior al 50%. De acuerdo con lo anterior, en ese país, se puede detectar la enfermedad en la fase en la que aún se puede curar al paciente; no en un estado avanzado donde no solo disminuyen las probabilidades de curación, sino en el que se utilizan más recursos en el manejo. En efecto, si se detecta el CGT a tiempo, se puede manejar por medio de una cirugía endoscópica ambulatoria; a diferencia del tratamiento para el CGA que requiere no solo cirugías complejas y mutilantes, sino tratamientos largos de quimioterapia y radioterapia que son más costosos para el sistema y son paliativos, no curativos (5).
Por ese motivo, se hace imperativo tratar de aplicar el sistema japonés de detección del cáncer gástrico. Este involucra la realización de exámenes de tamización (los cuales no se realizan en Colombia) y la preparación del paciente para la endoscopia con un líquido administrado media hora antes del examen, el cual incluye dos componentes principales pronasa y DMPS, o pronasa y simeticona. El primer componente es un mucolítico y el segundo elimina las burbujas de la saliva. Apoyando esta idea, múltiples estudios en Japón han demostrado que la premedicación con estas sustancias aumenta la tasa de detección del cáncer temprano tras mejorar la visibilidad en la endoscopia (6- 8). Esto es coherente, si se comprende que, cuando se realiza una endoscopia, siempre se encuentra abundante saliva y moco que cubre la mucosa, lo cual contribuye a ocultar lesiones muy pequeñas que podrían indicar el inicio de un cáncer gástrico y que el endoscopista puede pasar por alto si no las lava con abundante agua y paciencia.
En ese sentido, el uso del procedimiento tradicional no solo aumenta el tiempo del examen, sino la incomodidad del paciente si se practica sin sedación, e incluso los requerimientos de la sedación si se hace con ésta. En nuestro país, no preparamos a los pacientes con estas sustancias entre otras causas por desconocimiento del tema y porque el primer componente de la preparación, la pronasa, no se encuentra disponible y es muy costosa su importación. No obstante, la N-acetil cisteína (NAC) es un medicamento económico y ampliamente usado en nuestro país como sustancia mucolítica en neumología. De acuerdo con lo anterior, los autores de este artículo consideran que esta puede reemplazar a la pronasa en la mezcla con el DMPS, por lo cual se decidió realizar este estudio prospectivo para evaluar si la mezcla mejora la visibilidad de la endoscopia.
Materiales y métodos
El objetivo principal del trabajo consiste en evaluar si los pacientes premedicados con NAC más DMPS (Grupo A) presentan una mejor visibilidad en la endoscopia que los pacientes a los cuales se les administra un placebo (agua) (Grupo B). Dentro de los objetivos secundarios, se persigue evaluar si en los pacientes del Grupo A se detectan más lesiones estructurales: pólipos, úlceras o cáncer gástrico que en el B. En esa vía, se trata de un estudio doble ciego, aleatorizado, controlado con placebo, que se llevó a cabo en un hospital de tercer nivel entre enero y junio del año 2016, con pacientes consecutivos remitidos a la unidad para la realización de endoscopia digestiva alta.
Se incluyeron en total 203 pacientes, quienes aceptaron y firmaron el consentimiento informado. Los pacientes con antecedentes de cirugía digestiva alta, cáncer gástrico, hemorragia gastrointestinal, ingestión de cáusticos, embarazo, asma y reacciones alérgicas fueron excluidos. Este estudio fue aprobado en el comité de ética de la Universidad Nacional de Colombia. Los pacientes se asignaron al azar en dos grupos: al Grupo A se le administró 100 ml de agua mezclada con 400 mg de NAC y 200 mg (3 cm3 solución a 66 mg/cm3) de DMPS media hora antes de la endoscopia y al Grupo B solo se le administraron 100 ml de agua.
Todas las soluciones se prepararon en frascos tapados para que ni el paciente ni el médico vieran su contenido. Con todos los pacientes, se diligenció un formulario que incluía las principales variables demográficas, la escala de preparación, los hallazgos endoscópicos y la patología. Todos los procedimientos endoscópicos se realizaron por un único endoscopista (MG) con una experiencia superior a 100.000 endoscopias. Las endoscopias se practicaron de la forma usual en decúbito lateral izquierdo, con anestesia tópica en la garganta y sin sedación. El endoscopio utilizado fue un endoscopio EPK 1000 (PENTAX, Japón).
Durante la endoscopia, se evaluaron cuatro sitios distintos del estómago: el antro, la curvatura mayor, la curvatura menor, y el fondo gástrico. Para evaluar la visibilidad de la mucosa, se utilizó una escala validada, conocida como sistema de puntuación de Chang et al (7). Esta escala valora cada una de las cuatro áreas descritas del estómago y le asigna una puntuación de 1 a 4 así:
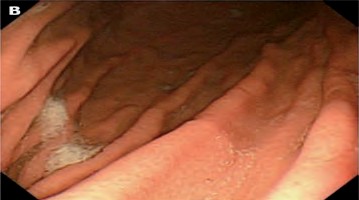
- Puntuación 1. (Figura 1) No se detecta pre- sencia de moco adherente sobre la mucosa gástrica.
- Puntuación 2. (Figura 2) Hay poca cantidad de moco en la mucosa gástrica, pero no altera la visión.
- Puntuación 3. (Figura 3) Se nota gran cantidad de moco en la mucosa gástrica que necesita menos de 50 ml de agua para limpiar.
- Puntuación 4. (Figura 4) Se evidencia gran cantidad de moco sobre la mucosa gástrica que requiere más de 50 ml de agua para poder limpiar el moco.
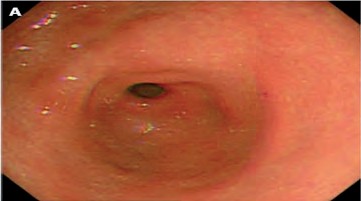 |
| Figura 1. Puntuación 1 Fuente: Toma propia. |
|
| Figura 2. Puntuación 2 Fuente: Toma propia. |
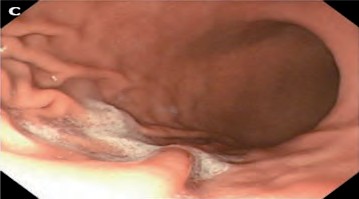 |
| Figura 3. Puntuación 3 Fuente: Toma propia. |
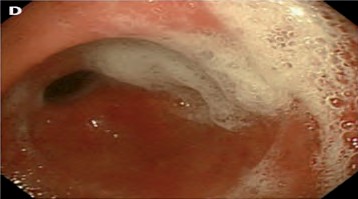 |
| Figura 4. Puntuación 4 Fuente: Toma propia. |
La suma de las puntuaciones de visibilidad de las cuatro áreas del estómago se considera como el IVT para cada paciente. Se valora de 4 a 16. Si se obtiene un 4, se logró la mejor visibilidad debido a que la mucosa en las cuatro áreas es óptima y, 16 representa la visibilidad más mala.
Análisis estadístico
Las características demográficas se evaluaron mediante una prueba de chi-cuadrado o análisis de varianza de una sola vía. Las puntuaciones de visibilidad de los dos grupos se valoraron mediante un análisis de varianza de una sola vía con comparaciones múltiples de Tukey. Los resultados se expresaron como media ± desviación estándar. P<0,05 fue considerado un resultado estadísticamente significativo. Para estimar si la mezcla de NAC más DMPS constituye un limpiador de la mucosa gástrica significativamente eficaz, se necesitaban reclutar alrededor de 80 pacientes en cada grupo (p<0,05; 95% de potencia). Considerando la pérdida de datos y errores de seguimiento, se registraron pacientes adicionales.
Resultados
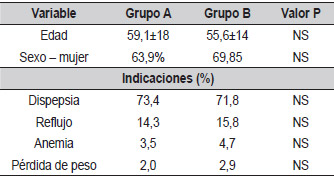
En total, se incluyeron 203 pacientes con un promedio de edad de 57 años, de los cuales 62,2% eran mujeres. El Grupo A estaba constituido por 98 pacientes y el Grupo B, por 105. En la Tabla 1 se muestran las principales características demográficas en cada uno de los grupos. No se presentaron diferencias en cuanto a edad o sexo en ninguno de los dos grupos. Tampoco se describieron diferencias en cuanto a las comorbilidades asociadas, las principales de ellas fueron hipertensión (15,4% versus 13,5%) y diabetes mellitus (4,1% versus 5,6% en el Grupo A y Grupo B respectivamente).
| Tabla 1. Principales características demográficas. |
Fuente: elaboración propia |
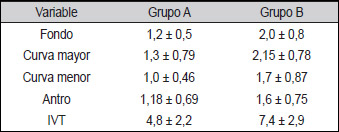
En cuanto al Índice de Visibilidad Total (IVT), se encontró que fue de 4,8 ± 2,2 en el Grupo A versus 7,4 ± 2,9 en el Grupo B con una p<0,001. Cuando se discriminaron cada una de las cuatro zonas (Tabla 2) se determinó que el rendimiento fue mejor en el Grupo A para zonas como el fondo del estómago 1,2 ± 0,5 versus 2,0 ± 0,8 y la curva, mayor 1,3 ± 0,79 versus 2,15 ± 0,78. Sin embargo, la puntuación registró inferioridad (mejor visibilidad) en las otras dos áreas para el grupo de pacientes que se preparó en comparación con el grupo que recibió el placebo.
| Tabla 2. Índice de Visibilidad Total en cada una de las cuatro zonas |
Fuente: elaboración propia |
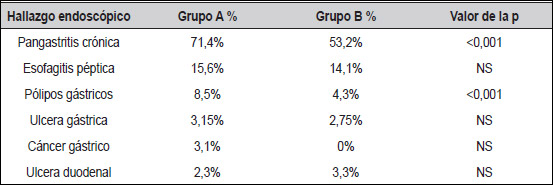
En cuanto a los hallazgos endoscópicos (Tabla 3), se halló que en tres pacientes del Grupo A se diagnosticó un cáncer temprano en comparación con ninguno del Grupo B. En ocho pacientes del Grupo A, se encontraron pólipos, mientras en el Grupo B cuatro hubo pacientes. En el 71,4% de los casos del Grupo A, el médico sugirió una pangastritis y en el Grupo B fue en el 53,2%. 68 pacientes del Grupo A fueron positivos para infección por Helicobacter pylori y 72, en el Grupo B (P NS).
| Tabla 3. Hallazgos endoscópicos |
Fuente: elaboración propia |
Discusión
En Colombia, más del 90% de los casos de CG se detectan en estado avanzado de desarrollo cuando el porcentaje de sobrevida a 5 años es menor al 10%, contrario a lo que ocurriría si se diagnostica de manera temprana, en cuyo caso sería mayor al 90%. Este tumor presenta una ocurrencia frecuente en los pacientes con dispepsia. Un estudio en pacientes con dispepsia no investigada que fueron sometidos a endoscopia digestiva alta (9) por este grupo encontró CG en el 9% de pacientes; de esos casos, 40 se diagnosticaron en etapas avanzadas de desarrollo y solo 10, en etapas tempranas. El 18% de los CGA y el 50% de los tempranos no manifestaban ninguno de los síntomas de alarma. En Colombia, el cáncer gástrico tiene una ocurrencia frecuente y se le pone muy poca atención a diferencia de Japón donde los programas masivos de prevención han logrado disminuir de manera significativa la mortalidad por este tumor mediante la detección temprana. Eso incide en que se pueda tratar más fácil e incluso curar. Eso se logra porque se realizan endoscopias de tamización y se prepara a los pacientes antes de las endoscopias con sustancias que lavan el estómago y permiten una mejor evaluación de la mucosa (9).
Para una mejor visualización de la mucosa gástrica, resulta fundamental la disminución de la cantidad de moco y las burbujas de saliva durante la endoscopia. Para lograrlo, la premedicación adecuada puede eliminar la necesidad de lavar el estómago durante el procedimiento, lo cual no solo es engorroso, sino que prolonga el tiempo del examen. En Japón, se utiliza ampliamente la pronasa como agente mucolítico antes de la endoscopia gastrointestinal. Un estudio aleatorio desarrollado por Fujii y et al (10) mostró que la premedicación con pronasa mejoró significativamente la visibilidad e las zonas de estudio y también acortó significativamente el tiempo de práctica del examen de la endoscopia. Kuo y et al (8) también concluyeron que la premedicación con 2.000 U de pronasa, 1,2 g de bicarbonato de sodio y 100 mg de DMPS en 100 ml de agua proporcionan visibilidad más clara durante la endoscopia. Sin la aplicación de DMPS, la pronasa sola no mejora la visibilidad en la endoscopia (12).Del mismo modo, en este estudio, se determinó que en el Grupo A (premedicación con NAC más DMPS en 100 ml de agua) la endoscopia presentó un mejor IVT que en el Grupo B donde solo se usó agua. En comparación con el estudio realizado por Kim y et al (11) no se utilizó pronasa (la cual no se consigue en nuestro medio), sino NAC. Los resultados obtenidos, sin embargo, fueron similares en el IVT 4,9 ± 1,5 para el estudio de Kim y 4,8 ± 2,2 para este trabajo. De esa manera, se asegura un mejor resultado en el examen que se reflejó en los hallazgos endoscópicos. Así pues, se lograron encontrar más lesiones estructurales como pólipos, úlceras e incluso tres casos de cáncer gástrico que probablemente no se hubieran detectado sin la preparación.
Por otra parte, se sabe que cuando el eritema de la mucosa se encuentra en el antro, se diagnostica una gastritis crónica antral. Sin embargo, el diagnóstico de una pangastritis es más grave, esto es, cuando el eritema está en el antro y en el cuerpo, porque puede tratarse de una lesión que afecte la secreción del ácido por el cuerpo gástrico y que conlleve a una atrofia, lesión premaligna que amerita seguimiento del paciente (12). Un hallazgo muy interesante del trabajo estiba en el hallazgo de varios pacientes en los cuales el diagnóstico endoscópico era de pangastritis para el grupo preparado 71,4% contra el 53,2% del Grupo B. La cifra es estadísticamente significativo y denota que el endoscopista podía ver mejor la gastritis o inflamación ante la ausencia de moco y saliva en el cuerpo del estómago.
Respecto a cómo funciona la premedicación, el líquido cae al fondo del estómago, luego se dirige por la curva mayor al antro y limpia a su paso el moco y la saliva presentes. Normalmente, se produce más de un litro de saliva al día la cual es deglutida constantemente. La NAC constituye un agente mucolítico empleado comúnmente tanto para la digestión del moco en la vía aérea, como para limpiar el moco de la mucosa del esófago y permite la detección de cáncer de esófago secundario al esófago de Barrett antes de la cromoendoscopia con azul de metileno (13). Su eficacia radica en la mejora de la visibilidad de la mucosa del estómago durante la endoscopia. En este estudio, la NAC proporciona iguales resultados en el IVT del estómago que la pronasa a un costo inferior. Un sobre de NAC cuesta 500 pesos y se encuentra disponible en todo el país. El costo total de la preparación incluyendo la NAC y el DMPS es de solo 2.000 pesos por paciente lo cual es aceptable para los beneficios que nos proporciona.
Adicionalmente, en este trabajo se determinó que las áreas con mejor visualización son el antro (1,18 versus 1,6) y la curva menor (1,0 versus 1,7) y la que presenta menor visibilidad es la curva mayor (1,3 versus 2,15). Esto sugiere que se le debe prestar mayor atención a esta área debido al alto riesgo de que se pasen por alto lesiones situadas bajo del moco o la saliva. Por otra parte, se ha demostrado que la pronasa no tiene efecto sobre la prueba de ureasa rápida para Helicobacter pylori y en este trabajo se detecta que la NAC tampoco manifiesta ningún efecto puesto que el porcentaje de positividad para los dos grupos evaluados fue igual.
En conclusión, se puede anotar que la preparación con una solución de 100 ml de agua que contiene NAC más DMPS, suministrada media hora antes de la endoscopia es factible y mejora significativamente la visibilidad de la mucosa del estómago. Eso permite que se puedan detectar más lesiones estructurales de la mucosa gástrica. Si los resultados de este trabajo se comprueban en estudios más grandes y en otras unidades representaría un paso importante para mejorar la visibilidad de la cavidad gástrica y permitiría probablemente la detección del cáncer gástrico en estado temprano, eso reduciría radicalmente la tasa de mortalidad por este tumor en el país sin aumentar de manera significativa los costos.
Referencias
1. Ferlay J, Soerjomataram I, Ervik M, Shin HR, Bray F, Forman D, et al. Estimates of worldwide burden of cancer in 2012: GLOBOCAN 2012. IJC. 2010;
127 (12): 2893- 917.
2. Otero W, Gómez M, Castro D. Carcinogénesis Gástrica. Rev Col Gastroenterol. 2009; 24 (3): 314- 28.
3. Correa-Pelayo, Chen V. Gastric Cancer. Cancer
Surveys. 1994; 19 (20): 55- 76.
4. Gómez M, Otero R, Ruiz. Factores de riesgo para cáncer gástrico en pacientes colombianos. Rev Col Gastroenterol. 2009; 24 (2): 134- 43.
5. Correa P. Gastric Cancer: Overview. Gastroenterology
Clin North Am. 2013; 42 (2): 211- 7.
6. Tahara T, Shibata T, Nakamura M, Okubo M, Yoshioka D, Arisawa T, Hirata I. The mucosal pattern in the non-neoplastic gastric mucosa by using magnifying narrow-band imaging endoscopy significantly correlated with gastric cancer risk. Gastrointest Endosc.
2010; 71 (2): 429- 430.
7. Chang CC, Chen SH, Lin CP, Hsieh CR, Lou HY, Suk FM, et al. Premedication with pronase or N-acetylcysteine improves visibility during gastroendoscopy: an endoscopist-blinded, prospective, randomized study. World J Gastroenterol. 2007; 13 (3): 444- 7.
8. Kuo CH, Sheu BS, Kao AW, Wu CH, Chuang CH. A defoaming agent should be used with pronase premedication to improve visibility in upper gastrointestinal endoscopy. Endoscopy. 2002; 34 (7): 531-534.
9. Pineda L, Otero w, Gómez M, Arbeláez V, Otero E.
Enfermedad estructural y valor predictivo de la historia clínica en pacientes con dispepsia no investigada. Rev Colomb Gastroenterol. 2004; 19(1): 13- 25.
10. Fujii T, Iishi H, Tatsuta M, Hirasawa R, Uedo N, Hifumi K, Omori M. Effectiveness of premedication with pronase for improving visibility during gastroendoscopy: a randomized controlled trial. Gastrointest Endosc. 1998; 47 (5): 382- 387.
11. Kim GH, Cho YK, Cha JM, Lee SY, Chung IK. Effect of pronase as mucolytic agent on imaging quality of magnifying endoscopy. World J Gastroenterol. 2015;
21 (8): 2483- 2489.
12. Dinis-Ribeiro M, Areia M, de Vries AC, Marcos-Pinto R, Monteiro-Soares M, O’ Connor A, et al. Management of precancerous conditions and lesions in the stomach (MAPS): guideline from the European Society of Gastrointestinal Endoscopy (ASGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP), and the Sociedade Portuguesa de Endoscopia Digestiva (SPEED). Endoscopy.
2012; 44: 74- 94.
13. Kaltenbach T, Sano Y, Friedland S, Soetikno R.
American Gastroenterological Association (AGA) Institute technology assessment on image- enhanced endoscopy. Gastroenterology. 2008; 134 (1): 327- 40.
Recibido: 19 de febrero de 2017.
Aceptado: 14 de junio de 2017.