Cáncer y mitocondria: un aspecto central para el desarrollo y crecimiento tumoral
Sofía Isabel Freyre-Bernal1, Jhan Sebastián Saavedra-Torres2, Luisa Fernanda Zúñiga-Cerón2, Andrés Felipe Olaya-Castañeda3 y Carolina Salguero4
Resumen
Se sabe que las células tumorales consumen más glucosa que las no tumorales. Además, las células tumorales expresan isoformas embrionarias de enzimas para la glucólisis, permitiendo su mayor actividad y obtención de energía en los diversos procesos cancerígenos. Algunos autores han sugerido que la hipoxia del tumor actúa como regulador del metabolismo energético y que puede redirigir a las células tumorales a utilizar la glucólisis como fuente de provisión de ATP cuando hay limitación de oxígeno. Otros autores sugieren que ese es el resultado de mutaciones en oncogenes, genes supresores y enzimas de la vía glucolítica o del metabolismo oxidativo mitocondrial (Myc, Akt, p53, HIF1-α). La aplicación de la tomografía de emisión de positrones (PET) en los servicios de medicina nuclear y radiología ha permitido usar la mitocondria como un organelo para el diagnóstico de cáncer cuantificando una mayor captación de glucosa por las células tumorales respecto del tejido no tumoral adyacente, mediante el uso del análogo radioactivo no metabolizable de la glucosa (18FDG, 18F-2-desoxiglucosa). Así pues, las investigaciones se han centrado en el metabolismo alterado como parte del desarrollo y crecimiento tumoral con el objetivo de inhibir la progresión a la metástasis de esta patología en los pacientes que no se pueden recuperar recibiendo tratamiento con quimioterapia y la radioterapia. El objetivo de esta revisión documental consiste en resaltar las generalidades e importancia de las mitocondrias en los mecanismos que promueven el cáncer.
Palabras claves: mitocondria; adenosín trifosfato; biogénesis de organelos; apoptosis; cáncer; medicina nuclear. (DeCS)
Cancer and mitochondria: a central aspect to tumor development and growth
Abstract
Tumor cells consume more glucose than the non-tumor cells. In addition, tumor cells express isoforms of embryonic glycolytic enzymes with higher activity to obtain energy in the various carcinogenic processes. Some authors have suggested that hypoxia of the tumor acts as a regulator of energy metabolism and can redirect to tumor cells to use the glycolysis as source for the supply of ATP when there is limitation of oxygen. In contrast, other authors suggest that this phenomena is the result of mutations in oncogenes, tumor suppressor genes and enzymes of the glycolytic pathway or oxidative metabolism mitochondrial including Myc, Akt, p53, HIF1-α. The application of Positron Emission Tomography (PET) in nuclear medicine services and radiology has allowed the use of mitochondria as an organelle that serves to diagnose cancer, quantify greater uptake of glucose by tumor cells on adjacent non-tumor tissue using analogue radioactive non-metabolizable glucose (18FDG, 18F-2-desoxiglucosa). Such research has focused on altered metabolism as part of development and tumor growth to inhibit the progression of cancer to metastases in patients that cannot be recovered by chemotherapy and radiation therapy. The aim of this review is to highlight the generalities and importance of mitochondria in the mechanisms that promote cancer.
Key words: mitochondria; adenosine triphosphate; organelle biogenesis; apoptosis; cancer; nuclear medicine. (DeCS)
_______________________
1. Bioquim. MSc. Docente. Departamento de Ciencias Fisiológicas, Facultad de Ciencias de la Salud, Universidad del Cauca, Popayán, Colombia.
2 Estudiantes del programa de Medicina, Facultad de Ciencias de la Salud, Universidad del Cauca, Grupo de Investigación en Salud
(GIS), Popayán, Colombia.
3 Estudiante del programa de Biología, Facultad de Ciencias Naturales, Exactas y de la Educación, Universidad del Cauca, Popayán, Colombia.
4 Bioquim, PhD. Departamento de Biología Celular y Molecular, Universidad de Harvard, Cambridge, Massachusetts, USA.
Introducción
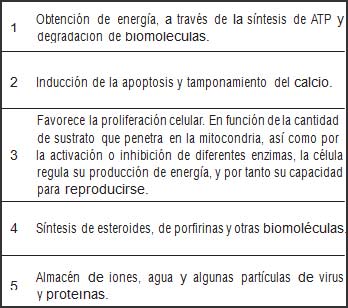
Las mitocondrias desempeñan diversas funciones entre ellas la producción de ATP y la de algunos intermediarios biosintéticos y también contribuye a dar respuesta ante el estrés celular mediante mecanismos como la autofagia y la apoptosis. Conforman una red dinámica que está integrada a otros compartimentos celulares (1). En este sentido, cumplen un papel fundamental en la generación de energía metabólica en las células eucariotas, responsables de la producción de la mayor parte de la energía útil derivada de la descomposición de los carbohidratos y ácidos grasos, que se convierte en ATP mediante el proceso de la fosforilación oxidativa (2) (Tabla 1).
| Tabla 1. Funciones generales de la mitocondria. |
Fuente: elaboración propia. |
Metodología
Se desarrolló una revisión bibliográfica en un margen de tiempo de 100 años, entre 1916 y 2016, con el objetivo de rastrear la evidencia actual validada y la evidencia histórica que aborda los estudios sobre la mitocondria. De ese modo, se recolectó un total de 106 documentos seleccionados a partir de la búsqueda bibliográfica en las bases de datos: Scielo, Elsevier, Pubmed, Redalyc, Springer, ScienceDirect, Medwave, Nature Reviews, Cochrane, EBSCO, Naxos y algunas bases de datos a las que ofrecen acceso la Universidad del Cauca y la Universidad de Harvard.
La búsqueda se limitó a la revisión de artículos publicados en el idioma inglés y español. Se desarrolló utilizando los términos DeCS: proteínas mitocondriales, ADN mitocondrial, cáncer, fosforilación oxidativa y angiogénesis. Para la gestión y la organización de la información, se utilizó el programa de libre acceso Mendeley; y se seleccionaron únicamente los estudios de los tipos: estudios experimentales, artículos originales y artículos de revisión documental que demostraran rigor sistemático en los análisis y que se enfocaran en los aspectos bioquímicos, biológicos, patológicos y experimentales acerca de los descubrimientos innovadores sobre la función de la mitocondria en los procesos cancerígenos. Adicionalmente, se realizaron revisiones de libros, manuales, mapas conceptuales y archivos que contuvieran información relevante y constatada sobre la biología y fisiopatología del cáncer en la actualidad. Finalmente, se construyó un marco teórico representado en la estructura del presente artículo.
La mitocondria y la síntesis de energía: la fosforilación oxidativa
La fosforilación oxidativa, que tiene lugar en la membrana interna mitocondrial, constituye un proceso de obtención de energía a partir de dos mecanismos íntimamente relacionados: el transporte de electrones, cuya ocurrencia se da en la cadena respiratoria, y la gestión del gradiente de protones a través de la ATP sintasa (3). Los substratos para estos procesos, en especial el poder reductor en forma de NADH y FADH, se obtienen a través de los procesos degradativos que tienen lugar en la matriz mitocondrial, tales como el ciclo de Krebs y la beta oxidación de ácidos grasos (4).
La cadena respiratoria se encuentra formada por cuatro complejos proteicos (numerados del I al IV), por los cuales transitan los electrones desde el NADH y FADH2 hasta su incorporación en el oxígeno para formar agua, y dos complejos transportadores que se encargan de canalizar los electrones entre los complejos proteicos (4). Todos los complejos proteicos tienen en común un centro metálico que en el caso de los complejos I, II y III es sulfoférrico, mientras que en el complejo IV es de cobre (3). La diferencia en la disposición y número de moléculas metálicas que intervienen en el proceso condicionan las diferencias del poder reductor de los complejos (4).
Adicionalmente, el tránsito de los electrones a través de los diferentes complejos proteicos de la cadena respiratoria genera un potencial REDOX que se utiliza para crear un gradiente de protones entre el espacio intermembrana y la matriz mitocondrial, ahí los protones ingresan a dicho espacio. El retorno a la matriz de los protones a favor de gradiente a través de la ATP sintasa produce cambios en la configuración espacial de esta, lo cual posibilita la fosforilación del ADP y la producción de ATP (4).
Por otra parte, los complejos I, III y IV atraviesan la membrana mitocondrial interna y participan en el paso de protones desde la matriz mitocondrial al espacio intermembrana, mientras que el complejo II solo contacta con la matriz mitocondrial e interviene en el ciclo de Krebs aportando la enzima succinato deshidrogenasa. Esta enzima facilita el paso de succinato a fumarato y la consiguiente reducción del FAD + a FADH (4). Sin embargo, cada complejo cumple con otras funciones (4) así, el complejo IV recibe y almacena los electrones cedidos por el complejo III para entregarlos adecuadamente al oxígeno y formar agua, mientras que el complejo III posibilita la interrelación con los otros complejos transportadores dependientes de la ubiquinol- citocromo-c reductasa (CoQ y CytC-cardiolipina) (4).
En consecuencia, como se decía anteriormente, la cadena respiratoria se completa con dos complejos trasportadores: uno dentro de la membrana interna y de naturaleza lipídica (CoQ) que se encarga del transporte de electrones desde los complejos I y II al III; y otro de naturaleza proteica con centro férrico ubicado en el espacio intermembrana (CytC-cardiolipina) que se encarga del transporte de electrones desde el complejo III al IV. Cuando la cesión de electrones entre los complejos no es adecuada, se producen especies reactivas del oxígeno (ROS) (4).
El efecto Warburg
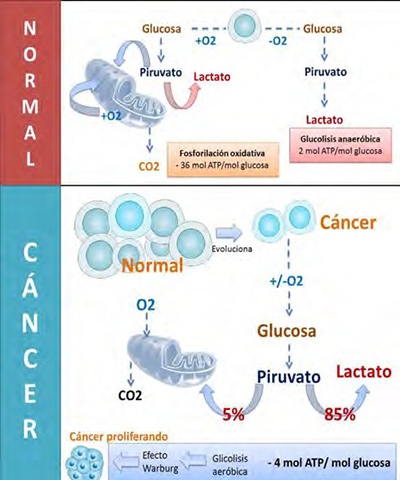
En el proceso conocido como glucólisis, la glucosa se introduce en la célula a través de los transportadores de glucosa y se metaboliza en piruvato en el citosol. Este proceso produce una pequeña cantidad de ATP, dos moléculas. En las células normales quiescentes, el piruvato derivado de la glucólisis se importa a la matriz mitocondrial donde posteriormente se convierte en acetil-CoA por la acción del complejo enzimático piruvato deshidrogenasa (PDH). La molécula de acetil-CoA participa en el ciclo de los ácidos tricarboxílicos (TCA) (ciclo de Krebs) en el que se genera poder reductor (NADH y FADH2) el cual se oxida mediante la fosforilación oxidativa. Este proceso es altamente eficiente para la generación de ATP. La oxidación completa de una molécula de glucosa produce 36 moléculas de ATP (38 si se incluyen los 2 ATPs producidos por la glucólisis) (5, 6).
La mayoría de las células cancerosas presentan alteraciones en el metabolismo de la glucosa (7). Comparadas con las células normales, las células cancerosas describen un incremento en la captación de glucosa y anomalías en la glucólisis. Este incremento en el consumo de glucosa genera una mayor cantidad de metabolitos glucolíticos y aumenta la cantidad de ATP generado por la glucólisis. Una gran parte del carbono proveniente de la glucosa, en la forma de varios intermediarios glucolíticos, se introducen en múltiples vías biosintéticas. La mayoría del piruvato generado durante la glucólisis se convierte ulteriormente en lactato en el citoplasma por la acción de la enzima lactato deshidrogenasa (LDH), se secreta y no se oxida en la mitocondria (5, 6).
Este cambio en el metabolismo fue observado por primera vez por Otto Warburg en 1924 quien lo nombró glucólisis aerobia o efecto Warburg. La hipótesis de Warburg sostenía que este metabolismo alterado era específico de las células del cáncer y que se originaba por defectos mitocondriales que inhiben la capacidad de oxidar de manera efectiva la glucosa a CO2. Una extensión de esta hipótesis propuso que las mitocondrias disfuncionales provocan cáncer (8, 9).
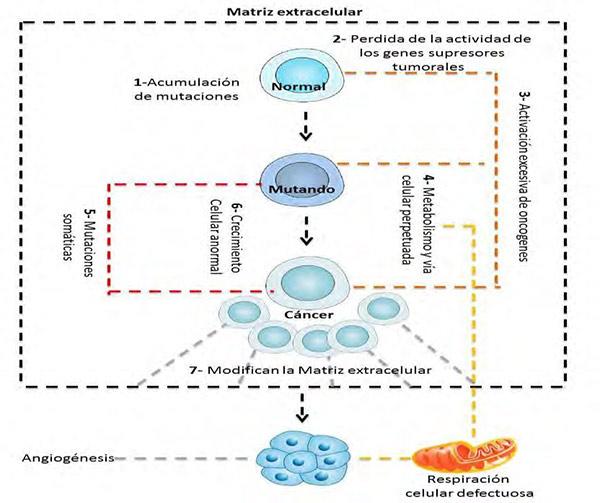
En la Figura 1, se aprecia cómo en la mitocondria normal sin activación de oncogenes se puede desarrollar la fosforilación oxidativa y la glucólisis anaeróbica en un equilibrio. Los tejidos tumorales metabolizan aproximadamente diez veces más glucosa a lactato que los tejidos normales en un tiempo dado. El efecto Warburg sostiene que lo que conduce a la carcinogénesis es una respiración celular defectuosa causada por un daño en las mitocondrias, además describe que las células cancerosas hacen uso de la glicólisis seguida de fermentación láctica como fuente de energía, incluso si hay oxígeno en cantidad apropiada para la respiración.
| Figura1. Comparación de los procesos en células normales y en células con cáncer. Fuente: elaboración propia |
|
Todos esos cambios causan daño oxidativo en la célula por acumulación de oxígeno reactivo en las especies (ORE). Esos compuestos inestables le pueden producir daño a los lípidos, a las proteínas y al ADN. Eso explicaría por qué se envejece y se puede tener predisposición al cáncer. Algunos genes mutados pueden hacer que la célula entre en lo que podría considerarse ‘vida eterna’, término inapropiado, pero que por motivos didácticos se contrapone con el de envejecimiento y muerte celular (apoptosis). Sin embargo, hay otros factores que contribuyen a conducir a las células a la apoptosis y hacer crecer nuevas células normales, el ADNmt se considera uno de los protagonistas de este proceso (10- 12).
Cuando falta el SOD, el antioxidante, la célula entra en oxidación y degeneración. En ese momento, cambia la información de los telómeros que cada vez se hacen más cortos y presentan pérdida de genes. Este proceso es producido por la enzima telomerasa que causa que estos se mantengan casi iguales a los normales y conduce a que la célula que presentaba inmortalidad, se reproduzca indiscriminadamente y se multiplique por todo el cuerpo; a ese proceso se le denomina cáncer (10-12). En condiciones normales, cuando el ADN del núcleo celular nota una alteración en la producción y formación de las células hijas, frena dicha producción e induce a la célula a la apoptosis. No obstante, si no puede hacerlo porque el daño ya es demasiado grave y no puede repararlo, la célula se sigue multiplicando en forma anómala y como consecuencia el paciente puede manifestar un cáncer o cualquier otra enfermedad degenerativa de origen neurológico o metabólico (10-12).
Los genes mitocondriales
La mitocondria posee su propio ADN el cual, aunque pequeño, codifica ciertas proteínas y complejos importantes para todas las funciones mitocondriales. Justamente por esa propiedad fue posible decodificarlo relativamente temprano, para 1981 todas sus secuencias fueron decodificadas (13). El ADN mitocondrial posee estructura circular y contiene aproximadamente 16.500 pares de bases, lo que lo hace más pequeño que el ADN nuclear. Todas las mitocondrias contienen muchas copias de cada molécula de ADN que se encuentran distribuidas en diferentes grupos por toda la matriz mitocondrial y se cree que se encuentran adheridas a la membrana mitocondrial interna. No se sabe con seguridad si el ADN mitocondrial se encuentra empacado, pero se cree que se parece más al bacteriano, que no posee histonas, que al nuclear. Aunque la cantidad de proteínas codificadas a partir de este ADN mitocondrial es muy poca, este genoma sufre procesos como la replicación, transcripción y traducción (13).
A partir del ARN de transferencia mitocondrial y de las secuencias de aminoácidos de proteínas codificadas por el genoma mitocondrial ha sido posible localizar todos los genes mitocondriales humanos en la molécula (13). Las mitocondrias contienen ADN y ARN, además de ribosomas para la biosíntesis de algunas proteínas en la matriz (14, 15). El ADN mitocondrial solo codifica el 1% de las proteínas de este orgánulo, la mayoría de ellas son codificadas en los genes nucleares, sintetizadas en los ribosomas del citosol e importadas a la mitocondria a través de señales de direccionamiento reconocidas por la translocasa del complejo de la mitocondria externa (16).
Los genomas mitocondriales muestran una gran variación como consecuencia de la evolución divergente (14). Los genes mitocondriales que se han conservado a través de la evolución incluyen genes ARNr, ARNt, y un pequeño número de genes que codifican proteínas implicadas en el transporte e electrones y la síntesis de ATP (17). Así pues, el genoma mitocondrial conserva similitud con su antepasado procariota, como hacer parte de la maquinaria para sintetizar proteínas. Además, algunos de los codones que las mitocondrias utilizan para especificar aminoácidos se diferencian de los codones eucariotas estándar. Sin embargo, la gran mayoría de las proteínas mitocondriales se sintetizan a partir de genes nucleares que se transportan hacia la mitocondria. Estos incluyen las enzimas requeridas para el ciclo del ácido cítrico, las proteínas implicadas en la replicación del ADN y la transcripción, y proteínas ribosomales (17).
Así pues, los complejos de proteínas de la cadena respiratoria comprenden una mezcla de proteínas codificadas por genes mitocondriales y proteínas codificadas por genes nucleares. Las proteínas tanto en las membranas mitocondriales externas e internas ayudan a transportar los compuestos recién sintetizados (17).
La apoptosis guiada por la mitocondria
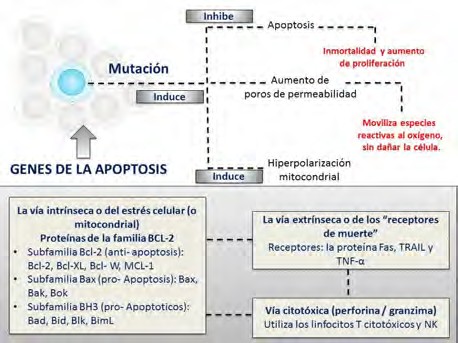
Los procesos de apoptosis se ejecutan normalmente durante el desarrollo para suprimir las células innecesarias o para eliminar las células que han sido dañadas por distintos agentes estresantes tales como la radiación o la oxidación (18). Si la apoptosis no opera correctamente se pueden presentar tumores (19), inmunodeficiencia, autoinmunidad o trastornos neurodegenerativos (20). Cuando los genes mutan y generan proteínas con acción antiapoptosis, la célula presenta una actividad de proliferación y supervivencia elevada; de esa forma se crea una actividad de hiperpolarización en la mitocondria para realizar los procesos de fermentación y regulación energética de la mitocondria oncogénica. A su vez, la mutación de estos genes posibilita que la célula pueda producir un desequilibrio aumentando en su producción de radicales libres, en la permeabilidad de los poros sin inducir a la apoptosis ni dañarla (Figura 2).
| Figura2. Los genes y la apoptosis. Fuente: elaboración propia. |
|
En la década de 1990, se obtuvo el primer indicio sobre el papel que desempeña la mitocondria en la inducción de la apoptosis cuando se demostró que la presencia de este organelo era necesaria para estimular la apoptosis en un tubo de ensayo (20). Desde entonces, los estudios se centraron en analizar diferentes características esenciales de este organelo para que desempeñe ese papel como por ejemplo: la capacidad de regular la permeabilidad de sus membranas controlando la liberación de componentes proteicos al citoplasma y la producción de radicales libres como el superóxido (20).
En ese contexto, la principal vía para la transmisión de una señal apoptótica (20) ocurre cuando el sistema nervioso se sobreexcita por la presencia de glutamato como pasa en los procesos isquémicos (21). En ellos, se ha observado una entrada masiva y prolongada del ion Ca2+ al citoplasma que es ‘detectada’ por la mitocondria (20). La unión de ligandos a receptores ‘de muerte’ como el TNFR1 o Fas localizados en la membrana citoplasmática activa las rutas de señalización que se dirigen a la mitocondria (22). Además, la célula también posee receptores de factores tróficos y citocinas que, si dejan de estimularse, desencadenan cascadas que conducen a modificaciones en la permeabilidad de las membranas de la mitocondria (20). Por último, el daño en el genoma celular puede ser detectado por ciertos factores de transcripción, como el p53, que inducen al incremento de las concentraciones citoplasmáticas de algunas proteínas que se traslocan a la mitocondria para ejercer el efecto proapoptótico (20, 23).
El gen p53 constituye el segundo gen supresor de tumores. La pérdida de su función se involucra en el desarrollo de cáncer de colon, mama, pulmón y cerebro. La inactivación puede ocurrir mediante la pérdida cromosómica o mutación. El gen Bcl-2 opera como gen regulador de la muerte celular programada (apoptosis). La proteína Bcl-2 funciona en la membrana celular de la mitocondria prolongando la vida de la célula individual y previniendo su apoptosis. El incremento en la vida de las células afectadas puede no conferir una transformación maligna, pero permite la activación de protooncogenes o la pérdida de la función de los genes supresores de tumores (24- 30). Todos los miembros antiapoptóticos de la familia de genes Bcl-2 se pueden comportar como oncogenes potenciales y algunas mutaciones pueden incrementar su expresión indirectamente como, por ejemplo, en las translocaciones observadas en linfomas y leucemias. Por otra parte, los miembros proapoptóticos de esta familia pueden actuar como genes supresores de tumores. Así, el gen Bax se encuentra mutado en algunas formas de cáncer gastrointestinal y en leucemias (24).
En ese sentido, el desafío que se encuentra por delante consiste en mapear las funciones, en las vías bioquímicas de apoptosis, de las proteínas apoptóticas encontradas recientemente. Eso permitirá entender mejor cómo la célula toma la decisión entre la vida y la muerte. Igualmente, es importante estudiar cómo estas vías se modifican en ciertas enfermedades humanas como las patologías neurodegenerativas y el cáncer; y cuánto de esta desregulación contribuye con su patogenia. De esa manera, se podrían diseñar nuevas estrategias terapéuticas para esas enfermedades (24, 31, 32).
Las caspasas, enzimas de la apoptosis que convergen en la mitocondria
Las caspasas son enzimas fundamentales para la muerte. La mayoría de estímulos que conducen a la apoptosis convergen en la mitocondria y provocan una permeabilización de su membrana externa. Con la permeabilización, se libera una serie de proteínas que activan las caspasas (33). Estas se localizan en forma de procaspasas en el citoplasma y en el espacio intermembranal de las mitocondrias, se activan mediante clivaje y actúan como ejecutoras que escinden moléculas de supervivencia celular y ponen en marcha las actividades que inducen a la muerte de la célula (33).
Actualmente, se han identificado 14 caspasas en mamíferos. Las caspasas 1 y 11 funcionan principalmente en el procesamiento de citocinas, mientras que las caspasas 2, 3, 6, 7, 8, 9, 10 y 12 participan en la regulación y ejecución de la apoptosis (33). La función de las otras caspasas todavía está por describirse. Así pues, estas son divididas en dos grupos: las caspasas iniciadoras con un dominio largo y las caspasas efectoras con un domino corto las cuales actúan sobre las endonucleasas y son las responsables directas de la fragmentación del ADN (33). La cadena de degradación proteica presenta sucesivos clivajes dependientes de la ubicación del ácido aspártico que se repite en la estructura de la enzima. Por lo pronto, se reconocen dos vías alternativas para activar las caspasas: la primera es iniciada por señales externas que activan un receptor de muerte en la superficie celular (vía extrínseca); y la segunda es activada por cambios en la integridad mitocondrial (vía intrínseca) (33).
Una baja apoptosis, el proceso responsable de la patología oncológica
De acuerdo con lo desarrollado anteriormente, cuando se descontrola la regulación de la apoptosis, se inicia el caos. La apoptosis constituye el proceso fundamental que permite que el desarrollo embrionario celular transcurra correctamente, posibilita que se eliminen los linfocitos B y T autorreactivos y permite que tengan lugar muchas otras funciones normales del organismo. Como mecanismo auto protector, la apoptosis se encarga de contrarrestar la proliferación celular descontrolada que se evidencia en los cánceres y que tiene lugar por la acumulación de mutaciones del ADN (11, 34- 36).
Si se muta una proteína importante para la defensa del organismo, como la p53, se pone en riesgo la función protectora de la apoptosis y se podrían acumular otras mutaciones sin que nada pueda impedirlo. Muchas funciones que se regulan con esta proteína se suelen considerar las principales inductoras del cáncer. Otro ejemplo de la importancia de este proceso se ve reflejado en el hecho de que algunos virus tienen la capacidad de bloquear la apoptosis y eso les permite replicarse con menos impedimentos haciendo posible que se diseminen con mayor rapidez. Simultáneamente, con una situación de ese tipo coexiste la posibilidad de modificar el ADN de la célula buena para estimular la progresión del cáncer (11, 37, 38).
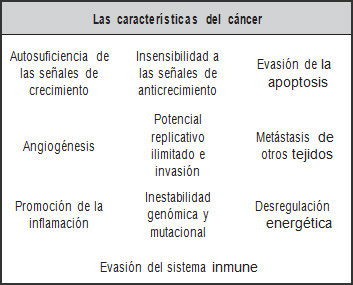
La célula del cáncer y su independencia
En los años 2000 y 2011, Hanahan y Weinberg resumieron la extensa investigación en cáncer producida en los últimos años y las 10 principales características del cáncer y su relación con la mitocondria en los artículos: Hallmarks of cáncer y Hallmarks of cáncer: the next generation (Tabla 2). Estos autores describen que las células cancerígenas pueden ser estimuladas por fenómenos infecciosos, inflamación, virus, tóxicos y demás acciones que permitan la proliferación de células anómalas. En dichas obras, destacan que, en los últimos años, se ha desplazado la visión centralista acerca del cáncer como una producción anómala de las mutaciones celulares, para considerar también que la evolución del tumor se basa en la aparición de cambios y estrés en el ecosistema celular que induce al genoma a la inestabilidad y produce mutaciones, activaciones de señales con secuencias erróneas y mecanismos de evasión del sistema inmune (39, 40) (Figura 3).
| Tabla 2. Las 10 principales características del cáncer y su relación con la mitocondria. |
Fuente: adaptado de Hanahan, & Weinberg (39, 40). |
Siguiendo esta línea, los tumores se desarrollan cuando las células normales sufren alteraciones genéticas que afectan los puntos de crecimiento. Eso deviene en un crecimiento desproporcionado que finalmente conlleva a la aparición de la enfermedad. A medida que las células pre-malignas evolucionan en su conversión a células cancerígenas, el ambiente que envuelve al tumor coevoluciona con él creando un circuito dinámico de interacción tumor-microambiente (39- 44).
| Figura 3. Cambios celulares que promueven la aparición del cáncer. Fuente: elaboración propia. |
|
Se estima que aproximadamente el 80% de los cánceres son carcinomas, es decir, cánceres que se originan en el tejido epitelial. El componente principal para el mantenimiento de este es el estroma que nutre, protege y da soporte al tejido epitelial. Vagamente, se podría decir que el estroma constituye el tejido conjuntivo que forma el entramado de un órgano y que incluye la matriz extracelular y las células que la sintetizan (fibroblastos, celulas endoteliales, etc.). Esta matriz extracelular está formada por una extensa red de colágeno, elastina y otras moléculas que dan soporte a toda la extensa red celular (45). Las células cancerígenas se comunican con su entorno durante el intercambio de moléculas solubles con el estroma de forma paracrina, lo cual provoca que el estroma se convierta en el soporte del tumor y que, por lo tanto, se facilite su progresión (cabe recordar que el éxito del tumor depende de su habilidad para sobrevivir en un microentorno inhóspito). Además de las células propias del estroma, las células inflamatorias también estarían presentes en este microambiente (40, 45).
La población de células cancerígenas modifica el microambiente con la promoción de la angiogénesis, es decir, mediante el reclutamiento de vasos sanguíneos para conseguir un aporte continuo de nutrientes. Adicionalmente, sufren cambios metabólicos que les permiten crecer cuando los vasos sanguíneos están alejados y no hay aporte de oxígeno (hipoxia). Otro aspecto crucial consiste en que pueden remodelar la matriz extracelular. Por ejemplo, las células cancerígenas tienen la capacidad de secretar metaloproteasas (MMPs) que degradan la matriz y les permite migrar lejos del tumor primario (40). Por lo tanto, los cambios en el microambiente del tumor promueven la migración y la invasión de las células cancerígenas produciendo la metástasis en otros órganos diferentes al del tumor primario (40, 46, 47).
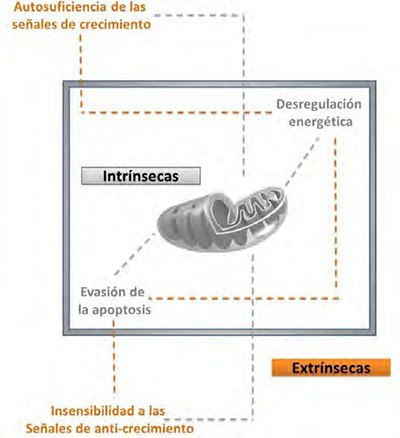
Ahora bien, se sabe que las células tienen una actividad óptima programada para evitar el estrés metabólico, pero solo en los procesos del cáncer se evidencia que también pueden valerse de propiedades y características que las conducen a potenciar vías metabólicas de alta eficiencia para reproducirse (40). En la Figura 4, se reflejan las cuatro características que participan en la actividad oncológica y su relación con la mitocondria, donde la evasión intrínseca de la apoptosis y la desregulación energética es llevada a cabo por la mitocondria para regular las señales externas y propias de la actividad mitocondrial (extrínsecas). Este proceso permite llevar acabo procesos de inestabilidad ante las señales de anticrecimiento a la célula que ha mutado sus genes mitocondriales y nucleares y generar una excesiva actividad de crecimiento y división celular.
| Figura 4. Características que participan en la actividad oncológica y su relación con la mitocondria. Fuente: elaboración propia. |
|
Protooncogenes y los genes supresores como reguladores del metabolismo
Cuando se habla de las bases genéticas del cáncer, tenemos que tener claro que las mutaciones en dos amplias clases de genes, los protooncogenes (por ejemplo: ras) y los genes supresores de tumor (por ejemplo: APC), desempeñan un papel muy importante en la inducción del cáncer (11). Estos genes codifican muchos tipos de proteínas que contribuyen a controlar el crecimiento y la proliferación celular (48- 50). Como es conocido, si un paso previo se efectuó de modo incorrecto o si se dañó el ADN, casi todos los tumores humanos presentan mutaciones inactivadoras en los genes que actúan en diversos procesos vitales del ciclo celular. Por ejemplo, la mayoría de los cánceres manifiestan mutaciones inactivadoras en los genes que codifican una o más proteínas que normalmente restringen la progresión a través del estadio G1 del ciclo celular. De igual manera, se encuentra una (ras) activa constitutiva u otra proteína de transducción de señales activada en diversos tipos de tumores humanos de diferentes orígenes (50, 51).
Cabe recordar que, se considera un oncogén a cualquier gen que codifica una proteína capaz de transformar células en cultivo o inducir cáncer. De los numerosos oncogenes conocidos, la mayoría derivan de genes celulares normales, como por ejemplo los protooncogenes cuyos productos promueven la proliferación celular (11, 50, 51). Otro ejemplo se evidencia cuando se habla del gen rasD, derivado mutante del ras, oncogén cuya proteína codificada provee una señal de crecimiento excesivo o descontrolado, permitiendo tener capacidades no solo nucleares en la célula afectada, sino también mitocondriales que permitan tener mayor número de factores de supervivencia en los metabolismos (11).
Por su parte, otros protooncogenes codifican las moléculas de señalización estimulante a los receptores encargados de procesos como el crecimiento, la supervivencia celular y algunos factores de transcripción. La conversión o activación de un protooncogén a un oncogén involucra por lo general una mutación con ganancia de función (50- 53). Al menos cuatro mecanismos permiten producir oncogenes a partir de los correspondientes protooncogenes:
1. Las mutaciones específicas: se entienden como el cambio en un único par de bases en un protooncogén que deriva en un producto proteico activo en forma constitutiva.
2. La translocación cromosómica: fusiona dos genes para producir un gen híbrido que codifica una proteína quimérica cuya actividad, a diferencia de las proteínas progenitoras, a menudo es constitutiva.
3. La translocación cromosómica: ubica un gen regulador de crecimiento bajo el control de un promotor diferente causando la expresión inadecuada del gen.
4. La amplificación: se entiende como la replicación anormal de un segmento de ADN que incluye un protooncogén de manera que se producen numerosas copias, eso conlleva a la sobreproducción de la proteína codificada.
De esa manera, un oncogén formado por cualquiera de los primeros mecanismos codifica una oncoproteína que se diferencia de la proteína normal codificada por el protooncogén correspondiente. Por el contrario, los otros dos mecanismos generan oncogenes cuyos productos proteicos guardan cierta identidad con las proteínas normales. El efecto oncogénico de estos últimos se debe a la sobreproducción de segmentos de ADN fuera de los rangos normales modificando, por ejemplo, la activación del núcleo y provocando cambios en la señalización mitocondrial (11).
La mayoría de los protooncogenes y de los genes supresores de tumores codifican componentes que participan en muchas vías de la transducción de señales y, tradicionalmente, su papel en la carcinogénesis se le atribuye a su capacidad de regular el ciclo celular y de sostener señales proliferativas que ayudan a las células a evadir la supresión del crecimiento y la muerte celular. Sin embargo, existe evidencia sobre la existencia de un concepto alterno que ha surgido en los últimos años, relacionado con la hipótesis de que la función primaria de los oncogenes activados y de los supresores de tumores inactivados es la reprogramación del metabolismo celular (5, 6). La evidencia también ha provocado que se desarrolle la propuesta de que los protooncogenes y los genes supresores de tumores evolucionaron para regular el metabolismo (54).
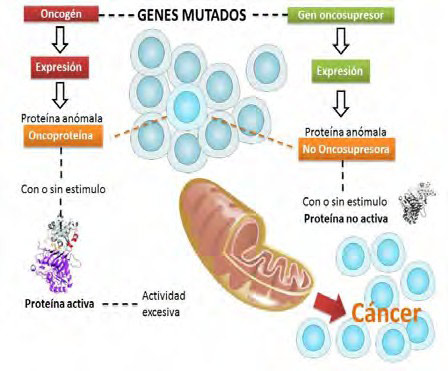
En la mitocondria, se desarrollan genes supresores de oncogenes que se comunican con el núcleo celular. Sin embargo, cuando estos genes mutan pierden la actividad regulatoria e inhibición hecho que genera un aumento de la actividad pro teica desarrollada por los oncogenes; que incide en la capacidad de activar con o sin estímulo las funciones que requiere la célula cancerígena para su supervivencia (Figura 5).
| Figura 5. Genes mutados y mitocondria. Fuente: elaboración propia. |
Fuente: adaptado de Hanahan, & Weinberg (39, 40). |
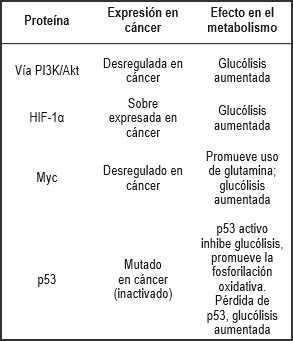
En la Tabla 3, se refleja la participación de los genes p53, Myc, HIF-1α, vía PI3K/Akt en el metabolismo del cáncer y los oncogenes c-Myc y AKT que se consideran implicados en la proliferación y supervivencia celular en cáncer. Se ha demostrado también que estos activan el metabolismo de la glucosa y pueden actuar en forma coordinada y armónica con el HIF. Cabe señalar que el cáncer y la disfunción mitocondrial conforman la última etapa de la cadena electrónica mitocondrial concerniente a la citocromo c-oxidasa, dependiente de p53.
| Tabla 3. La participación de los genes p53, Myc, HIF1α, Vía PI3K/Akt en el metabolismo del cáncer y los oncogenes c-Myc y AKT. . |
Fuente: Elaboración propia |
La mitocondria en el cáncer
Las mutaciones del ADNmt conllevan al desarrollo de una amplia variedad de cánceres. Estos incluyen adenocarcinoma renal, células de cáncer de colon, tumores de cabeza y cuello, tumores astrocíticos, tumores de tiroides, tumores de mama, tumores de ovario, de próstata y cáncer de vejiga, neuroblastomas y oncocitomas. Muchas mutaciones del ADNmt de las células cancerosas inhiben la fosforilación oxidativa. Aunque algunos de estos cánceres presentan asociaciones con polimorfismos ancestrales, otros pueden ser el resultado de mutaciones celulares de cáncer válido (55- 59). Las células cancerosas adquieren suficiente ATP para garantizar su proliferación y función sin cesar, esto ha logrado fascinar a muchos científicos durante casi un siglo (60, 61).
Como se había dicho anteriormente, los tejidos tumorales metabolizan aproximadamente diez veces más glucosa a lactato que los tejidos normales (59, 62). La hipótesis de Warburg sostiene que lo que conduce a la carcinogénesis es una respiración celular defectuosa causada por un daño en las mitocondrias (60, 61). El efecto Warburg describe que las células cancerosas hacen uso de la glicólisis seguida de fermentación láctica como fuente de energía, incluso si hay oxígeno en la cantidad apropiada para la respiración (63, 64). En otras palabras, en lugar de desarrollar un proceso de respiración completo en presencia de cantidades adecuadas de oxígeno, las células cancerosas se fermentan y siguen mutando para preservar su dominio tumoral (56, 65). En consecuencia, a nivel celular los tumores demuestran ventajas de supervivencia debido a la secreción de lactato (57, 66, 67).
El ácido láctico le confiere propiedades invasivas a las células tumorales afectando la estructura normal de los tejidos. Adicionalmente, la expresión del factor de crecimiento endotelial vascular y de su receptor (VEGF Y VEGFR) responde a diferentes estímulos para generar nuevos vasos sanguíneos a partir de los preexistentes (64, 68- 70). El VEGF estimula el crecimiento vascular endotelial celular, la supervivencia y la proliferación celular, regulada por la acción nuclear y mitocondrial de la célula. Asimismo, el VEGF y las mutaciones de genes, que conlleva a activar las metaloproteinasas para degradar la matriz extracelular, permiten una mayor acción metastásica (56, 70, 71,).
Estudios recientes han sugerido que el VEGF puede proteger las células de la apoptosis y aumentar su resistencia a la quimioterapia convencional y a la radioterapia (47, 72- 77). También se sugiere que el aumento de mutaciones en oncogenes, genes supresores de tumor y enzimas de la vía glucolítica o del metabolismo oxidativo mitocondrial (Myc, Akt, p53, HIF1-α) permiten generar potencializaciones para volver la célula cancerígena una célula metastásica eficiente (48, 55, 78- 81).
Adicionalmente, la proteína de factor inducible de hipoxia (HIF-1) se activa normalmente en respuesta a ciertas crisis celulares como la falta de oxígeno (82, 83). Los mecanismos normales y tumorales encargados de estimular la expresión de HIF-1, el cual se perpetúa cuando hay señales de daño al gen llamado SDH que se generó a partir de la célula con directrices de oncogenes para poder llevar una homeostasis única para el cáncer, consisten en suplir los altos niveles de glucosa y oxígeno que se presentan con el objetivo de poder replicarse sin control (56, 64, 84, 85).
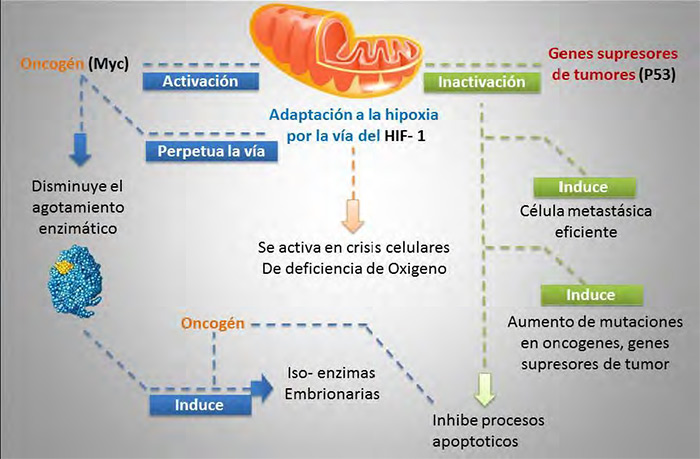
De acuerdo con lo que se muestra en la Figura 6, se han implicado la activación de oncogenes como el Myc, la inactivación de genes supresores de tumores como el p53 y la adaptación a la hipoxia por la vía del HIF-1 como mecanismos para estimular el efecto Warburg. El ADN mitocondrial codifica genes que pueden contribuir al desarrollo del cáncer tales mutaciones para proporcionar la adaptabilidad metabólica a la célula cancerosa. Por otra parte, la activación del MYC le permite a la mitocondria desarrollar poco agotamiento de enzimas metabolizantes para obtener energía a partir de lípidos y ácidos grasos. En el cáncer, la enzima piruvato deshidrogenasa es regulada para ajustar el flujo de la acetil-CoA y de los equivalentes de reducción en la mitocondria y para sostener la vía de la glucólisis tanto aeróbica como anaeróbica sin inducir procesos y genes de apoptosis. El metabolismo energético de cualquier célula proliferativa, ya sea cancerígena o no debe fundamentarse en una activa glucólisis. Afirmar hoy en día que las células tumorales consumen más glucosa que las no-tumorales no es ninguna novedad. Células tumorales usan y forman isoenzimas embrionarias para tener las vías metabólicas activas.
| Figura 6. Mecanismos para el cáncer Fuente: elaboración propia |
|
Variedad de combustibles metabólicos en las células tumorales
En las vías tumorales existe una gran variedad de combustibles metabólicos gracias a los cuales las células tumorales pueden utilizar una gran variedad de sustratos bioenergéticos como: la glutamina, la glucosa, los ácidos grasos, los cuerpos cetónicos y el acetato. Estos sustratos pueden ser proporcionados por las células del estroma en el microambiente (82, 86). En particular, la glutamina y la glucosa también pueden proporcionar bloques de construcción para garantizar la síntesis de muchas biomoléculas que permiten regular los procesos de oncogénesis. No hay que olvidar que las enzimas metabólicas con mutaciones se encuentran presentes en diversos tumores y los oncometabolitos acumulados, en los diversos tipos de tumores (86, 87).
Por otra parte, las células cancerosas también exhiben una mayor demanda de ácidos grasos además de glucosa y glutamina (59, 88). Los ácidos grasos pueden ser sintetizados de forma endógena o tomados a partir de fuentes exógenas. En los tumores de próstata, que importan menos glucosa que otros tumores (89), la β-oxidación de los ácidos grasos conforma una importante fuente de energía (90, 91). Adicionalmente, dos estudios recientes mostraron que el acetato constituye un sustrato bioenergético del glioblastoma y de las metástasis cerebrales (92). El catabolismo en las células del estroma y en los adipocitos ofrece combustibles y bloques de construcción para el crecimiento anabólico de células de cáncer a través del acoplamiento metabólico (49, 93).
La medicina nuclear y la función mitocondrial en el cáncer
La aplicación de la tomografía de emisión de positrones (PET) en los servicios de medicina nuclear y radiología como técnica de imagen para el diagnóstico y seguimiento de pacientes oncológicos (94) ha contribuido a consolidar los postulados de Warburg sobre el cáncer (95). Con esta técnica, se mide la mayor captación de glucosa por las células tumorales respecto del tejido no-tumoral adyacente utilizando el análogo radioactivo no-metabolizable de la glucosa (18FDG, 18F-2-desoxiglucosa). Se ha demostrado que la huella bioenergética correlaciona de forma inversa con la tasa de glucólisis aerobia en células derivadas de carcinoma colorrectal y con la tasa de captura de glucosa determinada por FDG-PET en carcinomas humanos de pulmón (96). En definitiva, estos hallazgos apoyan la teoría de que la actividad mitocondrial en la célula actúa como supresor tumoral (68).
El estudio de la huella bioenergética en series grandes de pacientes constituye una contribución fundamental para impulsar su traslación a la clínica. En este sentido, se ha puesto de manifiesto que la huella bioenergética opera como un marcador pronóstico en pacientes con cáncer de mama, colon y pulmón (97- 99). Del mismo modo, una elevada captación de FDG en el tumor permite discriminar grupos de pacientes con cáncer de pulmón que poseen un peor pronóstico (99). Además, la expresión de ß-F1-ATPasa en cáncer de mama y pulmón funciona como marcador independiente de la supervivencia de los pacientes (100). En este contexto, la huella bioenergética también ha resultado ser un marcador de la respuesta a quimioterapia en distintas células tumorales en cultivo, en tumores humanos en modelos murinos y en pacientes con carcinoma de colon (101, 102) de acuerdo con el papel que desempeña la H+-ATPsintasa en la muerte celular (103). Por tanto, la alteración de la huella bioenergética en el cáncer apoya fuertemente la idea de que la disfunción bioenergética de la mitocondria es un requisito indispensable para la progresión del cáncer.
Conclusiones
Mediante el análisis, se ha logrado determinar que existen diferentes alteraciones bioenergéticas en los diferentes tipos de cáncer debido a la variedad de proteínas y genes que se activan, no solo para llevar a cabo los procesos metabólicos por una única ruta, sino para conseguir nuevos mecanismos intrínsecos que evadan las acciones de la quimioterapia, la radioterapia y el propio sistema inmune; por lo cual, se erige como uno de los problemas de investigación principales para erradicar el cáncer. En la quimioterapia, existen fármacos que pueden inducir daño mitocondrial entre ellos: el mitomycin C, el profiromycin, el adriamycin (también denominado doxorubicin e hydroxydaunorubicin); inclusive también puede afectarse durante los regímenes quimioterapéuticos. A pesar de los avances obtenidos en los últimos años, no se ha podido cambiar la idea general de que las alteraciones en el metabolismo constituyen un fenómeno indirecto en el cáncer.
La medicina nuclear y la ciencia radiológica han permitido propiciar un avance diagnóstico grande en los diversos pacientes con cáncer, no obstante ha sido útil como marcador pronóstico en pacientes con cáncer de mama, colon y pulmón.
Conflictos de intereses
Ninguno declarado por los autores.
Financiación
Ninguna declarada por los autores.
Agradecimientos
Los autores estamos cordialmente agradecidos por la colaboración brindada por la Universidad del Cauca. Dedicamos este artículo a la señora Marlen Saavedra Espitia por su gran motivación a los estudiantes para aprender y conocer acerca del universo del cáncer.
REFERENCIAS
1. Nunnari J, Suomalainen A. Mitochondria: In sickness and in Health. Cell. 2012 Mar 16; 148 (6): 1145- 59. doi: http://dx.doi.org/10.1016/j.cell.2012.02.035.
2. Cooper GM. The Cell: A Molecular Approach. 2° ed. Sunderland (MA): Sinauer Associates; 2000. Disponible en: https://www.ncbi.nlm.nih.gov/books/ NBK9839/
3. Cooper GM, Hausmann RE. La célula. 5° ed. Madrid: Marban; 2010.
4. Gamero de Luna EJ, Gamero- Estévez E. Enfermedades mitocondriales. Med fam Andal. 2012 Dic; 13 (3): 244- 57.
5. Valle A, Soto I. Metabolismo energético y cáncer.
Vertientes Rev Esp en Ciencias de la Salud. 2014;
17 (2): 108- 13.
6. Lu J, Tan M, Cai Q. The Warburg effect in tumor progression: mitochondrial oxidative metabolism as an anti-metastasis mechanism. Cancer lett. 2015.
Ene 28; 356 (2 Pt A): 156- 64. doi: 10.1016/j.can- let.2014.04.001.
7. Galluzzi L, Kepp O, Heiden MGV, Kromer G. Metabolic targets for cancer therapy. Nat Rev Drug Discov. 2013
Nov; 12 (1): 829- 46. doi:10.1038/nrd4145
8. Koppenol WH, Bounds PL, Dang CV. Otto Warburg’s contributions to current concepts of cancer metabolism. Nat Rev Cancer. 2011 May; 11 (1): 325- 37.
9. Gatenby RA, Gillies RJ. Why do cancers have high aerobic glycolysis? Nat Rev Cancer. 2004 Nov; 4 (1): 891- 9. doi: doi:10.1038/nrc1478
10. Wallace DC. Mitochondrial diseases in man and mouse. Science. 1999 Mar 05; 283 (1): 1482- 93. doi: 10.1126/science.283.5407.1482
11. Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Matthew P. et al. Biología Celular y Molecular. 5° ed. Buenos Aires: Editorial Médica Panamericana;
2006. 1-973 pp.
12. Sánchez V. Mecanismos reguladores de la muerte celular no necrótica. Rev Cubana Invest Bioméd.
2001; 20 (4): 266- 74.
13. Laverde V. Monografía Genética: Las Mitocondrias:
¿Bacterias entre nuestras células? [Tesis]. Bogotá
(Colombia): Pontificia Universidad Javeriana; 2005.
14. López RJ. Función y biogénesis mitocondrial: Diferencias entre géneros. [Tesis de doctorado]. Palma (España): Universitat de les Illes Balears; 2005.
15. Hannafon BN, Ding WQ. Intercellular Comunication by Exosome-Derived microRNAs in Cancer. In J Mol Sci. 2013; 14 (7): 14240- 69. doi: 10.3390/ ijms140714240
16. Kierszembaum AL, Tres LL. Histología y Biología
Celular. 1° ed. España: Elsevier; 2012.
17. Scitable by Nature Education. Biología Celular de Seminarios: Las mitocondrias. Nature. 2014. p. Unidad 3.4.
18. Desagher S, Martinou JC. Mitochondria as the central control point of apoptosis. Trends Cell Biol. 2000
Sep; 10 (9): 369- 77.
19. Skulachev VP. Why are mitochondria involved in apoptosis?: Permeability transition pores and apoptosis as selective mechanisms to eliminate superoxide- producing mitichondria and cell. FEBS Lett. 1996 Nov
11; 397 (1): 7- 10. doi: https://doi.org/10.1016/0014-
5793(96)00989-1
20. Tornero D, Ceña V, Jordán J. La mitocondria como diana farmacológica en los procesos neurodegenerativos. OFFARM. 2002 Dic; 21 (11): 98- 102.
21. Kroemer G, Zamzami N, Susin SA. Mitochondrial control of apoptosis. Inmunol Today. 1997 Ene; 18 (1): 44- 51. Pubmed PMID: 9018974
22. Kumar V, Abbas A, Fausto N, Aster JC. Patologia Estructural y Funcional Robbins y Cotran. 8° ed. Barcelona, España: Elsevier Saunders; 2010. 120-
669 pp.
23. Bensaad K, Tsuruta A, Selak MA, Vidal MN, Nakano K, Bartrons R. TIGAR, a p53-inducible regulator of glycolisis and apoptosis. Cell. 2006 Jul 14; 126 (1): 107- 20. doi: 10.1016/j.cell.2006.05.036 PMID:
16839880
24. Akqul C, Moulding DA, Edwards SW. Alternative splicing of Bcl-2-related genes: functional consequences and potential therapeutic applications. Cell Mol life Sci. 2004 Sep; 61 (17): 2189- 99. doi: 10.1007/ s00018-004-4001-7 Pubmed PMID: 15338051
25. Wei MC. Bc1-2-related genes in lymphoid neoplasia.
Int J Hematol. 2004; 80 (1): 205- 9.
26. Iacobuzio-Donahue CA, Herman JM. Autophagy, p53, and Pancreatic Cancer. N Engl J Med. 2014 Abr 3;
370 (14): 1352- 3. doi:10.1056/NEJMcibr1400189
27. Doucas H, Berry DP. Basic principles of the molecular biology of cancer I. Surg. 2006 Feb; 24 (2): 43- 7.
28. Xue B, Wen C, Shi Y, Zhao D, Li C. Human NRAGE disrupts E-cadherin/beta-catenin regulated homotypic cell-cell adhesion. Biochem Biophys Res Commun.
2005 Oct 14: 336 (1): 247- 51.
29. Bertram JS. The molecular biology of cancer. Mol
Aspects Med. 2000 Dec; 21 (6): 167- 223.
30. Sánchez V. Papel de la angiogénesis en el crecimiento tumoral. Rev Cuba Invest Biomed. 2001; 20 (3): 223- 30.
31. Vergara J. Cell fate: death or immortalization (Part
II). Medwave. 2004; (7): (e3491).
32. Bhatt AN, Mathur R, Farooque A, Verma A, Dwarakanath BS. Cancer biomarkers-current perspectives. Indian J Med Res. 2010; 132:129- 49.
33. Sánchez R, Aboleda G. Mitocondria y muerte celular.
Nov - Publicación Científica en Ciencias Biomédicas.
2008; 6 (10): 190- 200.
34. Meza-Junco J, Montaño A, Aguayo Á. Bases mo- leculares del cáncer. Rev. Invest. Clin. 2006 Feb;
58 (1): 56- 70.
35. Paloma E. Expresión génica diferencial de la vía WNT
y de moléculas de adhesión y matriz extracelular en cáncer colorrectal esporádico con y sin inestabilidad en microsatélites. [Tesis de doctorado]. Madrid (España): Universidad Complutense de Madrid; 2010.
36. García J, Juaristi, Aguirre J. Oncología: oncogenes y genes supresores del cáncer. Primera. 1° Ed. España: UNNE ARAN; 2007.
37. Verma M, Kumar D. Application of mitochondrial genome information in cancer epidemiology. Clin Chim Acta. 2007 Aug; 383 (1- 2): 41- 50.
38. Wild CP, Law GR, Roman E. Molecular epidemiology and cancer: promising areas for future research in the post-genomic era. Mutat Res. 2002 Ene 29;
499 (1): 3- 12.
39. Hanahan D, Weinberg RA. The Hallmarks of Cancer.
Cell. 2000 Ene 7; 100(1): 57- 70.
40. Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011; 144 (5): 646- 74. doi:
10.1016/j.cell.2011.02.013
41. Cascales M, Álvarez JA. Metaloproteinasas, matriz extracelular y cáncer. An R Acad Nac Farm. 2010;
76 (1): 59- 84.
42. González G, González A, Delgado J, Gutiérrez LH.
Participación de las metaloproteasas de matriz en la progresión del cáncer. Rev Inst Nal Enf Resp Mex.
2009; 22 (4): 328- 36.
43. Saavedra JS, Zúñiga LF, Vásquez-López JA, Navia CA, Mosquera LP, Freyre SI. La matriz extracelular: un ecosistema influyente en la forma y comportamiento de las células. Morfolia. 2015; 7 (1): 12- 35.
44. Vivas D, Inga R. Yarlequé A. Uso potencial de componentes del veneno de serpiente en el tratamiento del cáncer. Rev Peru Med Exp Salud Pública. 2012;
29 (3): 396- 401.
45. Huang T, Civelek AC, Li J, Jiang H, Ng CK, Poste GC, et al. Complex microenvironment of HTB177 subcutaneous xenograft. J Nucl Med. 2012 Ago; 53 (1): 1262- 8.
46. Zuñiga LF, Freyre SI, Navia CA, Saavedra JS. Adhesión celular: el ensamblaje de la vía al cáncer. Morfolia. 2014; 6 (2): 3- 19.
47. Saavedra JS, Zúñiga LF, Vásquez-López JA, Navia CA, Mosquera LP, Freyre SI. La matriz extracelular: un ecosistema influyente en la forma y comportamiento de las células. Morfolia. 2015; 7 (1): 12- 35.
48. Thompson CB. Metabolic enzymes as oncogenes or tumor suppressors. N Engl J Med. 2009; 360 (8): 813- 5.
49. Lisanti MP. Martínez UE, Sotgia F. Oncogenes induce
the cancer-associated fibroblast phenotype: metabolic symbiosis and “fibroblast addiction” are new
therapeutic targets for drug discovery. Cell Cycle.
2013 Sep; 12 (17): 2723- 2732.
50. Harrington KJ. Biology of cancer. Medicine (Baltimore).
2008 Ene; 36 (1): 1- 4.
51. Johnston SR, Gore ME. Cancer Biology: Clinical
Applications. Surg. 2003 Jun; 21 (6): 160- 160.
52. Zhang S, Yu D. Targeting Src family kinases in anti- cancer therapies: turning promise into triumph. Trends Pharmacol Sci. 2012 Mar; 33 (3): 122- 8.
53. Fleming S. The molecular biology of cancer: the basics. Surg. 2003 Nov; 21 (11): III- VI.
54. Ward PS, Thompson CB. Metabolic Reprogramming: A cancer hallmark even Warburg did not anticipate. Cancer Cell. 2012; 21 (1): 297- 308.
55. Jäättelä M. Multiple cell death pathways as regulators of tumour initiation and progression. Oncogene. 23 (1): 2746- 56.
56. Wallace DC. Mitochondria and cancer. Nat Rev
Cancer. 2015; 12 (10): 685- 98.
57. Cuezva JM, Krajewska M, de Heredia ML, Krajewska S, Santamaría G, Kim H, et al. The bioenergetic signature of cancer: a marker of tumor progression. Cancer Res. 62 (22): 6674- 81.
58. Polyak K, Li Y, Zhu H, Lengauer C, Willson JK, Markowitz SD, et al. Somatic mutations of the mitochondrial genome in human colorectal tumours. Nat Genet. 20 (1): 291- 3.
59. Alam MM, Lal S, Fitzgerald KE, Zhang L. A holistic view of cancer bioenergetics: mitochondrial function and respiration play fundamental roles in the development and progression of diverse tumors. Clin Transl Med. 2016 Mar; 5 (1): 3.
60. Warburg O. El metabolismo de los tumores. Med.
1931: 15- 17.
61. Warburg O, Negelein KP. Ueber den Stoffwechsel der Tumoren. Biochem Z. 1924; 152 (1): 319- 44.
62. Warburg O. On the origin of cancer cells. Science.
1956; 123 (3191): 309- 14.
63. Vazquez A, Liu J, Zhou Y, Oltvai ZN. Catabolic efficiency of aerobic glycolysis: the Warburg effect revisited. BMC Syst Biol. 2010; 58 (4).
64. Wallace DC. Mitochondria and cancer. Nat Rev
Cancer. 2012; 12 (10): 685- 98.
65. Brunelle JK, Bell EL, Quesada NM, Vercauteren K, Tiranti V, Zeviani M, et al. Oxygen sensing requires mitochondrial ROS but not oxidative phosphorylation. Cell Metab. 2005; 1 (6): 409- 414.
66. Bertram JS. The molecular biology of cancer. Mol
Aspects Med. 2000: 21 (6):167- 223.
67. Warburg O. On the origin of cancer cells. Science. 1956; 123 (3191): 309- 14.
68. Cuezva JM, Ortega AD, Willers I, Sánchez L, Aldea M, Sánchez M. The tumor suppressor function of mitochondria: translation into the clinics. Biochim Biophys Acta. 2009; 1792 (1): 1145- 1158.
69. Folkman J. Cáncer: Principios y Práctica de Oncología. 7a Ed. Filadelfia: PA: Lippincott Williams & Wilkins; 2005. 2865- 2882 pp.
70. Martínez JD, Herrera LA. Angiogénesis: VEGF/VE- GFRs como blancos terapéuticos en el tratamiento contra el cáncer. Cancerología. 2006; (1): 83- 96.
71. Ferrara N. Vascular Endothelial Growth Factor: Basic Science and Clinical Progress. Endocr Rev. 2003;
25 (4): 581- 611.
72. Duffy AM, Bouchier-Hayes DJ, Harmey JH. Vascular Endothelial Growth Factor (VEGF) and Its Role in Non-Endothelial Cells: Autocrine Signalling by VEGF. Madame Curie Bioscience Database. USA Landes Bioscience. 2013; 21 (1): 779- 786.
73. Reichardt LF. Tomaselli K. Extracellular matrix mole- cules and their receptors: Functions in neural development. Annu Rev Neurosci. 1991; 14 (1): 531- 570.
74. Higginbotham JN, Demory M, Gephart JD, Franklin JL, Bogatcheva G, Kremers GJ, et al. Amphiregulinexosomes increase cancer cell invasion. Curr Biol.
2011; 21 (1): 779- 786.
75. Mandal DA. ¿Cuál es Metástasis? news-medical. net [Internet]. [2014 octubre 8]. Disponible en: http:// www.news-medical.net/health/What-is-Metastasis- (Spanish).aspx
76. Kuo TH, Kubota T, Watanabe M, Furukawa T, Tera- moto T, Ishibiki K, et al. Liver colonization competence governs colon cancer matastasis. Proc Natl Acad Sci U S A. 1995; 92 (1): 12085- 9.
77. Carmeliet P, Jain RK. Molecular mechanisms and clinical applications of angiogenesis. Nature. 2011;
473 (7347): 298- 307.
78. Cheresh DA, Stupack DG. Regulation of angiogene- sis: apoptotic cues from the ECM. Oncogene. 2008;
27 (48): 6285- 98.
79. Lutsenko SV, Kiselev SM, Severin SE. Molecular mechanisms of tumor angiogenesis. Biochemistry (Mosc). 2003; 68 (3): 286- 300.
80. Martinez JD, Parker MT, Fultz KE, Ignatenko N,
Gerner EW. Molecular Biology of Cancer Vol. 5. 1° Ed. Oxford: Chemotherapeutic Agents; 2003.
81. Tiwari N, Gheldof A, Tatari M, Christofori G. EMT as the ultimate survival mechanism of cancer cells. Semin Cancer Biol. 2012 Jun;22 (3): 194- 207
82. Boticario C. Innovaciones en el Cáncer. 1° Ed. Mexico: UNED; 2012. 408- 423 pp.
83. Zeng W, Liu P, Pan W, Ram Singh S, Wei Y. Hypoxia and hypoxia inducible factors in tumor metabolism. Cancer Lett. 2014; 356 (2): 263- 7.
84. Marín A. El factor inducido por la hipoxia-(HIF-1) y la glucólisis en las células tumorales. Rev Educ Bioquímica. 2009; 28 (2): 42- 51.
85. Simonnet H, Alazard N, Pfeiffer K, Gallou C, Béroud C, Demont J. Low mitochondrial respiratory chain content correlates with tumor aggressiveness in renal cell carcinoma. Carcinogenesis. 2002; 23 (1): 759- 68.
86. Bergström J, Furst P, Noree LO, Vinnars E. Intracellular free amino acid concentration in human muscle tissue. J Appl Physiol. 1974; 36 (6): 693- 7.
87. Wise DR., Ward PS., Shay JE. Cross JR, Grubber JJ, Sachdeva UM. Hypoxia promotes isocitrate dehydrogenase-dependent carboxylation of alpha- ketoglutarate to citrate to support cell growth and viability. Proc Natl Acad Sci U S A. 2011; 108 (49):
19611- 16.
88. Zaidi N, Lupien L, Kuemmerle N, Kinlaw WB, Swinnen JV, Smans K. Lipogenesis and lipolysis: the pathways exploited by the cancer cells to acquire fatty acids. Prog Lipid Res. 52 (4): 585- 589.
89. Price DT, Coleman RE, Liao RP, Robertson CN, Polascik TJ, DeGrado TR. Comparison of [18 F] fluorocholine and [18 F] fluorodeoxyglucose for positron emission tomography of androgen dependent and androgen independent prostate. cancer. J Urol.
2002; 168 (1): 273- 280.
90. Liu Y, Zuckier LS, Ghesani NV. Dominant uptake of fatty acid over glucose by prostate cells: a potential new diagnostic and therapeutic approach. Anticancer Res. 2010; 30 (2): 369- 374.
91. Zha S, Ferdinandusse S, Hicks JL, Denis S, Dunn TA, Wanders RJ, et al. Peroxisomal branched chain fatty acid beta-oxidation pathway is upregulated in prostate cancer. Prostate. 2005; 63 (4): 316- 23.
92. Comerford SA, Huang Z, Du X, Wang Y, Cai L, Wi- tkiewicz AK, et al. Acetate dependence of tumors. Cell. 2014; 159 (7): 1591- 602.
93. Martinez UE, Lisanti MP, Sotgia F. Catabolic cancer-
associated fibroblasts transfer energy and biomass to anabolic cancer cells, fueling tumor growth. Semin
Cancer Biol. 2014; 25 (1): 47- 60.
94. López-Ríos F, Sánchez-Aragó M, García-García E, Ortega AD, Berrendero JR, Pozo-Rodríguez F. Loss of the mitochondrial bioenergetic capacity underlies the glucose avidity of carcinomas. Cancer Res. 2007;
67 (1): 9013- 7.
95. Rigo P, Paulus P, Kaschten BJ, Hustinx T, Buri G, Jerusalem T. Oncological applications of positron emission tomography with fluorine-18 fluorodeoxyglu- cose. Eur J Nucl Med. 23 (1): 1641- 74.
96. Plathow C, Weber WA. Tumor cell metabolism imaging. J Nucl Med. 2008; 49 (Supl. 2): 43S- 63S.
97. Lin PC, Lin JK, Yang SH, Wang HS, Li AF, Chang SC. Expression of beta-F1-ATPase and mitochondrial transcription factor A and the change in mitochondrial DNA content in colorectal cancer: clinical data analysis and evidence from an in vitro study. Int J Color Dis. 2008; 23 (1): 1223- 1232.
98. Ortega AD, Sala S, Espinosa E, González M, Cuezva JM. HuR and the bioenergetic signature of breast cancer: a low tumor expression of the RNA-binding protein predicts a higher risk of disease recurrence. Carcinogenesis. 2008; 29 (11): 2053- 61.
99. Cuezva JM, Chen G, Alonso AM, Isidoro A, Misek DE, Hanash SM, et al. The bioenergetic signature of lung adenocarcinomas is a molecular marker of cancer diagnosis and prognosis. Carcinogenesis.
2004; 25 (1): 1157- 1163.
100.Isidoro A, Martínez M, Fernández PL, Ortega AD, Santamaría G, Chamorro M, et al. Alteration of the bioenergetic phenotype of mitochondria is a hallmark of breast, gastric, lung and oesophageal cancer. Biochem J. 2004; 378 (1): 17- 20.
101.Lin PC, Lin JK, Yang SH, Wang HS, Li AF, Chang SC. Expression of beta-F1-ATPase and mitochondrial transcription factor A and the change in mitochondrial DNA content in colorectal cancer: clinical data analysis and evidence from an in vitro study. Int J Color Dis. 2008: 23 (12): 1223- 32.
102.Sanchez-Arago M, Cuezva JM. The bioenergetic signature of isogenic colon cancer cells predicts the cell death response to treatment with 3-bromopyruvate, iodoacetate or 5-fluorouracil. J Transl Med.
2011; 9 (1): 9- 19.
103.Santamaria G, Martinez M, Fabregat I, Cuezva JM.
Efficient execution of cell death in non-glycolytic cells requires the generation of ROS controlled by the activity of mitochondrial H+ATP synthase. Carcinogenesis. 2005; 27 (5): 925- 935.
Recibido: 25 de octubre de 2016.
Aceptado: 2 de marzo de 2017.
Correspondencia:
hipocratesjsst@hotmail.com
Jhan Sebastián Saavedra Torres