CIRUGÍA MICROGRÁFICA DE MOHS TRATAMIENTO DE LOS TUMORES MALIGNOS CUTÁNEOS DE ALTA AGRESIVIDAD Y COMPLEJIDAD.
Michel Faizal Geagea1
RESUMEN
La cirugía micrográfica de Mohs es el tratamiento quirúrgico con más altas tasas de curación de los tumores malignos cutáneos agresivos localmente invasivos, minimizando el sacrificio innecesario de tejidos peritumorales sanos. Los márgenes oncológicos son determinados en etapas sucesivas, los tejidos son evaluados en cortes histológicos horizontales en tres dimensiones, identificando con precisión la localización de la persistencia oncológica y subsecuente escisión hasta la inexistencia del tumor respetando los tejidos sanos que no son removidos. La conclusión diagnóstica de la evaluación de las neoplasias cutáneas, se deriva del laudo histopatológico el cual debe conducir en la elección de la mejor opción terapéutica. El tratamiento del cáncer cutáneo es realizado con métodos quirúrgicos o médicos, bien sea por la destrucción a ciegas o por la evaluación histológica de los márgenes oncológicos que determinan una porción de los límites del tumor. Las neoplasias malignas cutáneas que no han recibido tratamiento o las recurrentes consideraciones de alto riesgo por presentar características clínicas y/o histológicas agresivas, deben recibir la mejor opción terapéutica. Actualmente la cirugía micrográfica de Mohs ofrece la mejor curabilidad de los pacientes con tumores cutáneos, con un menor sacrificio de los tejidos perilesionales sanos, resultando en pequeños defectos quirúrgicos comparados con las consecuentes de resecciones quirúrgicas convencionales, repercutiendo en la complejidad de la reconstrucción. Las altas posibilidades de curación y los menores defectos quirúrgicos resultantes de la cirugía micrográfica de Mohs, crea un impacto costo-efectivo en la reducción de procedimientos quirúrgicos repetidos.
Palabras clave: Cirugía de Mohs, cáncer de piel, resección tumoral, histopatología.
MOHS SURGERY IN TREATING AGGRESSIVE SKIN CANCERS
ABSTRACT
Final diagnosis in assessing skin cancers derives from histopathology, then choosing the best treatment option. Skin cancer treatment could be surgical or medical, either by tissue blind destruction or by histological assessment of cancer margins, determining a portion of tumor boundaries. Skin malignancies that have not been treated or whenever there are recurrent high- risk considerations because of clinical and / or histological aggressive characteristics, should receive the best treatment option. Currently, Mohs micrographic surgery offers the best curability of patients with skin tumors, with less damage of healthy perilesional tissues, resulting in small surgical defects when compared with conventional surgical resections, affecting the complexity of reconstruction. Higher chances of cure and minor surgical defects resulting from Mohs micrographic surgery, creates a cost-effective impact in reducing repeated surgical procedures.
Key words: Mohs surgery, skin cancer, tumor resection, histopathology.
___________________________
1 Profesor Titular. Dermatología y Cirugía Dermatológica. Universidad Nacional de Colombia. Miembro Correspondiente Academia Nacional de Medicina.
INTRODUCCIÓN
Los tumores cutáneos malignos localmente invasivos pueden ser tratados exitosamente por una variedad de técnicas que incluyen escisión local, crioterapia, radioterapia, curetaje, electrodesecación y obliteración con láser. Algunos métodos no quirúrgicos como tratamientos tópicos e inyecciones intralesionales de 5-fluoracilo, metotrexate, interferon o quimioterapia sistémica pueden lograr la erradicación. Aunque métodos diferentes a la escisión local con evaluación histológica de los márgenes pueden dar excelentes resultados, estos fallan en definir los límites del tumor y su resección.
Ciertos tipos de tumores malignos localmente invasivos y tumores originados en áreas anatómicas específicas poseen una alta frecuencia estadística de recurrencias locales. Este fenómeno es causado por conformación tumoral irregular y asimétrica, en donde proyecciones digitiformes neoplásicas impredecibles pueden extenderse lateral o profundamente, escapando a la visualización de la lesión clínicamente evidente, también el tumor puede invadir nervios, extenderse a huesos y cartílagos o penetrar a través de los planos de fusión embriológicos, que aunque no se han demostrado histológicamente, se originan por la unión embrionaria de las superficies epiteliales y es teorizado por la invasión profunda de tumores localizados en las áreas de la línea media facial.
La naturaleza microscópica de la infiltración tumoral hace que las extensiones neoplásicas malignas no puedan ser inspeccionadas o palpadas clínicamente. Con base en esta consideración se han diseñado varias fórmulas empíricas para determinar los márgenes de resección quirúrgica en el tratamiento oncológico adecuado teniendo en cuenta el tamaño, la historia clínica y la variedad histológica.
La imaginología moderna en la evaluación neoplásica cutánea no supera la precisión del examen microscópico de los cortes horizontales congelados y no son ampliamente utilizados en la determinación de la extensión y patrón de crecimiento de los tumores localmente invasivos.
Un inherente compromiso existe entre la tasa de curación y el ahorro de tejidos marginalmente sanos; evidentemente los márgenes quirúrgicos empíricos necesarios para lograr una reproducible alta tasa de curación, pueden llevar a resultados funcionales y cosméticos inaceptables, especialmente en la región facial, lugar común del cáncer cutáneo.
Las piezas quirúrgicas son enviadas al labora- torio de patología para la evaluación de márgenes quirúrgicos; regularmente los cortes del tejido son realizados en “tajada de pan”, cruz, perimétricos o combinaciones de estos. Se realizan cortes verticales cada dos a cuatro mm en el espécimen a evaluar; sin embargo, los espacios comprendidos entre estos dos a cuatro mm, dejan de ser evaluados y los tumores con proyecciones digitiformes, escapan al examen por estos métodos.
Excluyendo las posibilidades de micrometástasis o patrones de crecimiento discontinuo, hecho poco frecuente en la mayoría de tumores cutáneos primarios; la incorrecta determinación de márgenes libres de tumor es la explicación de recurrencias locales en tumores informados “completamente extirpados” (1).
La cirugía micrográfica de Mohs es el tratamiento quirúrgico con más altas tasas de curación de tumores malignos cutáneos localmente invasivos, minimizando el sacrificio innecesario de tejidos peritumorales sanos. Los márgenes oncológicos son determinados en etapas sucesivas, los tejidos son evaluados en cortes histológicos horizontales en tres dimensiones, identificando con precisión la localización de la persistencia oncológica y subsecuente escisión hasta la inexistencia del tumor, respetando los tejidos sanos que no son removidos (2-7).
La conclusión más importante para un paciente que es sometido a un procedimiento quirúrgico para el tratamiento de una neoplasia cutánea, es que el tumor haya sido completamente extirpado; para llegar a este punto debe existir una alianza entre el cirujano y el patólogo, coordinación, cooperación y comunicación o cualquier otro tópico respecto al examen histopatológico.
Generalmente, el cirujano extirpa un tumor y lo remite al patólogo, este a su vez realiza una serie de cortes en el espécimen y emite un resultado en la evaluación de los “márgenes” sobre la persistencia o ausencia tumoral. Regularmente, la terminología o idioma empleado es congruente entre el cirujano y el patólogo, pero existen circunstancias confusas y dudosas; un ejemplo es la definición de “margen”. Estas dudas se deben clarificar a través de una cercana comunicación ya que la falta de coope- ración entre el cirujano y el patólogo, podría llevar eventualmente a la recurrencia tumoral.
Definiciones
• Margen tumoral: borde clínico del tumor.
• Margen quirúrgico: límite de resección el cual se determina y marca preoperatoriamente.
• Margen patológico: tejido removido y remitido al laboratorio de patología para la evaluación de márgenes. El patólogo realiza una serie de cortes y emite un resultado basado en su evaluación.
Importancia de los márgenes libres de tumor
Los tumores incompletamente extirpados even tualmente pueden persistir, crecer y hacerse clínicamente aparentes, es decir, recurrentes pudiendo generar metástasis. Respecto al carcinoma basocelular incompletamente extirpado se han documentado tasas de recurrencias en el 34,8% y aquí radica la importancia de emplear un método de tratamiento que disminuya ostensiblemente estos valores (1).
Preparación de los especímenes
Orientación: es la marca que el cirujano deja en la pieza quirúrgica y usualmente es realizada con uno o varios elementos de suturas como sedas con el fin de guiar al patólogo.
Sección y corte: son los cortes o secciones que el patólogo realiza con un bisturí a la pieza o espécimen quirúrgico; estos fragmentos luego de ser fijados y cortados con un micrótomo, son montados en las láminas de vidrio, teñidos y puestos a punto para el examen histopatológico. Los diferentes métodos de corte influencian en la determinación de los márgenes patológicos y su interpretación. Los métodos corrientes de corte son: cruz, “tajada de pan“ (verticales paralelos), periféricos, cruz-verticales-paralelos.
Corte en cruz: es el corte en el cual se obtienen segmentos de fragmentos verticales a través de los ejes mayor y menor de la pieza quirúrgica configurando una cruz. Con este método se obtiene una evaluación de los márgenes de la porción central del espécimen y los periféricos no son adecuadamente evaluados.
Corte en tajada de pan (verticales paralelos): son cortes o segmentos verticales y paralelos a un eje central. La distancia entre uno y otro segmento puede ser variable escapando la evaluación completa del espécimen.
Corte en tajada de pan, en intervalos de 4 mm, sobre piezas quirúrgicas de escisión de carcinoma basocelular, dejando márgenes quirúrgicos de 2 mm, es 44% sensible en detectar tumor residual en los márgenes quirúrgicos (8).
Corte periférico: es un corte en el cual se toman del espécimen fragmentos laterales periféricos de dos mm de ancho dando una evaluación completa de los márgenes laterales; la evaluación del margen profundo se realiza por un corte vertical central u horizontal. Esta técnica de corte podría resultar en márgenes laterales falsamente positivos al evaluar los cortes del centro a la periferia, es de difícil evaluación en los márgenes profundos por la dificultad técnica de cortar tejido subcutáneo, no es ideal para pequeños especímenes por el riesgo de fragmentación o desorientación de reducidas piezas de tejido, en grandes especímenes es impracticable por el número de cortes que saturarían la capacidad de procesamiento de un laboratorio de patología.
Por lo anterior, variaciones en combinación de estas técnicas de corte se emplean con la intención de corregir los defectos individuales de cada una. Ejemplo: combinación de cruz y tajada de pan, periféricos y cruz.
Método de Mohs
Este método es ideal para evaluar todos los márgenes quirúrgicos de corte, con el cual los dermatólogos se han familiarizado más que los patólogos generales, en razón a que no se han introducido estas técnicas en los programas de residencia. Con está técnica, tanto los márgenes laterales como los profundos de cada segmento quirúrgico son evaluados en una sección de corte patológico. El tejido a evaluar con este método debe haber sido cortado por el cirujano, inclinando el bisturí 450 aproximadamente en el plano cutáneo, de tal forma que la epidermis permanezca sobre el mismo nivel del tejido subcutáneo para ser cortado horizontalmente con el micrótomo. Los cortes que son examinados antes de cortarlos y teñirlos para el examen histológico, son seccionados en subunidades con el fin de crear segmentos o secciones de apropiado tamaño para ser montadas en las bases de congelación del críostato y las láminas histológicas. De esta forma, se constituyen segmentos horizontales en donde los márgenes laterales y profundos se encuentran en el mismo plano. Estas consideraciones son críticas en la producción de un espécimen microscópico con márgenes completos de corte.
El método de Mohs implica congelamiento de los segmentos y los problemas de interpretación son los mismos de la evaluación de corte por congelación, tales como dificultades en lograr bajas temperaturas en el micrótomo optimizando la calidad de los cortes, cortes incompletos especialmente en el tejido adiposo, cortes gruesos y detalles celulares alargados.
El grado de esas dificultades e impedimentos depende del conocimiento y experiencia de los técnicos involucrados en el equipo de patología. Muy a pesar de estas limitaciones, el método de sección de Mohs alcanza tasas de curación entre el 95% y 99%, superando ampliamente las tasas de curación ofrecidas por otras técnicas.(1-7).
Desde que en 1941 el método fue introducido por Frederic Mohs y a partir de 1970 cuando la técnica fue establecida, se han creado varias modificaciones de la misma. Sin embargo, esas modificaciones no son sustitutas del verdadero método de Mohs y ni a los médicos, ni a los pacientes se les debe distraer su atención indicándoles que esos métodos son equivalentes (9).
Una de las erróneas modificaciones a la técnica de Mohs es enviar la pieza quirúrgica al laboratorio de patología para evaluación convencional por congelación, mientras el paciente y el cirujano esperan en la sala quirúrgica, creyendo falsamente el cirujano que tal proceso es el mismo que el realizado por el método de Mohs, cuando en realidad los patólogos usan cortes en cruz sobre las secciones de congelación rutinarias. No obstante, como anteriormente se mencionó, los cortes en cruz no evalúan la totalidad de los márgenes quirúrgicos. En un estudio de 100 casos de carcinoma basocelular y escamocelular resecados por dermatólogos usando escisiones de rasurado delgado y examinado por patólogos, se encontró que estos no acertaron en hallar o descartar tumor en el 19% de los casos. Esos estudios sugieren que los cortes por congelación son mejor interpretados por personas con más experiencias en ese método, bien sean cirujanos de Mohs o patólogos (10).
La realización de la técnica de congelación de cortes quirúrgicos periféricos y cortes horizontales a través de la base de la pieza quirúrgica, no es sustituta de la técnica de Mohs. Este método re- quiere buena comunicación y estrecha cooperación entre el cirujano y el patólogo. Debe darse especial atención a la orientación del tejido, teniendo en cuenta que el cirujano y el patólogo son diferentes personas, a diferencia de la verdadera cirugía de Mohs. Los principales problemas con los cortes periféricos, son la limitación en el tamaño de la pieza quirúrgica y el número de secciones por congelación requeridas, además de la dificultad en el proceso del margen horizontal profundo por la abundancia de tejido graso. Por donde se mire, el desgaste que produce el diseño de una versión modificada de la auténtica técnica de Mohs, no se espera que duplique la evaluación completa de los márgenes quirúrgicos que causan el método de Mohs.
Interpretación
La interpretación del informe histopatológico es parte integral de la atención del paciente, de tal forma que el cirujano debe determinar qué paciente ha sido tratado adecuadamente o si requiere otra terapia complementaria.
La lectura crítica del informe de patología, con- clusivo de márgenes negativos o libres de tumor, debe ser observada objetivamente interrogando con cautela las siguientes afirmaciones en la evaluación de todos los márgenes quirúrgicos: ¿Cuál método de evaluación patológica de márgenes ha sido empleado?, densidad del infiltrado inflamatorio que puede ocultar el tumor, desgarros o fragmentaciones de la pieza quirúrgica y orientación de la pieza quirúrgica. Todas las anteriores inquietudes indican posibles causas de márgenes falsos negativos que conducen a la recurrencia tumoral.
Contrariamente, un informe de márgenes patológicos con compromiso tumoral, implica la persistencia de tumor residual en el margen patológico del tejido resecado; sin embargo, las células tumorales detectadas microscópicamente pueden no estar en el lado externo de la pieza quirúrgica y el paciente realmente debe estar libre de tumor; un margen falso positivo puede también haber sido producido cuando la pieza quirúrgica haya sido procesada y el corte patológico ha sido efectuado muy grueso, al interior del bloque, lejano al verdadero corte del margen quirúrgico el cual podría ser negativo de células tumorales. Este escenario aporta una posible explicación de márgenes negativos con la técnica de congelación en la evaluación intraoperatoria y hallazgos de márgenes positivos comparados con los cortes de parafina cuando son evaluados posteriormente.
El uso de términos poco lacónicos por los patólogos en los informes puede crear un dilema. El empleo de frases como se observa la presencia de células tumorales cerca al margen es relativo y hay poco consenso sobre su definición entre los patólogos, especialmente cuando se utilizan objetivos microscópicos de diferente poder y si el patólogo define la distancia microscópica empleando un objetivo de alto poder o se orienta comparando con el diámetro de las células vecinas; tampoco existe uniformidad en la dirección de las acciones cuando un cirujano recibe el reporte informando que el tumor es detectado cerca de los márgenes.
En un estudio sobre recurrencias se demostró que estas eran tres veces más frecuentes cuando los márgenes fueron pequeños que cuando fueron positivos; aunque el autor no pudo explicar convincentemente esta discrepancia, esos hallazgos pueden reflejar la tendencia de los cirujanos a realizar rescisiones cuando los márgenes son positivos y no intervenir cuando son “cerca a los márgenes” (1).
Un punto importante a tratar es que la positividad de los márgenes por sí solos no traslada una absoluta recurrencia. Importantes estudios demuestran que las recurrencias ocurren en cerca de un tercio de los carcinomas basocelulares incompletamente resecados; la tasa de recurrencias del carcinoma escamocelular incompletamente extirpado es alta (9). Varias hipótesis especulan sobre por qué los pacientes con márgenes positivos no experimentan recurrencias, estas incluyen: respuesta inmune local, reacción inflamatoria, crecimiento tumoral lento y artificios de fijación (9). Un grupo de investigadores concluyó que el tipo histopatológico de carcinoma basocelular es predictor de recurrencias en pacientes con márgenes positivos, como son: carcinoma basocelular morfeiforme, micronodular, basoescamoso, infiltrante; se concluyó que las recurrencias ocurrieron durante los cinco años de seguimiento en el 93% de los pacientes con márgenes positivos y proyecciones tumorales que histológicamente contienen una gran cantidad de “irregularidades” en empalizada periférica; sin embargo, cuando esas irregularidades son mínimas no ocurren recurrencias (9).
Los resultados de ese estudio sugieren que el tipo histopatológico ayuda a predecir la probabilidad de recurrencias del carcinoma basocelular cuando el reporte de patología informa que los márgenes son positivos (9).
En la atención del paciente con cáncer de la piel, el cirujano y el patólogo deben trabajar como un equipo y entender la importancia del papel de cada uno. Si el clínico conoce cómo el espécimen fue correctamente orientado, cómo el tejido fue cortado, fijado, seccionado por el micrótomo y posteriormente teñido, puede sacar ventaja de los hallazgos histológicos y entender cómo las posibles alteraciones de las preparaciones pueden afectar esos hallazgos.
Desde esta perspectiva, un clínico puede derivar una inteligente interpretación del reporte de patología y elegir el mejor tratamiento para su paciente.
CONCEPTOS TÉCNICOS
Hoy en día la técnica por congelación es la más empleada. En un reciente censo, el 72% de los cirujanos usan la técnica micrográfica de Mohs por congelación exclusivamente, el resto usa la técnica de fijación in situ en el tratamiento de menos del 5% de los pacientes (2-6). La elección de la técnica de fijación in situ es seleccionada en algunas circunstancias como la hemostasia. Con la técnica de fijación in situ pueden ofrecerse ventajas para el tratamiento de tumores vasculares y tumores originados en áreas vasculares. Esta técnica también es empleada en el tratamiento de osteomielitis y en tumores que invaden el hueso. La equivalente alta tasa de curación que resulta de ambos métodos, se deriva del común denominador de superior control de los márgenes quirúrgicos, más que de la fijación in situ.
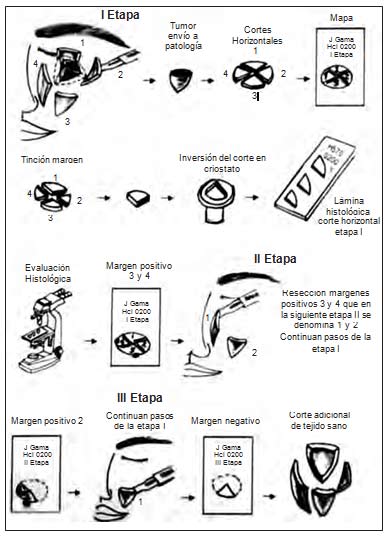
Técnica de fijación por congelación (figuras 1– 9)
1. Después de tener el consentimiento informado, el paciente es preparado asépticamente para la intervención. El área a ser resecada es delimitada usando un lápiz dermográfico o violeta de genciana delineando los márgenes clínicos del tumor y el margen quirúrgico periférico. El área se anestesia localmente, el anestésico más empleado es la lidocaina al 2% o 1% con o sin epinefrina al 1 x 200.000 (si está, o no indicado el uso de la epinefrina para lograr una mejor vasoconstricción), ya que la infiltración anestésica distorsiona los márgenes quirúrgicos y las área anatómicas, es preferible delimitar el margen oncológico como antes se mencionó.
El empleo de bloqueos tronculares en la cara de los nervios supraorbitarios, supratrocleares, infraorbitarios, mentonianos, entre otros, es útil en la prolongación del tiempo anestésico y en la disminución del dolor. La anestesia general se utiliza en un mínimo de los casos, no así es el trabajo interdisciplinario con el anestesiólogo en la anestesia local controlada o asistida de valuable beneficio en la seguridad y comodidad del paciente y el cirujano.
2. Luego de un tiempo de espera entre tres y diez minutos para permitir la vasoconstricción local, se inicia la resección oncológica del tumor en bloque clínicamente visible usando el bisturí o la cureta. Este espécimen o pieza quirúrgica es enviada directamente al laboratorio de patología para el estudio convencional. El empleo del curetaje está justificado por la sensación “gelatinosa” del tumor y la mayor resistencia del tejido aparentemente sano. Actualmente esta técnica de curetaje es poco empleada en razón a la remoción de tejido aparentemente sano con la resultante de mayores defectos quirúrgicos (11).
|
Figura 1. Representación esquemática de la cirugía micrográfica de Mohs |
3. La escisión planeada es delineada sobre la piel, con márgenes pequeños (2 y 3 mm) tomados desde el defecto quirúrgico dejado por el curetaje o resección tumoral en bloque. Se debe precisar la orientación rotacional; las marcas asimétricas de identificación correspondientes a las áreas del borde del defecto quirúrgico y el borde de la pieza quirúrgica deben hacerse usando suturas, violeta de genciana, lápiz dermográfico o fotografía digital.
4. La escisión se inicia angulando el bisturí 450, se continúa completamente alrededor de la superficie del defecto quirúrgico (remanente tumoral a estudiar) en ángulo de 450 y se prolonga en profundidad abajo de la piel y paralela a la superficie interna del defecto, asimilando al de una cúpula. Este método de escisión permite al histotecnólogo aplanar la superficie del espécimen más fácilmente en un plano horizontal. Se debe diseñar un mapa o gráfico escala 1:1 del defecto qui- rúrgico, el cual se emplea como referencia y orientación.
5. El tejido resecado debe tener un tamaño que quepa en una lámina histológica de vidrio; si esto no ocurre debe ser subdividido guardando una correcta orientación, manteniéndola con relación al área de escisión; cada segmento es enumerado con cifras arábigas (27). Los bordes de corte de cada segmento deben ser tinturados de diferentes colores para su orientación durante el examen histológico; el mapa o gráfico debe ser marcado de una forma similar al espécimen con colores o líneas sólidas o punteadas. Las tintas más comúnmente utilizadas son merbromina (rojo), ferrocianito ferroso (azul), tinta india (negro). Siguiendo la orientación del reloj, numerado en arábigo, marcando con negro (tinta india) el borde próximal a la numeración siguiente, es suficiente orientación en la mayoría de las ocasiones. El autor pinta tenuemente con la tinta china la cara ventral del corte horizontal del lado contrario a la superficie próxima del tumor.
|
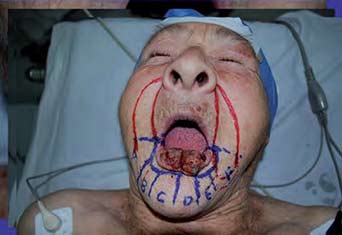 |
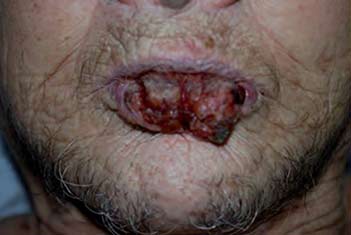
Figura 2. Paciente con carcinoma escamocelular agresivo del labio inferior. La evaluación no demostró compromiso metastásico ganglionar o sistémico |
Figura 3. Diseño de la resección oncológica, cirugía micrográfica de Mohs y proyección de la reconstrucción quirúrgica empleando colgajos de rotación bilateral por la técnica de "vons-bruns -gate-flap" |
6. La ventaja de la cirugía micrográfica de Mohs radica en la evaluación en un plano los márge- nes laterales y profundos del tumor bajo una visión horizontal. La intención es evaluar si el tumor se extiende o infiltra tejidos vecinos de tal forma que la observación de los cortes horizontales deben ser aquellos segmentos próximos en lateralidad (epidermis-dermis) y profundidad (tejido celular subcutáneo) que están más lejanos de la cara interior del defecto quirúrgico primario o remanente oncológico.
El espécimen o segmento es orientado con el lado interno (próximo al tumor) hacia abajo y colocado en la cajilla de congelación agregándole una gota de o.c.t. (optimum cutting temperature) que es una sustancia que im- pide el plegamiento del segmento del tumor a evaluar y la formación de cristales de hielo que dificultan la interpretación (4). El tejido debe mantenerse permanentemente plano para lograr una excelente superficie de corte en el críostato. Respecto a este instrumento debe estar a una temperatura de -20oC en promedio; la epidermis y dermis se logran cortar con buena calidad a -20 oC y el tejido graso a -40 oC. Volviendo sobre el espécimen a congelar y cortar, este debe permanecer permanentemente aplanado, lo cual se puede lograr usando las siguientes técnicas:
a. Rociado de nitrógeno líquido.
b. Aplanado del tejido entre unas pinzas de Adson para asepsia e introducirlo en un tanque de nitrógeno líquido; en especímenes muy pequeños es prefe- rible usar la técnica de o.c.t congelado, que consiste en congelar o.c.t a -20 oC dejándolo sobre una lámina de vidrio con un hoyuelo central sin congelar, lo cual se consigue dejando la punta de un borrador de lápiz; allí se deposita el espécimen de tejido a estudiar con el margen interno en contacto con la lámina de vidrio cubierto adicionalmente con o.c.t. y congelado, el espécimen es retirado de la lámina de vidrio y montado sobre una cajilla para corte.
c. Otra técnica comúnmente usada para aplanar el tejido es el extractor de calor, el cual es un bloque de metal pesado precongelado sobre el cual se monta el tejido. Otra forma es aplanar el tejido manualmente con un instrumento metálico delgado. La cuchilla de críostato debe iniciar el corte sobre el espécimen en posición horizontal y paralelo partiendo por la superficie externa del espécimen (más alejado de la cara interna del defecto quirúrgico oncológico) con el fin de evaluar primero la extensión o infiltración en la periferia y profundidad.
Los cortes horizontales son realizados entre 5 y 7 micras de grosor, pero en el tejido subcutáneo que no es fácil cortar se prefieren más gruesos. Los cortes preparados por congelación son teñidos para su observación microscópica, la tinción más utilizada es la hematoxilina eosina (2-6).
Las láminas estudiadas por el patólogo y el cirujano micrográfico de Mohs son observadas buscando la presencia de tumor residual o persistencia oncológica, la cual es marcada en la gráfica o mapa con una señal de positivo o negativo para tumor o simplemente con un punto rojo. Esta evaluación le permite al cirujano retornar a la exacta localización del tumor residual en el defecto quirúrgico del paciente y resecarlo.
|
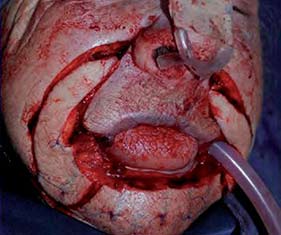 |
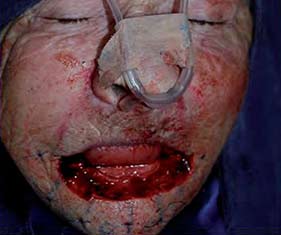
Figura 4. Resección oncológica del tumor labial, los planos quirúrgicos incluyeron los segmentos cutáneo, subcutáneo, muscular y mucoso; es decir espesor total transcutáneo-músculo-mucoso. Los cortes de Mohs estudiados patológicamente por congelación demostró la ausencia de neoplasia. |
Figura 5. Inicio de la reconstrucción quirúrgica por la técnica de "vons bruns gate flap". Colgajos de rotación bilaterales orientados sobre los pliegues nasolabiales transcutáneo muscular mucoso. |
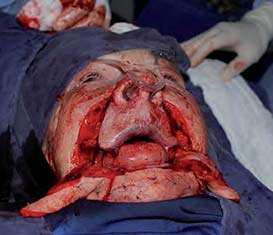 |
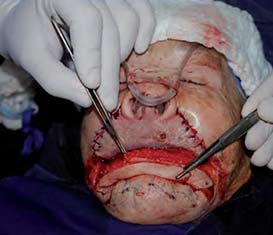 |
Figura 6. Disección de los colgajos. Obsérvese la complejidad de los colgajos en su espesor total. |
Figura 7. Rotación de los colgajos y sobreposición sobre el defecto quirúrgica primario (labial inferior). |
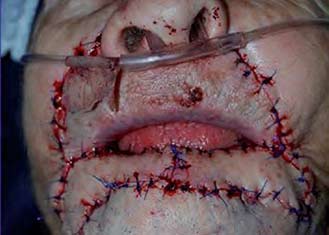 |
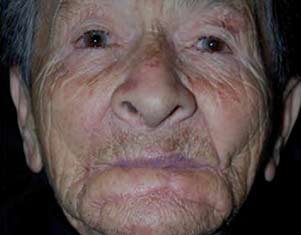 |
Figura 8. Sutura de los colgajos sobre defecto quirúrgico primario lográndose la completa reconstrucción. |
Figura 9. Estado posoperatorio tardío un (1) mes después de la intervención. |
Los detalles histológicos de las preparaciones por congelación no son tan claros como los de parafina y el corte transversal de las crestas interpapilares y estructuras anexiales, pueden semejarse a estructuras malignas. Con experiencia esos tejidos neoplásicos son usualmente reconocibles. Colateralmente, el intenso infiltrado inflamatorio puede enmascarar células neoplásica individuales o en grupo; en esas circunstancias algunas inmunotinciones han reportado detectar el cáncer que no ha sido visualizado con tinciones de rutina. Las técnicas de inmunohistoquímica han sido utilizadas exitosamente en carcinoma basocelular, carcinoma escamocelular, enfermedad de Paget extramamaria, lentigo maligno, carcinoma linfoepiteliomatoso cutáneo, dermatofibrosarcoma protuberans (2-6). Una alternativa en situaciones difíciles para la interpretación es someter los cortes a la parafinización, postergando la reconstrucción; igualmente este recurso técnico es usado en laboratorios de patología que no cuentan con tinciones de inmunohistoquímica.
7. El tumor residual es removido en sucesivas etapas (convencionalmente se designan con números romanos) en los segmentos comprometidos hasta que los márgenes quirúrgicos estén libres de tumor. Cada segmento remo- vido se designa en números arábigos y se denomina pasos. De esta manera el tejido no comprometido es preservado así como el tumor es secuencialmente removido. La graficación previa de cada etapa sirve como un documento en la historia clínica.
Técnica de fijación in situ
La técnica de fijación in situ y la congelación son similares en todos los pasos, excepto que la primera implica fijación antes de la escisión, eliminando la necesidad de anestesia y preservando un campo quirúrgico exsangüe. En breve se fundamenta en etapas secuenciales de fijación de los tejidos. El tejido a resecar se prepara similarmente a la técnica de fijación, infiltrando un anillo de anestesia peritumoramente, luego se inicia la etapa de resección tumoral en bloque, la cual está supeditada al volumen del tumor; sea cual fuere la decisión sobre el defecto quirúrgico o sobre la neoplasia previamente anestesiada, se aplica ácido tricloacético al 90% como hemostático y facilitador para la penetración de la pasta de Mohs. Cuando la superficie se blanquea la pasta de cloruro de zinc es aplicada en una delgada capa, el grosor de la aplicación depende de la profundidad de la piel y la profundidad de penetración deseada. Después, la lesión es perimétricamente delimitada colocando un vendaje adhesivo y cubriéndola con una gasa, previniendo así la extensión de la pasta sobre los tejidos sanos.
La composición de la pasta es: 34,5 ml de cloruro de zinc en solución saturada, 40 g de estigmita y 10 g de sanguinaria canadensis en polvo (2).
Esta pasta causa fijación lenta del tejido en un período superior a las 18 horas, el cloruro de zinc se hidroliza en agua y forma ácido hidroclórico el cual es el agente fijador activo provocando necrosis por coagulación. La penetración del fijador depende de la cantidad aplicada y del tiempo de duración o permanencia del fijador. La localización anatómica dicta la necesidad de penetración, quiere decir que menor penetración es preferible en áreas de mayor preservación tisular como la punta nasal o el hélix del oído. Es necesario administrar analgésicos, ya que es un proceso doloroso. Después de la fijación, la gasa se retira, se limpia el tejido y se continúa la misma técnica empleada por congelación, excepto que no es necesario aplicar anestesia adicional y no ocurre sangrado dentro del tejido fijado. La es- cisión se inicia angulando el bisturí 45o dentro del tejido fijado cerca al borde del tejido no fijado; la escisión continúa bordeando el defecto quirúrgico en un ángulo de 45o bajo la piel paralela a la super- ficie. El tejido resecado es orientado y subdividido en tamaños que permitan ser procesados para el examen microscópico, los bordes son marcados y el gráfico se diseña de manera análoga a los cortes por congelación. En razón a que los tejidos fijados con la pasta de cloruro de zinc son friables, la epidermis y la dermis son generalmente cortados entre 12 µm y 16 µm y el tejido graso entre 25 µm y 30 µm, tres veces más grueso que la técnica de congelación y seis veces mayores que los cortes en parafina, haciendo probablemente más difícil la interpretación histológica (5,6).
Si el análisis histológico es positivo para tu- mor residual, se procede a realizar los mismos pasos hasta la escisión; cada etapa de escisión con esta técnica in situ requiere usualmente un día. El defecto quirúrgico se repara por segunda intención o por reconstrucción inmediata. La clave del éxito de escisión de los tejidos fijados in situ es su resección a tiempo. Tejidos fijados por más de 24 horas son friables y difícilmente se pueden realizar cortes delgados. La fijación in situ acarrea marcada reacción inflamatoria en los tejidos y puede adicionar un beneficio al procedimiento.
La infiltración de linfocitos ha sido investigada en melanomas no fijados con la pasta de cloruro de zinc y se demostró incremento en la sobrevida (2-4). La intensa reacción inflamatoria desencadenada por la fijación in situ podría estimular la respuesta inmune específica y no específica contra las células tumorales, aunque esta hipótesis no ha sido estudiada en los tejidos fijados con cloruro de zinc.
Las ventajas de la técnica por congelación sobre la técnica de fijación in situ incluyen: eliminación del dolor preoperatorio causado por el fijador, facilidad de realizar múltiples etapas de escisión en el mismo día, cortes histológicos más delgados mejorando la calidad y precisión de la interpretación, reconstrucción inmediata del defecto quirúrgico obviando la necesidad de esperar el ablandamiento del tejido fijado.
Entre las desventajas encontramos: mayor sangrado, el empleo de anestesia local incrementa la toxicidad, potencial y especialmente cuando se intervienen tumores grandes o se emplean múltiples etapas quirúrgicas.
La técnica de fijación in situ está indicada en neoplasias vasculares, neoplasias ubicadas en áreas vascularizadas como el pene, neoplasias en espacios profundos y estrechos como el canal auditivo externo, neoplasias que invadan el hueso y neoplasias con alto riesgo de metástasis como el melanoma.
Técnica del procesamiento en parafina
Está técnica describe las mismas secuencias quirúrgicas empleadas en la técnica por congelación, diferenciándose en que los tejidos resecados son marcados, fijados en formol buferizado neutralizado y procesado en bloque de parafina y cortados entre 4 y 6 micras más delgado que las anteriores técnicas, facilitando la interpretación y mejorando la observación de los detalles histológicos (12).
Está técnica se indica en aquellas neoplasias de difícil interpretación histológica por congelación como son el melanoma o el dermatofibrosarcoma protuberans. Se emplea en centros quirúrgicos que carecen de refinamientos tecnológicos en la disponibilidad del criostato. La desventaja radica en el empleo de un mayor tiempo quirúrgico en la resección tumoral.
INDICACIONES DE LA CIRUGÍA MICROGRÁFICA DE MOHS
Indicaciones generales
• Tumores con márgenes pobremente definidos clínicamente
• Localización anatómica: oreja, cuero cabelludo, sien, preauricular, retroauricular, pliegue nasolabial, canto ocular interno, filtrum nasal, labial, dactilar, anogenital
• Tamaño: 0,5 cm o mayor a 2 cm de diámetro
• Tumores recurrentes
• Tumores incompletamente extirpados
• Invasión perineural
• Variedad histológica agresiva
• Pacientes inmunocomprometidos
• Carcinomas desarrollados sobre: áreas irradiadas, cicatrices, osteomielitis, inflamación crónica o ulceración
• Carcinomas asociados a síndromes genéticos.
La cirugía micrográfica de Mohs está indicada en la erradicación de tumores localmente agresivos de difícil tratamiento por métodos de rutina. Las principales variables consideradas en la evaluación de pacientes que son sometidos a esta cirugía son: morfología clínica, localización, tamaño tumoral, recurrencias de tratamientos previos, histología, nivel de invasión (7,13,14).
Los tumores con márgenes clínicos pobremente definidos pueden tener extensión subclínica con prolongaciones de células tumorales que se originan desde el tumor clínicamente observado.
Con las escisiones de rutina se requieren márgenes amplios y generosa cantidad de tejido normal debe ser removido para prevenir la recurrencias; paralelamente este espécimen histopatológico convencional no detecta pequeños nidos de células tumorales que se extienden por fuera del margen quirúrgico; la cirugía micrográfica de Mohs aventaja en este punto porque incrementa la probabilidad de escisión completa sin el sacrificio de tejidos sanos no comprometidos por el tumor.
Tumores localizados en ciertas áreas anatómicas son asociadas con pobre reconocimiento de la extensión y por ende, tienden a un alto riesgo de recurrencias; en la piel delgada próxima al cartílago como en la oreja, el tumor puede penetrar y extenderse lateralmente a lo largo del plano de menor resistencia comprometiendo una mayor cantidad de tejido. El fenómeno de la punta del iceberg ocurre cuando el tumor es mucho mayor de lo que aparenta clínicamente. Cuando son tratados por cirugía micrográfica de Mohs este fenómeno concluye en escisiones mayores a las que originalmente se proyectaron. La piel que recubre estructuras óseas como el cuero cabelludo, la sien, la parte superior la nariz y la frente, pueden reflejar un efecto similar al anterior. Los tumores que penetran al periostio pueden presentar patrones de crecimiento lateral resultando en grandes áreas de impredecible compromiso; sobre la punta nasal el tumor puede penetrar profundamente entre los planos del cartílago. Los planos de fusión embriología (no demostrados histológicamente) y que se presentan a lo largo del área preauricular, retroauricular, pliegue nasolabial, canto ocular interno, filtrum nasal, son otras áreas de penetración irregular tumoral profunda. Esas áreas tienen riesgo de recurrir sin son tratadas por métodos convencionales diferentes a la cirugía micrográfica de Mohs.
La cirugía micrográfica de Mohs está indicada en el tratamiento de tumores grandes o invasivos en cualquier localización ya que esos tumores tienen una alta incidencia de recurrencias cuando son tratados con métodos convencionales, esto es explicable por la tendencia de tumores muy grandes o invasivos a presentar expansión subclínica. Los tumores recurrentes deben ser considerados para la cirugía de Mohs (2-6,7,14).
El cáncer de la piel puede propagarse y crecer a lo largo de los planos de menor resistencia; en un tumor recurrente el crecimiento es irregular, impredecible y amplio; la fibrosis cicatricial producto de la escisión o la radioterapia previa puede restringir el crecimiento simétrico y fajas o botones de crecimientos malignos pueden proliferar entre el tejido cicatricial y los bordes quirúrgicos de la escisión previa, originando un plano lateral para el avance del tumor (2-6,7,14). Tumores recurrentes sobre escisiones reconstruidas con injerto o con colgajo desarrollan múltiples rutas de extensión tumoral, aquellos que recurren después de reconstrucciones con colgajos complicados son particularmente difí- ciles de resolver (2-4).
Ciertos tipos histológicos de tumores son conocidos por su agresividad local y recurrencia, entre ellos el carcinoma basocelular (morfeiforme, micronodular, metatípico, infiltrante) y otros tumores, deben ser rutinariamente considerados para la cirugía micrográfica de Mohs (2-6,7,14).
La alta tasa de recurrencia de los tumores citados refleja el grado de extensión subclínica que no es demostrado adecuadamente en los exámenes histopatológicos de rutina. La cirugía micrográfica de Mohs está indicada para el tratamiento de tumores que tienen un alto riesgo de metástasis relacionada con el tipo histológico del tumor (melanoma léntigo maligno), la localización de tumor (ejemplo carcinoma escamocelular del labio), tamaño tumoral (carcinoma escamocelular mayor de tres centímetros de diámetro), o la incapacidad del paciente para montar una respuesta inmunológica normal (2-6,7,14).
Otra indicación para la cirugía micrográfica de Mohs es cuando el examen histopatológico de un tumor rutinariamente extirpado revela que fue en realidad incompletamente resecado a pesar de haberse empleado márgenes quirúrgicos amplios, sugiriendo que el tamaño del tumor era clínicamente irreconocible. El abordaje quirúrgico inicial puede crear discontinuidad oncológica y dificultar a futuros tratamientos (2-6,7,14).
La extensión perineural de una neoplasia maligna es una vía de mínima resistencia de extensión a distancia. Grandes carcinomas escamocelulares son de particular tendencia a la invasión perineural; tumores mayores o iguales a 2,5 cm de diámetro demuestran invasión perineural en el 64% y en menores de 2,5 cm de diámetro se han reportado en el 11% (2). Algunos Estudios han demostrado una incidencia significativamente mayor de recurrencias de carcinoma escamocelular cuando existe invasión perineural, comparado con aquellos sin invasión perineural (2). La cirugía micrográfica de Mohs ofrece la menor frecuencia de recurrencias locales en el tratamiento de carcinoma escamocelular con invasión perineural. Sin embargo, por su alta morbilidad y mortalidad se recomienda la radioterapia como tratamiento adyuvante en el carcinoma escamocelular con invasión perineural (2).
Evitar la resección de tejidos sanos y el preciso control de los márgenes de la escisión quirúrgica de tumores en áreas vitales de la piel o en áreas con alta frecuencia estadística de recurrencias locales y metástasis, son excelentes candidatos para la cirugía micrográfica de Mohs (15).
Las áreas en las cuales la preservación de tejidos es altamente deseable como son los oídos y los labios, son a su vez regiones de frecuentes metástasis. La zona “H” de la cara incluye áreas cutáneas funcionales y cosméticas críticamente importantes como son: alas nasales, septum nasal, cantos oculares mediales y laterales, segmentos pre y retroauriculares, filtrum nasal y bermellón de los labios. Otras áreas en las que la preservación de tejidos es importante son los dedos, la unidad ungueal y la región anogenital (2-4,16).
En comparación con otros métodos quirúrgicos de tratamiento oncológico cutáneo, la cirugía micrográfica de Mohs provee la mejor posibilidad de escisión completa con mínimo sacrificio de tejidos peritumorales sanos. Esto redunda en pequeños defectos quirúrgicos, los cuales son de crítica importancia en el restablecimiento funcional y cosmético.
Indicaciones específicas
• Tamaño: 0,6 cm o mayor a 1– 2 cm de diámetro
• Carcinoma basocelular recurrente
• Localización: Zona H (ver indicaciones generales)
• Variedades histológicas: carcinoma basocelular morfeiforme, infiltrativo, micronodular, metatípico o basoescamoso, superficial, en campo de fuego (Más del 40 % de los carcinomas basocelulares pueden tener más de una variedad histológica)
• Carcinoma basocelular incompletamente resecado con márgenes laterales y profundos comprometidos, variedad histológica agresiva, localizaciones de alto riesgo deben ser tratadas con cirugía micrográfica de Mohs.
Carcinoma basocelular
El tratamiento de este tumor comprende la mayoría de las intervenciones en la cirugía micrográfica de Mohs. En el tratamiento de tumores primarios las tasas de curación a 5 años son del 99 % y en tumores recurrentes son del 96%, los resultados son muy buenos cuando se comparan con otras modalidades de tratamiento como: escisión quirúrgica: 89,9% – 82,6% respectivamente, curetaje y electrodesecación 92,3% y 60% y radioterapia 91,3% y 90,2% (6,73). Las tasas de curación del carcinoma basocelular con la cirugía micrográfica de Mohs varian dependiendo del tipo histológico, tamaño, localización y recurrencia. Los tumores menores de 3 cm de diámetro tienen una alta tasa de curación superior al 99% y menor del 93% si el tamaño es superior a 3 cm de diámetro (2,7).
Tumores localizados en el área perioral o peri orbitaria tienen tasas de curación ligeramente in- feriores al promedio, pero superiores al 98% (2,7).
Los tipos histológicos de carcinomas basocelulares que presentan una conducta biológica agresiva, deben ser tratados con cirugía micrográfica de Mohs.
El carcinoma basocelular morfeiforme puede ser clínicamente similar a una cicatriz. Histológicamente las bandas elongadas de células tumorales están inmersas en un estroma fibroso y es común la extensión subclínica del tumor (2-7).
En una serie de 51 carcinomas basocelulares morfeiformes el promedio de extensión subclínica fue de 7,2 mm por fuera del límite usualmente aparente (7,17).
El examen histopatológico con métodos y cortes de rutina no detecta las extensiones tumorales de los márgenes quirúrgicos en tumores intervenidos por escisión convencional. (2-7,14).
El tipo infiltrativo o agresivo también muestra bandas enlongadas de células tumorales con poca celularidad y sin un estroma fibroso denso. Muchos nidos irregulares de células tumorales con proyecciones espinosas comprenden el tumor. Típicamente, el tumor es pobremente demarcado y son comunes las invasiones perineurales profundas. En una serie de 47 pacientes con 51 recurrencias de carcinoma basocelular, la revisión histológica de los tumores originales reveló que el 65% estaban caracterizados por una pobre empalizada y com- ponente micronodular o infiltrativo (2,14) . Por tener esta naturaleza agresiva la cirugía micrográfica de Mohs está indicada.
El tipo micronodular de carcinoma basocelular pobremente definido y clínicamente se presenta como una placa. Histológicamente el pequeño tamaño de los nidos tumorales aparentan un conjunto de pequeñas esferas dispersas. El tipo micronodular tiene más probabilidad que el nodular en tener márgenes tumorales positivos cuando se realizan escisiones quirúrgicas simples (18,6% vs. 6,4%) (2). En un estudio retrospectivo de 69 carcinomas basocelulares micronodulares apareados con 69 controles de carcinoma basocelular nodular, la conclusión histológica fue que la extensión subclínica era significativamente mayor en la variedad micronodular (2,14).
El tipo basoescamoso o metatípico demuestra hallazgos histológicos de basocelulares y escamo- celulares. Biológicamente esos tumores se comportan como carcinoma escamocelular. Este tipo de tumor es más agresivo y tiene mayor posibilidad de recurrir con el tratamiento convencional. Similar al carcinoma escamocelular, el tipo metatípico tiene un gran potencial de metastizar, su incidencia ha sido estimada en 9,7% (2,14).
El tipo superficial es clásicamente no agresivo pero tiende a recurrir con escisiones rutinarias. Histológicamente, lóbulos de celular basaloides atípicas organizadas horizontalmente están presentes en la dermis papilar conectándose ampliamente con la epidermis. Esos lóbulos se extienden por fuera del borde clínicamente aparente. Las tasas de recurrencia de este tipo histológico son las mayores de todos los carcinomas basocelular (2-7,14).
El carcinoma basocelular en “campo de fuego” es un tipo de basocelular con focos multicéntricos discontinuos, este fenómeno puede ocurrir como resultado de recurrencias multifocales de carcinoma basocelular incompletamente tratado o como tumores primarios múltiples sobre un área previamente irradiada o expuesta a otro carcinógeno. El margen de este tumor es difícil de determinar clínicamente, la cirugía micrográfica de Mohs ha sido exitosa en delinear la verdadera extensión de este tumor (2-4).
Es de anotar que el 41% de los carcinomas basocelulares poseen más de un tipo histológico, acarreando un reto terapéutico en el abordaje quirúrgico, imperando en la consideración de su tratamiento el mayor tipo agresivo, ejemplo carcinoma basoescamoso, metatípico, morfeiforme, infiltrativo micronodular (17).
Otra encrucijada terapéutica son los tumores incompletamente operados, es decir, aquellos con márgenes histopatológicos verdaderamente positivos. El manejo de carcinomas basocelulares incompletamente operados continúa en controversia (17).
La evidencia sugiere que la remoción total de algunos carcinomas basocelulares no es necesaria para lograr la curación y aún en dos terceras partes de un tumor incompletamente operado no recurre (17).
La evaluación histológica de tumor residual en un estudio de 43 carcinomas basocelulares incompletamente operados y que fueron reintervenidos, demostró la presencia tumoral en el 7% al ser evaluados con cortes histológicos de rutina (17).
Sin embargo, en otro estudio de 78 carcinomas basocelulares incompletamente operados reintervenidos quirúrgicamente y evaluados usano cirugía micrográfica de Mohs, se halló tumor residual en el 55% de los casos, demostrándose una detención más acuciosa de tumor en cualquier límite del margen quirúrgico por el método de Mohs. En un estudio prospectivo de frecuencia de recurrencias en 34 carcinomas basocelulares incompletamente operados, el 41% recurrió en dos años (17).
En una revisión de sesenta carcinomas basocelular incompletamente operados, 58% recurrieron. En una serie de 187 basocelular incompletamente operados de ellos el 93% lo- calizados en la cabeza y el cuello, 119 fueron inmediatamente tratados con radioterapia o reoperados y 67% no recibieron ningún tratamiento. Después de un seguimiento de 2,7 años, en promedio y por análisis estadístico a cinco años, se demostró una probabilidad de curación en el grupo de radioterapia del 91% y en el grupo que no recibió tratamiento 61% (17).
En la evaluación de los márgenes positivos en una serie de 60 carcinomas basocelular incompletamente operados, 35 de ellos (58%) recurrieron. El riesgo de recurrencias fue alto en lesiones que comprometían el margen lateral y profundo. Los carcinomas basocelulares incompletamente operados, con margen profundo, positivos son difíciles de curar con reescisión quirúrgica. La probabilidad de recurrencias del carcinoma basocelular con margen lateral positivo es del 17 % y con margen profundo del 33% (17).
En el tratamiento de carcinoma basocelular incompletamente operado, importantes estudios han recomendado la reintervención inmediata, especialmente si el defecto quirúrgico fue reparado con colgajos o injertos de piel.
Una política más expectante puede ser más apropiada para aquellos tumores incompletamente operados con únicamente márgenes laterales positivos, tipo histológico, localización no agresiva y sin recurrencias (15).
En contraste, es más apropiado realizar retratamientos a pacientes con márgenes profundos positivos, tipo histológico, localización agresiva y tumores recurrentes. En esta situación la escisión con cirugía micrográfica de Mohs estaría indicada (17) .
Utilizando la técnica de Mohs la probabilidad de recurrencia en 5 años es de 1,4% en tumores primarios y 4% en tumores recurrentes (18).
La invasión perineural en el carcinoma Basocelular ha sido informado entre 1% y 3% de los tumores primarios y entre 5% y 7% de los tumores recurrentes. La presencia de invasión perineural (19) es un indicador de mal pronóstico, a su vez que este hallazgo es frecuente en los tipos histológicos agresivos: morfeiforme, infiltrativo y basoescamativo.
En razón a esta condición agresiva está indicada la cirugía de Mohs en pacientes con carcinoma basocelular e infiltración perineural, aunque la probabilidad de recurrencia en 5 años es de 7,7%, sin resultados concluyentes se recomienda radioterapia adyuvante (19).
Carcinoma escamocelular invasivo
• Infiltración perineural
• Localización labial: (Clak IV, V o 4 mm de profundidad)
• Localización en la oreja.
• Tumores con diámetros entre 0,5 o > 2 cm
• Tumores recurrentes
• Pacientes inmunosuprimidos
• Tumores desarrollados sobre lesiones pre-existentes.
Es el segundo tumor que es tratado con cirugía micrográfica de Mohs. En una serie de 3.355 tumores tratados con cirugía micrográfica de Mohs en la clínica Mayo, de Rochester, el 21% fue carcinoma escamocelular (2).
El tratamiento del carcinoma escamocelular casi siempre representa un reto mayor que el carcinoma basocelular, porque primariamente presenta metástasis locales creando áreas libres de tumor, en la cual acúmulos de células tumorales no continuan con la masa principal dominante. Metástasis locales ocurren comúnmente después de tratamientos no exitosos, ya que la masa tumoral debe ser continua para ser intervenida por la cirugía micrográfica de Mohs. Metástasis locales y distantes reducen la probabilidad de erradicación tumoral completa. En grandes series de carcinoma escamocelular tratados con cirugía micrográfica de Mohs, la tasa de curación a cinco años de pacientes con metástasis fue del 16% comparada con tasas de curación del 98% en aquellos pacientes sin metástasis (2-7).
En general, la tasa de metástasis de carcinoma escamocelular primario de la piel se estima entre el 2% y el 3%. La mayoría de metástasis comprometen los ganglios linfáticos regionales pero extensiones hematógenas a órganos distantes han sido reportadas entre el 5% y el 10% (2).
Los factores que se correlacionan con los riesgos de recurrencias y metástasis son: localización del tumor, invasión perineural, tamaño, diferenciación histológica, profundidad, tratamientos previos e inmunosupresión.
El carcinoma escamocelular desarrollado en áreas lesionadas por el sol raramente hace metástasis, si esto ocurre ha sido informado entre el 5,2% y 5,9% de los pacientes (20).
El carcinoma escamocelular que se desarrolla en áreas de inflamación crónica posee alto riesgo de metástasis. En cicatrices de quemaduras, metastatiza el 18%, en osteomielitis crónica el 31%, en áreas irradiadas el 20% y sobre el lupus eritematoso discoide el 30% (2).
La invasión perineural por el carcinoma escamocelular es más frecuente que el carcinoma basocelular. El carcinoma escamocelular con comomiso tumoral perineural puede alcanzar varios centímetros del sitio inicial de entrada del tumor al espacio perineural (2,7,14,21-24). Se encuentra invasión perineural en el 3,7% de los carcinomas escamocelulares (24). Grandes carcinomas es- camocelulares tienen mayores probabilidades de hacer invasión perineural. En el 64% de los tumores iguales o superiores a 2,5 cm de diámetro se ha encontrado invasión perineural, pero sólo en 11% de los tumores menores de 2,5 cm de diámetro (2). El carcinoma escamocelular neurotrópico del labio tiene pobre pronóstico, la incidencia de invasión perineural en lesiones del labio es del 1,9 al 10,8% (24). La sobrevida a cinco años de estos tumores en esta localización es del 35% (17).
Los tumores mal diferenciados igualmente demuestran invasión perineural. El carcinoma escamocelular con invasión perineural tratado por cirugía micrográfica de Mohs posee las más bajas tasas de recurrencias locales y metástasis que constan entre el 0%, 5,9% y 8%, respectivamente (24); comparados con las tasas de recurrencias locales y metástasis utilizando la escisión quirúrgica que están entre 47,2% y 34,8% respectivamente (24).
Las tasas de curación del carcinoma escamocelular tratados con cirugía micrográfica de Mohs son imprecisos. Una serie de 3.299 casos analizados por el mismo doctor Mohs en los que incluyó casos con carcinoma escamocelular metastásico y de gran extensión local, encontró que tumores de 2 cm de diámetro lograron tasas de curación a cinco años mayores al 99%, mientras que lesiones entre 2 y 3 cm de diámetro, curaron en el 82% y lesiones superiores a 3 cm de diámetro tuvieron tasas de curación del 59% a cinco años (2) .
El grado histológico del tumor influyó en la tasa de curación. Los cuatro grados de carcinoma escamocelular originalmente definidos por Broders en 1921 están basados en el grado de maduración o diferenciación celular. Los carcinomas escamocelulares de mejor diferenciación, grados 1 y 2 tuvieron tasas de curación a cinco años entre el 99 y 94 % respectivamente. Las tasas de curación a cinco años cayeron al 74% y 45% para los menos diferenciados, grados 3 y 4 respectivamente (2). El hecho que el 63,7% de las lesiones metastásicas son bien diferenciadas enfatiza que esta variante histológica por sí sola no es factor pronóstico (2). Las bajas tasas de curación de tumores grandes y con alto grado de indiferenciación, son principalmente causadas por metástasis y extensión a estructuras vitales. La mayoría que han sido curados con cirugía micrográfica de Mohs habían sido considerados incurables por otros métodos (2).
La profundidad tumoral es el nivel donde se encuentra el tumor. Existen mínimos riesgos de metástasis (6,7%) en las lesiones Clark I a III o lesiones hasta 4 mm de profundidad (2). El riesgo de metástasis incrementa marcadamente (45,7%) en las lesiones Clark IV o V o mayores a 4 mm de profundidad. Las lesiones labiales mayores a 6 mm y cutáneas mayores de 8 mm tienen alto riesgo de metástasis. Los carcinomas escamocelulares de la piel y el labio en los que ha fallado su curación por tratamientos previos, presentan significativamente altas tasas de metástasis que aquellos que no han recibido tratamiento (2).
En un reciente estudio de 1.263 pacientes con carcinoma escamocelular tratado con cirugía de Mohs y seguimiento a 5 años, se informan recurrencias de 3,9% distribuidas en: 2,6% de los tumores primarios y 5,9% de los tumores recurrentes; no se encontraron asociaciones entre recurrencias a 5 años y tamaño del tumor, subtipo histológico o localización (26).
La tasa de metástasis de lesiones recurrentes localmente es del 25,1% para carcinomas escamocelulares de la piel, 45% para carcinomas escamocelulares de la oreja y 31,5% para carcinoma escamocelulares del labio (25). El carcinoma escamocelular que recurre localmente en el sitio del tratamiento previo, tiene mayor probabilidad de desarrollar nuevas recurrencias. La recurrencia de retratamiento usando la cirugía escisional, es del 23,3% y con la cirugía micrográfica de Mohs, es del 10% (17).
La incidencia de carcinoma escamocelular en pacientes inmunosuprimidos es del 2,5 % la cual es 5 a 20 veces más alta que la incidencia en la población general (25). Incluye pacientes de transplante renal, leucemia, linfoma, epidermodisplasia verruciforme, micosis fungoide en tratamiento con agentes tópicos y el uso de varios agentes como ciclosporina, prednisona, azatioprina, ciclofosfamida en el tratamiento de varias enfermedades incluyendo Psoriasis, Epoc, penfigoide cicatricial, enfermedad renal, artritis reumatoidea, anemia anaplásica (25). Hay una notable ausencia en pacientes con SIDA probablemente por su corta sobrevida en compa- ración con los anteriores (25).
Existe correlación entre el grado de inmunosupresión celular, la infiltración linfocítica y el carcinoma escamocelular; la infiltración inflamatoria tumoral es de buen pronóstico, la ausencia se correlaciona con recurrencias locales y metástasis (25).
En pacientes con transplantes renales la respuesta inflamatoria en el carcinoma escamocelular está disminuida en comparación con pacientes controles normales de carcinoma escamocelular. Esos estudios sugieren que la inmunosupresión y la respuesta celular del huésped son importantes al determinar la incidencia y agresividad del carcinoma escamocelular mucocutáneo (25).
La localización, recurrencias y curación a cinco años, demuestran que la cirugía de Mohs fue superior comparada con otras modalidades terapéuticas (crioterapia, curetaje, electrodesecación, radioterapia y escisión quirúrgica. En los carcinomas escamocelulares localizados en la piel con modalidades Mohs la curación fue del 92,1% y con Mohs 96,9%, tumores en el labio tratados con modalidades no Mohs, la curación fue del 89,5% y con Mohs fue del 97,7%. En los tumores localizados en la oreja usando terapias no Mohs fue del 81,3% y con Mohs 94,7% y en tumores recurrentes con no Mohs fue 76,7% y con Mohs fue del 90% (25).
La cirugía micrográfica de Mohs está indicada en el tratamiento de pacientes con carcinoma escamocelular de alto riesgo pronóstico como son aquellos localizados en el labio, oreja, con tamaños mayores de 2 cm, pobre diferenciación histológica, lesiones profundas mayores de 4 mm o Clark IV o V, neurotrópicas, recurrentes, desarrolladas sobre lesiones preexistentes no irradiadas por el sol o en pacientes inmunosuprimidos. Las modalidades terapéuticas diferentes a la cirugía micrográfica de Mohs están indicadas en pacientes de bajo riesgo (25,26,28).
La localización de los tumores está relacionada con el alto riesgo pronóstico. Aquellos localizados en la oreja tienden a recurrir en el 18,7% y metastizar en el 11%. Los localizados en el labio recurren en el 10,5% y metastizan en el 13,7% (25).
Si se quiere ampliar el conocimiento sobre este tema, el lector puede consultar referencias adicionales (29-74).
REFERENCIAS
1. Rapini RP. False-negative surgical margins. Adv
Dermatol 1995; 10: 137-148.
2. Shriner DL, McCoy D.K, Goldberg DJ, Wagner RF. Mohs Micrographic Surgery. J Am Acad Dermatol
1998; 39: 79-97.
3. Bennett RG. Mohs surgery. New Concepts And
Application. Dermatol clin 1987; 5: 409-428.
4. Lang PG. Mohs Micrographic surgery. Fresh – Tissue technique. Dermat clin. 1989; 7: 613-626.
5. Greenway H T,Maggio K L.Mohs micrographic surgery and coetaneous Oncology. In:Robinson j k, hanke C W, Sengelmann R D, Siegel D M. (Ed). Surgery of the Skin proedural Dermatology.2005 Elsevier Inc
777-800.
6. Bricca G M, Brodland D. Mohs Surgery:The Full spectrum Of application. In:Riegel D S, Friedmann r J, Dzubow L M, Reintgen D S,Bystryn J-C, Marks r. (Ed). 2005 Elsevier Inc 537-548.
7. Ad Hoc Task Force, Connolly SM , Baker DR, Col- diron B M, et al. AAD/ ACMS/ASDSA/ASMS 2012 appropiate use criteria for Mohs micrographic surgery: a report of the American Academy of dermatology, American College of Mohs Surgery, American So- ciety for Dermatologic Surgery Assosiation, and the American Society for Mohs surgery. J Am Acad Dermatol 2012 ;67:531-50.
8. Kimyai– Asadi A, Bolberg L H, Jih MH. Accuray of serial transverse. Cross-sections in detecting residual basal cell carcinoma at the surgical margins of an elliptical excision specimen. J Am Acad Dermatol
2005; 53: 469– 474.
9. Larson PO, Donnell DO, Hetzer M. Dogan M. Mohs fixed tissue preparation in Maloney M, Torres A Hoff- mann TJ Helm KF (Ed): surgical dermatopathology, Massachusetts. Blackwell science, Inc. 1999; p.
49-78.
10. Alyssa YK, Bennett RG. Determining cancer at surgical margins. In: Maloney M, Torres A, Hoffmann TJ, Helm KF (Ed): surgical dermatopathology. Massachusetts. Backwell science, Inc, 1999; p.107-123
11. D Huang C , Boyce Sarah, Morthington M, Desmond R, Soong S-J. Randomized, controlled surgical trial of preoperative tumor curettage of basal cell carcinoma in Mohs micrographic surgery. J am Acad Dermatol
2004; 51: 585-591.
12. Clyton BD, Leshin B, Hitchcock. MG, Marks M, white WL Utility of rush paraffin-embedded tangential sections in the management of coetaneous neoplasm’s. Dermatol Surg 2000; 26: 671-678.
13. Lang PG. Osguthorpe J D. Indications and Limitations of Mohs micrographic surgery. Dermatol clin 1989;
7: 627-644.
14. Blechman A B, Patterson J W , Russell m A . Application of Mohs micrographic surgery appropriate-use critera to skin cancers at a iniversity healt system. J Am Acad Dermatol 2014;71: 29-35
15. Barrett TL. Greenway HT, Massullo V, Carlson C.
Treatment of basal cell carcinoma and squamous cell carcinoma with perineural invasion. Adv Dermatol
1993; 8: 277-305.
16. Forman S B,Ferringer T C,Garret A B. Basal Cell
Carcinoma Of The Nail Unit J Am Acad Dermatol 2007;56:811-814
17. Telfer NR, Colver GB, Bowers PW.Guidelines for the management of basal cell carcinoma. Br J Dermatol
1999; 141: 415-423
18. Leibovitch I, Huigol s c, selva D, Richards s, paver R. Basal cell carcinoma treated with Mohs surgery in Australia II. Outcome at 5 years. Follow– up. J am Acad Dermatol 2005; 53: 452-457.
19. Leibovitch I, Huigol s c, selva D, Richards s, paver R. Basal cell carcinoma treated with Mohs surgery in Australia III. Perineural invasion. J am Acad Dermatol
2005; 53: 458-463.
20. Larrabee WF. Immediate repair of facial defects.
Dermatol Clin 1989; 7:661-676.
21. Lawrence N, Cottel W. Squamous cell carcinoma of skin with perineural invasion . J Am Acad Dermatol
1994; 31: 30-33.
22. Malhotra R, James C L, Selva D, Huynh N, Huigol S C. the Australian Mohs database: periocular squamous intraepidermal carcinoma. Opthalmology 2004;
111:1925-9.
23. Matorin PA, Wagner RF Jr. Mohs Micrographic surgery: tecnical difficulties posed by perineural invasion. Inter J Dermatol 2002; 31:83-6.
24. Feasel A M, Brown TJ, Rogle MA, tschen J A, Nelson B R. perineural invasion of cutaneous malignances. Dermatol Surg 2001; 27:531-42.
25. Rowe DE, Carroll RJ, Day CL. Pronostic factors for local recurrence, metastasis and survival rates in squamous cell carcinoma of the skin, ear and lip. Implications for treatment modality selections. J Am Acad Dermatol 1992; 26: 976-990.
26. Leibovitch I, Huigol s c, selva D, Richards s, paver R. cutaneous squamous cell carcinoma treated with Mohs micrographic surgery in Australia I. Experience over
10 years. J am Acad Dermatol 2005; 53: 253-260.
27. Papa CA, Ramsey MH. Digital imaging for mapping
Mohs surgical specimens. J Am Acad Dermatol 2000;
43: 712-713.
28. Mohs FE. Mohs Micrographic surgery. A historical perspective. Dermatol clin 1989; 7: 609-611.
29. Adams BB, R Gloster HM. Double nicking for Mohs tissue specimen. J Am Acad Dermatol 2000; 42:
1067-1068.
30. Gloster HM, Taylor AF. Surgical Pearl: The Use of Multiple Different tissue specimens on the same glass slide to enhance the efficiency of frozen section preparation in Mohs micrographic surgery. J Am Acad Dermatol 1998; 39: 107-108.
31. Leibovitch I, Huigol SC, Selva D, Richards S, Paver R. Cutaneous squamous cell carcinoma treated with Mohs micrographic surgery in Australia II. Perineural invasion. J Am Acad Dermatol 2005; 261-266.
32. Broadland DG, Zitelli JA. Surgical margins for excision of primary cutaneous squamous cell carcinoma. J Am Acad. Dermatol 1992; 27: 241-248.
33. Heaphy M.R., r Ackerman AB. The nature of solar keratosis: a critical review in historical perspective. J Am Acad Dermatol 2000; 43:138-150.
34. Leibovitch I, shyamala CH, selva D, et al. Cutaneous squamous carcinoma in situ (Bowen´s disease): treatment with Mohs micrographic surgery. J Am Acad Dermatol 2005; 52: 997-.1002.
35. Wang S Q,Goldberg L H,Nemeth A . The merits of Adding toluidine blue-stained slides in Mohs surgery in the treatment of a microcystic adnexial carcinoma. J Am Acad Dermatol 2007,56:1067-1069
36. riedman. PM, Friedman RH, Jiang B, Nourik, Amo- nette R, Robins P. Microcystic adnexal carcinoma: Collaborative series rewiew and update. J. Am Acad Dermatol 1999; 41: 225-231.
37. Leibovitch I, shyamala C H, selva D, et al. Microcystic adnexal carcinoma: treatment with Mohs micrographic surgery. J A m Acad Dermatol 2005; 52: 295-300.
38. Huether MJ, Zitelli JA, Broadland DE. Mohs microgra- phic surgery for the treatment of spindle cell tumors of the skin. J Am Acad Dermatol 2001; 44: 656-659.
39. Hendi A, Brodland D G, zitelli J A. Extramammary paget´s disease: surgical treatment with Mohs micrographic surgery. J A m Acad Dermatol 2004; 51:
767-773.
40. O´Connor W J, Lim K , zalla MJ, Gangnot M, Otley cc, Nguyen TH, et al. Comparison of Mohs micrographic surgery and wide excision for extramammary paget´s disease. Dermatol. Surg 2003; 29: 723-7.
41. Cohen LM. What’s new in lentigo maligna. Adv
Dermatol 1999. 15: 203-231.
42. Menaker G M, chiang J K, tabila B, Moy R L. Rapid HMB– 45 staining in Mohs micrographic surgery for melanoma in situ and invasive melanoma. J am Acad Dermatol 2001; 44: 833-836.
43. Grevey SC, Zax RH, McCall MW. Melanoma and
Mohs Micrographic surgery. Adv Dermatol 1995; 10:
175-199.
44. Johnson TM, Smith JW, Nelson BB, Chang A. Cu- rrent therapy for cutaneous melanoma. J Am Acad Dermatol 1995; 32: 689-706.
45. Zitelli JA, Brown C, Hanusa BH. Mohs Micrographic surgery for the treatment of primary cutaneous me- lanoma. J Am Acad Dermatol 1997; 37: 236-245.
46. Zitelli JA, Brown C, Hanusa BH. Surgical margins for excision of primary cutaneous melanoma. J Am Acad Dermatol 1997; 37:422-429.
47. Weihstock MA, Sober AJ. The risk of progression of lentigo maligna to lentigo maligna melanoma. Br J Dermatol 1987; 116: 303-310.
48. Cohen LM. Lentigo maligna and lentigo maligna melanoma. J Am Acad Dermatol 1995; 33: 923-936.
49. Robinson JK. Margin control for lentigo maligna. J Am Acad Dermatol 1994; 31(1): 79-85.
50. Kelley L C, starkus L. Immunohistochemical staining of lentigo maligna during Mohs micrographic surgery using Mart-1. J am Acad Dermatol 2001; 46: 78-84.
51. Bienert TN, trotter MJ, Arlette JP. Treatment of cuta- neous melanoma of the face by Mohs micrographic surgery. J. cutan med surg 2003; 7:25-30.
52. Hitchcock MG, Leshin B. White WL. Pitfalls in frozen section interpretation in Mohs micrographic surgery. Adv Dermatol 1998; 13: 427-462.
53. Boyer J D, zitelli J A, Brondland D G, D’ Angelo G D. Local control of primary Merkel cell carcinoma: Review of 45 cases treated with Mohs micrographic surgery with and without adjuvant radiation. J Am Acad Dermatol 2002; 47: 885-892.
54. Piérdard G E, Fazzar, Henry F, et al. collision of primary malignant neoplasms on the skin: the con- nection between malignant melanoma and basal cell carcinoma. Dermatology; 1997; 194(4): 378-379.
55. Spencer J M, Nossa– R, Tse D t, Sequeira M. Se- baceus carcinoma of the eyelid treated with Mohs Micrographic surgery. J Am Acad Dermatol 2001;
44: 1004-1009.
56. Katz K H, Helm K F, Billingsley E M, Maloney M E.
Dense inflammation does not mask residual primary basal cell carcinoma during Mohs micrographic surgery. J Am Acad Dermatol 2001: 45: 231-238.
57. Mondragon RM, Barrett TL. Current concepts: the use of immunoperoxidase techniques in Mohs microgra- phic surgery. J Am Acad Dermatol 2000; 43:66-71.
58. Jiménez FJ, Clark RE. Buchanan MD. Kamino H.
Lymphoepithelioma – like carcinoma of the skin trea- ted with Mohs micrographic surgery in combination with immune staining for citoqueratinas. J Am Acad Dermatol 1995; 32: 878-881.
59. Jiménez FJ, Grichnik JM, Buchanan MD, Clark RE.
Inmunohistochemical techniques in Mohs microgra- phic surgery: Their potential use in the detection of neoplastic cell masked by inflammation. J Am Acad Dermatol 1995; 32:89-94.
60. Stonecipher MR, Leshin B, Patrick J,White WL.
Management of lentigo maligna and lentigo malig- na melanoma with paraffin– embedded tangential sections: Utility of immunoperoxidase staining and supplemental vertical sections. J Am Acad Dermatol
1993; 29: 589-594.
61. Banfield CC, Dawber PR, Walker N. et al. Mohs micrographic surgery for the treatment of in situ nail apparatus melanoma: A case report . J Am Acad Dermatol 1999; 40: 98-99.
62. Siegle JR, Schuller DE. Multidisciplinary surgical approach to the treatment of perinasal nonmelanoma skin cancer. Dermatol Clin 1989; 7: 711-731.
63. Weisberg NK, Bertagnolli MM, Becker DS. Combined Sentinel lymphadenectomy and Mohs micrographic surgery for the high– risk cutaneous squamous cell carcinoma. J Am Acad Dermatol 2000; 43: 483-488.
64. Bernstein G. Healing by secondary intention. Dermatol
Clin 1989; 7: 645-660.
65. Leonard A L, Hanke W . Second Intention healing for intermediate and large postsurgical defects of the lip. J Am Acad Dermatol 2007 ; 57:832-835
66. Faizal M , Bulla F. Carcinoma faciales múltiples de alta agresividad, manejo y técnicas de reconstrucción quirúrgica. Rev. Col. Dermatol: 1998; 6 (2): 25-20.
67. Thibault MJ, Bennett RG. Success of delayed full – thickness skin grafts after Mohs micrographic surgery. J Am Acad Dermatol 1995; 32: 1004-1009.
68. Fritz T, Burg G, Hafner J. Eyebrow reconstruction with free skin and hair– bearing composite graft. J Am Acad Dermatol 1999; 41: 1008-1010.
69. Madani S, Huilgol S, Carruthers A. Unplanned in- complete Mohs micrographig surgery. J Am Acad Dermatol 2000; 42: 814-819.
70. Cook J, Zitelli JA. Mohs micrographic surgery : A cost analysis. J Am Acad Dermatol 1998; 39: 698-703.
71. Silapunt s, Peterson S R. Alcalay J, Golberg Lh.
Mohs tissue mapping and processing: a survey study. Dermatol surg 2003; 29: 1109-12.
72. Lebwohl M, Bernhard JD. The case for micrographi- cally controlled skin surgery. Editorial. J AM Acad Dermatol 2000; 42: 698-699.
73. Liang CL, Jambusaria-Pahlajani A, Karia PS, et al. A Systematic review of outcome data for dermatofibrosarcoma protuberans with and without fibrosarcoma- tous change. J Am Acad Dermatol 2014,71:781-786.
74. Bricca G M, Brodland D G, Ren D, zitelli J A. Cuta- neous head and neck melanoma treated with Mohs micrographic surgery. J Am acad Dermatol 2005;
52: 92-100.
Recibido: Abril 2, 2015
Aceptado: Mayo 2, 2015
Correspondencia: Michel Faizal mfaizalg@gmail.com