ANÁLISIS DEL PERFIL CARDIOVASCULAR EN NIÑOS Y ADOLESCENTES CON EPILEPSIA IDIOPÁTICA TRATADOS EN MONOTERAPIA CON ÁCIDO VALPROICO O CARBAMAZEPINA
Randy Guerra-Olivares1, Alicia Alayón2, Raimundo Castro3,
Francisco Cabrera- Portieles4, Salim Díaz5
RESUMEN
Introducción: El uso apropiado de ácido valproico y carbamazepina ha mostrado marcada eficacia para el control de las crisis en pacientes con diagnostico de epilepsia; sin embargo, se ha visto asociado a ciertos efectos secundarios. Entre ellos, cobran especial importancia aquellos que afectan el peso corporal y el perfil bioquímico. Objetivo: Evaluar la presencia de factores de riesgo cardiovasculares en niños y adolescentes diagnosticados con epilepsia idiopática, tratados en monoterapia con ácido valproico o carbamazepina. Métodos: Estudio analítico de corte transversal en niños y adolescentes con diagnóstico de epilepsia en monoterapia con alguna de las dos drogas mencionadas, a quienes se les realizó toma de medidas antropométricas como peso y talla, se calculó índice de masa corporal y se tomaron muestras de sangre para realizar cuantificación en suero de la droga, glucemia y perfiles lipídicos. Resultados: Del total de 30 pacientes, 14 fueron medicados con ácido valproico y 16 con carbamazepina, edad promedio del primer grupo, 9,4 años (IC95% 7,0 a 10,9), 50 % género masculino; (IC95% 26,8 a 73,2) recibiendo dosis promedio de de 26,8 mg/kg/día. Grupo carbamazepina, con edades promedio de 10,3 años (IC95% 8,8 a 11,8), 9 pacientes masculinos (56,3 %; IC95% 33,2 a 76,9) y 7 femeninos (43,7 %; IC95% 23,1 a 66,8), recibiendo dosis promedio de 14,1 mg/kg/día (IC95% 12,6-15.7; mínimo 8,8 y máximo 21,3). Del total de niños 26,7 % presentaban retardo de crecimiento y el 73,3 % normalidad. Todos los casos tuvieron glucemias menores de 100 mg/dL y triglicéridos mayores de 100 mg/dL. En el grupo de carbamazepina, 75% presentaban hipercolesterolemia (≥ 170 mg/dL) superior al grupo ácido valproico (21,4 %; 3/14); con diferencia de proporciones (IC95% 18 a 74 %; p = 0,003*). Conclusiones: Los resultados obtenidos sugieren que es necesario considerar las alteraciones del perfi l lipídico en relación del tratamiento con cualquiera de las dos drogas estudiadas, en razón de los incrementos en las concentraciones de colesterol total y triglicéridos evidenciados en esta serie, a efecto de poder intervenirlos de manera oportuna
Palabras clave: Perfil lipídico, epilepsia, carbamazepina, ácido valproico.
CARDIOVASCULAR PROFILE ANALYSIS OF CHILDREN AND ADOLESCENTS WITH IDIOPATHIC EPILEPSY TREATED IN MONOTHERAPY WITH VALPROIC ACID OR CARBAMAZEPINE
ABSTRACT
Introduction: The appropriate use of valproic acid and carbamazepine has shown marked efficacy for seizure control in patients with a diagnosis of epilepsy, however, it has been associated with certain side effects. Particularly important are those affecting body weight and biochemical profile. Objective: To evaluate the presence of cardiovascular risk factors in children and adolescents diagnosed with idiopathic epilepsy treated in monotherapy with either of the two drugs. Methods: Cross-sectional analytical study in children and adolescents diagnosed with epilepsy treated with this monotherapy, who underwent anthropometric measurements such as weight and height, calculated body mass index and samples taken from blood for quantification of the drug in serum, blood glucose and lipid profiles. Results: Of the 30 patients, 14 were medicated with carbamazepin and 16 with valproic acid. The latter group mean age of 9.4 years (95% 7.0 to 10.9), 50% male, (95% CI 26.8 to 73 2) receiving an average dose of 26.8 mg / kg / day. The former group, with an average age of 10.3 years (95% CI 8.8 to 11.8), 9 male patients (56.3%, 95% CI 33.2 to 76.9) and 7 females (43.7% 95% CI 23.1 to 66.8), received an average dose of 14.1 mg / kg / day (95% 12,6-15.7, minimum 8.8 and maximum 21.3). 26.7% of children had growth retardation and 73.3% were normal. All cases had blood glucose below 100 mg / dL and triglycerides above 100 mg / dL. 75% of the carbamazepine group had hypercholesterolemia (≥ 170 mg / dL), more than in the other group (21.4%, 3/14), with a difference of proportions (95% CI 18-74%, P = 0.003 *). Conclusions: Results suggest the necessity to look for alterations in lipid profile in relation to treatment with either drug, especifically because increase in total cholesterol and triacylglyceride were evidenced in this series. If such alterations are found, physicians can intervene them in a timely manner.
Keywords: Lipid profile, epilepsy, carbamazepine, valproic acid.
INTRODUCCIÓN
La epilepsia es, según la ILAE (International League Against Epilepsy), un “trastorno neurológico crónico caracterizado por una predisposición del cerebro para generar crisis epilépticas recurrentes, con consecuencias neurobiológicas, cognitivas, psicológicas y sociales” de acuerdo a la clasificación de 1989 la definición corresponde a dos o más crisis recurrentes no provocadas. Este concepto ha evolucionado hasta que recientemente, en el 2005 se definió el término epilepsia como un desorden cerebral crónico caracterizado por una predisposición a desarrollar crisis epilépticas, con una serie de consecuencias neurobiológicas cognitivas, psicológicas y sociales. La definición de epilepsia requiere de por lo menos una crisis epiléptica. Es decir, a partir de esta definición se puede deducir que un paciente que haya tenido una sola crisis pero que tenga un factor de alto riesgo de recurrencia de crisis ya sea perinatal, familiar o electroencefalográfico, sufre de epilepsia. La definición no ha variado con la nueva clasificación del 2010 (1-3).
Es una enfermedad frecuente, con una prevalencia en América Latina y el Caribe que oscila entre 6 y 43 casos por cada 1 000 habitantes (4). En Colombia, la tasa de incidencia está entre 26 y 70 por cada 100 000 personas y la prevalenciaglobal reportada por el Estudio Neuro-epidemiológico Nacional (Epineuro) es de 10,8/1 000 (IC95% 8,5 a 13) (5), con poca variación entre las regiones a excepción de la región oriental donde es del 23/1 000 (6).
Su tratamiento se fundamenta en el uso de drogas que deben administrarse de manera permanente y entre las más frecuentes se encuentran el ácido valproico (AV), y la carbamazepina (CBZ), en tratamiento con monoterapia como la mejor elección en pacientes pediátricos (7).
Ambos medicamentos han mostrado marcada eficacia para el control de las crisis; sin embargo, su uso también se ha visto asociado a múltiples efectos secundarios. Entre ellos, cobran especial importancia los que afectan el peso corporal y los perfiles lipídicos, en razón de las evidencias existentes que permiten vincular el uso permanente de fármacos antiepilépticos con el incremento en la morbimortalidad por causas cardiogénicasy cerebrovasculares (8), así como interacciones medicamentosas que pudieran afectar el normal desarrollo de los pacientes tratados con estas drogas (9).
Por lo anterior, se planteó el presente trabajo de investigación cuyo objetivo fue evaluar la presencia de factores de riesgo cardiovascular en niños y adolescentes diagnosticados con epilepsia idiopática, tratados con monoterapia de AV o CBZ.
1 MD. Investigador – Neurociencias. Centro Latinoamericano de Investigación en Epilepsia-CLIE. Fundación Centro Colombiano de Epilepsia y Enfermedades Neurológicas-FIRE. Cartagena, Colombia.
2 MSc. Bioquímica Clínica, Docente Universidad San Buenaventura, Cartagena
3 MSc. Microbiología- Docente Universidad San Buenaventura, Cartagena
4 MD. Neurofi siólogo. Fundación Centro Colombiano de Epilepsia y Enfermedades Neurológicas-FIRE. Cartagena, Colombia. Docente Universidad de Cartagena, Colombia. Centro Latinoamericano de Investigación en Epilepsia (CLIE).
5 MD. Neurocirujano. Fundación Centro Colombiano de Epilepsia y Enfermedades Neurológicas-FIRE. Cartagena, Colombia.
MATERIALES Y MÉTODOS
Se realizó un estudio analítico de corte transversal en un grupo de niños y adolescentes con diagnóstico de epilepsia y tratamiento con AV o CBZ en monoterapia, a quienes se les realizó toma de medidas antropométricas como peso y talla, y se calculó el índice de masa corporal (IMC). Se tomaron muestras de sangre para realizar cuantificación en suero de la droga, glucemia y perfil lipídico.
Como indicador de alteraciones de peso corporal se utilizó el índice Z de IMC para la edad (Z IMC/edad) y para crecimiento el índice Z de talla para la edad (Z talla/edad), y se aplicaron los criterios de la Resolución 2121 de 2012, por la cual se adoptan para Colombia los patrones de crecimiento publicados por la OMS en el año 2006 para niños y adolescentes de 0 a 18 años (10).
De acuerdo con el índice Z IMC/edad, se consideró normalidad cuando el valor se ubica entre -1 y +1; bajo peso, menor que -1; sobrepeso, entre+1 y +2 y obesidad cuando supere +2. Para Z talla/ edad se consideró normalidad cuando los valores estuvieran entre -1 y +1; riesgo, entre -1 y -2 y retardo de crecimiento cuando fueran inferiores a-1(11). Se excluyeron del estudio aquello pacientes que manifestaran estar recibiendo cualquier otro tipo de medicamento, dieta alimenticia especial, estado de embarazo o enfermedad crónica concomitante.
Para las cuantificaciones en suero, se tomó una muestra de sangre al paciente con un ayuno de 8-10 horas en dos tubos de 5 mL, uno conteniendo EDTA como anticoagulante y el otro sin anticoagulante. La extracción de muestras de sangre se realizó por lo menos tres semanas después del inicio de tratamiento o cambio de dosis, y antes de la administración de la primera dosis del día.
Los niveles en suero de AV y CBZ, fueron determinadosmediante una prueba de inmunoanálisis de polarización (Abbott AxSYM®). Por su parte, las glucemias y perfiles lipídicos se realizaron utilizando estuches comerciales.
Para el procesamiento de los datos se utilizó el programa estadístico SPSS v. 17.0. Se sometieron a pruebas de normalidad (Kolmogoro y Smirnof), para decidir el uso posterior de pruebas de t de Student para variables paramétricas, o su equivalente en caso contrario. Todo el estudio se llevó a cabo de conformidad con las exigencias establecidas en la Resolución 008430 de 1993 del Ministerio de Salud de la República de Colombia y fue sometido a evaluación y aprobación por el Comité de Ética de la institución.
RESULTADOS
Se incluyeron en el estudio un total de 30 pacientes diagnosticados con epilepsia, 14 medicados con AV (denominado grupo AV) y 16 con CBZ (denominado grupo CBZ), todos pertenecientes a estratos 1 y 2, en su mayoría residentes en Cartagena o municipios aledaños.
La edad promedio para el grupo AV fue de y una distribución homogénea con respecto al sexo (50 % masculino; IC95% 26,8 a 73,2). Recibían en promedio una dosis de 26,8 mg/kg/día (IC95% 23,0 a 30,6; mínimo 17,9 y máximo 40,2). Las concentraciones en suero de AV fueron 67,4 mg/mL (IC95% 51,2 a 83,5; mínimo 23,4 y máximo 130,1).
El grupo CBZ presentó una edad promedio de 10,3 años (IC95% 8,8 a 11,8) y quedó conformado por nueve pacientes de sexo masculino (56,3 %; IC95% 33,2 a 76,9) y siete de sexo femenino 43,7 %; IC95% 23,1 a 66,8). Al momento del estudio se encontraban recibiendo una dosis promedio de 14,1 mg/kg/día (IC95% 12,6-15.7; mínimo 8,8 y máximo 21,3), con concentraciones promedio en suero del medicamento de 6,2 mg/mL (IC95% 5,3 a 7,0; mínimo 2,2 y máximo 8,9).
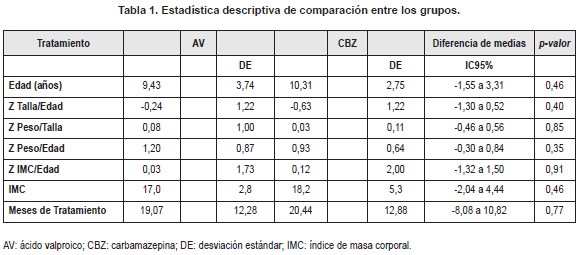
Ambos grupos mostraron ser similares cuando se compararon los promedios de edad, índices nutricionales de crecimiento, obesidad y tiempos de tratamiento (Tabla 1).La presencia de alteraciones de peso corporal de la población total y discriminada de acuerdo con el tipo de tratamiento se muestra en la tabla 2.
 |
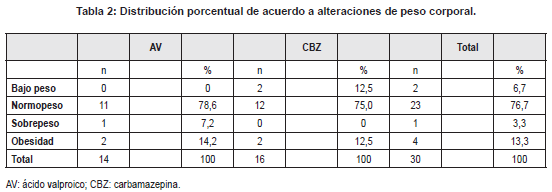 |
Al realizar la clasificación según el índice Z talla/edad y utilizando los criterios antes descritos,el 26,7 % (8/30) del total de los niños presentaban riesgo o retardo de crecimiento, y el 73,3 % (22/30) restante normalidad. No fue posible establecerdiferencias cuando se compararon los grupos AV y CBZ, presentándose riesgo o retardo de crecimiento en porcentajes de 28,6 % (4/14) y 25 % (4/16), respectivamente.
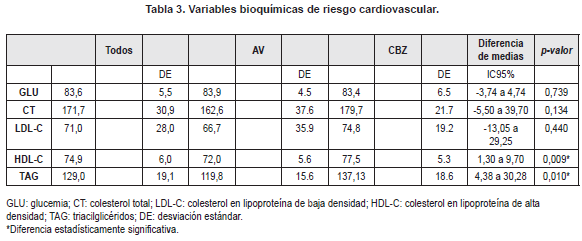
Se evidenció moderada correlación negativa entre las glucemias y la dosis diaria de AV (r = -0,540; p = 0,046), y positiva entre las concentraciones en suero de CBZ y colesterol total y LDL (r = 0,603; p = 0,013 y r = 0,553; p = 0,026, respectivamente). (Los resultados de las glucemias y los perfiles lipídicos se resumen en la tabla 3).
Todos los pacientes presentaron glucemias menores de 100 mg/dL, mientras que las concentraciones de triglicéridos en todos los casos fueron mayores de 100 mg/dL. El 75 % (12/16) de los pacientes del grupo CBZ presentaron hipercolesterolemia (≥ 170 mg/dL), lo cual fue superior al compararlo con la frecuencia de esta dislipidemia en el grupo AV (21,4 %; 3/14; diferencia de proporciones IC95% 18 a 74 %; p = 0,003).
 |
DISCUSIÓN
Al momento del estudio, los dos grupos mostraron ser similares en lo que respecta a sus promedios de indicadores de crecimiento y peso corporal, así como para edades y tiempos de tratamiento. Las dosis de medicación así como las concentraciones en suero en todos los casos resultaron dentro de los límites recomendables. En ambos grupos fue posible identificar la presencia de alteraciones de peso corporal y crecimiento.
En lo que respecta al exceso de peso, se encontraron pacientes con sobrepeso u obesidad, sin embargo, la frecuencia de este hallazgo resultó ser similar a lo reportado en la Encuesta Nacional de la Situación Nutricional 2010 (12), que mostró para niños colombianos sin epilepsia en similares edades y condiciones socioeconómicas, un porcentaje cercano al 16 %. Esto se distancia de lo hallado por otros autores quienes vinculan la epilepsia con mayores prevalencias de obesidad, inclusive antes de instauración de tratamiento (13) y aumento de peso corporal, principalmente, al inicio de la ingesta en el tratamiento con AV (14).
Lo anterior permite pensar que el contexto socioeconómico del grupo estudiado, con frecuencia caracterizado por la pobreza y la malnutrición (15,16), podría estar enmascarando, por lo menos en parte, el efecto que reporta la literatura, especialmente si se toma en consideración que el aumento de peso se considera más relacionado a cambios de comportamiento en la ingesta alimentaria que a modificaciones hormonales (17).
Sumado a lo anterior, ninguno de los pacientes del grupo AV presentó bajo peso, situación que sí se identificó en dos integrantes del grupo CBZ (12,5 %). Este porcentaje resulta superior a lo esperado, cuando se compara con el 2 % de bajo peso que reporta la encuesta anteriormente citada (12) y, en ese sentido, induce a considerar que, sumado a una inadecuada alimentación, podría estarse presentando, por acción de la CBZ, un incremento en la degradación de ciertas vitaminas, tal como se menciona en la literatura(18-22).
Por otra parte, cobra especial importancia debido al rango etario de los pacientes, el hallazgo de indicadores de retraso de crecimiento en ambos grupos, con un porcentaje general (8/30; 26,7 %) superior a lo hallado en población sin epilepsia que oscila entre 8,8 y 13,4 % para condiciones socioeconómicas similares (12).
Los pacientes con epilepsia en tratamiento están presentando alteraciones en peso y talla que podrían ser la resultante de las condiciones propias de la enfermedad, la medicación y de las condiciones del contexto
Al categorizar a los pacientes de acuerdo con sus concentraciones de lípidos y glucosa en suero, pudo observarse que ninguno de los pacientes presentó glucemias elevadas ni HDL-C disminuidas, pero todos los niños y adolescentes estudiados, independientemente del tratamiento, presentaron triacilglicéridos (TAG) en suero superiores a las concentraciones recomendadas y halladas en estudios nacionales (23), lo que sugiere que, más allá de variables socioculturales o genéticas, la administración del tratamiento podría estar contribuyendo con esta alza.
Los resultados de los perfiles bioquímicos de riesgo cardiovascular en la literatura no son del todo concluyentes, en tal sentido mientras que algunos autores no reportan diferencias significativas al comparar niños en tratamiento con AV con niños control (24,25), otros muestran asociación de estos parámetros, demostrando inclusive diferencias en la alteración de los indicadores clínicos de padecimiento vascular (26).
En comparación con el AV, la CBZ ha sido considerada menos implicada con riesgo cardiovascular, debido especialmente a las evidencias que la relacionan con mayores concentraciones de HDL-C (27-32), en coherencia con los resultados obtenidos en el presente estudio. Sin embargo, el intervalo de confianza para las diferencias de HDL-C calculado no logra ser concluyente desde el punto de vista de su significación clínica, y deberá ser verificado en estudios posteriores.
Sumado a lo anterior, el grupo CBZ mostró mayor presencia de hipercolesterolemia y moderadacorrelación positiva entre la dosis diaria de CBZ y los niveles en suero de CT y LDL-C, resultados que contribuyen a debilitar la seguridad cardiovascular adjudicada a la CBZ, tal como se reporta en la literatura (33).
A su vez, el intervalo de confianza para las diferencias de los TAG no contiene valores de relevancia práctica, aunque cabe mencionar que, en este caso, independientemente del tratamiento, todos los pacientes presentaron concentraciones de TAG que superan los valores de referencia.
Por su parte el grupo AV mostró mejor comportamiento frente al riesgo cardiovascular, con baja presencia de hipercolesterolemia y menor concentración promedio de TAG, sin embargo, el hallazgo de moderada correlación negativa entre los niveles de glucemia y la dosis diaria, podría ser indicio de compromiso de este medicamento con la homeostasis de la glucosa, coherente con la evidencia que lo relacionan con hormonas vinculadas con el metabolismo de los glúcidos (34-37).
CONCLUSIONES
Este acercamiento al estudio de la población de niños y adolescentes con epilepsia idiopática en tratamiento en la ciudad de Cartagena de Indias, Colombia, hizo posible identificar dianas específicas hacia donde deben encaminarse los esfuerzos para lograr un enfoque integral de riesgos antropométricos y metabólicos que pudieran estar relacionados con la misma condición de la enfermedad o de su tratamiento farmacológico. Uno de esos elementos es el relacionado con los estimadores nutricionales, cuya determinación permitió identificar pacientes con alteraciones de peso en ambos sentidos; en ese orden de ideas, el control del peso corporal resulta indispensable, tanto en el sentido de evitar el efecto perjudicial cardiovascular del exceso de peso, como en el sentido inverso de valores inferiores a lo normal que, junto con el déficit de crecimiento, pudieran estar mostrando un compromiso con el desarrollo.
Para el grupo estudiado, las condiciones de contexto obligan a mirar con detenimiento en estos pacientes los indicadores de crecimiento y desarrollo, toda vez que dichas condiciones pudieran esconder alteraciones, al combinarse con efectos propios de la enfermedad o su tratamiento.
En lo que respecta a la evaluación del riesgo cardiovascular, los resultados obtenidos sugieren que, aun cuando no se observen concentraciones de HDL-C disminuido, es necesario considerar el resto de modificaciones del perfil lipídico, específicamente en razón de los incrementos en las concentraciones de CT y TAG evidenciados en este estudio, a efecto de poder intervenirlos de manera oportuna.
Conflicto de intereses: ninguno.
REFERENCIAS
1. Commission on Classification and Terminology of the International League against Epilepsy. Proposal for revised clinical and electrographic classification of epileptic seizures. Epilepsia 1981; 22(4): 489-501.
2. Commission on Classification and Terminology of the International League against Epilepsy. Proposal for revised classification of epilepsies and epileptic syndromes. Epilepsia 1989; 30(4):389-99.
3. Berg AT, Berkovic SF, Brodie MJ, Buchhalter J, Cross JH, Van Emde Boas W, et al. Revised terminology and concepts for organization of seizures and epilepsies: report of the ILAE Commission on Classification and Terminology. Epilepsia 2010; 51(4): 676-85.
4. Organización Panamericana de la Salud. Oficina Regional de la Organización Mundial de la Salud. Estrategia y Plan de Acción sobre la Epilepsia 2011. 51° Consejo Directivo y 63° sesión del Comité regional. Washington DC. EUA.
5. Chacón V, Muñoz C, Rivas Nieto JC, Miranda CA. Estudio descriptivo de la prevalencia de depresión en pacientes conepilepsia que consultan el Hospital Psiquiátrico Universitario del Valle (HPUV) y la Liga contra la Epilepsia (LCE) en Cali, Colombia. RevColombPsiquiatr 2007; 36(1):31-40.
6. Vélez A, Eslava-Cobos J. Epilepsy in Colombia: epidemiologic profile and classification of epileptic seizures and syndromes. Epilepsia 2006; 47(1):193-201.
7. Vargas JA, Carrizosa J, Alfaro JM, Balthazar V, Cornejo JW, Cadavid AM, et al.Alteraciones del desarrollo físico y sexual en varones prepúberes y púberes con epilepsia, Hospital Universitario San Vicente de Paúl, Medellín, Colombia, 2005-2006.Iatreia [online] 2008; 21(3): 219-28. Disponible en: http://www.redalyc.org/articulo.oa?id=180513864001Fecha de acceso 8 de julio de 2013.
8. Jiménez ME. Avances en el manejo de la epilepsia.RevNeuropsicolNeuropsiq Neurociencias. 2004; 6(1):51-61.
9. Misra A, Aggarwal A, Singh O, Sharma S. Effect of carbamazepinetherapy on vitamin D and parathormone in epileptic children. Pediatr Neurol 2010; 43(5):320-324.
10. Ministerio de la Protección Social. Resolución 2121de2010 (junio 9). Por la cual se adoptan los Patrones deCrecimiento publicados por la Organización Mundial dela Salud, OMS, en el 2006 y 2007 para los niños, niñasy adolescentes de 0 a 18 años de edad y se dictan otras disposiciones. Diario Oficial No. 47.744 de 18 de junio de 2010.
11. Gil A. Tratado de Nutrición. Tomo III 2ª Ed. Mayo 2010. Edit. Panamericana Madrid. 3412 páginas 12. Instituto Colombiano de Bienestar Familiar (ICBF). EncuestaNacional de la Situación Nutricional en Colombia. ENSIN. 2010 Bogotá Colombia, Instituto Colombiano de Bienestar Familiar. Disponible en: http://www.icbf.gov.co/ portal/page/portal/PortalICBF/NormatividadGestion/ENSIN1/ ENSIN2010/LibroENSIN2010.pdf Fecha de acceso 4 de julio de 2013.
13. Daniels ZS, Nick TG, Liu C, Cassedy A, Glauser TA.Obesity is a common comorbility for pediatric patients with untreated, newly diagnosed epilepsy. Neurology 2009; 73(9): 658-664.
14. Abaci A, Sygi M, Yis U, Demir K, Dirik E, Bober E. Metabolic alterations during valproic acid treatment: a prospective study. Pediatr Neurol 2009; 41(6): 435-439.
15. Pérez G, Salazar I. La pobreza en Cartagena: un análisis por barrios. Centro de Estudios Económicos Regionales (CEER) del Banco de la República, Cartagena. Documento de trabajo sobre economía regional 2007; número 94. Disponible en: http://www.banrep.gov.co/sites/default/files/ publicaciones/archivos/DTSER-94.pdfFecha de acceso 5 de julio de 2013.
16. Departamento Administrativo Nacional de Estadística, DANE. Oficina de prensa. Comunicado de prensa: La pobreza en Colombia. 2013. Disponible en: http://www. dane.gov.co/files/investigaciones/condiciones_vida/pobreza/ cp_pobreza_2012.pdfFecha de acceso 5 de julio de 2013.
17. Martin CK, Han H, Anton SD, Greenway FL, Smith SR.Effect of valproic acid on body weight, food intake, physical activity and hormones: results of a randomized controlled trial. J Psychopharmacol 2009; 23(7): 814–825.
18. Tjellesen L, Christiansen C, Rodbro P, Hummer L. Different metabolism of vitamin D2 and vitamin D3 in epileptic patients on carbamazepine Acta Neurologica Scandinavica 1985; 71(5):385-389.
19. Vilaseca M, Monrós E, Artuch R, Colomé C, Farré C, Valls C, Cardo E, Pineda M. Anti-epileptic drug treatment in children: hyperhomocysteinaemia, B-vitamins and the 677C-T mutation of the methylenetetrahydrofolate reductase
gene. European Journal of Paediatric Neurology 2000; 4:269-277.
20. Karabiber H, Sonmezgoz E, Ozerol E, Yakincy C, Otlu B, Yologlu S. Effects of valproate and carbamazepine on serum levels of homocysteine, vitamin B12, and folic acid. Brain & Development 2003; 25:113-115.
21. Mintzer S, Boppana P, Toguri J, DeSantis A. Vitamin D levels and bone turnover in epilepsy patients taking Carbamazepine or Oxcarbazepine.Epilepsia 2006; 47(3): 510–515.
22. Bochynska A, Lipczynska- ojkowska W, Guga a-Iwaniuk M, Lechowicz W, Restel M, Graban A, Lipska B, Ryglewicz D.
The effect of vitamin B supplementation on homocysteine metabolism and clinical state of patients with chronic epilepsy treated with carbamazepine and valproic acid. Seizure 2012. 21: 276-281.
23. Poveda E, Callas N, Baracaldo C, Castillo C, Hernández P, Guerra M. Evaluación de las concentraciones de lípidos y apoproteínas A-I y B-100 en un grupo de escolares de cincodepartamentos del centro-oriente de Colombia. Biomédica 2007; 27(3):385-99.
24. Dewan P, Aggarwal A, Faridi M. Effect of phenytoin and valproic acid therapy on serum lipid levels and liver function tests. Indian Pediatrics 2008; 45(10):855-858.
25. Yildiz M, Simsek G, Uzun H, Uysal S, Sahin S, Balci H. Assessment of low-density lipoprotein oxidation, paraoxonase activity, and arterial distensibility in epileptic children who were treated with anti-epileptic drugs. Cardiol Young2010; 20(5): 547-554.
26. Tan TY, Lu CH, Chuang HY, Lin TK, Liou CW, Chang WN, Chuang YC. Long-term antiepileptic drug therapy contributes
to the acceleration of atherosclerosis. Epilepsia 2009; 50(6):1579-1586.
27. Kim J, Lee H. Metabolic and Hormonal Disturbances inWomen with Epilepsy on Antiepileptic Drug Monotherapy. Epilepsia 2007; 48(7):1366-70.
28. Pita-Calandre E, Rodríguez-López CM, Cano MD, Peña-Bernal L. Lípidos, lipoproteínas y apolipoproteínas séricas en epilépticos adultos tratados con carbamazepina, ácido valproico o fenitoína. Rev Neurol 1998; 27(159):785-789.
29. Tomoum HY, Awadallah MM, Fouad DA, Ali AH. Lipid profile, apolipoproteins A and B in children with epilepsy. J Child Neurol2008; 23(11):1275-81.
30. Kumar P, Tyagi M, Tyagi Y, Kumar A, Kumar A, Rai Y.Effect of anticonvulsant drugs on lipid profile in epileptic patients. Internet JNeurol 2004; 3(1) DOI: 10.5580/137b.
31. Aggarwal A, Kumar M, Faridi M. Effect of Carbamazepine on Serum Lipids and Liver Function Tests. Indian Pediatrics
2005; 42(9): 913-918.
32. Svalheim S, Luef G, RauchenzaunerM,Mørkrid L, Gjerstad L, Taubøll E. Cardiovascular risk factors in epilepsy patients taking levetiracetam, carbamazepine or lamotrigine. Acta- NeurolScand 2010; 122 (Suppl. 190):30-33.
33. Brämswig S, Kerksiek A, Sudhop T, Luers C, VonBergmann K, Berthold H. Carbamazepine increasesatherogenic lipoproteins: mechanism of action in male adults. Am J Physiol Heart CircPhysiol2002; 282(2):H704-H716.
34. Uluaga IF, Kulua U, Senera U, Koseb S, Zorlua Y. Theeffect of carbamazepine treatment on serum leptin levels. Epilepsy Res2009; 86(1): 48-53.
35. Rauchenzauner M, Haberlandt E, Scholl-Bürgi S, Ernst B, Hoppichler F, Karall D et al. Adiponectin and visfatin concentration in children treated with valproic acid. Epilepsia 2008; 49(2):353-357.
36. Rauchenzauner M, Haberlandt E, Scholl-Bürgi S, Karall D, Schoenherr E, Tatarczyk T,et al. Effect of valproic acid treatment in body composition, leptin and soluble leptin receptor in epileptic children. Epilepsy Res 2008; 89(2-3): 142-149.
37. Verrotti A, Basciani F, De Simone M. Trotta D, Morgese G, Chiarelli F. Insulin resistance in epileptic girls who gain weight after therapy with valproic acid. J Child Neurol 2002; 17(4):265-268.
Fecha de Recibido: Agosto 29, 2013.
Fecha de Aprobado: Septiembre 23, 2013.
Dirección para correspondencia:
Dr. Randy Guerra Olivares: dr.randyguerra@gmail.com,
cliefire@gmail.com
Fundación Centro Colombiano de Epilepsia y Enfermedades
Neurológicas (FIRE). Calle 1ª, El Edén, Barrio Ternera. Cartagena
– Colombia A.A 604 y 5007. Conmutador: 57-6618107 –
57-6618111 Fax: 57-6618127 www.epilepsiacolombia.org