CÁNCER DIFERENCIADO DE TIROIDES
¿POR QUÉ ESTÁ AUMENTADO SU FRECUENCIA?
Alfredo Jácome Roca1
RESUMEN
Aunque el cáncer de tiroides ocupa un porcentaje menor de los casos de cáncer, no dejan de presentarse un buen número de casos. En su gran mayoría se trata de cánceres diferenciados (papilar y folicular), con buen pronóstico y excelente supervivencia. En décadas recientes se ha notado un incremento mundial de cánceres papilares, aunque con pocas excepciones, se trata de carcinomas muy pequeños, llamados microcarcinomas o carcinomas ocultos. Con el objeto de destacar los aspectos más relevantes de estos tumores y tangencialmente de los cánceres tiroideos pobremente diferenciados o indiferenciados, presentamos esta revisión que también discute las indicaciones conservadoras o citorreductivas de los tratamientos quirúrgicos y otros de naturaleza ablativa. La casuística nacional es cada vez más importante.
Palabras clave. Cáncer de tiroides, carcinoma, tiroidectomía total, terapia supresiva con levo- tiroxina, inhibidores de la tirocina cinasa, nódulo tiroideo, aspirado citológico.
DIFFERENTIATED THYROID CANCER
WHY IS ITS FREQUENCY INCREASING?
ABSTRACT
Although thyroid cancer represents a small percentage of cancer cases, there still have a good number of affected patients. The vast majority are differentiated cancers (papillary and follicular), with good prognosis and excellent survival. Recent decades have seen a global increase in papillary cancers, although with few exceptions, they are very small carcinomas, called micro- carcinomas or occult carcinomas. This review highlights most relevant aspects of these tumors (and marginally poorly differentiated or undifferentiated thyroid cancers). We also discuss the indications of cytoreductive (oncologic) thyroidectomy versus a conservative one, and other complementary treatments such as remnant ablation with radioiodine, TSH suppressive the- rapy and chemotherapy. Colombian medical literature on the subject is increasingly important.
Key words: Thyroid cancer, carcinoma, total thyroidectomy, suppressive therapy with levothyro- xine, tyrosine kinase inhibitors, thyroid nodule, aspiration cytology.
![]()
1 . MD, FACP. Internista-Endocrinólogo, Académico de Número, Editor de la revista MEDICINA.
INTRODUCCIÓN
El cáncer de tiroides representa generalmente el 1% de los diagnósticos anuales de tumores malignos en los Estados Unidos, y generalmente esta cifra es similar en otros países (1). En algunos las cifras pueden variar; por ejemplo en el Japón, tal vez como asunto étnico o más probablemente por sus graves desastres nucleares durante la segunda guerra o más recientemente relacionados con los daños contaminantes en plantas nucleares, relacionadas con un tsunami, el cáncer de tiroides es más frecuente; por ejemplo, el 50% de las autopsias que allá se realizan, presentan microcarcinomas papilares ocultos.
La incidencia de cáncer de tiroides aumentó de manera importante en Rusia y países circun- vecinos, a raíz del desastre nuclear de Chernobyl. Pero aparte de esos casos concretos, existe un incremento mundial de la incidencia de cáncer diferenciado de tiroides en las últimas décadas.
EL NÓDULO TIROIDEO
Es común en la consulta de endocrinología la valoración de bocios, pero en particular de nódulos tiroideos, únicos o dominantes, dentro de un bocio multinodular. Para su estudio clínico se basa en diversas ayudas paraclínicas que indican o descartan una cirugía, aconsejan el tipo de operación y el uso de terapias complementarias. La historia clínica es importante en relación con la edad, sexo, raza, historia familiar de cáncer de tiroides, la clínica de función tiroidea, la palpación de la glándula tiroides y de los ganglios linfáticos cervicales. En los pacientes con carcinoma anaplásico suele ser muy notorio un bocio grande, de consistencia dura, con evidencia de disnea, disfonía y presencia del síndrome de la vena cava superior. En tumores avanzados de otra histología, pueden referirse también síntomas obstructivos.
Como exámenes complementarios se acostumbra solicitar una ecografía o ultrasonografía de cuello (buscando nódulos hipoecogénicos sin el signo del halo, pero con microcalcificaciones u otros cambios característicos); la gammagrafía de tiroides (buscando nódulos “fríos”, solitarios o dominantes dentro de un bocio multinodular); es de anotar que los bocios hiperfuncionantes rara vez se asocian con malignidad, así que es conveniente pedir pruebas de función tiroidea. La TSH ha resultado ser un marcador muy importante para el estudio del nódulo tiroideo, ya que niveles altos correlacionan con malignidad y bajos con benignidad; la calcitonina también (para tumores medulares), pero no debe usarse como marcador rutinario en zonas con buena ingesta de yodo y baja incidencia de carcinomas medulares. La tiroglobulina solo sirve como marcador cuando se ha hecho una resección quirúrgica total de la tiroides, complementado con suministro de dosis oncolíticas de yodo radiactivo. En ese caso, el único origen de la tiroglobulina circulante tiene que ser tumoral. En tiempos recientes se está utilizando también la tomografía de emisión de positrones o PET en algunas indicaciones (2).
La prueba diagnóstica más importante es el aspirado citológico con aguja fina (ACAF, y no BACAF). En sentido estricto el término correcto es ACAF, ya que en la aspiración con aguja fina se utiliza una aguja calibre 25-27, y dependiendo de las circunstancias o de las preferencias del operador, la aspiración se puede realizar con o sin succión de la jeringa; si se utiliza la succión, esta debe ser liberada antes de salir del nódulo. En general uno o dos pases son suficientes para hacer la evaluación citológica. Por su parte, la BACAF (Biopsia Aspiración Con Aguja Fina) no es en sentido estricto un término correcto, ya que la biopsia no utiliza aguja fina (por el contrario utiliza agujas de grueso calibre –TRUCUT-). Otra diferencia es que en la ACAF de tiroides se establece como criterio de una muestra adecuada 6 grupos celulares (cada uno con mínimo 10 células) mientras que en la biopsia se extraen “cilindros de tejido” Finalmente, los “cilindros” de la biopsia son fijados en formol, mientras que el aspirado de la ACAF se fija en alcohol al 96%; y en general, la realización de Biopsias (TRUCUT) en el estudio de enfermedad tiroidea nodular no multiplica de una manera significativa el rendimiento diagnóstico con relación a la ACAF; es más, la concordancia entre la ACAF y la biopsia con aguja TRUCUT es muy baja (en cambio la concordancia entre la ACAF y los especímenes quirúrgicos es alta). Por lo anterior, pensamos que debe evitarse el término BACAF, a pesar de ser utilizado extensamente y de manera intercambiable en la literatura (3). Esta ACAF se puede realizar guiando la aguja por palpación del nódulo, aunque es más recomendable hacerla guiada por ecografía.
La citología de un nódulo dominante o único puede indicar benignidad, malignidad, o no ser diagnóstica. En los dos extremos es más clara la conducta, pero en los casos indeterminados habrá que acudir al seguimiento de los pacientes, ACAF repetidas o a los exámenes paraclínicos que hemos mencionado. En relación con las imágenes preoperatorias, la American Thyroid Association (ATA) ha publicado un consenso reciente (2015) que afirma lo siguiente:
• Debe valorarse rutinariamente la glándula por ultrasonografía (ahora de alta resolución) para examinar los tumores primarios y las adeno- patías cervicales (Figura 1).
• ACAF guiada por ultrasonografía sobre las adenopatías sospechosas.
• TAC o RNM con contraste en ciertos casos (4).
Generalmente los enfermos llegan a consulta con un nódulo solitario de la tiroides (5% son malignos), aunque algunos vienen con un nódulo dominante dentro de un bocio multinodular que ha crecido (2). En esos casos, algunas características pueden sugerir malignidad: mayor en sexo masculino, en menores de 30 o en mayores de 60, crecimiento rápido, la presencia de nódulos no dolorosos, de consistencia dura o fijados a tejidos subyacentes, o la palpación adicional de masas cervicales que indican metástasis linfáticas regionales.
Si se determina que la lesión es maligna –en el caso de carcinomas papilares– o es sospechosa pero no determinada por citología –en el caso de adenomas/carcinomas foliculares, se procederá al tratamiento, siempre quirúrgico, en caso de malignidad.
TIPOS HISTOLÓGICOS DE CÁNCER TIROIDEO
La clásica división según su histología continúa siendo la misma de muchos años. El tipo más común es el papilar (80%), afortunadamente el de mejor pronóstico, seguido por tumores de mayor agresividad, en orden creciente el folicular (10%), el medular (5-10%), el de Hürthle –una variante del folicular– (2-3%) y el anaplásico (1-2%), que sigue causando una mortalidad del 100% a cinco años. Otros tumores más raros son los linfomas primarios de tiroides y los sarcomas (5,6).
CÁNCERES DIFERENCIADOS Y OTROS TUMORES MALIGNOS DE LA TIROIDES
La unidad anatómica y funcional de la glándula tiroides es el folículo, que tiene células epiteliales donde se forma la tiroxina, que rodean un espacio en el cuál se deposita el coloide. En estas células se originan tanto los adenomas benignos como los tumores malignos diferenciados, que son la gran mayoría. En estos cánceres, las células se parecen mucho al tejido normal de la tiroides cuando se observan en un microscopio. Se trata de los carcinomas papilar, folicular y de células de Hürthle. Otros tipos de cánceres tiroideos menos comunes son el carcinoma medular, el insular (pobremente diferenciado) y el anaplásico (indiferenciado).
|
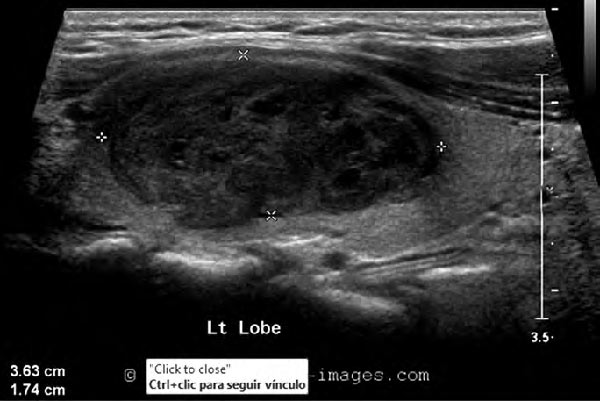
Figura 1. Ultrasonografía de un paciente con carcinoma papilar en el lóbulo izquierdo. La masa observada es grande e hipoecoica, que infiltra marcadamente el lóbulo izquierdo. Aunque no hay una evidencia definida de microcalcificaciones, los márgenes del tumor están pobremente definidos y hay ausencia de un halo hipoecoico claro alrededor de la masa. Ecografía por cortesía del Dr. Ravi Kadasne para el portal http://www.ultrasound-images.com/thyroid.htm |
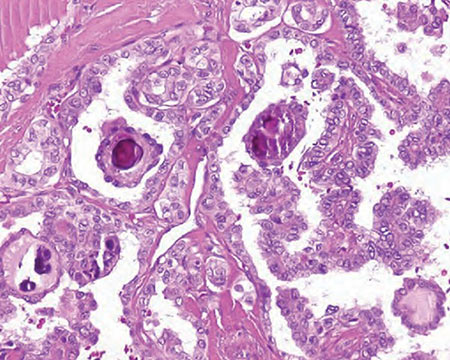
a. Carcinoma papilar. El más común de todos; originado generalmente en un solo lóbulo de la tiroides. A pesar de su lento crecimiento, se propaga a ganglios cervicales con frecuencia. Su tratamiento es exitoso, su pronóstico muy bueno, pero se presentan recaídas hasta en uno de cada tres casos. Generalmente se preenta en mujeres en edad reproductiva con las características clínicas de curso lento y escasa mortalidad, aunque el proceso cambia en los niños y en los mayores de 70 años. En el grupo que ha recibido previamente radioterapia de cabeza y cuello –en la posguerra era común en los Estados Unidos irradiar las amígdalas hipertróficas de los niños– el cáncer tiende a ser multifocal, metastatiza a ganglios linfáticos tempranamente y su pronóstico ya no es tan bueno (7-11). Un subtipo del carcinoma papilar, el subtipo folicular (o variante folicular-papilar mixta) se ve con más frecuencia. La forma habitual de carcinoma papilar y el subtipo folicular tienen el mismo pronóstico favorable cuando se descubren temprano y su tratamiento es el mismo. Estos cánceres presentan papilas histológicamente, y también los característicos “cuerpos psamoma” en la mitad de los casos. Existen también otros subtipos menos frecuentes y más agresivos (Figura 2).
Los carcinomas papilares pueden ser multi-focales hasta en un 50%, generalmente no invaden la cápsula y en un 50% presentan compromiso ganglionar. El pronóstico de supervivencia es 90% y hasta en un 98%, en pacientes jóvenes. Sin embargo, pueden presentar altas tasas de morbilidad debido a recaídas en un 30% y la causada por tratamientos repetidos (5-9).
Los adultos mayores que tienen enfermedad tumoral más limitada, paradójicamente tienen mayor supervivencia que lo que indicarían su edad y sexo, en comparación con adultos jóvenes o aquellos mayores de 45 años que presentan metástasis a distancia (12).
b. Carcinoma folicular. Este tipo de cáncer tiroideo –uno de cada diez casos– es generalmente más visto en regiones que han tenido bocio endémico, y en donde no es infrecuente que pueda haber una ingesta pobre de yodo (o por el contrario, a veces excesiva debido a agresivas políticas de suministro de sal yodada). Solo un 5% se disemina a los ganglios linfáticos cervicales pero como su diseminación es hematógena, puede en cambio propagarse a otras partes (pulmones, huesos). El pronóstico –aunque bueno– no es tan favorable como el del carcinoma papilar (8). No es posible determinar citológicamente la posible malignidad de un nódulo folicular por solo BACAF (80% son benignos) y se requiere lobectomía para confirmar si hay cáncer (5, 6,8).
d. Carcinoma de células de Hürthle. Conocido igualmente como de células oxifílicas, es una variante de carcinoma folicular y se observa en 3% de los casos de cáncer de tiroides. Como es menos probable que capte el yodo radiactivo, será más difícil de diagnosticar y la ablación radionuclear no funcionará bien.
Adaptado de Muniesa JA, Lázaro JM. Cáncer de tiroides en el Registro Hospitalario de Tumores de Teruel y experiencia con la PAAF. Boletín Oncológico del Área Sanitaria de Teruel. Boletín No. 19. |
Figura 2. Carcinoma papilar, con inclusiones de cuerpos psamoma. |
Los restantes tipos de cáncer de tiroides ocurren con menos frecuencia y su pronóstico varía de acuerdo al estado o a la histología, llegando a ser francamente malo en el caso de los tumores anaplásicos. Estos son:
e. Carcinoma medular tiroideo. Se origina en las células C (parafoliculares) de la tiroides, son productoras de la hormona hipocalcemiante calcitonina; cuando se malignizan, producen excesivamente calcitonina, o igualmente son estimuladas con pentagastrina (8). También producen antígeno carcinoembrionario, conocido con las siglas CEA. A veces se puede propagar a ganglios linfáticos, pulmones o hígado, habiéndose detectado previamente o no, un nódulo tiroideo. También tiene el problema de no captar yodo radiactivo, por lo que su diagnóstico original y de presencia de metástasis, así como de su tratamiento, se dificulta. La mayoría de los casos son esporádicos y se presentan en adultos mayores, con compromiso de un solo lóbulo tiroideo. Cuando son familiares, se desarrollan durante la niñez o juventud, propagándose tempranamente y tienen presencia multifocal en ambos lóbulos. Este es el tipo de tumor que puede hacer parte de la neoplasia endocrina múltiple (síndromes de MEN), que presenta tumores benignos o malignos en otras glándulas endocrinas como islotes pancreáticos, paratiroides, suprarrenales, etc. (5,6).
f. Carcinoma anaplásico. Es indiferenciado y afortunadamente una forma poco común (1- 2%). Algunas veces se origina en cánceres papilares o foliculares ya presentes. Tiene evolución rápida y desenlace fatal, generalmente en menos de un año. Otros tumores malignos originados en la glándula tiroides son los linfomas y los sarcomas, que por su rareza no los discutiremos en este artículo (8).
FACTORES PREDISPONENTES
Como factores que inciden en la etiología, además de los hereditarios y cambios de tipo genético, debemos mencionar la radiación cervical en niños y adolescentes (pero no con el uso diagnóstico o terapéutico de yodo radiactivo). En algunos bocios generados por defectos enzimáticos en la formación de las hormonas tiroideas, la TSH elevada que se asocia con ellos puede jugar un papel en el desarrollo de carcinomas tiroideos (6,7). En zonas yodo deficientes se ve un número relativamente menor de carcinomas papilares y algo más de foliculares y anaplásicos. La ingesta crónica de yodo en exceso puede también jugar un papel.
FACTORES HEREDITARIOS, ONCOGENES Y GENES SUPRESORES TUMORALES
Ciertos síndromes hereditarios raros pueden asociarse con cánceres papilares o foliculares. Tal es el caso de la poliposis adenomatosa familiar o síndrome de Gardner, existiendo un riesgo 160 veces mayor de desarrollar carcinomas papilares, especialmente en mujeres menores de 35 años. Otros casos hereditarios con tumores tiroideos benignos y malignos asociados son los hamartomas múltiples (Enfermedad de Cowden), en el síndrome de Peutz-Jeghers (poliposis intestinal familiar) y en el de ataxia-telangiectasia (13). Los pacientes con tiroiditis de Hashimoto presentan un riesgo 67 a 80 veces superior al de la población en general para el desarrollo de este tipo de neoplasia. En carcinomas medulares de tipo familiar se hallan mutaciones en diferentes exones del protooncogén RET del cromosoma 10 y que lo convierten en un gen con actividad oncogénica. Entre 3 y 33% de los carcinomas papilares sin antecedentes de irradiación y entre el 60 y 80% de los irradiados presentan reordenamientos en el oncogén RET/ PTC y, con menor frecuencia en los NTRK, RAS y GSP. Mutaciones puntuales inactivadoras de al menos dos oncogenes supresores (p53 y gen del retinoblastoma, Rb) se han hallado con mucha frecuencia en los carcinomas anaplásicos y, en cambio, son raras en las células de los carcinomas diferenciados, incluso en los que coexisten con los indiferenciados en la misma glándula (14).
La base biológica molecular del cáncer de tiroides originado en los folículos (el bien diferenciado) es la activación de las tirocinasas intracelulares, es decir de las vías MAPK y PI3K, a través de mutaciones genéticas somáticas o reacomodaciones genéticas. En los pobremente diferenciados (insulares) y en los indiferenciados (anaplásicos), se acumulan las alteraciones genopoyéticas vistas en los bien diferenciados aunque también se pueden observar nuevas mutaciones. Los medulares (originados en las células C), se activa la RET cinasa, a través mutaciones de la RET germinal o de mutaciones de la RET o de la RAS. Gracias a este conocimiento, se han desarrollado compuestos quimioterápicos para el tratamiento del cáncer tiroideo (15).
ESTUDIOS COLOMBIANOS
En nuestro medio se encuentran estudios recientes con información proveniente de varias zonas del país, concentrados en temas como epidemiología, cirugía y patología de este tumor (16). El cáncer de tiroides en Colombia tiene una incidencia calculada en 2008 de 7,9 por 100.000 para mujeres y de 0,8 por 100.000 para hombres (8). Entre 2003 y 2007 se presentaron 1.145 casos nuevos en el Instituto Nacional de Cancerología, que fueron clasificados por su tipo histopatológico en relación con la frecuencia, así: papilar (88%), folicular (3%), medular (3%), de células de Hürthle (1%), anaplásico (1%) y otros, o no clasificados (4%), es decir, un porcentaje mayor de casos de carcinoma papilar y un poco menor de los demás, en comparación con los promedios mundiales. Se calcula que anualmente aparecen 1.600 casos nuevos en Colombia (7). Grupos de universidades en Bogotá (Javeriana, La Sabana) y Medellín (Pontificia Bolivariana) se han preocupado por las técnicas quirúrgicas, y también han realizado metaanálisis sobre varios aspectos de este cáncer (10, 17-24).
Un reciente estudio de costo-beneficio favorece la realización de tiroidectomías totales sobre hemi-tiroidectomías en neoplasias foliculares, excepto en casos de alto riesgo de hipoparatirodismo residual o de lesión del nervio recurrente laríngeo (17), en concordancia con la tendencia observada en las últimas décadas, de hacer tiroidectomías oncológicas (o citorredución quirúrgica agresiva) en casos de carcinoma papilar, porque a pesar de su buen pronóstico, se trata de cánceres que a menudo tienen origen multicéntrico, con un número no despreciable de recidivas en casos de hemitiroidectomía, y en una cuarta parte de los casos, con variantes histológicas agresivas. La experiencia del grupo multidisciplinario de la Fundación Cardioinfantil de Bogotá, con cerca de medio millar de casos, justificó estas tiroidectomías oncológicas (que incluían en muchos casos vaciamientos centrales y laterales), por la presencia de los factores antes mencionados y en un número de casos, la falta de un adecuado seguimiento de los pacientes (11).
TRATAMIENTO
En caso de un diagnóstico positivo, está indicada la cirugía, pero se sigue discutiendo qué tan agresiva debe ser en los casos de neoplasia bien diferenciada, que como decíamos es la variedad menos peligrosa y afortunadamente, la más común. Por ejemplo, se puede hacer una lobectomía para confirmar la patología de manera indiscutible, caso usual como decíamos en nódulos foliculares. Una publicación de la ALT (Asociación Latinoamericana de Tiroides), aunque es clara en la recomendación de la tiroidectomía, es partidaria de conductas menos agresivas (teniendo en cuenta su buen pronóstico y la posibilidad de complicaciones nada deseables como la parálisis del recurrente laríngeo, hipopa- ratiroidismo posquirúrgico, hipotiroidismo, tetania transitoria, infección o formación de queloides), pero eso sí con seguimiento rutinario del paciente, para confirmar su evolución (25-27). El problema es que no es lo mismo un paciente con cáncer de tiroides, operado en grandes capitales con disponibilidad de tecnología diagnóstica de punta, citólogos y cirujanos de cuello experimentados, que el caso intervenido en ciudades intermedias o más pequeñas. Los errores diagnósticos son mayores, al igual que las complicaciones de la tiroidectomía (Tabla 1).
Aunque es frecuente que el cáncer papilar invada los ganglios cervicales, también puede ocurrir que haya metástasis pulmonares u óseas, e incluso a otros órganos, aunque menos frecuentemente. En caso de metástasis en ganglios linfáticos cervicales recurrentes o persistentes en pacientes con carcinoma bien diferenciado, la ATA recomienda tiroidectomía total (por la multicentricidad del tumor) con vaciamiento radical de cuello (en algunos casos bilateral e incluso con vaciamiento de mediastino anterior), seguimiento activo de los casos, ablación con yodo radiactivo, radioterapia externa o resección con procedimientos mínimamente invasivos, teniendo en cuenta la agresividad biológica del tumor (25).
Un interesante estudio comprueba lo que se conoce desde hace años, que la experiencia del cirujano conlleva una resección adecuada para las necesidades del paciente, a menos complicaciones y a mejor pronóstico. En el artículo se concluye que estos mejores resultados se obtienen con cirujanos que hacen al menos 30 tiroidectomías cuando son casos sin metástasis. En casos más avanzados se requieren cirujanos que realicen al menos 50 tiroidectomías (28).
Una sociedad científica española publicó unas guías en las que –al igual que los especialistas de América Latina– recomiendan cirugías más conservadoras en microcarcinomas o en tumores de menos de 2 cm, tratando de evitar el uso de ablaciones posteriores con radioyodo (29). Otros insisten en que hay que valorar la situación de cada paciente, pues hay casos en que no conviene ser tan agresivos en la terapéutica. Sin embargo, parece haber más partidarios de las tiroidectomías totales con vaciamientos de cuello, en momentos en que la incidencia de cáncer diferenciado de tiroides está aumentando a nivel mundial. Se ha concluido que el uso del ultrasonido y de la ACAF tienen que ver con la mayor cantidad de diagnósticos (30); en otro estudio se habla de que la triplicación de diagnósticos de carcinoma papilar realizados en personas mayores se debe al acceso a servicios de atención médica de calidad, donde se logran más y mejores diagnósticos (31).
Un grupo multidisciplinario de la Universidad del Cauca presentó un análisis de su casuística local en un estudio retrospectivo de tiroidectomía; también una revisión sistemática de la situación en Suramérica y en Colombia. Estas dos publicacio- nes contribuyen a la ya creciente literatura médica nacional sobre el tema (32,33). Estos autores se preguntan por qué en su casuística los microcarcino- mas papilares se han triplicado en incidencia, no así los más grandes –excepción hecha de ocasionales series de otros países– o con histología diferente.
¿Obedece esto a que el Departamento del Cauca ha sido una región con un 80% de bocio endémico, y ahora –corregido este– es una población que tiene una ingesta excesiva de yodo? ¿Será que la mayor cobertura de salud de su población o el acceso a mejores tecnologías permiten un mayor número de diagnósticos? ¿Tienen que ver los factores genéticos? Probablemente se trate de la suma de estos factores, hecho no demasiado preocupante porque los carcinomas ocultos, pequeños por definición, no requieren un tratamiento agresivo. Pero no hay que olvidar que aunque la mortalidad es escasa en los pacientes que presentan estos “cánceres buenos”, la morbilidad no lo es tanto y la ansiedad de estos enfermos es mucha.
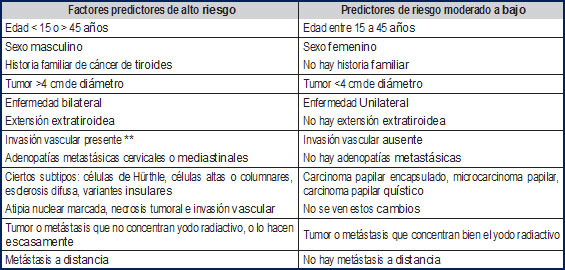
* Las variables en relación con el paciente van en letra itálica. Las demás variables se relacionan con el tumor propiamente dicho. ** La invasión vascular se ve tanto en cánceres papilares como foliculares. |
Tabla 1. Estratificación de variables de riesgo con influencia en la recurrencia y en la mortalidad por cáncer * |
TRATAMIENTOS COMPLEMENTARIOS
Un par de meses después de la tiroidectomía, en los pacientes con carcinomas diferenciados -dependiendo del caso– se procede al tratamiento ablativo con dosis variables de yodo radiactivo (131-I), que disminuye el riesgo de recaída y convierte a la tiroglobulina en un marcador tumoral. Como el aumento de la TSH optimiza el efecto ablativo del radioyodo, hay dos métodos para lograrlo: Uno, suspendiendo la suplencia de levotiroxina por algo más de un mes (lo que conlleva a una serie de alteraciones incon- venientes relacionadas con el hipotiroidismo), o en forma más moderna, con la aplicación intramuscular de una ampolla de 1.1 mg de TSH recombinante humana (rhTSH) por dos días consecutivos, y al tercer día se administra la dosis ablativa de 131-I (entre 30 y 300 mCi); dos días después se hace la medición de tiroglobulina y de anticuerpos antitiroglobulina. El rastreo corporal (en busca de tejido tumoral metastásico) se hace una semana más tarde. Un resultado óptimo se vería si no hay niveles de tiroglobulina y el rastreo corporal es negativo (34).
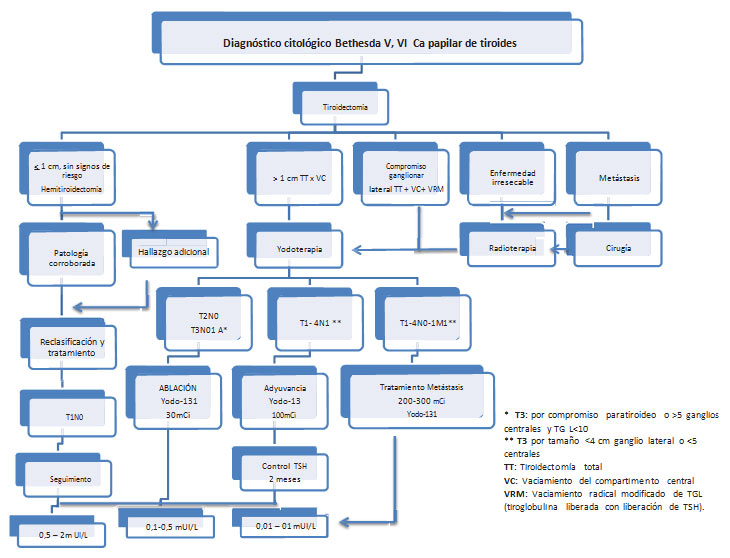
Enseguida se inicia (o continúa) la dosis supresiva de levotiroxina, buscando niveles de TSH entre 0.5 y 0.01 mUI/L para evitar la recaída en pacientes con riesgo de intermedio a alto, o una TSH en niveles normales bajos, para pacientes de bajo riesgo (34). Cuando todas estas medidas fallan, queda la opción de radioterapia externa o del uso quimioterapeútico de inhibidores de tirosina cinasa (TKI). Estos TKI se han utilizado en casos avanzados de carcinoma medular de tiroides, y en casos de carcinoma diferenciado resistente al radioyodo. Entre ellos están el Sorafenib, Lenvati- nib, Selumetinib y al menos cinco más (35). En la Tabla 2, vemos un flujograma para el tratamiento.
|
Tabla 2. Flujograma. Tratamiento inicial del cáncer diferenciado de tiroides. Adaptado de Rojas LJ. Manejo del cáncer diferenciado de tiroides. En: Recomendaciones de la ACE para el diagnóstico y manejo de las enfermedades tiroideas. 2015. Asociación Colombiana de Endocrinología, Diabetes y Metabolismo. Carlos A. Builes Barrera Editor PP127-40 |
REFERENCIAS
1. Vanderpump, MP. The epidemiology of thyroid di- sease. Brit Med Bull, 2011; 99 (1), 39.
2. Latorre-Sierra G. Enfoque del paciente con nódulo tiroideo. Fascículos de Endocrinología, Tiroides.
2011; 4: 36-48.
3. Chala AI, Pava R, Franco HI, Alvarez A, Franco A. Criterios ecográficos diagnósticos de neoplasia maligna en el nódulo tiroideo: Correlación con la punción por aspiración con aguja fina y la anatomía patológica. Rev Colomb Cir 2013; 28(1):15-23.
4. Yeh MW, Bauer AJ, Bernet VA, Ferris RL, Loevner LA et al, and for the American Thyroid Association Surgical Affairs Committee Writing Task Force. Ame- rican Thyroid Association Statement on Preoperative Imaging for Thyroid Cancer Surgery. Thyroid. 2015;
25(1): 3-14.
5. National Cancer Institute: PDQ Thyroid Cancer Treatment. Bethesda, MD: National Cancer Institute. February 28, 2014. http://cancer.gov/cancertopics/ pdq/treatment/thyroid/HealthProfessional.
6. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Thyroid Carcinoma. http://www.nccn.org/professionals/phy- sician_gls/PDF/thyroid.pdf
7. Cuervo-Martínez JA, Osorio LK, Romero-Rojas AE, Olaya-Morales N. Caracterización clínica e histopato- lógica del carcinoma papilar de tiroides en el Instituto Nacional de Cancerología ESE, Bogotá-Colombia durante los años 2006 a 2012. Rev Colomb Cancerol,
2013; 17(4): 188.
8. Garavito G. Cáncer de tiroides. Fasc. Endocrinol
ACE 2011; 4: 49-56.
9. Rojas JC, Niño DC, Wandurraga EA et al. Descripción de los hallazgos histopatológicos en la terapia inicial del cáncer de tiroides en un centro de referencia en Bucaramanga, Colombia. Rev Colomb Endocrinol Diab Metabol 2015; 2(1): 40-43.
10. Sanabria A, Zúñiga S. Carcinoma papilar de tiroides en niños y adolescentes: relación de las caracterís- ticas patológicas con la recurrencia. Rev Colomb Cir
2007; 22(4):202– 208.
11. Sánchez G, Gutiérrez C, Valenzuela A, Tovar JR.
Carcinoma diferenciado de la glándula tiroidea: hallazgos en 16 años de manejo multidisciplinario. Rev Colomb Cir. 2014; 29:102-109.
12. Maier TM, Schober O, Gerß J, Görlich D et al. Diffe- rentiated thyroid cancer patients more than 60 years old paradoxically show an increased life expectancy. J Nucl Med. 2015; 56(2):190-195.
13. Pilarski R, Nagy R. Genetic testing by cancer site:
endocrine system. Cancer J. 2012;18(4):364-71.
14. Farid NR. Molecular pathogenesis of thyroid cancer: the significance of oncogenes, tumor suppressor genes, and genomic instability. Exp Clin Endocrinol Diabetes. 1996;104 Suppl 4:1-12.
15. Tiedje V, Zwanziger D, Ting S, Schmid KW, Führer D. [Molecular pathogenesis of thyroid tumors]. Dtsch Med Wochenschr. 2015 Apr 7. [Epub ahead of print]
16. Jácome-Roca A. Aportes colombianos a la tiroido- logía. Rev Colom Endocrinol Diab Metabol. 2014;
1 (1): 33-41.
17. Corso C, Gomez X, Sanabria A, Vega V, Dominguez LC, Osorio C.Total thyroidectomy versus hemithyroi- dectomy for patients with follicular neoplasm. A cost-utility analysis. Int J Surg. 2014; 12(8):837-42.
18. Alfonso E, Sanabria A, Castillo M.Surgeons over- estimate the risk of malignancy in thyroid nodules, evaluation of subjective estimates using a bayesian analysis. Biomedica. 2011;31(4):590-8.
19. Sanabria A, Domínguez LC, Vega V, Osorio C.Prognosis of patients with thyroid cancer who do not undergo surgical treatment: a SEER database analysis. Clin Transl Oncol. 2011;13(9):692-6.
20. Yasmany Cabrera E, Cifuentes PA, Sanabria Á, Domínguez LC. (2014). Ambulatory thyroidectyomy: cost-minimization analysis in Colombia. Rev Colomb Cir, 2014; 29(4), 319-326.
21. Zúñiga S, Sanabria A. Prophylactic central neck dis- section in stage N0 papillary thyroid carcinoma. Arch Otolaryngol Head Neck Surg. 2009;135 (11):1087-91
22. Sanabria A, Carvalho AL, Piana de Andrade V, Pablo Rodrigo J, Vartanian JG, et al. Is galectin-3 a good method for the detection of malignancy in patients with thyroid nodules and a cytologic diagnosis of “follicular neoplasm”? A critical appraisal of the evi- dence. Head Neck. 2007; 29(11):1046-54.
23. Sanabria A, Carvalho AL, Silver CE, Rinaldo A, Shaha AR et al. Routine drainage after thyroid surgery--a meta-analysis. J Surg Oncol. 2007; 96(3):273-80.
24. Kowalski LP, Sanabria A, Vartanian JG, Lima RA el al. Total thyroidectomy with ultrasonic scalpel: a multicenter, randomized controlled trial. Head Neck.
2012 ;34(6):805-12.
25. Brito JP, Yarur AJ, Prokop LJ, McIver B, Murad MH, Montori VM. Prevalence of thyroid cancer in multino- dular goiter versus single nodule: a systematic review and meta-analysis. Thyroid, 2013; 23(4): 449-455.
26. Pitoia F, Bueno F, Urciuoli C, Abelleira E et al. Outco- mes of patients with differentiated thyroid cancer risk-stratified according to the American Thyroid Association and Latin American Thyroid Society risk of recurrence classification systems. Thyroid, 2013;
23(11), 1401-1407.
27. Pitoia F, Ward LS. Differences between Latin Ame- rican and American Associations´Thyroid Cancer Guidelines. Thyroid 2010; 20 (4): 361-63.
28. Adkisson CD, Howell GM, McCoy KL, Armstrong MJ et al. Surgeon volume and adequacy of thyroi- dectomy for differentiated thyroid cancer. Surgery.
2014;156(6):1453-58
29. Díez JJ, Oleaga A, Álvarez-Escolá C, Martín T, Ga- lofré JC; en representación del Grupo de Trabajo de Cáncer de Tiroides de la Sociedad Española de Endocrinología y Nutrición. Clinical guideline for management of patients with low risk differentiated thyroid carcinoma. Endocrinol Nutr. 2015 Apr 6. pii: S1575-0922(15)00076-5. doi: 10.1016/j.endo
nu.2015.02.006. [Epub ahead of print]
30. Zevallos JP, Hartman CM, Kramer JR, Sturgis EM, Chiao EY. Increased thyroid cancer incidence co- rresponds to increased use of thyroid ultrasound and fine-needle aspiration: A study of the Veterans Affairs health care system. Cancer. 2015; 121 (10): 741-746
31. Morris LGT, Sikora AG, Tosteson TD, Davies L.The Increasing Incidence of Thyroid Cancer: The Influence of Access to Care. Thyroid. 2013, 23(7): 885-891
32. Vargas-Uricoechea H, Herrera-Chaparro J, Meza- Cabrera I, Agredo-Delgado V. Cáncer de tiroides, experiencia en Suramérica y Colombia. Medicina (Bogotá). 2015; 37 (2): 139-162.
33. Vargas-Uricoechea H, Herrera-Chaparro J, Meza- Cabrera I, Agredo-Delgado V. Cáncer de tiroides e indicaciones de tiroidectomía (experiencia de 10 años en el departamento del Cauca-Colombia, periodo
2004-2013). Medicina (Bogotá) 2015; 37 (2): 109-121.
34. Llamas-Olier A, Martínez MC, De los Reyes A, Cadena E, Rojas L, Varela H, Angarita E. Terapia empírica del cáncer de tiroides con I-131 como estrategia diagnóstica para identificar lesiones ocultas en pacientes con tiroglobulina elevada sin enfermedad estructural identificable. Rev Colomb Cancerol, 2014;
18(4), 157-165.
35. Cadena E, Bastidas F, Angarita E, Garzón JG.
Resección de recaídas de cáncer diferenciado de tiroides mediante cirugía radioguiada. Rev Colomb Cancerol 2012; 16(2):130-134.
36. Rojas Melo LJ, Pitoia F. Uso de TSH recombinante humana en el cáncer diferenciado de tiroides. En: Tratado de Tiroides (CA Builes Barrera, Editor), Asociación Colombiana de Endocrinología, Diabetes y Metabolismo, Bogotá, 2014. Pp: 371-379
37. Díaz Torres RE, Véliz López J, Wohllk González N.
Inhibidores de tirosina cinasa en cáncer de tiroides. En: Tratado de Tiroides (CA Builes Barrera, Editor), Asociación Colombiana de Endocrinología, Diabetes y Metabolismo, Bogotá, 2014. Pp: 400-409
Recibido: Abril 17, 2015
Aceptado: Mayo 2,2015
Correspondencia: Alfredo Jácome Roca ajacomeroca@gmail.com