CÁNCER DE TIROIDES E INDICACIONES DE TIROIDECTOMÍA
EXPERIENCIA DE 10 AÑOS EN EL DEPARTAMENTO
DEL CAUCA, COLOMBIA, PERIODO 2004-2013
Hernando Vargas-Uricoechea1, Jorge Herrera-Chaparro2, Ivonne Meza-Cabrera3, Valentina Agredo-Delgado4
RESUMEN
Introducción: El cáncer tiroideo es el cáncer endocrino más común de todos los diagnosticados en los Estados Unidos. El incremento en su frecuencia se debe al aumento en la incidencia del tipo papilar; su principal forma de presentación es en tumores pequeños. Metodología: Se realizó una búsqueda manual exhaustiva de los registros de patología de individuos que fueron sometidos a tiroidectomía en dos centros de referencia en Popayán-Cauca, entre los años 2004 y 2013. Se realizó un análisis exploratorio para calcular las medidas de ocurrencia en enfermedad tumoral y no-tumoral. Resultados: Se documentaron 463 tiroidectomías; 205 fueron por cáncer de tiroides y 258 fueron por patología distinta al cáncer de tiroides; 195 correspondieron a las diferentes variedades de carcinoma diferenciado (95,121%); 168 fueron para el tipo papilar clásico y sus variedades (81,95%); 22 fueron para carcinoma folicular (10,73%); 3 para carcinoma de células de Hürthle (1,46%); 2 se rotularon como mixtos (0,975%); 6 (2,92%) correspondieron a carcinoma pobremente diferenciado; 2 correspondieron a carcinoma medular (0,975%) y 2 fueron clasificados como anaplásicos (0,975%). Conclusiones: El incremento en el número de cirugías en patología tiroidea tumoral y no-tumoral puede explicarse por un aumento real en la frecuencia –por un factor medioambiental explícito– (ingesta excesiva de sal yodada) y por un “sobrediagnóstico” originado por un mayor acceso a estudios de imágenes y una mayor frecuencia de ACAF. El incremento en los procedimientos en patología no-tumoral puede deberse principalmente a conductas, decisiones o creencias por parte del cirujano y del paciente.
Palabras clave: Cáncer, bocio, incidencia, tiroides, tiroidectomía, yodo, sobrediagnóstico.
![]()
1 MD. Esp. Medicina Interna y Endocrinología, MSc (Epidemiol), Dr. (Hon) Ciencias de la Salud. Candidato a Ph.D en Ciencias
Biomédicas. Profesor Asistente, Departamento de Medicina Interna. Universidad del Cauca, Popayán.
2 MD. Esp. Cirugía. Profesor Titular, Departamento de Ciencias Quirúrgicas. Universidad del Cauca, Popayán.
3 MD. Esp. Anatomía Patológica, Coordinadora Laboratorio de Patología; Hospital Universitario San José, Patóloga adscrita a la compañía de Patólogos del Cauca, Popayán.
4 Estudiante de Medicina IX semestre de la Universidad del Cauca, Facultad Ciencias de la Salud, Popayán, Colombia.
THYROID CANCER AND THYROIDECTOMY INDICATIONS A 10-YEAR EXPERIENCE IN CAUCA DEPARTMENT, COLOMBIA, DURING YEARS 2004-2013
ABSTRACT
Introduction: Thyroid cancer is the most common endocrine cancer diagnosed in the United States. The increase in frequency is due to greater incidence of the papillary type, when seen as a small tumor. Methodology: We performed a comprehensive manual search of pathology records of individuals who underwent thyroidectomy at two reference centers in the city of Popayán, Cauca, between years 2004 and 2013. An exploratory analysis calculated the number of times thyroidectomy was done for tumor and for non-tumor disease. Results: We documented 463 thyroidectomies; 205 were for thyroid cancer and 258 were for other conditions; 195 cases (95.121%) were classified as differentiated thyroid carcinoma; of these, 168 were classical papillary carcinoma and subtypes (81.95%); 22 were follicular carcinomas (10.73%); 3, Hürthle-cell carcinomas (1.46%); 2 were labeled as mixed (0.975%); 6 (2.92%) were poorly differentiated carcinomas, 2, medullary carcinomas (0.975%) and 2 were classified as anaplastic (0.975%). Conclusions: The increased number of surgeries in thyroid (tumor and non-tumor) disease can be explained by an actual increase in frequency-by a environmental explicit-factor (excessive intake of iodized salt) and moreover, can be explained by a “over-diagnosis” caused by increased access to imaging studies and a a larger number of fine-needle aspiration citologies (ACAF). The increase in thyroidectomies for non-tumoral pathology may be primarily due to a physician tendency to a surgical approach, decisions and beliefs by both surgeons and patients.
Key words: Cancer, goiter, incidence, thyroid, thyroidectomy, iodine, overdiagnosis.
INTRODUCCIÓN.
El cáncer de tiroides es el cáncer endocrino más común (1,0-1,5%) de todos los cánceres diagnosticados en Estados Unidos de Norte América (USA) cada año tienen un origen en la glándula tiroidea; además, se considera el quinto cáncer más frecuentemente diagnosticado en mujeres; por ejemplo, en Italia es el segundo en frecuencia en mujeres menores de 45 años (1,2). Este cáncer presenta un incremento continuo en su incidencia en los últimos 30 años en el mundo, y países como Italia, Israel, Japón y Suiza reportan el mayor porcentaje de incremento en la tasa de incidencia (con la característica de ser más frecuente en mujeres). En los países del Reino Unido se encuentra el menor porcentaje de incremento en la tasa de incidencia, dicha tendencia se presenta prácticamente en todos los continentes, excepto en África. Los países que presentan la incidencia más alta de cáncer de tiroides (por 100.000 individuos) son: Islandia (16,3); Israel (15,8); Malta (15,7); USA (14,2) y Qatar (14,1) (3,4).
El incremento en la frecuencia de cáncer de tiroides es casi exclusivamente debido al aumento en la incidencia del tipo papilar, sin cambios significativos en la frecuencia de los tipos folicular, anaplásico y medular; su principal forma de presentación es en tumores pequeños, aunque también hay un aumento en la incidencia en tumores grandes (5-8). No obstante el incremento en la incidencia, la mortalidad por cáncer de tiroides permanece casi invariable (alrededor de 0,5 casos por 100.000 personas) y aunque se describe un leve incremento en la tasa de mortalidad –especialmente en hombres– para el Instituto Nacional de Cancerología de USA (INC), el número de casos nuevos de cáncer de tiroides en USA es de 12,9 por 100.000 hombres y mujeres por año; y el número de muertes por dicho cáncer es de 0,5 por 100.000 hombres y mujeres por año (estas tasas son ajustadas por edad y se basan en los casos y muertes reportadas en el periodo de tiempo entre los años 2007 y 2011). Adicionalmente, se calcula que el 1,1% de hombres y mujeres podrían ser diagnosticados con cáncer de tiroides en algún punto a lo largo de su vida, basado en los datos establecidos entre los años 2009 y 2011 (9-12). La prevalencia de cáncer de tiroides en el año 2011 se estimó en 566.708 personas que vivían con dicho cáncer en USA (123.088 hombres y 443.620 mujeres).
Para el Instituto Nacional de Cancerología de Colombia (INCC) la incidencia de cáncer se estimó a partir de las bases de datos departamentales de mortalidad y población para los años 2002-2006, las bases de datos de los registros poblacionales de cáncer de Bucaramanga (2000-2005), Pasto (1998-2002) y Manizales (2002-2006), y las cifras de incidencia del Registro Poblacional de Cáncer de Cali –RPCC– (1998-2002). Se estimaron 32.316 casos anuales nuevos de cáncer en hombres y 38.571 en mujeres (13-16).
Para cáncer de tiroides, en dicho periodo se encontró con relación a la incidencia, una Tasa Cruda (TC) anual de 0,7 y de 16 para hombres y mujeres, respectivamente; y una Tasa Ajustada por Edad (TEE) anual de 0,8 y 17,1 para hombres y mujeres, respectivamente; con relación a la mortalidad, se documentó una TC de 0,3 y 0,7 para hombres y mujeres, respectivamente; y una TEE de 0,3 y 0,7 para hombres y mujeres, respectivamente (curiosamente la TC y la TEE para mortalidad por cáncer de tiroides fueron idénticas). Los datos del INCC no tomaron en cuenta los del Registro Poblacional de Cáncer de Antioquia –RPCA– (donde se analizó la información preliminar en el periodo de tiempo 2007-2009). De acuerdo al RPCA, y según los datos publicados por estadísticas vitales, en los que se tomaron las cifras de mortalidad del DANE (2000-2009) e información preliminar del año 2010 de la Secretaría Seccional de Salud y Protección Social de Antioquia, el cáncer de tiroides pasó de ser la décima causa de morbilidad en el año 2006 a la sexta para el periodo 2007-2009, pero curiosamente el cáncer de tiroides ocupó el tercer lugar en frecuencia en mujeres –por encima del cáncer de cuello uterino, colon y recto, pulmón y ovario– (17,18). En el año 2012, se describieron las tendencias en términos de la incidencia y mortalidad de cáncer en Cali (experiencia de 50 años) por parte del grupo del RPCC; se encontró que las tasas de incidencia y mortalidad diferían de manera significativa de acuerdo con el tipo histológico, registrando un incremento en la tasa de incidencia para el carcinoma papilar, especialmente en las mujeres; mientras que el carcinoma folicular y el anaplásico habían declinado en el tiempo (periodo 1962-2007) (19).
Planteamiento del problema
Los datos disponibles de cáncer de tiroides para el departamento del Cauca son muy escuetos, existiendo un subregistro en los datos sobre su incidencia, prevalencia y mortalidad. Los datos oficiales provienen de aquellos publicados por el INCC para el periodo 2002-2006: en hombres, los casos anuales fueron de 2,0 con una TC anual de 0,3 (de incidencia estimada) y una TEE anual de 0,4 (también de incidencia estimada); las muertes en el periodo fueron de 6,0 con una TC de mortalidad observada anual de 0,2 y TEE anual (de la mortalidad observada) de 0,2. En mujeres, la distribución fue: Casos anuales 105; la TC anual: 16,9 (de incidencia estimada); la TEE anual: 19 (también de incidencia estimada); las muertes en el periodo fueron 25; la TC anual de 0,8 (de mortalidad observada) y la TEE anual (también de mortalidad observada) de 0,9.
El Departamento del Cauca está situado en la zona suroccidental de Colombia y hace parte de las regiones Andina, Pacífica y Amazónica, con una superficie aproximada de 29.308 km2, equivalente al 2,7% del país y es el doceavo departamento en extensión, con una altitud desde el nivel del mar hasta los 5.780 metros. Limita por el norte con el departamento del Valle del Cauca, por el oriente con los departamentos de Huila, Tolima y Caquetá; por el sur con los departamentos de Putumayo y Nariño y por el occidente con el Océano Pacífico. La Población que se autorreconoce como Indígena en el departamento del Cauca, según datos para el 2005, del Departamento Administrativo Nacional de Estadística (DANE) es la segunda del país después de La Guajira. Según el censo del 2005, el departamento del Cauca tiene 1’268.937 habitantes. El 39,87% de la población se ubica en la zona urbana y el 60,13% en la zona rural. El 50,62% de la población son hombres y el 49,37% son mujeres, con un relativo equilibrio entre ambos sexos y un índice de masculinidad de 102,66 hombres por cada 100 mujeres. El 60,7% de la población es menor de 30 años. Para la población total del departamento del Cauca (proyección para el año 2006) de un número de 1’308.090 habitantes, el 73,1% (856.403) pertenecían al régimen subsidiado en salud; 18,3% (214.395) correspondía a las personas no afiliadas al Sistema General de Seguridad Social en Salud; 8,5% (237.292) correspondía al régimen contributivo, y el resto pertenecía al régimen de excepción –sin disponer de datos de distribución exactos a diciembre de 2006– (20,21). La cobertura de atención en salud para pacientes sometidos a cirugía tiroidea (en la mayoría de los casos) son realizadas en los tres centros asistenciales de mediana y alta complejidad de la ciudad de Popayán, Hospital Universitario San José (HUSJ), Clínica la Estancia (CLE) y Hospital Susana López de Valencia (HSLV) y salvo excepciones, las lecturas y los análisis histopatológicos de las piezas quirúrgicas de las tiroidectomías se llevan a cabo, por diversas indicaciones, en la Compañía de Patólogos del Cauca (CPC) y en el laboratorio de patología del HUSJ.
MATERIALES Y MÉTODOS
Ante la ausencia de bases de datos y registros electrónicos en las dos instituciones especializadas con laboratorio de patología (CPC y HUSJ) se procedió a la búsqueda manual de los archivos desde enero 1 de 2004 hasta diciembre 31 de 2013. No se dispone de datos manuales antes de enero de 2004. La búsqueda se realizó teniendo como criterios de inclusión: Tiroidectomía total o parcial (subtotal, casi-total, hemitiroidectomía, lobectomía) y población adulta o mayor de 18 años. Todos los casos registrados fueron confirmados por análisis histopatológico realizado por dos patólogos sin conocimiento del concepto de su contraparte. En caso de discrepancias se solicitaba una junta de patólogos, por lo que todos los resultados fueron confirmados, bien sea por la concordancia entre los dos patólogos o por concepto de la junta de patólogos. Los datos acerca de la mortalidad y causa de muerte fueron tomados a partir de los registros disponibles en la Secretaría de Salud Departamental, de la Registraduría Nacional del Estado Civil y de los registros disponibles en el HUSJ, CLE y HSLV. Se excluyeron de la búsqueda los resultados de Aspiración con Aguja Fina –ACAF– y biopsias TRUCUT por diversas indicaciones. El análisis exploratorio de los datos se realizó mediante la construcción de tablas resumen para calcular las medidas de ocurrencia tanto para las características demográficas como para las del diagnóstico.
RESULTADOS
Durante el periodo de los diez años evaluados, en la búsqueda se documentaron 463 tiroidectomías, de las cuales 205 fueron catalogadas como cáncer de tiroides (44,28%) y 258 se clasificaron como Patología Distinta al Cáncer de Tiroides –PDCT– (55,72%); 123 casos fueron documentados en el laboratorio de patología del HUSJ desde enero 01 del 2004, 69 casos correspondientes a cáncer de tiroides (56,1%) y 54 casos a PDCT (43,9%).
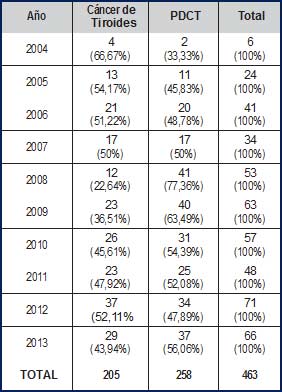
En la CPC se documentaron 340 casos desde enero 01 de 2006, de los cuales 136 casos correspondieron a cáncer de tiroides (40%) y 204 correspondieron a PDCT (60%). La frecuencia de cáncer de tiroides y de PDCT, de acuerdo al año de registro se muestra en la Tabla 1. La mayor frecuencia de tiroidectomías se llevó a cabo en el año 2012 (71 en total, equivalente al 15,33%); sin embargo, la frecuencia fue ascendente desde el año 2004, originando que entre el 2009 y el 2013 se documentaran 305 tiroidectomías (65,9%) superando el número de procedimientos realizados entre 2004 y 2008 (158 tiroidectomías, equivalente al 34,1%). La menor frecuencia se encontró en el año 2004, con 6 tiroidectomías (1,29%).
La mayor frecuencia de cáncer de tiroides se documentó en los años 2012 y 2013, con 37 y 29 casos, respectivamente. De hecho, 135 casos de cáncer de tiroides fueron registrados entre 2009 y 2013 (correspondiente al 65,85% del total de casos de cáncer documentados). Por otro lado, la distribución de la PTDC denota la mayor frecuencia entre los años 2008 - 2009, con un total de 81 casos (31,39%); y entre 2012 - 2013, con 71 casos (27,51%).
|
Tabla 1. Frecuencia de cáncer de tiroides y de PDCT, de acuerdo al año de registro |
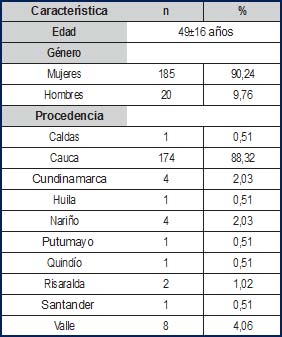
El promedio de edad de cáncer de tiroides en ambos sexos fue de 49,735 años, para mujeres fue de 49,41 años; y para hombres de 52,94 años; la mediana de edad para ambos sexos en aquellos diagnosticados con cáncer de tiroides fue de 51 años, las características sociodemográficas de la población estudiada se muestran en la Tabla 2.
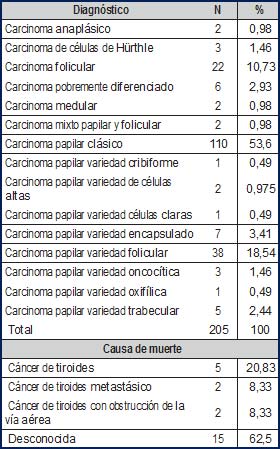
En general, el carcinoma papilar clásico y sus variedades, el folicular, el mixto (papilar y folicular) y el de células de Hürthle sumaron en conjunto 195 casos (95,121%); 168 correspondieron a carcinoma papilar –clásico y sus variedades– (81,95%); 22 fueron rotulados como carcinoma folicular (10,73%); 3 correspondieron a carcinoma de células de Hürthle (1,46%) y 2 se rotularon como mixto (0,975%).
Por otra parte, 6 casos (2,92%) correspondieron a carcinoma pobremente diferenciado; 2 correspondieron a carcinoma medular (0,975%) y 2 fueron clasificados como anaplásico (0,975%).
|
Tabla2. Características sociodemográficas |
En mujeres se presentaron 185 casos de cáncer de tiroides, de los cuales la distribución de los subtipos demuestra que 176 casos correspondieron a cáncer bien diferenciado de tiroides (todos los subtipos del cáncer papilar y el cáncer folicular) equivalente al 95,13%; el 4,87% restante (9 casos) correspondieron a cáncer pobremente diferenciado, cáncer medular y anaplásico.
En hombres se presentaron 20 casos de cáncer de tiroides, de los cuales la distribución de los subtipos demuestra que 19 casos (95%) correspondieron a cáncer bien diferenciado de tiroides (todos los subtipos del cáncer papilar y el cáncer folicular) y solo un caso de carcinoma pobremente diferenciado fue documentado (5%). En ambos sexos, el carcinoma papilar clásico y el carcinoma papilar variedad folicular ocuparon el primero y segundo puesto en frecuencia (en ese orden), siendo el carcinoma folicular el tercero en frecuencia para ambos sexos. La frecuencia de los subtipos de cáncer de tiroides y la causa probable de muerte se muestra en la Tabla 3. En mujeres, la aparición del carcinoma papilar variedad cribiforme fue el que se presentó a edades más tempranas (35 años), mientras que el carcinoma anaplásico y el pobremente diferenciado se documentaron en etapas más tardías de la vida (71 y 71,8 años, respectivamente).
|
Tabla 3. Frecuencia de los subtipos de cáncer de tiroides y causa probable de muerte |
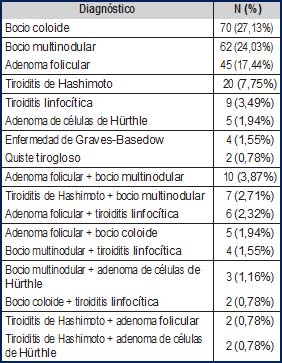
En hombres, el carcinoma papilar variante trabecular fue el que tuvo una presentación más temprana (48 años), mientras que el carcinoma papilar variante encapsulado se documentó en una etapa más tardía (67 años). De los 24 fallecidos (correspondiente al 11,7% de los 205 pacientes con cáncer de tiroides) se pudo obtener información de 9 de ellos, 2 muertes corres- pondieron a los dos casos de pacientes rotulados con cáncer anaplásico, estos fallecieron antes del año del diagnóstico; 4 muertes correspondieron a carcinoma pobremente diferenciado, 2 muertes ocurrieron en aquellos con carcinoma papilar y 1 muerte se presentó en aquellos con carcinoma folicular. No se pudo obtener más datos del resto de los fallecidos, lo que imposibilitó realizar un análisis de supervivencia global y estratificado. Los resultados de las 258 tiroidectomías restantes y que correspondían a PDCT son mostrados en la Tabla 4. El bocio coloide y el bocio multinodular fueron los dos diagnósticos más frecuentes (51,15% del total) siguiendo en frecuencia el adenoma folicular (17,44%), la tiroiditis de Hashimoto (7,75%), y la tiroiditis linfocítica (3,49%); estos cinco diagnósticos se especifican de manera aislada, sin otras patologías asociadas.
|
Tabla 4. Frecuencia de otras Patologías Diferentes al Carcinoma Tiroideo (PDTC) |
DISCUSIÓN
La experiencia regional en el departamento del Cauca denota un incremento en el número de indicaciones quirúrgicas por patología tiroidea neoplásica y no-neoplásica a lo largo el periodo observado, con una mayor frecuencia quirúrgica en patología no-neoplásica, lo que podría sugerir:
1. Un incremento innecesario en la indicación quirúrgica de patología no-neoplásica (bocio coloide, bocio multinodular, adenoma folicular, tiroiditis de Hashimoto y tiroiditis linfocítica).
2. La indicación quirúrgica en patología no-neoplásica se debe a fenómenos compresivos, o al deseo expreso del paciente o del médico tratante por la cirugía.
3. Del total de indicaciones quirúrgicas en la patología tiroidea, se llevan a cirugía los casos de patología neoplásica confirmada únicamente por citología aspirativa, y no aquellos con sospecha clínica y/o bioquímica, lo que reduce significativamente el número de procedimientos en personas con algún grado de sospecha de neoplasia, mientras que mantendría relativamente constante el número de aquellos que se llevan a cirugía por patología no-neoplásica.
4. Existe un aumento de “falsos-positivos” en las citologías aspirativas de nódulos tiroideos, lo cual se descarta en el bloque histopatológico, incrementando innecesariamente el número de procedimientos quirúrgicos.
5. Existe aún la creencia equívoca de que el tratamiento de la enfermedad nodular tiroidea y del bocio difuso es exclusivamente quirúrgico, lo que inclina la balanza a favor de una mayor frecuencia de enfermedad no-neoplásica. La falta de registros y de seguimiento en el paciente dificulta establecer con precisión las razones que explicarían este aspecto.
Por otra parte, intentamos realizar un análisis de supervivencia; no obstante, la ausencia de datos robustos sobre el seguimiento y sobre mortalidad impidió llevarlo a cabo; las explicaciones son varias:
1. El análisis de supervivencia tiene como objetivo de estudio el tiempo de seguimiento hasta la ocurrencia de un evento de interés y cobra vital importancia cuando existen observaciones censuradas. La función de supervivencia se define como la probabilidad de que una persona sobreviva (no le ocurra el evento de interés) al menos hasta el tiempo t. Para la población con patología tiroidea, no existen datos sobre el seguimiento, y mucho menos acerca de la confirmación de eventos de interés (como por ejemplo, mortalidad, recaída tumoral, entre otros).
2. En el Cauca, los datos sobre mortalidad por algún evento en salud de la población son registrados en parte en la Secretaría Departamental de Salud; estos datos se extraen de certificados de defunción, los cuales en la totalidad de los datos disponibles en los individuos afectados por cáncer de tiroides (y que habían fallecido) no especificaban la causa de muerte (la causa de muerte en todos los casos fue, según el certificado de defunción, “falla multiorgánica”).
Los otros registros de mortalidad fueron obtenidos a partir de la información aportada por la Registraduría Nacional del Estado Civil, en donde pudimos extraer en algunos individuos la causa de muerte (en los escasos datos suministrados, la causa de muerte reportada fue también “Falla multiorgánica"). No pudimos obtener datos de mortalidad provenientes del HUSJ, CLE y HSLV. Por lo anterior, y ante la falta de registros adecuados sobre la causa de muerte en los pacientes no fue posible realizar un análisis de supervivencia en la población estudiada.
En esta serie, más del 95% de los cánceres de tiroides fueron clasificados como “diferenciados” lo cual está ligeramente por encima de la frecuencia reportada en otros estudios; y sólo <5% de la población estudiada tiene carcinoma pobremente diferenciado, medular o anaplásico. Es probable que un mayor acceso (y a veces indiscriminado) a métodos diagnósticos como la ecografía y la ACAF expliquen el aumento en el número de procedimientos quirúrgicos (tanto en enfermedad neoplásica como no neoplásica), surgiendo el "sobrediagnóstico" como una explicación a este hecho; por otra parte, en el departamento del Cauca en el año 1948 se documentó una prevalencia de bocio superior al 80%, y posteriormente, después de los programas para yodización de la sal, se encontró en la población escolarizada en el año 1966 una prevalencia de bocio de 79,56% en 6.234 niños examinados, y una deficiencia de yodo evidente proveniente de la dieta; ya en el periodo entre 1994-1998 se encontró una reducción significativa en la tasa de bocio, con ingestas de sal yodada >99% y un promedio de ingesta de sal (g/persona/día) de 7,47 –la OMS recomienda un máximo de ingesta diaria de sal en adultos saludables de 5 g–. Es probable que el fácil acceso y el aumento en la ingesta de sal yodada explique el aumento de cáncer de tiroides en una población catalogada previamente como “deficiente” de yodo, y es probable también que el aumento en la autoinmunidad tiroidea (bien reconocida en áreas con aumento del consumo de yodo) tenga alguna influencia en el incremento de la frecuencia de cáncer de tiroides (22,23).
Desde el punto de vista epidemiológico, las aproximaciones que investigan si el bocio conlleva a cáncer de tiroides en humanos, se basan en:
a. La evaluación de datos descriptivos.
b. La comparación de las tasas de cáncer de tiroides entre áreas con bocio endémico y áreas libres de bocio.
c. La evaluación de las tendencias en el tiempo de cáncer de tiroides después de la implementación de medidas universales de suplementación de yodo, las cuales reducen la frecuencia de bocio endémico en un área determinada.
d. Las evaluaciones que determinan si los individuos con bocio tienen un mayor riesgo de cáncer de tiroides, o si los casos de cáncer de tiroides tienen una historia más frecuente de hiperplasia y nódulos que los controles (24).
El concepto de ingesta de yodo y cáncer de tiroides se fundamenta a través de varios análisis, realizados en países en donde se han implementado programas de yodización universal de la sal; por ejemplo, en Salta (Argentina) una región con alta prevalencia de bocio, se investigó la historia natural de cáncer de tiroides y de tiroiditis antes y después de la profilaxis con yodo en la población, durante un periodo de 31 años. El carcinoma papilar fue el que más incrementó su frecuencia, mientras que el número de carcinoma folicular y medular permaneció sin cambios; después de la profilaxis con sal yodada, los casos de tiroiditis fueron más frecuentes en individuos con carcinoma papilar que en aquellos con cáncer no-papilar (<0,05); indicando que una alta ingesta de yodo proveniente de la dieta puede estar asociada con una alta frecuencia de cáncer papilar de tiroides y tiroiditis, y que la tiroiditis está mayormente asociada con cáncer papilar que con otros tipos de cáncer de tiroides. En la misma región, pero en un seguimiento a 40 años, se corroboraron los mismos hallazgos (25,26). En Dinamarca, en dos regiones evaluadas (una con deficiencia leve y otra con deficiencia moderada de yodo), se determinó si la incidencia de cáncer de tiroides era diferente entre esas dos regiones después de la implementación de un programa nacional de suplementación de yodo. Se estudiaron todos los cánceres de tiroides notificados por el registro Danés de cáncer en el periodo 1973-1997, enfocándose en los cuatro subtipos más frecuentes: papilar, folicular, medular y anaplásico; no se encontraron diferencias regionales en la incidencia total de cáncer folicular o en la de cáncer papilar; hubo un incremento leve, pero no significativo en la incidencia total, principalmente como resultado de un incremento en la incidencia del subtipo papilar en ambas regiones (27,28).
Similarmente, en una región del noreste de Rumania (Moldavia) reconocida como una región con bocio endémico leve, se evaluaron los cambios en la incidencia de cáncer de tiroides después de la yodización universal de la sal entre 2001 y 2004 con la incidencia de cáncer de tiroides entre 2005 y 2008 en la misma región. El número de casos de cáncer papilar se incrementó de 125 casos (2001 – 2004) a 276 casos (2005 – 2008). El número de casos de cáncer folicular disminuyó de 52 casos (2001 – 2004) a 27 casos (2005-2008). La relación entre cáncer papilar y cáncer folicular se incrementó de 4,8/1 (2001 – 2004) a 10,61/1 (2005 – 2008). El número de cáncer medular se incrementó de 6 casos (2001 – 2004) a 24 casos (2005 – 2008). El número de casos de cáncer anaplásico se incrementó de 7 (2001 – 2004) a 12 casos (2005 – 2008). El número total de casos de cáncer de tiroides se incrementó dramáticamente después de la introducción de la yodización universal de la sal (de 190 casos en el periodo 2001-2004, a 339 casos en el periodo 2005-2008) (29).
En Shenyang, una ciudad del noreste de China, se determinó la incidencia de cáncer de tiroides antes y después de implementar el programa de yodización universal de la sal (el cual fue instituido en China en 1996). La tasa de detección de cáncer papilar y medular se incrementó, mientras que la de cáncer folicular disminuyó, sin cambios en la frecuencia de cáncer pobremente diferenciado (30).
También en China se evaluó el efecto de la ingesta de yodo sobre enfermedades tiroideas en tres comunidades representativas y definidas con ingesta deficiente de yodo (A), ingesta normal de yodo (B) e ingesta excesiva de yodo (C). Se encuestaron para enfermedades tiroideas en un periodo de 5 años. No se encontró cáncer de tiroides en las comunidades A y B, pero 10 pacientes fueron identificados (a nivel basal) en la comunidad C (ingesta excesiva de yodo). Trece nuevos casos de cáncer de tiroides fueron diagnosticados en la comunidad C y no hubo casos en las comunidades A y B, puntualizando el hecho de que la ingesta excesiva de yodo puede estar relacionada con una alta prevalencia de cáncer de tiroides, al compararse con poblaciones con ingesta baja o adecuada (31).
En Carinthia, una región de Austria, reconocida como endémica de bocio y deficiente de yodo, se evaluó la incidencia de cáncer de tiroides bajo el impacto de dos factores de riesgo regionales: la contaminación con yodo radioactivo de los suelos de Austria, proveniente de Chernobyl en 1986, y el incremento en la yodización de la sal en un programa general de profilaxis de bocio, iniciado en 1991. Se compararon los periodos de tiempo entre 1984-1989, 1990-1995, y 1996- 2001; se documentaron 734 casos de cáncer de tiroides (76% papilar; 18% folicular; 3% medular; 2% anaplásico y 1% oxifílico). La relación mujer: hombre fue de 3:1; la tasa de incidencia anual se incrementó en 8,05% en mujeres y 11,6% en hombres (32).
En Suecia, después de un programa de suplementación de yodo, la incidencia de cáncer papilar se incrementó, y la de cáncer folicular disminuyó; estas tendencias fueron las mismas en otras regiones evaluadas, por lo que se consideró que no estaban relacionadas con el programa de suplementación, pero podían explicarse por diferentes patrones de causalidad para los diferentes subtipos histológicos. De igual forma, un estudio de casos y controles (484 casos de cáncer de tiroides entre 1980 y 1992) demostró que las áreas deficientes de yodo, donde el bocio había sido endémico, se asociaba con el aumento en el riesgo de cáncer folicular mientras que el riesgo de cáncer papilar fue observado únicamente en mujeres expuestas a deficiencia de yodo durante la pubertad (33,34).
El tamizaje para cáncer de tiroides en individuos con enfermedad nodular tiroidea (como para cualquier otro tipo de cáncer) se basa en la presunción que el cáncer tiene un fenómeno progresivo y gradual en el tiempo; los resultados favorables sobre la supervivencia permiten concluir que la detección temprana en estadíos iniciales reduce en forma dramática la mortalidad por cáncer. Sin embargo, la incidencia de la enfermedad en ciertos tipos de cáncer (cuello uterino y colon) se reduce después de que los programas de tamizaje son implementados; por otra parte, el tamizaje en búsqueda de cáncer de mama y próstata ha incrementado la incidencia de los mismos, aunque el impacto positivo sobre la mortalidad no ha sido como inicialmente se esperaba. La frecuencia óptima de tamizaje depende de la tasa de crecimiento del cáncer; si es un cáncer de rápido crecimiento, el tamizaje es poco efectivo; si es de crecimiento lento –pero progresivo– con latencia prolongada y en donde se documenta una lesión precancerosa, el tamizaje es ideal; es más, en este caso puede realizarse un tamizaje menos frecuente.
En el caso de tumores indolentes, la detección es potencialmente dañina, ya que puede originar un “sobretratamiento”. Para aquellos tumores que se desarrollan de manera rápida o se diseminan tempranamente, el tamizaje es menos probable que mejore el desenlace. Sin embargo, la identificación de individuos de alto riesgo para tumores letales y de rápido crecimiento (por ejemplo, portadores de mutaciones en BRCA1 y BRCA2 en cáncer de mama), las estrategias de prevención –cirugía profiláctica– se traducen en un impacto positivo sobre la supervivencia al compararse con el tamizaje. El cáncer de tiroides es un ejemplo de cómo la aplicación de métodos diagnósticos como la ecografía, la Tomografía Axial Computarizada, la Resonancia Nuclear Magnética y el mayor acceso y realización de ACAF, ha derivado en una mayor detección de una enfermedad por lo demás indolente (35-37); por ejemplo, en USA entre 1975 y el 2009 la incidencia de cáncer de tiroides pasó de 4,9 por 100.000 hab a 14,3 por 100.000 hab mientras que la tasa de mortalidad permaneció constante (de 0,56 por 100.000 a 0,52 por 100.000). Dicho incremento en la incidencia se debió casi por completo al cáncer papilar pequeño (< 2 cm) el cual es considerado el tipo histológico más indolente. El tamizaje basado en la enfermedad ha contribuido al sobrediagnóstico, el cual si no es reconocido, conllevaría a sobretratamiento, reduciendo de esta forma la efectividad global del tamizaje. Finalmente, el incremento en la exposición a factores medioambientales (radiación ionizante, cósmica, pesticidas, solventes, carcinógenos), al igual que el incremento en la frecuencia de enfermedad tiroidea autoinmune, el sobrepeso- obesidad, han sido asociados con la presencia de cáncer de tiroides. Deben realizarse estudios que evalúen dicha asociación en nuestro medio.
FORTALEZAS Y LIMITACIONES
Nuestro estudio tiene como fortaleza el hecho de que la gran mayoría de las personas con indicación quirúrgica de enfermedad tiroidea tumoral y no-tumoral, se realizan el procedimiento en uno de los tres sitios descritos previamente (HSLV, CLE y HUSJ) y la totalidad de los reportes histopatológicos (salvo excepciones) son evaluados en la CPC y en el laboratorio de patología del HUSJ.
Las limitaciones del estudio radican que no existen –hasta el momento de su realización y de la recolección de los datos y la creación de la base de datos– registros electrónicos o manuales ordenados; es más, en los casos descritos hasta el año 2009 no se dispone de la totalidad de los datos de identificación del paciente, procedencia e indicación quirúrgica. No existe un registro de clasificación y estratificación del cáncer de tiroides, como tampoco existe el registro de seguimiento y datos completos de supervivencia.
CONCLUSIONES
El manejo quirúrgico en enfermedad tiroidea sigue siendo prevalente, tanto para enfermedad tumoral como para la no-tumoral; el alto número de procedimientos en enfermedad no-tumoral puede deberse a preferencias de manejo por parte del cirujano y/o el paciente, mientras que el incremento en el número de procedimientos en enfermedad tumoral puede deberse a “sobrediagnóstico” y a un posible aumento en el riesgo de cáncer de tiroides en una población con profunda deficiencia de yodo décadas atrás, en la cual se ha implementado un programa universal de yodización de la sal, y en donde además la ingesta de la misma sobrepasa el estándar internacional de consumo.
Es necesario realizar estudios poblacionales a gran escala, que evalúen los posibles factores de riesgo asociados al cáncer de tiroides en nuestra población.
CONFLICTOS DE INTERÉS
Los autores del presente estudio declaran no tener conflicto de intereses en la realización del trabajo y del manuscrito.
AGRADECIMIENTOS
A la Compañía de Patólogos del Cauca, en especial a los doctores Ángel Ceballos y Jaime Álvarez, y al laboratorio de Patología del Hospital Universitario San José de Popayán por permitir y facilitar el acceso a sus registros manuales.
REFERENCIAS
1. Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer.
2015; 136(5):359-386.
2. Ferlay J, Steliarova-Foucher E, Lortet-Tieulent J, Rosso S, Coebergh JW, Comber H, Forman D, Bray F. Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012. Eur J Cancer.2013; 49(6):1374-1403.
3. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015; 65(2):87-108.
4. Dal Maso L, Guzzinati S, Buzzoni C, Capocaccia R, Serraino D, Caldarella A, Dei Tos AP, Falcini F, Autelitano M, Masanotti G, Ferretti S, Tisano F, Tirelli U, Crocetti E, De Angelis R; AIRTUM Working group. Long-term survival, prevalence, and cure of cancer: a population-based estimation for 818 902
Italian patients and 26 cancer types. Ann Oncol.2014;
25(11):2251-2260.
5. Vigneri R1, Malandrino P, Vigneri P. The changing epidemiology of thyroid cancer: why is incidence increasing? Curr Opin Oncol.2015; 27(1):1-7.
6. Li N, Du XL, Reitzel LR, Xu L, Sturgis EM. Impact of enhanced detection on the increase in thyroid cancer incidence in the United States: review of incidence trends by socioeconomic status within the surveillance, epidemiology, and end results registry, 1980-2008. Thyroid.2013; 23(1):103-110.
7. Jung CK, Little MP, Lubin JH, Brenner AV, Wells SA Jr, Sigurdson AJ, Nikiforov YE. The increase in thyroid cancer incidence during the last four decades is ac- companied by a high frequency of BRAF mutations and a sharp increase in RAS mutations. J Clin Endocrinol Metab. 2014; 99(2):276-285.
8. Albarel F, Conte-Devolx B, Oliver C. From nodule to differentiated thyroid carcinoma: contributions of molecular analysis in 2012. Ann Endocrinol (Paris).
2012;73(3):155-164.
9. Enewold L, Harlan LC, Stevens JL, Sharon E. Thyroid Cancer Presentation and Treatment in the United States. Annals of Surgical Oncology.11/2014; DOI: 10.1245/ s10434-014-4209-1.
10. La Vecchia C, Malvezzi M, Bosetti C, Garavello W, Bertuccio P, Levi F, Negri E. Thyroid cancer mortality and incidence: a global overview. Int J Cancer.
2015;136(9):2187-2195.
11. Rahib L, Smith BD, Aizenberg R, Rosenzweig AB, Fleshman JM, Matrisian LM. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Res. 2014;74(11):2913-2921.
12. Li N, Du XL, Reitzel LR, Xu L, Sturgis EM. Impact of enhanced detection on the increase in thyroid cancer incidence in the United States: review of incidence trends by socioeconomic status within the surveillance, epidemiology, and end results registry, 1980-2008. Thyroid. 2013;23(1):103-110.
13. Pardo C, Cendales R. Incidencia estimada y mortalidad por cáncer en Colombia 2002-2006. Bogotá; Instituto Nacional de Cancerología; 2010.
14. Colombia. Ministerio de la Protección Social. Plan Nacional para el control del cáncer en Colombia 2010-2019.
15. Situación del cáncer en el Departamento de Antioquia.
Análisis de la información preliminar, años 2007-2009. Registro Poblacional de Cáncer de Antioquia (RPCA).
16. Pardo C. Sistemas de información en cáncer: Bases para la planeación en salud. Vigilancia del Cáncer en Colombia. Bogotá:Instituto Nacional de Cancerología;
2011.
17. Arias N. Registros poblacionales de cáncer: avances en Colombia, Chile y Brasil. Rev. Fac. Nac. Salud Pública 2013;31(1):127-135.
18. Curado MP, Edwards B, Shin HR, Storm H, Ferlay J, Heanue M, Boyle P. Cancer incidence in five continents. IX. IARC Press; Lyon, France: 2007. Published by the International Agency for Research on Cancer.ISBN 97892832 21609.
19. Bravo LE, Collazos T, Collazos P, García LS, Cor- rea P.Trends of cancer incidence and mortality in Cali, Colombia 50 years experience. Colomb Med.2012;43(4):246-255.
20. Peña-Echavarría MZ, Idárraga-Granda EJ. “Indica- dores básicos, Departamento del Cauca, República de Colombia, 2010” Colombia: OPS, Publicación
2010. ISSN 2027-6478.
21. Dane, Proyecciones nacionales y departamenta- les de población 2006-2020. www.dane.gov.co/ files/investigaciones/población/proyepobla06–
20/7proyecciones–pob.pdf.
22. Ministerio de Salud, Instituto Nacional de Salud, Instituto Colombiano de Bienestar Familiar, Socie- dad Colombiana de Endocrinología, UNICEF-OPS/ OMS, Colciencias. Prevalencia de los Desórdenes por Deficiencia de Yodo e Ingestión Promedio de Sal. Colombia, 1994-1998. Santa Fe de Bogotá, D.C., primera edición; noviembre de 2001. ISBN
958-13-0129-1.
23. WHO/UNICEF/ICCIDD. Assessment of iodine de- ficiency disorders and monitoring their elimination: a guide for programme managers [updated 1st September 2008]. 3rd edn. Geneva, Switzerland: World Health Organization, 2007.
24. Knobel M, Medeiros-Neto G. Relevance of iodine intake as a reputed predisposing factor for thyroid can- cer. Arq Bras Endocrinol Metab.2007;51(5):701-712
25. Harach HR, Williams ED. Thyroid cancer and thyroid- itis in the goitrous region of Salta, Argentina, before and after iodine prophylaxis. Clin Endocrinol (Oxf).
1995;43(6):701-706.
26. Harach HR, Escalante DA, Day ES. Thyroid cancer and thyroiditis in Salta, Argentina: a 40-yr study in relation to iodine prophylaxis. Endocr Pathol.
2002;13(3):175-181.
27. Sehestedt T, Knudsen N, Perrild H, Johansen C.
Iodine intake and incidence of thyroid cancer in
Denmark. Clin Endocrinol (Oxf). 2006;65(2):229-233.
28. Sun X, Shan Z, Teng W. Effects of increased iodine intake on thyroid disorders. Endocrinol Metab (Seoul).
2014;29(3):240-247.
29. Buzduga C, Mogoş V, Găleşanu C, Vulpoi C, Un- gureanu M, Cristea C, Preda C, Ciobanu D, Ferariu D, Florea N, Zbranca E. Epidemiology and histology of malignant thyroid nodules in North East Region of Romania (Moldavia) before and after alimentary salt universal iodination. Rev Med Chir Soc Med Nat Iasi. 2011;115(1):45-48.
30. Dong W, Zhang H, Zhang P, Li X, He L, Wang Z, Liu Y. The changing incidence of thyroid carcinoma in Shenyang, China before and after universal salt iodization. Med Sci Monit. 2013;19:49-53.
31. Teng W, Shan Z, Teng X, Guan H, Li Y, Teng D, Jin Y, Yu X, Fan C, Chong W, Yang F, Dai H, Yu Y, Li J, Chen Y, Zhao D, Shi X, Hu F, Mao J, Gu X, Yang R, Tong Y, Wang W, Gao T, Li C. Effect of iodine intake on thyroid diseases in China. N Engl J Med.
2006;354(26):2783-2793.
32. Gomez Segovia I, Gallowitsch HJ, Kresnik E, Kum- nig G, Igerc I, Matschnig S, Stronegger WJ, Lind P. Descriptive epidemiology of thyroid carcinoma in Carinthia, Austria: 1984-2001. Histopathologic features and tumor classification of 734 cases under elevated general iodination of table salt since 1990: population-based age-stratified analysis on thyroid carcinoma incidence. Thyroid. 2004;14(4):277-286.
33. Pettersson B, Coleman MP, Ron E, Adami HO. Iodine supplementation in Sweden and regional trends in thyroid cancer incidence by histopathologic type. Int J Cancer.1996;65:13-19.
34. Galanti M, Sparen P, Karlsson A, Grimelius L, Ekbom A. Is residence in areas of endemic goiter a risk factor for thyroid cancer? Int J Cancer.1995;61:615-621.
35. Zahl PH, Jorgensen KJ, Gotzsche PC. Overesti- mated lead times in cancer screening has led to substantial underestimation of overdiagnosis. Br J Cancer.2013;109:2014-2019.
36. Hall SF, Irish J, Groome P, Griffiths R. Access, ex- cess, and overdiagnosis: the case for thyroid cancer. Cancer Med.2014;3(1):154-161.
37. Esserman LJ, Thompson IM, Reid B, Nelson P, Ransohoff DF, Welch HG, Hwang S, Berry DA, Kinzler KW, Black WC, Bissell M, Parnes H, Srivastava S. Addressing overdiagnosis and overtreatment in cancer: a prescription for change. Lancet Oncol.
2014;15(6):234-242.
Recibido: Abril 2, 2015
Aceptado: Abril 16, 2015
Correspondencia: Hernando Vargas Uricoechea hernandovargasuricoechea@gmail.com