CONCEPTOS ACTUALES SOBRE NEFROPATÍA DIABÉTICA
Germán Durán Avendaño1, Germán Gamarra Hernández2, Alfredo Jácome3
RESUMEN
La enfermedad renal del diabético –o nefropatía diabética– es una de las causas más importantes de mortalidad, de enfermedad renal terminal, de terapia de suplencia renal (diálisis y trasplante) y se asocia con una mala calidad de vida. Por lo general el paciente involucrado padece diabetes mellitus por más de 10 años, presenta micro o macroalbuminuria antes de desarrollar una disminución de la filtración glomerular, muestra signos característicos en el estudio de la biopsia renal y puede presentar signos clínicos de daño en otros órganos como en la retina o en los nervios periféricos.
Actualmente la nefropatía diabética se diagnostica de una manera precoz por medio de tamizajes anuales de microalbuminuria y determinaciones de creatinina sérica en los diabéticos, renoprotección con inhibidores del sistema renina-angiotensina-aldosterona, tratamiento de la hipertensión arterial y control de la glicemia a largo plazo, además de los enfoques característicos en la educación del diabético, programas de ejercicio físico, manejo nutricional con dietas balanceadas y fraccionadas, reducción de azúcares refinados, reducción de la ingesta de sodio, de proteínas –o intercambio de algunas de estas por proteínas de origen vegetal– e insulinoterapia –a menudo con un régimen intensivo– para control adecuado de la glicemia.
Palabras clave: Diabetes mellitus, enfermedad renal crónica, enfermedad renal terminal, neropatía diabética, insulina, inhibidores de la ECA, sistema renina-angiotensina-aldosterona, antagonistas del receptor de angiotensina II, bloqueadores de la renina, estatinas, terapia de suplencia renal.
1 MD, Internista-Nefrólogo, Asociación Médica de los Andes. Miembro de Número de la Asociación Colombiana de Nefrología y
Miembro Correspondiente, Academia Nacional de Medicina, Bogotá.
2 MD, MSc. Internista-Nefrólogo, Profesor Titular, Universidad Industrial de Santander. Miembro de Número, Academia Nacional de
Medicina.
3 MD, FACP. Internista-Endocrinólogo. Miembro Honorario, Asociación Colombiana de Endocrinología, Diabetes y Metabolismo, Miembro de Número, Academia Nacional de Medicina, Bogotá.
CURRENT CONCEPTS ON DIABETIC NEPHROPATHY
ABSTRACT
Diabetic kidney disease, or diabetic nephropathy, is a most important cause of mortality in end- stage renal disease, renal substitution therapy (dialysis and transplantation) and is associated with poor quality of life. Usually, the patient presents diabetes mellitus for over 10 years, with micro or macroalbuminuria before developing a decrease in glomerular filtration, showing characteristic findings in the study of renal biopsy. They also may have clinical signs of damage to other organs such as the retina or peripheral nerves. Currently, early diagnosis is made through annual screening of microalbuminuria and of serum creatinine levels in known diabetics. Ne- phroprotection with inhibitors of the renin-angiotensin-aldosterone system, treatment of high blood pressure and glycemic control in the long term, besides the characteristic approaches of diabetic education, exercise programs, nutritional management with balanced and fractionated diets, reducing refined sugars, sodium, proteins, or exchanging some of them for vegetal proteins. Insulin therapy is necessary, often with an intensive regime for adequate glycemic control.
Key words: Diabetes mellitus, chronic renal disease, end stage renal disease, diabetic nephropathy, insulin, ACE inhibitors, angiotensin II receptor blockers, renin antagonists, statins, renal substitution therapy.
INTRODUCCIÓN
La Nefropatía Diabética (ND) es la causa principal de insuficiencia renal en el mundo y el predictor más fuerte de mortalidad en los pacientes con Diabetes Mellitus (DM). La tasa anual de mortalidad es del 20% aproximadamente. La epidemia global de obesidad –en particular en América Latina y entre los hispanos que viven en los Estados Unidos– conduce a una mayor incidencia de DM tipo 2, y por ende, de ND. Por esta razón se ha revisado el tema –pero no de manera exhaustiva– aunque arroja nuevos conceptos en este campo, especialmente en lo relacionado con las nuevas terapias.
FISIOPATOLOGÍA
La ND es una enfermedad que involucra genes e interacciones ambientales. El control estricto de la glucosa significativamente disminuye su incidencia, lo que indica que las alteraciones metabólicas inducidas por la hiperglicemia, incluyendo los cambios en la utilización de la energía y la disfunción mitocondrial, juegan un papel crítico en la iniciación de la enfermedad. El control de la hipertensión arterial (HTA), especialmente con medicamentos que inhiben el sistema renina-angiotensina-aldosterona (SRAA), es efectivo para retardar la progresión de la enfermedad. Mientras que la ND se considera una complicación microvascular de la DM, la evidencia creciente indica que la pérdida de podocitos y la disfunción epitelial juegan un papel importante. La inflamación, hipertrofia de las células, y la desdiferenciación (proceso que hace que una célula diferenciada pueda “volver” a un estado menos diferenciado dentro de su mismo linaje) por la activación de las vías clásicas de la regeneración, contribuyen aún más a la progresión de la enfermedad (1).
El medio metabólico alterado (hiperglicemia, hiperlipidemia, y resistencia a la insulina) da inicio a la ND (figura 1). De hecho, estudios muy conocidos como el DCCT (Estudio del Control de la Diabetes y de sus Complicaciones) establecieron que el control estricto de la glucosa, o sea, bajando el nivel de la hemoglobina glicosilada (HbA1c) hasta un 7%, frente al 9% inicial, reduce el desarrollo de la ND en más del 50% en los pacientes con Diabetes Mellitus tipo 1 (DM 1) (2,3).
Figura 1. Diagrama esquemático sobre la patogénesis de la nefropatía diabética. La hiperglicemia activa la vía de los polioles, produce hiperfiltración glomerular, activa el sistema renina-angiotensina-aldosterona, aumenta la glicosilación avanzada de las proteínas (AGE), aumenta las especies oxígeno-reactivas (ROS), activa la vía del diacilglicerol (DAG)/proteína cinasa C (PKC), y un aumento del Factor de Crecimiento Transformador beta (Tgfb) lleva a respuestas celulares anormales, tales como superproducción de matrices extracelulares e inflamación del riñón. La diabetes también afecta la producción del óxido nítrico (NO), Angiopoyetina 2 (Angpt2) y glicocáliz de las células endoteliales glomerulares y lleva a lesión endotelial. En los podocitos, la reducción de la expresión del factor de crecimiento endotelial vascular A (VEGFA) aumenta el objetivo del mecanismo de la señalización de la rapamicina (mTOR), mientras que la resistencia a la insulina produce disfunción de los podocitos, lo que lleva a desprendimiento de estos podocitos y apoptosis. Además, la fibrosis túbulo-intersticial también juega un papel significativo. Estos tipos celulares están estrechamente conectados, y la disfunción de un compartimiento puede diseminarse a otros tipos celulares. (Adaptado de Maezawa Y, Takemoto M, Yokote K. Cell biology of diabetic nephropathy: Roles of endothelial cells, tubulointerstitial cells and podocytes. J Diabetes Investig. 2015; 6(1):3-15) |
Los grandes ensayos clínicos recientes (AC- CORD, VADT, ADVANCE) no mostraron sin embargo un beneficio estadísticamente significativo por la reducción de la HbA1c a menos del 7% en los pacientes con DM tipo 2 (DM 2) (4). Estos resultados –aunque inesperados– indican que la hiperglicemia desempeña un papel crítico en la iniciación de la ND, pero que su papel en el control de la progresión necesita ser mejor definido. Un problema en la interpretación puede ser que los pacientes con DM 2 podrían haber experimentado años de alteraciones metabólicas antes de ser diagnosticados con diabetes, lo que puede contribuir a la aparición de la ND, incluso antes de recibir el diagnóstico de DM 2 (4-6). Esto se ha llamado “memoria metabólica“.
El aumento de especies reactivas de oxígeno (ROS, sigla en inglés), que contienen tanto radicales de oxígeno como otros que pueden fácilmente convertirse en radicales libres, y –entre el primer grupo– la generación de superóxido por las mitocondrias disfuncionales en la diabetes, ha sido postulado como el evento iniciador primario en el desarrollo de las complicaciones diabéticas (7,8). Hay dos sitios principales dentro de la mitocondria, donde puede ocurrir una fuga de electrones para producir superóxido, a saber, NADH deshidrogenasa (complejo I) y el complejo III (9). Limitar esta generación y los antioxidantes ROS ha sido muy eficaz en la reducción del desarrollo de la ND en diferentes modelos animales (10). Infortunadamente, los efectos beneficiosos de los antioxidantes no se han traducido en éxito terapéutico para los pacientes (11).
En la ND temprana (alteraciones producidas en el riñón cuando su glicemia filtrada persiste en 200 microgramos/minuto o en una muestra parcial de orina), la relación de albúmina con la creatinina excretada en ese mismo día pasa de 30 miligramos de albuminuria, siendo este el tope para el hombre en condiciones normales, y 20 miligramos el tope para una mujer en condiciones normales. En un comienzo hay hiperfiltración y luego se normaliza. Cuando pasa de 30 miligramos se denominaría microalbuminuria y cuando se excede de los 500 miligramos ya se denomina proteinuria (o macroalbuminuria), y se presenta disminución de la filtración glomerular. Un paciente con más de 500 miligramos/24 horas tiene ND.
EPIDEMIOLOGÍA
Las estadísticas de pacientes con ND oscilan entre el 30 y el 50% de la población en diálisis. Se trata de diabéticos a quienes les ha progresado su nefropatía y en Colombia tenemos 500 pacientes por millón de habitantes. En los Estados Unidos, Japón y en los países avanzados, son 1.300 personas por millón de habitantes en terapias de reemplazo de la función renal, vale decir en diálisis. En los Estados Unidos, alrededor de 200.000 pacientes reciben atención por Falla Renal Terminal (ESRD, por sus siglas en inglés) debido a ND, con 50.000 nuevos pacientes que inician diálisis cada año (1).
La retinopatía va de la mano de la ND (“la retina es el espejo del riñón”). Actualmente sabemos que casi todo diabético desarrolla retinopatía y neuropatía con el tiempo, pero solo el 30-40% de pacientes con DM 1 y entre 15-20% de aquellos con DM 2 llegan a tener ND después de 20 años de sufrir la enfermedad. Sin embargo, el número de casos observados en DM 2 es considerablemente mayor, ya que esta forma de DM es mucho más común que la DM 1.
PATOLOGÍA
Paul Kimmelstiel (1900-1970) y Clifford Wilson (1906-1997) describieron por primera vez la enfermedad de Kimmelstiel-Wilson, glomerulosclerosis nodular intercapilar o glomerulohialinosis, lesión patognomónica de la ND, aunque la más común es la glomerulosclerosis difusa. La glomerulosclerosis nodular puede cursar clínicamente como un síndrome nefrótico (figura 1) (12). La hipertrofia y proliferación celulares hacen que a menudo los riñones de los pacientes con ND estén aumentados de tamaño.
El Comité de Investigación de la Sociedad de Patología Renal comisionó a patólogos americanos y europeos expertos en el tema, para que hicieran una clasificación de los cambios histopatológicos observados en nefropatía diabética. Aunque ellos reconocen que los cambios túbulo-intersticiales y vasculares son también importantes y por sí solos pueden llevar a IRC, les parece más significativo hacer la clasificación basados en las lesiones glomerulares. Así ellos propusieron 4 clases: Una primera, en que se observa engrosamiento de la membrana basal. La segunda incluye expansión del mesangio. En la tercera se pueden observar lesiones de Kimmelstiel–Wilson y ya en la cuarta, glomérulosclerosis global. El problema consiste en la falta de correlación con la clínica y con el pronóstico de la enfermedad.
FACTORES QUE AFECTAN LA PROGRESIÓN
La ND afecta a un tercio de la población de DM 1 o DM 2. Los factores que afectan la progresión de la enfermedad incluyen la excreción de albúmina de acuerdo con la edad, la duración de la DM, el tabaquismo, el control adecuado o no de la glicemia, el nivel de colesterol y el uso de Inhibidores de la Enzima Convertidora de la Angiotensina (IECA), moléculas que a partir del captopril en el año 1979 se han venido utilizando, con el desarrollo posterior de los antagonistas de receptores de la angiotensina II (ARA II) y ahora, los bloqueadores de renina. Para el año 2050 la prevalencia de la DM se incrementará con implicaciones socio-económicas, especialmente en los países en vía de desarrollo. La prevalencia global de la ND en los adultos se estima que se elevará de un 6.4% (285 millones de pacientes) en el 2010 a 7.7% (439 millones de pacientes) en el 2030. Este incremento será mayor en los países en vías de desarrollo (69%) comparado con los países desarrollados (20%). Esto se dará en más del 90% de países muy poblados como China o India y este incremento se verá en nefrópatas por DM 2.
Figura 2. Biopsia renal con coloración PAS, vista con microscopía de luz, que muestra varios nódulos hialinos en un glomérulo de un paciente diabético de larga data, lesión denominada glomerulosclerosis intercapilar (nodular) o enfermedad de Kimmestiel-Wilson. En la parte inferior derecha se observa una arteriola engrosada, típica de arteriolosclerosis hialina vista también en riñones diabéticos. (http://library. med.utah.edu/WebPath/RENAHTML/RENAL028.html) |
El estudio Joslin en 79 pacientes con DM 1, inicialmente normoalbuminúricos, desarrollaron microalbuminuria y ERC, especialmente en grupos de avanzada edad, estados 4 y 5; la desarrollaron en 12 años, en un 29%. De este 29%, la mitad nunca tuvo proteinuria o regresaron a normoalbuminuria (9 pacientes), probado por biopsia renal que tenía ND. Las causas se encuentran aún en investigación (13).
Para llegar a una ND terminal no es necesario que el paciente pase por la etapa de proteinuria. Es cierto que en el pasado prevalecía la visión de que la DM 2 se debía a lesiones en el glomérulo, con una caracterizada progresión de la microalbuminuria a la proteinuria y a la enfermedad renal crónica (ERC). Ahora se han encontrado pacientes que llegan a diálisis sin proteinuria, y se ha establecido más allá de toda duda que existe un tipo de nefropatía diabética no-proteinúrica que puede ser el resultado de la enfermedad microvascular, como lo sugiere la observación de microinfartos cerebrales en la Resonancia Magnética Nuclear (RMN) con predicción subsiguiente de pérdida de la función renal.
Un hallazgo similar de disminución de la filtración glomerular (FG) con normo-albuminuria fue confirmado en DM 1 y DM 2, 30% con FG
<60 m/min/1.73 m2 (preponderancia en mujeres) sin albuminuria y sin retinopatía diabética, en un estudio representativo nacional por el NHANES (14). Un 55% de personas con FG<60 ml/min/1.73 m2 y persistente excreción normal de albúmina urinaria en una cohorte australiana, reprodujo lo que los norteamericanos habían encontrado en una muestra representativa de personas con DM 2 (15).
Se ha observado albuminuria muy pronunciada en diabéticos sin IECA, comparados con pacientes que tomaban enalapril, según un trabajo del Grupo de Familias de Gargano, Italia (16). En estos últi- mos, hubo una reducción del 50 % en la excreción de albúmina. La HbA1c debe estar en menos de 6 en las personas normales y en menos de 7, en diabéticos; la dosis de insulina se debe disminuir en el paciente con ERC. A los pacientes diabéticos se les pusieron 5 metas (Tabla 1). A los que cumplían menos de 3 metas, se les iban aumentando las lesiones y para los pacientes que cumplían 3 o más de estas metas, eran muy pocas las complicaciones después de 25 meses.
El mismo grupo estudió la relación entre la resistina sérica, la rata albúmina/creatinina urinaria (ACR) y la FG en 635 personas blancas, no diabéticas y no tratadas, encontrando que los niveles de resistina estaban independientemente asociadas con ACR y con FG en este grupo de pacientes, teniendo en cuenta que la resistina y la FG comparten algunos antecedentes genéticos. Su estudio sugiere fuertemente que la resistina juega un papel en la modulación de la función renal (17).
Como los pacientes con enfermedad renal terminal (ERT) presentan anemia severa por deficiencia de eritropoyetina (EPO), edema, falla cardiaca y la diálisis generalmente mejora estos problemas, no se conoce aún cuál es el tiempo óptimo para iniciar la diálisis en estos enfermos, lo que hay que investigar porque se ha sugerido que un comienzo temprano podría ser dañino, y aumentaría el riesgo de muerte. Investigadores japoneses se pusieron en la tarea de averiguar qué factores de riesgo de diálisis temprana podría haber en pacientes con ND. De 52 pacientes, 19 estaban en diálisis temprana y 33, en diálisis tardía. Se observó una asociación significativa de diálisis temprana y edad superior a los 65 años, y la aparición de neumonía, por lo que ellos recomiendan reforzar la vacunación contra neumococo en pacientes mayores, para evitar la diálisis temprana (18).
PATOGÉNESIS DE LA NEFROPATÍA DIABÉTICA
Esta es multifuncional. Tienen que ver en ella la HTA, el metabolismo anormal de los carbohidratos, metabolismo anormal de los lípidos, acumulación de lípidos, regulación de factores profibróticos (renina, angiotensina II, factor beta transformador del crecimiento y factor de crecimiento endotelial vascular), citocinas inflamatorias (FNT, interleukina 1 β, quimioatracción MM), incremento del estrés oxidativo, incremento en la producción de productos avanzados de la glicosilación (1, 19).
MANEJO DE LA DIABETES
Esto se hará según el estado en que se encuentre el paciente. Si es normotenso y no tiene albuminuria alta, se requiere controlarle la hiperglicemia y la presión arterial. Cuando ya empieza a notarse una albuminuria persistente, se deben dar IECA o ARA II. Si el paciente pasa ya a un estado 3 de la ND, hay que dar IECA más ARA II, o más un diurético, combinados con una dieta y se deben añadir otros antihipertensivos (no se deben dar IECA/ARA II si la creatinina es superior a 3 mg/dl, pero se puede usar un diurético de asa, como la furosemida). Si hay proteinuria (o hiperlipidemia), añadir una estatina. Si prevenimos la ND, controlar la glicemia; los pacientes tratados con terapia convencional con agentes orales deben pasar a insulina, o a un esquema agresivo de insulinoterapia (Tabla 1).
|
Una revisión sistemática con metaanálisis realizada para evaluar los beneficios y daños de la insulinoterapia intensiva versus convencional en pacientes con DM 1, incluyó 18 ensayos clínicos aleatorios con 2254 participantes. Todos los ensayos tuvieron alto riesgo de sesgo. No hubo un efecto significativo sobre la mortalidad en la terapia intensiva, pero puede haber efectos benéficos en el aspecto macrovascular y en la nefropatía, aunque este enfoque tiene efectos perjudiciales por hipoglicemia grave (20).
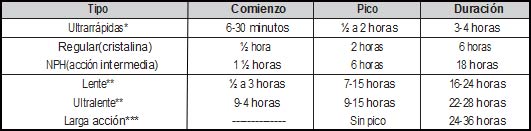
La aplicación convencional de la insulina es cada doce horas, iniciando con 10 unidades antes del desayuno y comida, bien NPH o 70/30. Se puede iniciar administrando 0,3 U/kg/peso –pasando paulatinamente a una dosis de 0,5/0,6 mg/kg/peso diarios y distribuyendo 2/3 de la dosis antes del desayuno, y 1/3 antes de la cena, y una proporción rápida/NPH de 1/3 antes del desayuno y 1/2 antes de la cena. Teniendo en cuenta que para un adulto de 65-70 kg, la dosis total es usualmente de unas 40 unidades diarias (25 en a.m., 15 en p.m.), de las veinticinco unidades de la mañana podrían ser aproximadamente 20 de NPH y 5 de cristalina, y de las quince de la noche, 10 de NPH y 5 de cristalina. Cuando las glicemias postprandiales están >180 mg/ dL, es conveniente utilizar la mezcla 70/30. Estas dosificaciones son algo empíricas, pues dependen del grado de absorción y de la sensibilidad de los receptores (que tienen que ver con el peso, con medicamentos, etc.). Lo importante es cumplir con la meta de obtener hemoglobinas glicosiladas de <7%, o glicemia en ayunas normales y postprandiales un poco más altas (21).
En quienes se va incrementando la microalbuminuria, se debe usar terapia intensiva en lugar de terapia estándar de insulina. En este caso, para cuatro inyecciones diarias (y el correspondiente monitoreo), dar el 50% de la dosis como insulinas glargina o detemir, una vez al día; además, insulina de acción rápida, 20% antes del desayuno, 15% antes del almuerzo y otro 15% antes de la comida (Tabla 2).
La terapia intensiva tiene más riesgo de hipoglicemia. Cada vez es más frecuente el uso de modernas bombas de infusión continua de insulina para enfermos con DM 1, en los que el medicamento se administra de acuerdo con la ingesta, el ejercicio y los niveles de glicemia, con buenos resultados por el entrenamiento adecuado que los pacientes reciben. Es conveniente recordar que los requerimientos diarios de insulina se reducen en pacientes con falla renal. La hipertensión arterial también debe manejarse agresivamente, para proteger la función renal.
INHIBIDORES DEL SISTEMA RENINA- ANGIOTENSINA-ALDOSTERONA
Los fármacos que inhiben el SRAA han demostrado su eficacia en el tratamiento de la hipertensión, la isquemia coronaria, la insuficiencia cardiaca o la nefropatía diabética y son de elección en las estrategias terapéuticas para reducir el riesgo cardiovascular y se usan para retardar el comienzo o disminuir la progresión de la ND (22-25). Hasta ahora solo había dos posibilidades para inhibir el SRAA, usar los IECA o los ARA-II. Recientemente se ha introducido en terapéutica el grupo de los inhibidores directos de la renina por vía oral, cuyo primer representante es el aliskiren, aprobado para el tratamiento de la hipertensión arterial (26). Esto es importante porque la inhibición de la renina se plantea como la forma más eficaz de bloquear el SRAA al actuar en su punto inicial, la transformación de angiotensinógeno en angiotensina I, paso limitante del sistema, sin afectar al metabolismo de las kininas ni producir fenómeno de escape, además de reducir la actividad de renina plasmática. Desde el punto de vista farmacológico, aliskiren se comporta como antagonista competitivo del angiotensinógeno en la renina, ya que ocupa el sitio activo de la enzima e impide que lo haga el angiotensinógeno y, por tanto su conversión en Angiotensina I (27, 28). El uso de inhibidores del SRAA debe suspenderse en pacientes con niveles de creatinina sérica superior a 3 mg/dL. Hay partidarios del manejo agresivo con una combinación de IECA y ARA II, aunque es necesario la observación cautelosa por el riesgo de hiperkalemia o de disminución de la filtración glomerular.
Tabla 2. Tipos de insulinas (tiempo aproximado de acción) * Aspártica, Lispro, Glulisin. |
Una revisión muy reciente sobre el tema del uso combinado de IECA y ARA II mostró que tanto en estudios experimentales como en humanos con ERC hay reducción de la proteinuria con prevención de la aparición de lesiones estructurales y de ESRD, de manera más efectiva que con una sola droga. El “Protocolo de Remisión Clínica” fue utilizado en humanos, y la efectividad de dosis máximas tolerables de la combinación medicamentosa fue particularmente notoria en ERC no diabética. Sin embargo los estudios ONTARGET para pacientes con riesgo cardiovascular aumentado y ALTITUDE, para enfermos con DM 2 y nefropatía declarada, la adición de un IECA o un inhibidor de renina al ARA II losartán no arrojó resultados superiores al uso aislado del losartán. El estudio VA NEPHRON D encontró que la terapia combinada de losartán y lisinopril disminuyó en un 34% el riesgo de reducciones predefinidas en la tasa estimada de filtración glomerular, ERT o muerte, en comparación con el uso de losartán solo en 1.448 pacientes con DM 2 y nefropatía manifiesta. Infortunadamente, el efecto del tratamiento no logró alcanzar una significación nominal (p = 0,07) debido a la interrupción prematura del estudio. Por lo tanto, el Protocolo de Remisión Clínica se considera la herramienta más poderosa para prevenir la progresión a ERT en la ERC proteinúrica no diabética. Los resultados del estudio VALID –actualmente en desarrollo– mostrarán si este enfoque se puede extender de forma segura a los pacientes con DM 2 (29).
TERAPIAS NUEVAS
No solo se debe controlar la glicemia sino también estrictamente la presión arterial y los factores de crecimiento profibrótico, que median el paso fibrótico en DM 1 y DM 2. El SRAA estimula factores de crecimiento implicados como efectores directores en fibrosis del glomérulo, como el factor de crecimiento tumoral β (30,31). En un estudio aleatorio con 77 pacientes y con Pirfenidona, pequeña molécula sintética con potente actividad antifibrótica, hubo mejoría de la tasa de filtración glomerular después de un año de estar usando Pirfenidona (32). Las moléculas Betaglicano y Decorin son anticuerpos neutralizantes del TGF-β (33). La Fluorofenodina, otro agente piridínico, ha sido estudiado en un modelo de células renales estimuladas por la AT II; reduce la producción de ROS e inhibe la expresión del TGF-β y es más potente que la pirfenidona (26). Una antraquinona (Rheína o ácido cásico) aislada del ruibarbo, mejora el daño renal, reduce la expansión de la matriz mesangial extracelular y en las células epiteliales (34, 35). Entre otras moléculas que inhiben la fibrosis tenemos el ácido antranílico (Tranilast) y la Bardoxolena; vale decir que la Bardoxolena creó una conmoción porque los resultados han sido de reversión, es decir, la recuperación de la FG en un trabajo con un seguimiento a un año, mostrando recuperación de entre 20 y 45 ml/min/1.73 m2, en un estudio doble ciego, aleatorizado (36). El Tranilast (ácido antranílico) suprime la síntesis de colágeno interfiriendo al TGF-β (37, 38).
OTROS NUEVOS PASOS
Cotransportadores de sodio y glucosa (SGLT2)
El SGLT2 es un transportador celular tubular proximal de baja afinidad y alta capacidad que reabsorbe la glucosa filtrada, o sea, al incrementar estos transportadores se van a incrementar los niveles de glucosa plasmática. Hay antagonistas como el Phlorizina y Sergliflozina, que van a evitar la absorción de glucosa y van a bloquear péptidos como el glucagón. Los antagonistas no específicos de los receptores SGLT2 proveen una interesante opción terapéutica para disminuir la carga de glucosa en diabetes (39). Los fármacos Daplaglifozina y Sergliflozina son inhibidores más específicos y están siendo estudiados (40).
La progresión y manifestaciones de la ND están asociadas a la activación del sistema inmune por lo que los investigadores han empleado múltiples estrategias para interferir con las redes de señales inflamatorias como el Toll-like receptor (TLR), factor de necrosis tumoral 2alfa (TNF), signal through (STAT-3) y otras citoquinas (41-44).
Medicina herbal
Existen plantas como la Tripterygium wilfordii Hook F que contienen sustancias inmunosupresoras, triptolida una de ellas, usada milenariamente en la China para la artritis y modernamente para diversas en patologías autoinmunes como la artritis reumatoide (en forma de triptolida o como extracto de la planta). Un estudio realizado en la China, sobre 45 pacientes con DM2, se dividió en 3 ramas; en uno de los grupos se administró Tripterygium wilfordii Hook F, en otro, ibesartán, y en un tercero, ambas sustancias. Como la aparición de podocitos urinarios se ha sugerido como un marcador temprano de actividad en nefropatía diabética, se encontró que la planta sola podría ser efectiva en la prevención de la lesión del podocito en la nefropatía diabética, mediada al menos parcialmente, por la regulación hacia debajo de la expresión del CTGF (“Connective Tissue Growth Factor”), OPN (Osteopontina) y TGFβ (“Transforming Growth Factor beta 1”).
Además, se expresó una acción sinergística cuando se combinó con el ibesartán (45). El qizhi jiangtang es un medicamento herbal chino que puede reducir efectivamente la proteinuria de pacientes con ND estado 3b, y retardar el progreso de la falla renal. Sus mecanismos de acción se relacionan con la reducción del ET-1, elevación del NO, mantenimiento del equilibrio dinámico de tromboxano A2/ prostaciclina (TXA2/PGI2) y la protección de las células endoteliales vasculares (46).
Micofenolato y pentoxifilina
El micofenolato mofetil (MMF) es un inmunosupresor que se utiliza en los trasplantados renales para evitar el rechazo. El MMF actúa sinergísticamente con los IECA y ARA II en el tratamiento de algunas nefropatías en animales de experimentación, por lo que se sugiere que combinándolos se pueda prevenir la progresión hacia ESRD de trasplantados crónicos, o en pacientes con nefropatías lúpicas o diabéticas (47). Estudios experimentales han demostrado acciones benéficas sobre el riñón cuando se logra una inhibición del TNF-alfa, como cuando se administra pentoxifilina, que ha demostrado efectos benéficos significativos en pacientes con nefropatía diabética (48).
Medicamentos para la gota
Los inhibidores de la xantina oxidasa (alopurinol) y la colchicina, están siendo estudiados en roedores para investigar su efecto en la progresión de la ND (49).
Receptores de hormonas nucleares como blanco terapéutico
Los análogos de la vitamina D (como el para calcitol), utilizados en el hipoparatiroidismo y en el hiperparatiroidismo, atenúan las lesiones renales en varios modelos animales, pues interfieren con el SRAA, que contribuye al daño del glomérulo, como ya hemos dicho. Con el fin de hacer claridad sobre el papel del receptor de vitamina D (VDR) en la fibrogénesis renal, se estudiaron dos grupos de ratones, uno deficiente en VDR mientras que el otro no lo era. Utilizando la técnica de la obstrucción unilateral ureteral por siete días, se observó un daño renal mucho más severo con atrofia tubular y fibrosis intersticial marcada en el primer grupo. La administración de losartán, un ARA II, redujo notablemente la lesión renal en estos ratones (50, 51). El receptor de la vitamina D atenúa la fibrosis renal, al suprimir el SRAA. La activación del VDR del podocito protege de la lesión renal diabética al suprimir el SRAA local en el podocito, bloqueando su apoptosis. La activación del V DR del macrófago inhibe –por la misma razón– la aterosclerosis.
El receptor nuclear intermedio en la vía del ácido mevalónico farnesoide X es activado por los ácidos biliares hidrofóbicos, se encuentra en hígado, intestino, glándulas adrenales y en mayor cantidad en el riñón. Su activación previene la ateroesclerosis en el receptor LDL e impide la calcificación vascular en ratones diabéticos con ERC (52). En ratones diabéticos con FXR suprimido hay incremento en proteinuria, glomérulo-esclerosis, fibrosis tubulointersticial, expansión mesangial, daño de podocitos, engrosamiento de la membrana basal glomerular, incremento de la infiltración de macrófagos, incremento de la expresión de SREBP 1 y 2 que resultan en incremento de la concentración de triglicéridos y colesterol en el riñón (53).
REGENERACIÓN RENAL: ¿ALGO PARA EL FUTURO?
Las células madre derivadas de la médula ósea fallaron en diferenciarse en células epiteliales renales y cuando se inyectaron en adipocitos a largo plazo se reportó esclerosis glomerular debido a la complejidad del riñón.
Recientemente se identificaron células progenitoras capaces de diferenciarse en podocitos y en células tubulares en el polo urinario de la cápsula de Bowman del riñón humano adulto. La evidencia sugiere que la evolución de desórdenes glomerulares depende del balance del daño y la regeneración de células madre renales lo cual representa una nueva herramienta promisoria para prevenir y tratar la glomeruloesclerosis (54).
EFECTOS DEL TRASPLANTE DE PÁNCREAS EN LA PREVENCIÓN Y REVERSIÓN DE LA NEFROPATÍA DIABÉTICA
El trasplante de páncreas (PTx) es el único tratamiento capaz de restaurar la normoglicemia sin exponer a los pacientes a los riesgos de hipoglicemias severas, lo cual permite examinar los efectos de la euglucemia a largo plazo en prevenir, detener o reversar la nefropatía diabética. La hipoglicemia es la parte más sombría en el diabético, marca un pronóstico terrible en cuanto a supervivencia.
El PTx, realizado simultáneamente o poco después del trasplante renal en pacientes con DM 1 previene la recurrencia de las lesiones de la glomerulopatía diabética en el riñón trasplantado. En humanos con DM 1 y PTx, se estudiaron antes del PTx, a los 5 años y a los 10 años, lesiones glomerulares leves a avanzadas y estas habían mejorado marcadamente a los 10 años, casi que desaparecido. La remodelación túbulo-intersticial también fue posible. (55)
PREVENCIÓN DE LA DIABETES
La prevención de la DM 2 es importante por todas las consideraciones en términos de calidad de vida y económicos (disfunción renal, cardíaca, visión, amputaciones e incrementos en la mortalidad).
Vemos cómo en muchos trabajos importantes, en los cuales fueron agrupados pacientes, estos requerían más de tres medicamentos para estar controlados. La monoterapia no es posible para que un paciente esté controlado, esta situación se ha visto en muchísimos estudios.
MODIFICACIÓN DEL ESTILO DE VIDA
Dieta y/o ejercicio
Según el estudio finlandés Diabetes Prevention Study (DPS) en 522 pacientes de edad media, obesos, con intolerancia a la glucosa, en el primer año habían perdido 4.2 kilos y a los 4 años habían reducido 58% la incidencia de diabetes. El estudio US Diabetes Prevention Program (DPP) aleatorizó
3234 pacientes con intolerancia a la glucosa en ayunas (95,4 mg/dL o más), en intervención intensiva en el estilo de vida y metformina comparadas con placebo e intervención estándar. En el grupo intensivo, se hicieron 140 minutos de ejercicio se- manal, dieta baja en calorías y grasas y consejería nutricional personalizada. La meta de pérdida de peso fue de 7% a las 24 semanas. El grupo intensivo redujo 58% la incidencia de DM 2 comparado con el otro grupo. Los que hicieron ejercicio, aunque no lograran las metas de pérdida de peso, redujeron
44% la incidencia de DM 2 y fue muy interesante encontrar que la efectividad de la intervención fue mayor en el grupo de 60-85 años (56).
Se observó en un estudio realizado en 13 países que –principalmente la nefropatía y menos la retinopatía– estuvo relacionada con niveles altos de triglicéridos y bajos de colesterol HDL, con buen control de colesterol LDL. Por consiguiente se sugiere hacer estudios sobre tratamiento para la dislipidemia en los pacientes diabéticos, con el fin de prevenir la enfermedad microvascular diabética (57).
En resumen, consideramos que la ND es una patología que se debe tener muy en cuenta por su frecuencia, por la morbimortalidad que causas, y por la carga económica que representa en el sistema colombiano de salud, ya de hecho agobiado con 25.000 pacientes en diálisis crónica, de los cuales cerca de la mitad lo están a causa de ND. A nuestro modo de ver, un problema es la falta de diagnóstico de DM en muchos pacientes que la tienen pero que no lo saben. En segundo lugar, la falta de educación sobre el tema, tanto en los diabéticos ya diagnosticados, como en los médicos generales mismos. Estos correctamente le sugieren al enfermo dieta y actividad física, más alguna sulfonilurea o metformina. Sin embargo, probablemente el seguimiento no incluye determinaciones de hemoglobina glicosilada (Hb A1C) cada tres meses, de determinación de microalbuminuria cada año, de revisión periódica de los ojos para detectar retinopatía, y sobre todo, no se resuelven a tratar al paciente con insulina, una vez que los antidiabéticos orales dejan de servir. Solo cuando presentan alguna descompensación seria, en el hospital se les inicia la insulina. Pero aun así no es frecuente que se logren estrictos controles de la glicemia y de la Hb A1C. Aunque es común que se prescriban IECA o ARA II para los diabéticos con microalbuminuria o albuminuria macroscópica, solo hasta que el paciente tenga niveles de creatinina superiores a 3 mg/dL se recomienda la visita al nefrólogo. Creemos que el enfermo diabético debe someterse a un protocolo preventivo de las complicaciones crónicas de la DM, buen manejo de la HTA, aproximación adecuada con la dieta y ejercicio, evitar agentes nefrotóxicos y mantener a raya las infecciones urinarias. Este manejo de prevención y promoción debe tener pleno apoyo de las EPS e IPS a cargo. De esta manera, se podría evitar o retardar la ERC y la terapia de suplencia renal.
REFERENCIAS
1. Reidy K, Kang HM, Hostetter T, Susztak K. Molecular mechanisms of diabetic kidney disease. J Clin Invest
2014; 124(6): 2333–2340.
2. Maezawa Y, Takemoto M, Yokote K. Cell biology of diabetic nephropathy: Roles of endothelial cells, tubulointerstitial cells and podocytes. J Diabetes Investig. 2015; 6(1):3-15.
3. Nathan DM, DCCT/EDIC Research Group. Diabe- tes control and complications trial: epidemiology of diabetes interventions and complications study at 30 years, advances and contributions. Diabetes. 2013;
62(12):3976–3986.
4. Dluhy RG, McMahon GT. Intensive glycemic control in the ACCORD and ADVANCE trials. N Engl J Med.
2008;358(24):2630–2633
5. Gerstein HC, Miller ME, Byington RP, Goff DC Jr, Bigger JT et al. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med. 2008;
358(24):2545–2559.
6. Patel A, MacMahon S, Chalmers J, Neal B, Billot L
et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med. 2008; 358(24):2560–2572.
7. Brownlee M. Biochemistry and molecular cell biology of diabetic complications. Nature. 2001;
414(6865):813–820.
8. Brownlee M. The pathobiology of diabetic com- plications: a unifying mechanism. Diabetes.
2005;54(6):1615–1625.
9. Forbes JM, et al. Deficiency in mitochondrial com- plex I activity due to Ndufs6 gene trap insertion induces renal disease. Antioxid Redox Signal. 2013;
19(4):331–343.
10. Susztak K, Raff AC, Schiffer M, Bottinger EP. Glucose- induced reactive oxygen species cause apoptosis of podocytes and podocyte depletion at the onset of diabetic nephropathy. Diabetes. 2006;55(1):225–233.
11. Golbidi S, Ebadi SA, Laher I. Antioxidants in the treatment of diabetes. Curr Diabetes Rev.
2011;7(2):106–125.
12. Kimmelstiel P, Wilson C. Benign and Malignant Hypertension and Nephrosclerosis: A Clinical and Pathological Study. Am J Pathol 1936; 12(1):45-82.
13. Perkins BA, Ficociello LH, Roshan B, Warram JH, Krolewski AS. In patients with type 1 diabetes and new- onset microalbuminuria the development of advanced chronic kidney disease may not require progression to proteinuria. Kidney Int. 2010; 77(1):57-64.
14. Lane PH, Steffes MW, Mauer SM. Glomerular struc- ture in IDDM women with low glomerular filtration rate and normal urinary albumin excretion. Diabetes.
1992; 41(5):581-6.
15. Thomas MC, Macisaac RJ, Jerums G, Weekes A, Moran J, Shaw JE, Atkins RC. Nonalbuminuric renal impairment in type 2 diabetic patients and in the gene- ral population (national evaluation of the frequency of renal impairment co-existing with NIDDM [NEFRON]
11). Diabetes Care. 2009; 32(8):1497-502.
16. De Cosmo S, Minenna A, Zhang YY, Thompson R, Miscio G et al. Association of the Q121 variant of ENPP1 gene with decreased kidney function among patients with type 2 diabetes. Am J Kidney Dis. 2009;
53(2):273-80.
17. Menzaghi C, Salvemini L, Fini G, Thompson R, Man- giacotti D et al. Serum resistin and kidney function: a family-based study in non-diabetic, untreated individuals. PLoS One. 2012; 7(6).
18. Mizuno T, Hayashi T, Kato R, Noguchi A, Hayashi HN
et al. Risk factors for an early dialysis start in patients with diabetic nephropathy end-stage renal disease. Ther Clin Risk Manag. 2014; 10:73-6.
19. Maezawa Y, Takemoto M, Yokote K. Cell biology of diabetic nephropathy: Roles of endothelial cells, tubulointerstitial cells and podocytes. J Diabetes Investig. 2015; 6(1):3-15.
20. Kähler P, Grevstad B, Almdal T et al. Targeting intensive versus conventional glycaemic control for type 1 diabetes mellitus: a systematic review with meta-analyses and trial sequential analyses of ran- domised clinical trials. BMJ Open 2014; 4:e004806.
21. Jácome-Roca A. Medicamentos para la diabetes tipo 2, lo nuevo y lo tradicional. Medicina (Bogotá)
2008; 30 (2): 102-110.
22. McMullan CJ, Lambers Heerspink HJ, Parving HH, Dwyer JP, Forman JP, de Zeeuw D. Visit-to-visit va- riability in blood pressure and kidney and cardiovas- cular outcomes in patients with type 2 diabetes and nephropathy: a post hoc analysis from the RENAAL study and the Irbesartan Diabetic Nephropathy Trial. Am J Kidney Dis. 2014; 64(5):714-22.
23. Karalliedde J, Maltese G, Hill B, Viberti G, Gnudi L. Effect of renin-angiotensin system blockade on soluble Klotho in patients with type 2 diabetes, sys- tolic hypertension, and albuminuria. Clin J Am Soc Nephrol. 2013; 8(11):1899-905.
24. Weil EJ, Fufaa G, Jones LI, Lovato T, Lemley KV et al. Effect of losartan on prevention and progression of early diabetic nephropathy in American Indians with type 2 diabetes. Diabetes. 2013; 62(9):3224-31.
25. Modulation of advanced glycation end products by candesartan in patients with diabetic kidney disea- se, a dose-response relationship study. Saha SA, LaSalle BK, Clifton GD, Short RA, Tuttle KR. Am J Ther. 2010; 17(6):553-8.
26. Morales Olivasa FJ, Yagoa LE. Aliskiren: el primer inhibidor directo de la renina introducido en terapéu- tica. Rev Esp Cardiol Supl. 2009; 9(A):41-8.
27. Lizakowski S, Tylicki L, Renke M, Rutkowski P, Heleniak Z et al. Effect of aliskiren on proteinuria in non-diabetic chronic kidney disease: a double-blind, crossover, randomised, controlled trial. Int Urol Ne- phrol. 2012; 44(6):1763-70.
28. Lizakowski S, Tylicki L, Renke M, Rutkowski P, He- leniak Z et al. Aliskiren and perindopril reduce the levels of transforming growth factor-β in patients with non-diabetic kidney disease. Am J Hypertens.
2012; 25(6):636-9.
29. Gentile G, Remuzzi G, Ruggenenti P. Dual Renin- Angiotensin System Blockade for Nephroprotec- tion: Still under Scrutiny. Nephron Physiol. 2015;
129(1):39-41.
30. Levin A, Beaulieu MC. Trials and tribulations of new agents, novel biomarkers, and retarding renal progression. J Am Soc Nephrol. 2011; 22(6):992-3.
31. Lv M, Chen Z, Hu G, Li Q. Therapeutic strategies of diabetic nephropathy: recent progress and future perspectives. Drug Discov Today. 2014; S1359-6446 (14): 00412-7.
32. Sharma K, Ix JH, Mathew AV, Cho M, Pflueger A et al. Pirfenidone for diabetic nephropathy. J Am Soc Nephrol. 2011; 22(6):1144-51.
33. Xiong X, Mei W, Xie Y, Liu J, Lu M et al. PLoS One.
2014; 27; 9 (10):e111242. Fluorofenidone offers improved renoprotection at early interventions during the course of diabetic nephropathy in db/db mice via multiple pathways.
34. Zheng JM1, Zhu JM, Li LS, Liu ZH. Rhein reverses the diabetic phenotype of mesangial cells over- expressing the glucose transporter (GLUT1) by inhibiting the hexosamine pathway. Br J Pharmacol.
2008; 153(7):1456-64.
35. Gao Q, Qin WS, Jia ZH, Zheng JM, Zeng CH, Li LS, Liu ZH. Rhein improves renal lesion and ameliorates dyslipidemia in db/db mice with diabetic nephropathy. Planta Med. 2010;76(1):27-33.
36. de Zeeuw D, Akizawa T, Audhya P, Bakris GL, Chin M et al. Bardoxolone methyl in type 2 diabetes and stage 4 chronic kidney disease. N Engl J Med. 2013;
369(26):2492-503.
37. Soma J, Sato K, Saito H, Tsuchiya Y. Effect of tra- nilast in early-stage diabetic nephropathy. Nephrol Dial Transplant. 2006; 21(10):2795-9.
38. Soma J, Sugawara T, Huang YD, Nakajima J, Kawa- mura M. Tranilast slows the progression of advanced diabetic nephropathy. Nephron 2002; 92 (3):693-698
39. Vallon V, Sharma K. Sodium-glucose transport: role in diabetes mellitus and potential clinical implications. Curr Opin Nephrol Hypertens 2010; 19 (5): 425-431.
40. Ghosh RK, Ghosh SM, Chawla S, Jasdanwala SA.
SGLT2 inhibitors: a new emerging therapeutic class in the treatment of type 2 diabetes mellitus. J Clin Pharmacol. 2012; 52(4):457-63.
41. Panchapakesan U, Pegg K, Gross S, Komala MG, Mudaliar H et al. Effects of SGLT2 inhibition in hu- man kidney proximal tubular cells--renoprotection in diabetic nephropathy? PLoS One. 2013; 8(2):e54442
42. Nielsen SE, Schjoedt KJ, Rossing K, Persson F, Schalkwijk CG et al. Levels of NT-proBNP, markers of low-grade inflammation, and endothelial dys- function during spironolactone treatment in patients with diabetic kidney disease. J Renin Angiotensin Aldosterone Syst. 2013; 14(2):161-6
43. Vlassara H, Uribarri J, Cai W, Goodman S, Pyzik R et al. Effects of sevelamer on HbA1c, inflammation, and advanced glycation end products in diabetic kidney disease. Clin J Am Soc Nephrol. 2012; 7(6):934-42
44. Adler SG, Schwartz S, Williams ME, Arauz-Pacheco C, Bolton WK et al. Phase 1 study of anti-CTGF monoclonal antibody in patients with diabetes and microalbuminuria. Clin J Am Soc Nephrol. 2010;
5(8):1420-8
45. Ma RX, Zhao N, Zhang W. [The effects and mecha- nism of Tripterygium wilfordii Hook F combination with irbesartan on urinary podocyte excretion in diabetic nephropathy patients]. Zhonghua Nei Ke Za Zhi. 2013; 52(6):469-73
46. Guo ZA, Yu CJ, Liu G, Meng FC, Li Y, Peng SL [Treatment of stage 3b diabetic kidney disease patients with macroalbuminuria by qizhi jiangtang capsule: a multicenter randomized control clinical study]. Zhongguo Zhong Xi Yi Jie He Za Zhi. 2014;
34(9):1047-52
47. Allison AC, Eugui EM. Mechanisms of action of mycophenolate mofetil in preventing acute and chronic allograft rejection. Transplantation. 2005 Oct
15;80(2 Suppl):S181-90
48. Navarro-González JF, Jarque A, Muros M, Mora C, García J. Tumor necrosis factor-alpha as a therapeu- tic target for diabetic nephropathy. Cytokine Growth Factor Rev. 2009 Apr;20(2):165-73
49. Liu P, Chen Y, Wang B, Zhang F, Wang D, Wang Y. Allopurinol treatment improves renal function in patients with type 2 diabetes and asymptomatic hy- peruricemia: 3-year randomized parallel-controlled study. Clin Endocrinol (Oxf). 2014 Nov 17. [Epub ahead of print]
50. Zhang Y, Kong J, Deb DK, Chang A, Li YC. Vitamin
D receptor attenuates renal fibrosis by suppressing the renin-angiotensin system. J Am Soc Nephrol
2010; 21(6):966-973
51. Krairittichai U, Mahannopkul R, Bunnag S. An open label, randomized controlled study of oral calcitriol for the treatment of proteinuria in patients with dia- betic kidney disease. J Med Assoc Thai. 2012; 95
Suppl 3:S41-7.
52. Miyazaki-Anzai S, Levi M, Kratzer A, Ting TC, Lewis LB, Miyazaki M. Farnesoid X receptor activation prevents the development of vascular calcification in ApoE-/– mice with chronic kidney disease. Circ Res 2010; 106 (12):1807-1817
53. Wang XX, Jiang T, Shen Y, Caldas Y, Miyazaki- Anzai S et al. Diabetic nephropathy is accelerated by farnesoid X receptor deficiency and inhibited by farnesoid X receptor activation in a type 1 diabetes model. Diabetes 2010; 59(11):2916-2927
54. Becker JU, Hoerning A, Schmid KW, Hoyer PF. Immi- grating progenitor cells contribute to human podocyte turnover. Kidney International 2008; 72(12):1468-73
55. Mauer M, Fioretto P Pancreas transplantation and reversal of diabetic nephropathy lesions. Med Clin North Am. 2013; 97 (1): 109-14
56. Yoon U, Kwok LL, Magkidis A. Efficacy of lifestyle interventions in reducing diabetes incidence in pa- tients with impaired glucose tolerance: a systematic review of randomized controlled trials. Metabolism.
2013; 62(2):303-14
57. Sacks FM, Hermans MP, Fioretto P, Valensi P, Davis T et al. Association between plasma triglycerides and high-density lipoprotein cholesterol and microvascular kidney disease and retinopathy in type 2 diabetes mellitus: a global case-control study in 13 countries. Circulation. 2014; 129(9):999-1008
Recibido: Febrero 20, 2015
Aprobado: Marzo 10, 2015
Correspondencia: Germán Duran Avendaño germanduran01@gmail.com
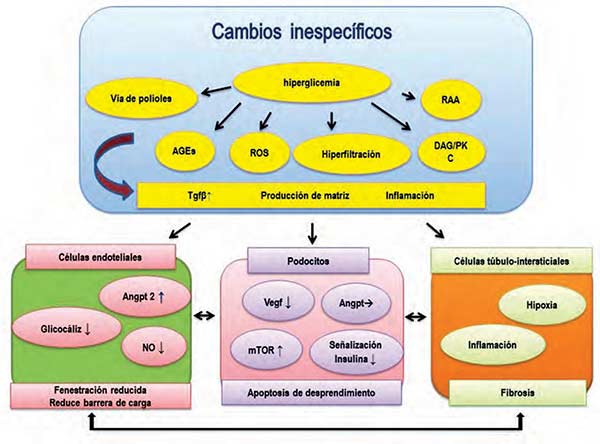
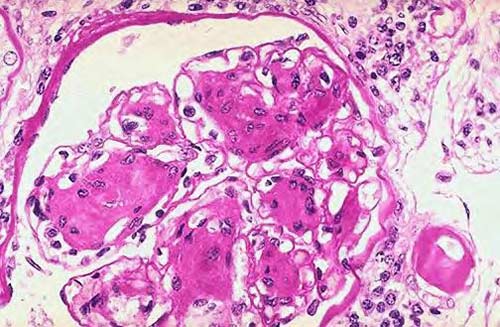
 Tabla 1. Cinco metas para el paciente con nefropatía
Tabla 1. Cinco metas para el paciente con nefropatía