ESTUDIOS DE PATOLOGÍA MOLECULAR UTILIZADOS PARA EVALUAR LA AMPLIFICACIÓN DEL ONCOGÉN HER2 EN CÁNCER DE MAMA. OPINIÓN CLÍNICA
Luz Fernanda Sua1, Juan Carlos Bravo2, William Franco3
RESUMEN
La importancia en la detección de la amplificación de oncogén HER2, es esencial en el cán- cer de mama puesto que estas pacientes no responden a los tratamientos de quimioterapia y hormonales convencionales, traduciéndose así en una menor sobrevida. La determinación del oncogén HER2 tiene un papel crucial como diana terapéutica del trastuzumab. A continuación describiremos estas metodologías las cuales son: la técnica de hibridación in situ fluorescente (FISH), la hibridación in situ cromogénica (CISH) y la técnica hibridación in situ cromogénica y con plata (Dual ISH), métodos usados para el estudio del oncogén HER2, en la selección correcta de las pacientes con cáncer de mama que son candidatas a recibir trastuzumab, teniendo una gran utilidad e impacto clínico.
Palabras clave: Amplificación HER2, Hibridación in situ fluorescente (FISH), Hibridación in situ cromogénica (CISH) e Hibridación in situ cromogénica y con plata (DISH).
1 Médico, ESP. Anatomía Patológica y Patología Clínica. Estudiante de Doctorado en Ciencias Biomédicas. Departamento de Patología y Medicina de Laboratorio. Patología Molecular. Fundación Valle del Lili. Universidad ICESI. Facultad de Salud. Cali, Colombia.
2 Médico, ESP. Anatomía Patológica. Jefe del Servicio de Patología. Departamento de Patología y Medicina de Laboratorio. Patología
Molecular. Fundación Valle del Lili. Universidad ICESI. Facultad de Salud. Cali, Colombia.
3 Médico, ESP. Oncología Clínica y Quimioterapia. Unidad de Cáncer. Fundación Valle del Lili. Universidad ICESI. Facultad de
Salud. Cali, Colombia.
MOLECULAR PATHOLOGY STUDIES USED TO EVALUATE THE HER2 ONCOGEN AMPLIFICATION IN BREAST CANCER. CLINICAL OPINION
ABSTRACT
The importance in detection of HER2 oncogene amplification is essential in breast cancer because these patients do not respond to standard chemotherapy and hormonal treatments, leading to a shorter survival. The determination of HER2 oncogene plays a crucial role as a therapeutic target for trastuzumab. Methodologies described herein are fluorescence in situ hybridization (FISH), chromogenic in situ hybridization (CISH) and enhanced with silver chromogenic in situ hybridization technique (Dual ISH), methods used to study HER2 oncogene in the proper selection of patients with breast cancer who are candidates for trastuzumab, being very useful and with good clinical impact.
Key words: HER2 amplification, fluorescence in situ hybridization (FISH), chromogenic in situ hybridization (CISH) and chromogenic and silver in situ hybridization (DISH).
El diagnóstico del cáncer de mama que actualmente hacemos los patólogos, no solo es morfológico y descriptivo, sino que define el tratamiento, al determinar los factores pronósticos y predictivos en los tumores mamarios. Actualmente contamos con nuevas metodologías comparables a la hibridación in situ fluorescente (FISH) para el estudio de la amplificación del oncogén HER2 y que tienen ventajas no solo morfológicas, sino costo efectivas, son automatizadas, tiene sensibilidad y especificidad similares al FISH, esta metodología es la hibridación in situ cromogénica y con plata Dual ISH o DISH. (1)
La importancia de la determinación del estado del oncogén HER2 radica en que aquellas pacientes con cáncer de mama que tienen la amplificación del oncogén HER2, presentan una resistencia mayor a los tratamientos convencionales de quimioterapia, al tratamiento hormonal y por lo tanto una tasa de supervivencia menor. (2)
El oncogén HER 2 (c-erbB-2) es miembro de la familia de receptores del factor de crecimiento epidérmico constituido por cuatro miembros: HER1 (erb-B1), HER2 (erb-B2), HER3 (erb-B3) y HER4 (erb-B4). El proto-oncogén HER2 está localizado en el cromosoma 17q y codifica para una glico-proteína transmembranal de 185 KDa, que posee actividad tirosin quinasa intrínseca.
El análisis del estado del oncogén HER2 es un requisito esencial para la selección de las pacientes tratadas con trastuzumab, un anticuerpo monoclonal humanizado de tipo IgG1 que se une de manera selectiva y eficiente al receptor del HER2. Este receptor está presente en grandes cantidades en la superficie de algunas células malignas, estimulando su crecimiento. Cuando el trastuzumab se une al HER2, se frena el crecimiento de estas células neoplásicas malignas y por lo tanto el desarrollo tumoral. Este fármaco solo debe ser empleado en tumores cuya sobrexpresión del HER2 haya sido determinada mediante un método exacto y validado. (3)
El oncogén HER2 se encuentra amplificado en alrededor del 20%-30% de los cánceres de mama, desempeñando un importante papel en su patogénesis y agresividad biológica.
Además en el estudio de la neoplasia metastásica del cáncer de mama se ha observado que en el 21% de los casos, estos tumores puede cambiar el estatus del HER2. Por ello, la determinación del estado del HER2 forma parte del diagnóstico anatomopatológico rutinario del cáncer de mama. (4,5)
Se debe realizar la amplificación de HER2 en los casos que resulten indeterminados (score 2+) por inmunohistoquímica (IHQ). El método FISH, CISH y DISH detectan la amplificación del gen y no el nivel de expresión de la proteína HER2 la cual se observa con IHQ. (6)
HIBRIDACIÓN IN SITU FLUORESCENTE (FISH)
La hibridación in situ con fluorescencia (FISH), es una técnica de citogenética molecular, que revolucionó el análisis cromosómico en la genética del cáncer, con ella se puede detectar simultáneamente cambios cromosómicos numéricos (aneuploidias) y estructurales (deleciones y translocaciones) en un locus especifico de protoocogenes, localizados en un mismo cromosoma o cromosomas diferentes.
Es una técnica que utiliza moléculas fluorescentes, llamadas fluorocromos, para poder localizar genes o fragmentos de DNA. La técnica consiste en preparar cortas secuencias de DNA de una sola hebra, estas son llamadas sondas, las que son complementarias de las secuencias de DNA a estudiar. (1)
Estas sondas son marcadas con fluorocromos y posteriormente se hibridan o unen al DNA complementario, permitiendo así localizar las secuencias en las que se encuentran. Se aplica sobre cortes de tejido o extensiones citológicas y se observa la fluorescencia al microscopio de epifluorescencia con filtros específicos. (7)
Existen tres kits disponibles Oncor®, PathVy-sion® y Dako®, estos dos últimos con marcaje centrómerico; estos utilizan una sonda locus específica para el gen HER2 y una segunda sonda centromérica para el cromosoma 17, realizándose un cociente entre el número de copias del oncogén HER2 y el de centrómeros del cromosoma 17 por núcleo celular para establecer el nivel de amplificación.
Los criterios de interpretación buscan disminuir la probabilidad de errores interpretativos. Se debe tener en cuenta:
• El corte del tumor con hematoxilina y eosina (H&E) debe seleccionar la zona del carcinoma invasor, el estudio no se realiza en áreas de carcinoma in situ.
• Inicialmente se evalúa el control, si no es adecuado se debe repetir la prueba.
• Se debe contar un mínimo de 20 células neoplásica en dos campos diferentes de carcinoma invasor.
Los criterios de amplificación según la guía de lectura recomendada por la ASCO/CAP del año 2013,(8) son:
Niveles normales o no amplificados:
Relación HER2/cromosoma 17 <2.0 y promedio de copias de HER2 <4.0 señales por célula.
Niveles equívocos:
Relación HER2/cromosoma 17 <2.0 y promedio de copias de HER2 >4.0 pero <6.0 señales por célula.
Niveles amplificados:
Relación HER2/cromosoma 17 >2.0 (sin importar el número de copias promedio de HER2) o promedio de copias HER2 >6.0 señales por célula (sin importar la relación HER2/cromosoma17). Las sondas de utilidad diagnóstica son:
• Sondas centroméricas: usadas para la detección de alteraciones numéricas y como control de referencia de la hibridación de sondas de locus específicos.
• Sondas especificas del locus: usadas para la detección de translocaciones, deleciones o amplificaciones, como sondas de fusión o sondas Split.
La principal ventaja del FISH es que se puede realizar en núcleos interfasicos sin tener que establecer cultivos celulares. Los cultivos de tumores sólidos presentan muchas dificultades especialmente con la proliferación celular in vitro, lo que afecta notoriamente el éxito de los estudios cromosómicos convencionales. Por lo tanto el FISH permite realizar un análisis citogenética molecular rápido, con una alta especificidad y sensibilidad en tejidos tumorales. (9)
No obstante, no todos los laboratorios de patología de hospitales y clínicas poseen los equipos requeridos o el personal capacitado necesario para realizar o interpretar los ensayos FISH por lo que su aplicación suele limitarse a laboratorios/centros de referencia.
HIBRIDACIÓN IN SITU CROMOGÉNICA (CISH)
Procedimiento alternativo más económico que FISH. Según las experiencias publicadas existe una buena correlación entre FISH y CISH. En ambas técnicas la preparación de la muestra y el método de hibridación son similares. La principal diferencia radica en el método de detección. (1)
La técnica CISH utiliza sondas de ADN marcadas con digoxigenina específicas para el locus del gen HER2 en el cromosoma 17q para hibridarla con los ácidos nucleicos complementarios presentes en la muestra de cáncer de mama.
La sonda marcada con HER2 se elabora usando la Subtraction Probe Technology (SPT™, Tecnología de sonda por sustracción), una técnica patentada y registrada que crea sondas específicas, eliminando significativamente las secuencias repetitivas que se encuentran en los ácidos nucleicos humanos.
La técnica CISH permite evaluar aberraciones genéticas bajo un microscopio de luz mediante detección cromogénica. Los resultados de tinción por CISH pueden verse claramente con un microscopio de luz estándar y una lente de 40x. El estado de amplificación del gen HER2 puede visualizarse en el contexto de la morfología del tejido circundante. (10)
En los criterios de amplificación por CISH se debe observar:
• >5 puntos, o grupos grandes, o una mezcla de múltiples puntos y grupos grandes, o mezcla de puntos múltiples y grupos pequeños, o grupos pequeños del gen HER2 presentes por núcleo en la mayoría (>50%) de las células cancerosas en el área de tejido elegida para la enumeración.
• Un grupo grande es un grupo de señales de forma irregular, que es 5 veces superior al diámetro de un solo punto. Como referencia deberá usarse un solo punto de las células epiteliales cancerosas o normales del mismo portaobjetos.
Un grupo pequeño es un grupo de señales de forma irregular, que tiene entre 3 y 5 veces el diámetro de un solo punto.
Sin amplificación:
• De 1 a 5 puntos del gen HER2 presentes por núcleo en una mayoría (>50%) de células cancerosas en el área de tejido elegida para la enumeración.
• Un solo punto tiene bordes lisos y redondeados, y se halla presente en células normales y cancerosas. (10)
En general, los resultados del CISH son coincidentes con FISH aunque existe una menor precisión en algunos casos que presentan una baja amplificación y polisomía del cromosoma 17.
Si se quiere estandarizar el número de cromosomas 17 se debe utilizar otro corte de tejido seriado y emplear una sonda específica para el centrómero
17. Por ello, con CISH no se puede estudiar de forma simultánea HER2 y el cromosoma 17 en todos los casos, como si ocurre con FISH. Aunque encontramos kits que permiten determinar tanto el HER2 y el cromosoma 17 en un mismo corte de tejido, estos no se encuentran hasta el momento aprobados por la FDA (Agencia gubernamental de control de alimentos y medicamentos de los EE.UU) para su determinación.
Encontramos kits disponibles como CISH Her2- DNA Zymed® o CISH SPOT-Light®, con los que se han realizado estudios comparativos con la técnica FISH. Pero solo se encuentra aprobado por la FDA el kit CISH SPOT-Light®.
En un estudio comparativo de FISH y CISH podemos ver que los resultados mostraron una concordancia del 99,0% en 206 casos analizados (IC 95%: 96,5%–99,9%), indicando una notable concordancia entre el Kit para HER2 mediante CISH SPOT-Light® y el análisis para HER2 de PathVysion®. (11)
Otro estudio muestra la concordancia global entre FISH y CISH 94,8% k 0,86 (165 de los 174 casos valorables con ambas técnicas). Sensibilidad de CISH (considerando FISH como Gold estándar) 97,5%; especificidad 94%; VPP 82,9%; VPN 99,2%. Concordancia interobservador global de CISH 97,5%(k 0,95) utilizando el kit Her2-DNA Zymed®. (11)
HIBRIDACIÓN IN SITU CROMOGÉNICA Y CON PLATA (DUAL-ISH)
Actualmente esta técnica se utiliza para el estudio de la amplificación del oncogén HER2, esta metodología utiliza el mismo principio básico del CISH (12, 13,14) y es tan sensible y específica como el FISH, nosotros en la Fundación Valle del Lili la hemos implementado, siendo los primeros en realizarla en el país. (Tabla 1).
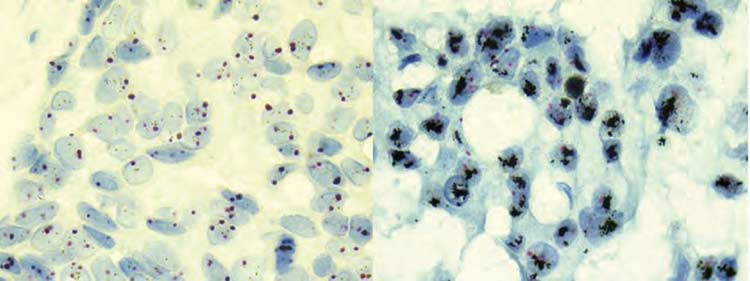
La técnica Dual ISH para nosotros los patólogos es muy amigable, permite observar la morfología del área tumoral infiltrante de una forma clara (Figura 1), lo que no ocurre con el FISH. Además nos permite conservar la preparación en el archivo, realizar el análisis en un microscopio de luz, sin los costos que significa un microscopio de fluorescencia. Tiene una alta sensibilidad y especificidad comparables con el FISH y es reproducible. Así como el FISH, también requiere entrenamiento para su lectura. Otro punto a considerar es que es una metodología totalmente automatizada, aprobada por la FDA desde el año 2010 y que se puede realizar en el equipo Benchmark XT de ventana®. (1,16)
Tabla 1. Comparación de las diferentes metodologías analizadas, donde se evidencian las ventajas de la hibridación in situ cromogénica y con plata (Dual ISH)
|
Figura 1. A. Técnica Dual ISH, se observa de forma clara la morfología del área infiltrante en este carcinoma ductal. Se reconoce el centrómero del cromosoma 17 (rojo-cromógeno) y el gen HER2 (negro-plata) en los núcleos neoplásicos. B. Caso amplificado con formación de clusters. |
Metodología de lectura
• Cuantificación en el área infiltrante de 20 núcleos tumorales, conteos entre 1.8-2.2 de la relación HER2/Chr17, se deben cuantificar otros 20 núcleos en un área diferente pero infiltrante.
• Conteos finales mayor o igual a 2 (HER2/ Chr17) significa amplificación del oncogén HER2, conteos menores de 2 se interpretan como no amplificación del oncogén HER2.
OPINIÓN EN LA PRÁCTICA DE ONCOLOGÍA CLÍNICA
El oncogén HER2 se encuentra amplificado entre una quinta y una tercera parte de los cánceres de mama (17), lo cual justifica su estudio en todos los cánceres invasivos de mama y constituye tanto un factor pronóstico, como una diana terapéutica (18), ya que dada la alta frecuencia del cáncer de mama en la consulta oncológica, hace imprescindible su adecuada y segura confirmación.
Como se ha demostrado en diferentes publicaciones, la valoración del HER2 puede llegar a ser incorrecta hasta en un 20% de las muestras estudiadas (19), representando que hasta una quinta parte de las pacientes o bien reciba un tratamiento que no necesita y que tiene una toxicidad cardiaca no despreciable, o lo que es igual o peor, que no reciba la terapia antiHER2 teniendo el receptor sobreexpresado con el subsiguiente mayor riesgo de recidiva o diseminación.
Si a este porcentaje “esperable” de error en la identificación de la sobrexpresión del gen, le sumamos que en un nuestro medio (Colombia), una buena parte de las biopsias iniciales de las neoplasias de mama se procesan en laboratorios externos de Patología de mediano o bajo volumen, donde las técnicas de fijación pueden deteriorar parcialmente la calidad de las muestras que posteriormente se remiten a los centros de Patología de alto volumen como el nuestro, la posibilidad de una lectura inapropiada es aún mayor, pues una adecuada técnica de fijación es necesaria para el correcto procesamiento del tejido y la posterior validez del test (20, 21).
Es por tanto una necesidad sentida para el Oncólogo Clínico cuando tiene enfrente una paciente con cáncer de mama, saber con exactitud si dicha paciente es portadora o no de la amplificación del HER2, para poder tratar a todas las que tienen la amplificación y a ninguna de las que no se encuentre amplificada.
El desarrollo y la implementación de métodos de detección de la amplificación del HER2 que sean accesibles y reproducibles como el Dual ISH, y que por el tipo de procesamiento de la muestra o tejido sean mucho menos susceptibles al error, constituye un apoyo diagnóstico muy bienvenido en la consulta oncológica.
CONCLUSIONES
• La evaluación por sobre la expresión del HER2 puede estudiarse por técnicas de amplificación genética como FISH, DISH o CISH. Es impor- tante señalar que el Dual ISH es un método que tiene menor costo que el FISH y que los resultados obtenidos por ambas técnicas son comparables. La técnica Dual ISH se está implementando progresivamente como una alternativa real en el diagnóstico clínico, por ser precisa y reproducible.
• La técnica FISH permite estudiar a la vez el oncogén HER2 y el cromosoma 17, al igual que la técnica Dual ISH.
• La utilización del trastuzumab está determinado
actualmente por la amplificación del HER2, utilizando técnicas como inmunohistoquímica (Hercep-test), FISH o Dual ISH aprobadas por la ASCO (Asociación Americana de Oncología Clínica) y el CAP (Colegio Americano de Pa- tólogos). Además, cada una de estas técnicas tiene un kit específico aprobado por la FDA.
• El análisis preciso es esencial para identificar pacientes con la expresión de HER2, que serán beneficiadas con los tratamientos específicos. Los falsos negativos niegan a las pacientes un tratamiento que prolonga la vida y con los falsos positivos las pacientes no se benefician de estos tratamientos, considerando que pueden verse afectadas por los efectos secundarios de la quimioterapia.
CONFLICTOS DE INTERÉS
Ninguno informado.
REFERENCIAS
1. Sua Luz F, Maestro de las Casas ML, Vidaurreta M, et al. Review: Fluorescent In Situ Hybridization (FISH), chromogenic in situ hybridization (CISH) and Chromogenic in Situ Hybridization with Silver (DISH): its use for detection of HER2 gene amplification in breast cancer. J Pathol, Senol and Breast. 2010: 23 (4): 168-172
2. Hanna W, Gelmon K. Review of the literature on HER2/neu testing and the role of HER2/neu as a prognostic and predictive factor in breast cancer. Update December 2000 to July 2001. Curr Oncol
2002; 9 (Suppl.1): S2-S17
3. Herceptin (trastuzumab) package insert, Genentech, South San Francisco, CA, 2004, www.fda.gov
4. Wolff AC, et al. American Society of Clinical On- cology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer. Arch Pathol Lab Med 2007; 131:18-43
5. Mass RD, Press MF, Anderson S, Cobleigh MA,Vogel CL, Dybdal N et al. Evaluation of clinical outcomes according to HER2 detection by fluorescence in situ hybridization in women with metastatic breast cancer treated with trastuzumab.Clin Breast Cancer 2005;
6(3):240-246.
6. Hamilton A, Piccart M. The contribution of molecular markers to the prediction of response in the treatment of breast cancer: A review of the literature on Her-2, P-53 and bcl2. Ann Oncol 2000; 11: 647-63.
7. Hicks DG, Tubbs RR. Assessment of the HER2 status in breast cancer by fluorescence in situ hybridization: a technical review with interpretive guidelines. Hum Pathol 2005; 36: 250-61.
8. Wolff AC, Hammond MEH, Hicks D, et al. Recom- mendations for Human Epidermal Growth Factor Receptor 2 (HER2) Testing in Breast Cancer: Ame- rican Society of Clinical Oncology (ASCO) / College of American Pathologists (CAP) Clinical Practice Guideline Update. J Clin Oncol. October 7, 2013 as
10.1200/JCO.2013.50.9984
9. Todorović-Raković N Jovanović D, Nesković- Konstantinović Z, Nikolić-Vukosavljević D. Prog- nostic value of HER2 gene amplification detected by chromogenic in situ hybridization (CISH) in metastatic breast cancer.Exper Mol Pathol, 2007; 82: 262-268.
10. Elbauomy Elsheikh S, Green AR, Lambros MB, et al. FGFR1 amplification in breast carcinomas: a chromogenic in situ hybridisation analysis. Breast Cancer Res 2007; 9: R23.
11. Rueschoff J, et al. HER2 status assessment by chro- mogenic in situ hybridization (CISH) demonstrates high sensitivity for predicting response to Herceptin.
27th Annual San Antonio Breast Cancer Symposium,
2004.
12. Sáez A, Andreu FJ, Fernández S, Dinarès MC, Parra T, Escoda MR, et al. Amplificación del gen HER-2 en cáncer de mama: Estudio comparativo de la determinación por técnica de Hibridación in situ fluorescente (FISH) y cromogénica (CISH). Congreso de la Sociedad Española de Anatomía Patológica (SEAP). Hospital Parc Taulí. Sabadell 2005.
13. Wilkinson, DG. In situ hybridization a practical approach. 2nd edition. Oxford University press. USA.1999. P 224.
14. Dietel M, Ellis I, Hofler H et al. Comparison of auto- mated silver enhanced in situ hybridization (SISH) and fluorescence-ISH (FISH) for validation Her2 gene status in breast carcinoma. Virchow Arch 2007; 451:
19-25.
15. García-Caballero T, Grabau D, Green A et al. Determination of HER2 amplification in primary breast cancer using dual-colour chromogenic in situ hybridization is comparable to fluorescence in situ hybridization: a European multicentre study involving 168 specimens. Histopathol 2010, 56: 472–480.
16. Gruver AM, Peerwani Z, Tubbs RR. Out of the darkness and into the light: bright field in situ hybridisation for delineation of ERBB2 (HER2) status in breast carcinoma. J Clin Pathol 2010; 63:210-219.
17. Slamon DJ, Clark GM, Wong SG, et al: Human breast cancer: Correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science
1987; 235:177-182
18. Yamauchi H, Stearns V, Hayes DF: When is a tumor marker ready for prime time? A case study of c-erbB-2 as a predictive factor in breast cancer. J Clin Oncol
2001; 19:2334-2356
19. Paik S, Bryant J, Tan-Chiu E, et al: Real-world perfor- mance of HER2 testing-National Surgical Adjuvant Breast and Bowel Project experience. J Natl Cancer
Inst 2002; 94:852-854
20. Zarbo RJ, Hammond ME: Her-2/neu testing of cancer patients in clinical practice. Arch Pathol Lab Med
2003; 127:549-553
21. Plata A, Torres M, Lopez R, Andrade R. Determination of the HER2 amplification status by in situ fluorescent hybridization and concordance with immunohisto- chemistry for breast cancer samples in Colombia. Colomb Med. 2013: 44 (2).
Recibido: Junio 15, 2014
Aprobado: Noviembre 3, 2014
Correspondencia: Luz Fernanda Sua lufer24@hotmail.com