USO DE NUEVAS METODOLOGÍAS EN LA PRÁCTICA CLÍNICA: ESTUDIO DE LA AMPLIFICACIÓN DEL ONCOGÉN HER2 CON HIBRIDACIÓN IN SITU CROMOGÉNICA Y CON PLATA (DUAL ISH) EN EL CÁNCER DE MAMA
Luz Fernanda Sua1, Juan Carlos Bravo2, William Franco3
RESUMEN
Introducción: La determinación del oncogén HER2 es crítica en las pacientes que responderán al anticuerpo monoclonal humanizado Trastuzumab. La técnica de hibridación in situ cromogénica y con plata (Dual ISH) ha sido exitosamente probada en la detección de la amplificación del gen HER2, un importante biomarcador del cáncer de mama que combina las ventajas de la automatización y la microscopía de luz, mejorando el flujo de trabajo en el laboratorio. Objetivos: verificar si la metodología automatizada de hibridización in situ cromogénica y con plata (Dual ISH) realizada en el equipo Benchmark XT de Ventana Medical Systems® puede ser comparable con la hibridización in situ fluorescente (FISH) en casos de la Fundación Valle del Lili. Metodología: Previa aprobación del Comité de Ética de la Fundación Valle del Lili, evaluamos un total de 42 casos, encontrando 98.1% con un nivel de concordancia total, tanto de la hibridización in situ fluorescente (FISH) y de la inmunohistoquímica (IHQ) con el ISH Dual. Determinamos un nivel de concordancia del 94.4% en el estudio del nivel de amplificación del gen HER2 por FISH y por ISH Dual. La concordancia entre la determinación de la expresión de la proteína HER2 por IHQ y por ISH Dual fue del 100%. Al evaluar nuestro coeficiente Kappa este fue de 0.97 y nuestro coeficiente de correlación intraclases en referencia con el FISH fue casi perfecto 0.85. Conclusión: nosotros observamos una reducción del tiempo de procesamiento con la técnica Dual ISH al ser una metodología automatizada (Equipo BenchMark XT de Ventana®) cuando la comparamos con el protocolo FISH. La técnica Dual ISH permite la evaluación morfológica y estudia simultáneamente el centrómero del cromosoma 17 y el oncogén HER2. Esta metodología se estudia en el microscopio de luz (60x), es cuantitativa, se puede archivar y se encuentra aprobada por la Administración de Drogas y Alimentos de los Estados Unidos (FDA).
Palabras clave: HER2, hibridización, cáncer de mama.
1 MD. Especialista en Anatomía Patológica y Patología Clínica. Estudiante de Doctorado en Ciencias Biomédicas. Departamento de Patología y Medicina de Laboratorio. Patología Molecular. Fundación Valle del Lili. Universidad ICESI. Facultad de Salud. Cali, Colombia.
2 MD. Especialista en Anatomía Patológica. Jefe del servicio de patología. Departamento de Patología y Medicina de Laboratorio.
Patología Molecular. Fundación Valle del Lili. Universidad ICESI. Facultad de Salud. Cali, Colombia.
3 MD. Especialista en Oncología Clínica y Quimioterapia. Unidad de Cáncer. Fundación Valle del Lili. Universidad ICESI. Facultad de Salud. Cali, Colombia.
USE OF NEW METHODOLOGIES IN CLINICAL PRACTICE: STUDY WITH AMPLIFICATION OF HER2 ONCOGENE WITH IN SITU CHROMOGENIC AND SILVER HYBRIDIZATION (ISH DUAL) IN BREAST CANCER
ABSTRACT
Introduction: Determination of HER2 oncogene is critical in patients who will respond to the humanized monoclonal antibody, Trastuzumab. Chromogenic and silver in situ hybridization technique (Dual ISH) has successfully proved to detect HER2 gene amplification, an important breast cancer biomarker with the combined advantages of automation and light microscopy, thus improving workflow in the laboratory. Objectives: To determine whether the chromogenic and silver in situ hybridization automated methodology (Dual ISH) using XT Ventana Benchmark® can be comparable with the fluorescent in situ hybridization (FISH) in cases seen at the Valle del Lili Foundation. Methodology: Prior approval of Ethics Committee of the Valle del Lili Foundation, we evaluated a total of 42 cases, finding 98.1% with a level of total concordance of both fluorescent in situ hybridization (FISH) and immunohisto-chemistry (IHC), with Dual ISH. We also found 94.4% level of concordance when analysing the level of HER2 gene amplification by FISH and by Dual ISH. The concordance of determination of HER2 protein expression by both IHC and Dual ISH was 100%. Our Kappa coefficient was 0.97 and the intraclass correlation coefficient was a near perfect 0.85, compared with our FISH reference. Conclusion: We observed a reduction in processing time with Dual ISH technique -since this is an automated methodology (using a Ventana Medical Systems Benchmark XT® equipment) - when compared with the FISH protocol. Dual ISH technique allows morphological evaluation, simultaneously studying both the centromere of chromosome 17 and HER2 oncogene. This quantitative methodology is carried out with light microscope (60x), it can be filed and is FDA (Food and Drug Administration) approved.
Key words: HERS2, hybridization, breast cancer.
INTRODUCCIÓN
La técnica de hibridación in situ cromogénica y con plata (Dual ISH) ha sido exitosamente demostrada para detectar la amplificación del gen HER2, un importante biomarcador del cáncer de mama mediante la combinación de las ventajas de la au- tomatización y la microscopía de luz, mejorando el flujo de trabajo en el laboratorio. (1)
Además de esto, el Dual ISH es una técnica segura, de bajo costo y que también puede ser utilizada en la detección de amplificación de oncogén HER2 en otras enfermedades además del carcinoma de mama. (2,3)
La prueba de hibridación in situ cromogénica y con plata (Dual ISH), permite la medición de la cantidad de copias del gen HER2 encontradas en el tejido tumoral mamario. El oncogén HER2 está localizado en el cromosoma 17. Una cantidad excesiva de la proteína producida por el gen se encuentra en algunos tipos de células tumorales, incluyendo las células del cáncer de mama. (2)
La FDA basó la autorización del Dual ISH en un estudio realizado en Estados Unidos con 510 muestras de tumores de pacientes con cáncer de mama. Este estudio mostró que la prueba fue eficaz en confirmar que la muestra del tumor de un paciente tenía una cantidad de copias del gen HER2 mayor a la normal en el 96% de las muestras de tumores positivos para HER2. (4)
Estudios recientes han observado una excelente correlación entre los resultados obtenidos por Dual ISH y FISH (hibridación in situ fluorescente) (5), con las ventaja de la técnica Dual ISH que puede ser evaluada en conjunto con la morfología; las preparaciones se pueden archivar y el patólogo puede realizar el análisis en un microscopio de luz normal (6,2).
MATERIALES Y MÉTODOS
Previa aprobación por el comité de ética de la Fundación Valle del Lili, se seleccionaron las muestras de 67 pacientes. El estudio realizado es retrospectivo, descriptivo, no intervencional, del periodo comprendido del año 2010 a abril del 2012. Como criterios de inclusión debían tener carcinoma infiltrante, tener mastectomía, tener representado el tumor en 3 bloques de parafina, tener realizado el estudio por inmunohistoquímica del oncogén HER2 y aquellos casos equívocos (2+) debían tener reali- zada la hibridación in situ fluorescente (FISH). Los criterios de exclusión fueron trucuts, casos que no hibridaron o pérdida del material en el microarreglo de tejido. Todas las muestras fueron teñidas con la coloración de hematoxilina y eosina para realizar en ellas el análisis histopatológico, confirmando la presencia de carcinoma infiltrante. Una vez aplicados los criterios de inclusión y exclusión nuestra (n) fue de 42 casos, distribuido así: 18 casos HER2 equivoco (2+), 11 casos HER2 negativos (0 o 1+) y 13 casos HER2 positivos (3+).
Posterior a ello se seleccionaron las áreas en cada muestra para la construcción del microarreglo de tejido, este se construyó según el protocolo estándar del laboratorio de patología molecular de la Fundación Valle del Lili. Una vez realizado el microarreglo, estas muestras fueron cortadas a 4 micras en el micrótomo y montadas en las láminas precargadas (Super Frost Plus Slides), para ser corridas en el equipo automatizado Benchmark XT de Ventana®.
En el ensayo Ventana® HER2 Dual ISH de cocktail de sondas de DNA, la sonda marcada con Dinitrofenol (DNP) y la sonda marcada con Digoxi- genina (DIG) son hibridadas simultáneamente en la muestra de tejido. El gen de HER2 se detecta por la sonda marcada con DNP y visualizada utilizando el kit de detección Ventana® ultraView Silver ISH DNP (SISH). El centrómero del Cromosoma 17 se detecta con la sonda marcada con DIG y se visualiza con el kit de detección ultraView Red ISH DIG. Los resultados obtenidos al utilizar este sistema de Detección Dual se observan empleando un microscopio de luz, donde el HER2 aparece en forma de puntos negros (SISH) y el centrómero del Cromosoma 17 como puntos rojos (RED ISH).
RESULTADOS
La cuantificación del nivel de amplificación fue realizada según el protocolo de Ventana® (4,6). Los casos seleccionados como controles positivos fueron 13, ellos corresponden a un 31% de la muestra. La correlación con el Dual ISH e inmunohistoquímica fue del 100%. Los casos seleccionados como negativos fueron 11, ellos corresponden a un 26% de la muestra. La correlación con el Dual ISH e inmunohistoquímica fue del 100%. Nuestros casos equívocos fueron 18, estos corresponden a un 43% de la muestra, de estos el nivel de concordancia solo con el FISH fue de 94.4% (Tabla 1)
tabla 1. Correlación de la técnica Dual ISH con el FISH en los casos equívocos (2+) por inmunohistoquímica.
|
FISH + |
FISH- |
TOTAL |
DISH + |
4 |
0 |
4 |
DISH - |
1 |
13 |
14 |
TOTAL |
5 |
13 |
18 |
La concordancia global como metodología fue de un 98.14% al comparar los casos positivos, negativos y equívocos estudiados por inmunohistoquímica y FISH.
Para la cuantificación de la amplificación del gen HER2 realizamos un ejercicio de lectura conservando el enmascaramiento y comparando a dos evaluadores, uno con experiencia y otro patólogo con poca experiencia, logrando demostrar la reproducibilidad interobservador. El Kappa del evaluador experimentado fue de 0.85 casi perfecto y el Kappa del evaluador poco experimentado fue bueno 0.68. Comparamos el Dual ISH con el FISH encontrando un 17% de discordancia y un Coeficiente de correlación intraclases del 83% en el laboratorio de Patología de la Fundación Valle del Lili (Tabla 2).
tabla 2. Evaluador 1 (experimentado) con un kappa de 0.85 casi perfecto y el evaluador poco experimentado (2) con un kappa bueno de 0.68, demostrando la reproducibilidad de la Metodología.
|
Correlación |
|
Intraclases/ Kappa FISH |
Intraclases/ Kappa 1 |
|
Evaluador 1 |
0.97 |
|
Evaluador 1 |
0.85 |
|
Evaluador 2 |
0.96 |
0.98 |
Evaluador 2 |
0.68 |
0.82 |
DISCUSIÓN
Pudimos implementar esta metodología, verificándola y correlacionado las diferentes metodologías que utilizamos en el laboratorio de patología molecular de la Fundación Valle del Lili. Estas son: hibridación in situ cromogénica y con plata (Dual ISH), hibridación in situ fluorescente (FISH) e inmunohistoquímica con un 98.14% de concordancia, datos similares ya publicados en Europa y Estados Unidos. (2,7)
Nuestro laboratorio es el primero en implementar la técnica Dual ISH y utilizarla para diagnóstico en paciente con cáncer de mama en Colombia, como parte de la práctica clínica diaria. La metodología de lectura es reproducible entre patólogos lo cual pudimos demostrar con nuestro ejercicio, al superar los kappas y la correlación intraclases. Estos datos son correlacionados con los datos ya publicados en el desarrollo de la metodología de lectura del Dual ISH. (2,7,8)
Cuando analizamos el caso discordante (Figura 1), pudimos determinar una cuantificación menor. Como en el estudio de aprobación de la FDA algunos de los casos discordantes fueron validados en un 81% con el diagnostico determinado por Dual ISH en las segunda evaluación de expertos (4). A continuación observamos la tabla comparativa de las dos metodologías. (Tabla 3)
Experiencia en la práctica clínica y quirúrgica oncológica
El oncogén HER 2 se encuentra amplificado entre una quinta y una tercera parte de los canceres de mama (9), lo cual justifica su estudio en todos los canceres invasivos de mama, y constituye tanto un factor pronóstico como una diana terapéutica (10), ya que dada la alta frecuencia del cáncer de mama en la consulta Oncológica, hace imprescindible su
adecuada y segura confirmación.
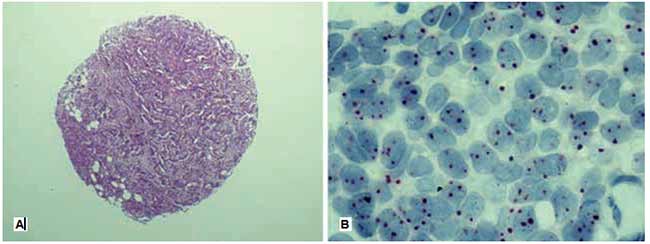 |
Figura 1. Caso discordante con la hibridación in situ fluorescente (FISH) A. Microarreglo de tejido, carcinoma ductal infiltrante (Coloración de Hematoxilina y Eosina). B. Estudio de amplificación del oncogén HER2 (negro) y el centrómero del cromosoma 17 (rojo), se cuantificaron en total 40 núcleos, resultado final no amplificado (Her2/Chr17 ratio: 1.72)
tabla 3. Comparación del FISH con el Dual ISH.
técnica |
FISH |
Dual DISH |
Microscopio |
Fluorescencia |
Óptico |
Automatización |
Manual, laborioso y personal especializado |
Totalmente automatizado |
Estudia en la preparación |
Simultáneamente HER2 y cromosoma 17 |
Simultáneamente HER2 y cromosoma 17 |
Técnica |
Entrenamiento, interpretación y cuantitativa |
Entrenamiento y cuantitativo |
Sensibilidad y especificidad |
Alta (98-100%) |
Alta (98-97%) |
Aprobado FDA |
Si |
Si BenchMark Ventana® |
Archivarse |
No |
Si |
Señal |
Decae con el tiempo |
Más estable |
Colores |
2 a 4 sondas de diferente color |
2 colores |
Evaluación morfológica |
Limitada |
Buena |
Costo |
Alto |
Medio-bajo |
Tiempo de proceso |
Más de 24 horas |
12 horas |
Como se ha demostrado en diferentes publicaciones, la valoración del HER2 puede llegar a ser incorrecta hasta en un 20% de las muestras estudiadas (11), representando ello que hasta una quinta parte de las pacientes o bien reciba un tratamiento que no necesita y que tiene una toxicidad cardiaca no despreciable, o lo que es igual o peor, que no reciba la terapia antiHER2 teniendo el re- ceptor sobreexpresado con el subsiguiente mayor riesgo de recidiva o diseminación.
Si a este porcentaje “esperable” de error en la identificación de la sobreexpresion del gen, le sumamos que en un nuestro medio (Colombia), una buena parte de las biopsias iniciales de las neoplasias de mama se procesan en laboratorios externos de Patología de mediano o bajo volumen, donde las técnicas de fijación pueden deteriorar parcialmente la calidad de las muestras que posteriormente se remiten a los centros de Patología de alto volumen como el nuestro, la posibilidad de una lectura inapropiada es aún mayor, pues una adecuada técnica de fijación es necesaria para el correcto procesamiento del tejido y la posterior validez del test (12).
Es por tanto una necesidad sentida para el Oncólogo Clínico cuando tiene enfrente una paciente con cáncer de mama, saber con exactitud si dicha paciente es portadora o no de la amplificación del HER2, para poder tratar a todas las que la tienen la amplificación y a ninguna de las que no se encuentre amplificado HER2.
El desarrollo y la implementación de métodos de detección de la amplificación del HER2 que sean accesibles y reproducibles como el Dual ISH, y que por el tipo de procesamiento de la muestra o tejido sean mucho menos susceptibles al error, constituye un apoyo diagnóstico muy bienvenido en la consulta oncológica.
Como bien se explica en este artículo, el Servicio de Patología de la Fundación Valle del Lili logró validar un test de detección de la amplificación del gen altamente confiable y reproducible, que dadas las condiciones del entorno en que se mueve el paciente Oncológico en la región, debería convertirse en estándar de detección al ser comparable con el FISH.
CONCLUSIONES
– La técnica de hibridación in situ cromogénica y con plata (Dual ISH) es una metodología validada por la FDA y que tiene tan buena sensibilidad y especificidad como la hibridación in situ fluorescente (FISH).
– Este método permite tener un estudio morfológico mejor del área a estudiar, es más costo efectivo y tiene tantas ventajas como la técnica FISH.
– El Servicio de Patología de la Fundación Valle del Lili logró validar un test de detección de la amplificación del gen HER2 altamente confiable y reproducible.
CONFLICTOS DE INTERÉS
Ninguno declarado.
FUENTES DE FINANCIACIÓN
Fondos provenientes de la Fundación Valle del Lili, Departamento de Patología y Medicina de Laboratorio.
REFERENCIAS
1. Francis GD, Jones MA, Beadle GF, Stein SR. Bright- field in situ hybridization for HER2 gene amplification in breast cancer using tissue microarrays. Correlation between chromogenic (CISH) and automated silver- enhanced (SISH) methods with patient outcome. Diagn Mol Pathol 2009; 18: 88-95.
2. Sua Luz F, Maestro de las Casas ML, Vidaurreta M, et al. Review: Fluorescent In Situ Hybridization (FISH), chromogenic in situ hybridization (CISH) and Chromogenic In Situ Hybridization with Silver (DISH): its use for detection of HER2 gene amplification in breast cancer. J Pathol Senol Breast. 2010; 23 (4):
168-172.
3. Ramieri MT, Murari R, Botti C, Pica E, Zotti G, Alo PL. Detection of HER2 amplification using the SISH technique in breast, colon, prostate, lung and ovarian carcinoma. Anticancer Res 2010; 30:1287-1292.
4. Papouchado BG, Myles J, Lloyd RV, Stoler M, oli- veira AM, Downs-Kelly E, Morey A, Bilous M, Nagle R, Prescott N, Wang L, Dragovich L, McElhinny A, Garcia CF, Ranger-Moore J, Free H, Powell W, Loftus M, Pettay J, Gaire F, Roberts C, Dietel M, Roche P, Grogan T, Tubbs R. Silver in situ hybridization (SISH) for determination of HER2 gene status in breast carcinoma. Comparison with FISH and assessment of interobserver reproducibility. Am J Surg Pathol
2010; 34: 767-776.
5. Shousha S, Peston D, Amo Takyi B, Morgan M, Ja- sani B. Evaluation of automated silver-enhanced in situ hybridization (SISH) for detection of HER2 gene amplification in breast carcinoma excision and core biopsy specimens. Histopathol 2009; 54: 248-253.
6. Dietel M, Ellis IO, Hofler H, Kreipe H, Moch H, Dankof A, Kolble K, Kristiansen G. Comparison of automa- ted silver enhanced in situ hybridization (SISH) and fluorescence ISH (FISH) for the validation of HER2 gene status in breast carcinoma according to the gui- delines of the American Society of Clinical Oncology and the College of American Pathologists. Virchow’s Arch 2007; 451: 19-25.
7. García-Caballero T, Grabau D, Green A et al. Determi- nation of HER2 amplification in primary breast cancer using dual-colour chromogenic in situ hybridization is comparable to fluorescence in situ hybridization: a European multicentre study involving 168 specimens. Histopathol 2010, 56, 472–480.
8. Aaron M Gruver, Ziad Peerwani, Raymond R Tubbs.
Out of the darkness and into the light: bright field in situ hybridisation for delineation of ERBB2 (HER2) status in breast carcinoma. J Clin Pathol 2010;
63:210-219.
9. Slamon DJ, Clark GM, Wong SG, et al: Human breast cancer: Correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science
235:177-182, 1987
10. Yamauchi H, Stearns V, Hayes DF: When is a tumor marker ready for prime time? A case study of c-erbB-2 as a predictive factor in breast cancer. Clin Oncol
19:2334-2356, 2001
11. Paik S, Bryant J, Tan-Chiu E, et al: Real-world per- formance of HER2 testing-National Surgical Adjuvant Breast and Bowel Project experience. J Natl Cancer Inst 94:852-854, 2002
12. Zarbo RJ, Hammond ME: Her-2/neu testing of cancer patients in clinical practice. Arch Pathol Lab Med
127:549-553, 2003
Recibido: Junio 15, 2014
Aprobado: Agosto 15, 2014