RESISTENCIA BACTERIANA A LOS ANTI-MICROBIANOS: UNA TERRIBLE AMENAZA
Gustavo Malagón Londoño1
RESUMEN
La resistencia microbiana a la acción de los antibióticos se cierne a pasos agigantados, algo que embarga la atención del mundo médico y preocupa hondamente al sector hospitalario. Crece el desconcierto y a veces la sensación de impotencia del profesional, con la natural desazón, angustia y desconfianza de las familias. Lo más selecto del mundo científico y de los organismos nacionales é internacionales (con la Organización Mundial de la Salud a la cabeza), adelantan grandes esfuerzos ante la arremetida de esos minúsculos organismos que propician uno de los más serios problemas de salud pública.
Palabras clave: Resistencia bacteriana, antibióticos, membranas bacterianas, inhibición enzimática, biopelículas
BACTERIAL ANTIBIOTIC RESISTANCE: A WORRYING THREAT
ABSTRACT
Microbial resistance to action of antibiotics hovers rapidly, seizing attention of medical world and deeply worrying hospital people. Growing confusion -and sometimes helplessness- of health professionals, go along with uneasiness, anxiety and mistrust of people who are related to patients. Both the elite of scientific world and national and international agencies (headed by World Health Organization), make great efforts to block the onslaught of these tiny organisms, causing one of the most serious public health problems.
Key words: Bacterial resistance, antibiotics, bacterial membranes, enzymatic inhibition, biofilms
1 MD, ESP, Miembro Honorario, Academia Nacional de Medicina, Bogotá.
RESEÑA HISTÓRICA
La idea de que las enfermedades eran propaga- das por organismos invisibles había sido propuesta desde épocas remotas, como de la antigua Roma, por investigadores que trataban de explicar la razón de las epidemias. Durante siglos se presentaron diferentes conceptos. Fracastoro dio a conocer en el siglo XVI la clasificación de las enfermedades epidémicas en tres categorías: contagio directo por contacto, contagio indirecto de quienes dormían en el lecho antes ocupado por un enfermo infeccioso, transmisión aérea al estilo de la del polen; los agentes de la enfermedad debían ser tan pequeños para ser percibidos a simple vista. Ya en el siglo XVIII Marcus Plenciz, de Viena, argumentó razonablemente que la enfermedad infecciosa debía ser causada por microorganismos vivientes.
Poco tiempo antes de Pasteur, Agostino Bassi en 1836 había demostrado que la enfermedad del gusano de seda era causada por un hongo parásito y propuso cómo podía controlarse. Pasteur debió luchar arduamente contra quienes se negaban a creer que los responsables de las enfermedades eran unos microorganismos, así él mismo afirmara que no eran los causantes, sino simplemente su agentes. Sus trabajos y los del Alemán Max Von Pettenkofer, gran investigador químico de la época, quien con microbiólogos interesados en el tema lle- garon a admitir que las enfermedades podían estar vinculadas a un microorganismo específico, pero no por que este fuera la causa: podía operar donde hubiera una disposición a la enfermedad, debida a malas circunstancias constitucionales o ambientales. Para probar su punto de vista, adquirió de Ludwig Koch una dosis letal del virus del cólera y se la bebió, sin otros efectos adversos que una leve diarrea.
La fama de Pasteur surgió desde el momento en que afirmó que existía una conexión indiscutible entre microbios y enfermedad, dejando en claro que los microbios no eran la causa, pero sí sus agentes como lo demostraba con el bacilo del ántrax del que afirmaba que diseminaba virus peligrosos, por lo cual sostenía que mas que pensar en aniquilar el bacilo había que desarmarle y hacer así menos peligrosa su presencia. La teoría de Pasteur estaba un tanto de acuerdo con Claude Bernard quien afirmó que era el terreno más importante que el mismo germen. En su laboratorio de microbiología, Pasteur analizó el proceso de fermentación láctica, alcohólica y butírica, para concluir que el fenómeno era causado por la acción de microorganismos, contraviniendo la teoría histórica de la generación espontánea. Pero todo prosperó para aquel cuan- do indujo el cólera en pollos de los cuales guardó gérmenes que inocularía en pollos sanos que no sucumbirían a la epidemia, lo cual repitió por analogía en el caso de la joven vaquera de Jenner a la cual inoculó, dando origen a la vacunación que salvaría tantas vidas. Ya en las postrimerías del siglo XVIII, el médico español José Celestino Mutis introdujo en la Nueva Granada la práctica de la inoculación de la viruela para detener una epidemia creciente.
A finales del Siglo XIX y principios del XX, Robert Koch descubre el bacilo de la tuberculosis y sienta las bases para la lucha frontal contra la malaria que había hecho numerosas víctimas en las campañas Napoleónicas del norte de Italia; antes en el Nuevo Mundo se había sufrido esta enfermedad traída por los Españoles y que pudo controlarse con la corteza de uno de los árboles del género Cinchona. Koch aportó al X Congreso Internacional de Medicina de Berlín celebrado en 1890, la Tuberculina, que llenó de esperanzas al mundo.
Paul Ehrlich (1854-1915) y Sahachiro Hata (1873-1938) descubrieron las propiedades tera- péuticas del arsénico y lanzaron al mercado un preparado orgánico con el nombre de “Salvarsán”, que marcaba un éxito en la lucha contra la sífilis (1). Mas adelante, con el descubrimiento de los antibióticos, se lograrían grandes avances en la lucha contra esta temible patología.
Pero uno de los hitos del pasado siglo, en 1928, sin duda fue el descubrimiento de la Penicilina por Alexander Fleming, quien en forma casual, cuando adelantaba el estudio sobre comportamiento de una bacteria del género Staphilococcus, observó que aparecía una substancia con movimiento alrededor de un moho de la especie Penicillium notatum con inmensa capacidad para la absorción de los esta- filococos. Fleming bautizó esta substancia con el nombre de “Penicilina” y publicó sus resultados un año más tarde en el British Journal of Experimental Pathology. Diez años más tarde Ernst Boris Chain y Howard Walter Florey consiguieron el aislamiento de la penicilina en estado anhidro. El descubrimiento le valió a Fleming el nombramiento de caballero de la Corona Británica en 1943 y dos años más tarde recibió el Premio Nobel de Fisiología y Medicina, junto con Chain y Florey.
El nuevo antibiótico curó espectacularmente numerosos casos de infección microbiana, pero paulatinamente su uso masivo, muchas veces desenfrenado, llevó a generar resistencias mi- crobianas. Se plantearon interesantes hipótesis: Una, se abusa de la utilización del antibiótico por creencia optimista de acción universal y absoluta, otra, las bacterias sucumben indiscutiblemente ante el bombardeo del fármaco, con dosis masivas, o al menos se debilita indefinidamente su acción. Proliferaron diversos tipos de antibióticos a partir de los mismos principios farmacoquímicos del primero. Ante la crudeza de la infección en muchos casos y la pobre o nula respuesta al fármaco utilizado, surgió la práctica de recurrir a mezclas de antibióticos con la esperanza de que casualmente uno de ellos, al menos, sería efectivo.
Fleming en su discurso de aceptación del premio Nobel en 1945, expresó: “No es difícil hacer que los microbios desarrollen resistencia a la penicilina en el laboratorio, al exponerlos a concentraciones insuficientes o inadecuadas para matarlos. Y este mismo fenómeno ha ocurrido ocasionalmente en el cuerpo”. Con esta afirma- ción del propio Fleming se abre la perspectiva que confirma esta hipótesis y en poco tiempo se activan los estudios de la resistencia bacteriana a la vez que se inician importantes avances en el desarrollo de nuevos antibióticos (2).
Poco tiempo después del inicio del uso clínico de la penicilina, se observó una proliferación de Staphylococcus aureus resistente a penicilina, lo cual llegó a ser una grave problema hospitalario a nivel mundial. Este problema se presentó por la capacidad de estos Staphylococcus aureus de producir penicilinasas; esta beta-lactamasa y la mayoría de sus isoenzimas han atacado a la ma- yoría de los betalactámicos, convirtiéndose en el principal mecanismo de resistencia para este tipo de antimicrobianos.
RESISTENCIA BACTERIANA EN LA ACTUALIDAD
Hoy se cuenta con más de 200 antibióticos disponibles, no obstante, el médico de este siglo frente a la multirresistencia está abocado a un escenario similar al de la era preantibiótica. La aparición de bacterias Gram negativas resistentes a cefalosporinas de tercera generación y a amino- glucósidos y el grave problema de enterococos y estafilococos resistentes a la Vancomicina -y a numerosos antibióticos- así lo comprueban. Pre- ocupa notablemente el hecho fundamentado en importantes investigaciones, que en los últimos 30 años ha aparecido una cantidad muy limitada de nuevas clases de antibióticos; la mayoría de los nuevos fármacos son modificaciones parciales de antibióticos ya existentes (3-8).
Inicialmente se creyó que las bacterias se transformaban al exponerse a los antibióticos (fenómenos de mutación), pero con los avances en el campo, se ha demostrado que la base de la resistencia microbiana, reside en los genes de las bacterias, es decir en el ácido desoxirribonu- cléico (ADN). Esto apoya la hipótesis evolutiva en la aparición de la resistencia. A pesar de tratarse de un fenómeno natural hay suficiente evidencia para establecer una asociación directa entre el uso extenso e indiscriminado de los antibióticos y la aparición cada vez más frecuente de bacterias resistentes como resultado de una fuerte presión de selección.
En la mayoría de las recientes publicaciones (4,
5, 7-10) sobre resistencia bacteriana y los factores por los cuales las bacterias pueden evadir la acciónde los antibióticos, se mencionan tres mecanismos:
1. Concentración insuficiente del antibiótico para alcanzar el blanco de acción, generalmente por alteración en la permeabilidad. 2. Inactivación del antibiótico por hidrólisis o modificación enzimática.
3. Alteración del blanco de acción.
La alteración de la permeabilidad la explican porque los antibióticos tienen que penetrar en la bacteria a través de porinas como canales para poder concentrarse en su interior. Las porinas son proteínas y si el gen (o genes) que codifican para estas sufre alguna mutación, se modifica su con- figuración y se puede perder la capacidad de esta porina para conferirle permeabilidad al antibiótico. Tanto la modificación enzimática como la hidrólisis para la inactivación del antibiótico, son presentadas como el mecanismo más común de resistencia a los betalactámicos, a los aminoglucósidos y al cloranfenicol y esto lo relacionan con la capacidad de la bacteria para inactivar a los antibióticos, ya sea por hidrólisis o por modificación de los mismos hacia productos derivados inactivos.
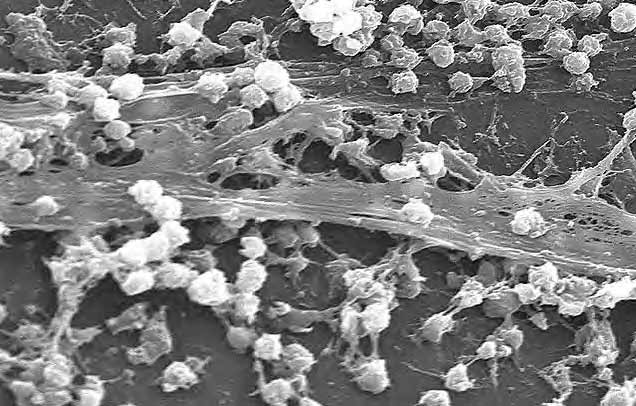 |
Figura 1. Biopelícula de Staphylococcus aureus en un cateter (CDC Public Health Image Library). El crédito de la fotografía es para Rodney M. Donlan, PhD and Janice Carr, del CDC de Atlanta.
En la llama- da alteración del blanco de acción, el antibiótico pierde la capacidad de unirse a su sitio, blanco de acción. O sea que existe un cambio estructural o adquisición de nuevo material genético que codifica para un blanco alterado, al punto de disminuir o no permitir el enlace del antibiótico.
Frente a la resistencia microbiana a la acción de los antibióticos, se han descrito varios meca- nismos para explicar el fenómeno (9): la inhibición enzimática, las alteraciones de las membranas bacterianas, la alteración de los sitios de ataques ribosómicos, la alteración de algunas enzimas, la evasión de inhibición producida por el antibiótico y el mecanismo de las biopelículas (Tabla 1). Sobre este último, según Costerton el 99% de las bacte- rias se encuentran organizadas en biopelículas; ya en el siglo XVII, Leeuwenhoek había hecho la primera observación sobre estas biopelículas que él mostraba como una túnica protectora, pero Costerton las describió en 1978 como una barrera impenetrable, por la poderosa matriz con que se rodean y que pueden restringir de forma mecánica, la difusión de un antibiótico (10-13). La disminución de nutrientes, de oxígeno, o la acumulación de metabolitos bacterianos, pueden favorecer que las bacterias entren en fase de crecimiento lento o fase estacionaria, lo cual bloquea los mecanismos a los cuales va dirigida la acción de los antibióticos. Existe la expresión de genes de resistencia, al activarse genes relacionados con la formación de biopelículas. Han demostrado que las bacterias formadoras de biopelículas, son 500 veces más resistentes a los antibióticos, que las no formadoras. Hall- Stoodley reportó en el 2006, sobre la base de biopsias de mucosa de oído medio en niños con otitis media recurrente, la presencia de biopelículas, con lo cual se comprobaba el muy alto porcentaje de exacer- baciones y de franca resistencia a los esquemas antibióticos en esta enfermedad (14,15).
En 2006, la organización Infectious Diseases Society of America (IDSA) publicó una lista de los 6 gérmenes que han desarrollado mecanismos de resistencia a antimicrobianos: Staphylococcus aureus resistente a la Meticilina, Escherichia coli y Klebsiella pneumoniae, Acinetobacter baumannii y Enterococcus resistentes a Vancomicina y Pseu- domona aeruginosa a la Vancomicina; además relacionó varios casos de Staphylococcus Aureus resistentes igualmente a la Vancomicina. Lo anterior como una notificación del fenómeno progresivo; de tiempo atrás se había comprobado la aparición de bacterias Gram negativas resistentes a cefalospo- rinas de tercera generación y a aminoglucósidos (16-22).
 |
Tabla 1. Mecanismos para explicar el fenómeno de la resistencia
Recientemente un grupo de estudio de vigilan- cia de infección neumocócica de la Organización Panamericana de la Salud reportó un análisis de de 1649 cepas de S. pneumoniae de niños con infecciones invasivas de diferentes países de Latinoamérica y encontró un porcentaje global de 24.9% resistentes a la Penicilina; las cifras más altas correspondieron a México, Uruguay y Chile y en escala descendente a Brasil, Argentina y Colombia, correspondió el porcentaje más bajo a Colombia con el 12.1% (3).
PREOCUPACIÓN POR EL AUMENTO INCONTROLADO DE LA RESISTENCIA DE LOS GÉRMENES GRAM-NEGATIVOS A CASI TODOS LOS ANTIBIÓTICOS
Pero algo especialmente preocupante es el aumento casi incontrolado de la resistencia de los gérmenes Gram negativos a casi todos los anti- bióticos; esto ha llevado a la voz de alarma de la Organización Mundial de la Salud para convocar a todas las autoridades científicas a un esfuerzo mancomunado para buscar medidas de contención. Algunas cifras como las de la National Nosocomial Infections Surveillance (2003) muestran la incidencia de infecciones por Gram Negativos en Unidades de Cuidado Intensivo con 65.2% en neumonías,71% en infecciones urinarias, 33.8% en infecciones quirúrgicas, 23.8% en bacteriemias, con aumentos de resistencia de 3 a 5% en E. coli, en Klebsiella neumoniae del 5 al 20%, en Pseudomona aeruginosa del 10 al 25%, a Acinetobacter baumannii del 25 al 70%; esto significó el aumento incontrolado de carbepenemasas responsables de la resistencia a prácticamente la totalidad de los antibióticos beta- lactámicos, inclusive a las cefalosporinas de tercera generación que en un momento dado ofrecían la única tabla de salvación (23).
Pero no se trata de llevar los datos negativos hasta la fase de pesimismo y desesperación… Hay que regresar a las medidas de prudencia, análisis científico, a la prevención de la infección comenzando por el elemental lavado de manos, a la aplicación minuciosa de estrategias de control: evitar el abuso incontrolado del consumo de antibióticos: no todos los cuadros febriles o de amago de infección requieren del uso automático de los antibióticos.
Para la vigilancia de la resistencia bacteriana, la OMS en su “estrategia mundial para la contención de la resistencia bacteriana” recomendó el programa WHONET, desarrollado desde 1986 por Thomas O’Brien y John Stelling de la Universidad de Harvard. Este es un programa para el manejo de las bases de datos para la administración de los resultados del laboratorio de microbiología. Promueve aumentar el uso local de los datos de laboratorio y estimula para la colaboración entre los diferentes centros mediante el intercambio de información.
Ya para 1995 la American Society for Micro- biology promovió la necesidad de hacer reportes periódicos sobre resistencia bacteriana para llevar información oportuna a los profesionales y orien- tarlos para la selección de los antimicrobianos más apropiados. Surgieron numerosas redes y proyec- tos de vigilancia incluyendo los financiados por la misma industria farmacéutica, como el proyecto ALEXANDER y las redes SENTRY y MYSTIC. Estos esfuerzos sumados a los muy activos ac- tualmente de la European Antimicrobial Resistance Surveillance System y de los CDC de los Estados Unidos, prometen esperanzadores avances para la contención o al menos la disminución notable del fenómeno (24-26).
A toda esa importante labor de los equipos científicos empeñados en la búsqueda de solucio- nes, caben elementales pero definitivos esfuerzos de la comunidad y los organismos locales con los cuales pueden hacerse notables aportes en esta cruzada para beneficio de todos: Atender más al profesional experimentado que a la recomendación callejera o del empírico distribuidor de productos farmacéuticos. Promover la educación continuada sobre la materia en el personal de salud. En los hospitales conformar equipos multidisciplinarios competentes para el manejo de las infecciones. Así mismo velar por la calidad de los laboratorios de investigación y control.
Mientras tanto, los programas de biogenética, bioquímica, microbiología y bioingeniería en general, adelantan tareas muy serias y juiciosas con el estímulo de la Organización Mundial de la Salud y las grandes organizaciones internacionales que están enfrentadas a este fenómeno creciente de la resistencia bacteriana y a los problemas de salud pública representados en el desbordamiento de las infecciones con notable pérdida de vidas, aumento de las incapacidades laborales y costos crecientes para atención de la salud.
El 30 de abril de 2014, la Organización Mundial de la Salud afirmó que muchos de los avances médicos del siglo pasado podrían perderse a través de la propagación de la resistencia a los antimicrobianos. Algunas enfermedades infecciosas, curables ante- riormente, pueden resultar intratables y propagarse por todo el mundo. Esto ya no es una predicción futura, sino algo que ha comenzado a suceder.
El documento "La resistencia a los antimicro- bianos: informe mundial sobre la vigilancia de 2014" muestra que la resistencia a los antibióticos está en todas partes y tiene el potencial de afectar a cualquier persona, de cualquier edad, en cualquier país (27).
Los programas de vigilancia y control de los procesos infecciosos varían mucho de país a país, y en algunos hay brechas o simplemente los pro- gramas no existen. Para la prevención se necesitan medidas higiénicas como disponer del agua potable, controlar las infecciones en los centros de salud y vacunar ampliamente para reducir la necesidad de antibióticos. Es necesario que la industria desa- rrolle nuevos métodos diagnósticos, y sobre todo, nuevos antibióticos. Se debe detectar la farmaco- rresistencia y desarrollar programas específicos para cada país con el fin de evitarla o controlarla. Los antibióticos solo deben prescribirse en casos realmente necesarios y deben ser los adecuados para el tratamiento de la enfermedad. El informe también incluye información sobre la resistencia a los medicamentos para el tratamiento de otras infecciones como el VIH, la malaria, la tuberculosis y la gripe; además proporciona la imagen más com- pleta de la resistencia a los medicamentos hasta la fecha pues incorpora datos de 114 países (27).
A finales de 2013 y durante 2014, han apareci- do numerosas actualizaciones sobre el tema, cuya lista incluyo aquí para referencia de los lectores interesados (28-32).
REFERENCIAS
1. Jácome A. El Salvarsán y las Sulfas. En Historia de los Medicamentos, Ed. Acad. Nal. Med. (A. Jácome).
2003 pp.174-183
2. Sir Alexander Fleming Banquet Speech at Nobel Prize reception. 1945. http://www.nobelprize.org/nobel_pri- zes/medicine/laureates/1945/fleming-speech.html
3. Alpuche-Aranda CM, Romano-Mazzotti L. Resisten- cia bacteriana, epidemiología, impacto clínico. En: Malagón-Londoño G, Álvarez Moreno C. Infecciones Hospitalarias, tercera edición 2010; Editorial Medica Panamericana, Buenos Aires, Bogotá.
4. Berger-Bachi B. Resistance mechanisms of Gram positive bacteria. Int J Med Microbiol, 2012; 292:27-35.
5. Powers JH. Antimicrobial drug development—the past, the present and the future. Clin Microbiol Infect.
2004; 10 (suppl 4): 23-31.
6. Nikaido H. Multidrug efflux pumps of Gram negative
bacteria. J Bacteriol 1996; 178:5853-9.
7. Appelbaum PC. MRSA- The tip of the iceberg. Clin
Microbiol Infect.2006; 12(suppl.2); 3-10.
8. Gould IM. The epidemiology of antibiotic resistance.
Int J Antimicrob Agents. 2008; 32 (Suppl.1); S2-9.
9. Stefani S, Agodi A. Molecular epidemiology of the antibiotics resistance. Int J Antimicrobial Agents.2000;
13: 143.53
10. Tenover FC. Mechanisms of antimicrobial resistance in bacteria. Am J Infect Control; 2006; 34:S310
11. Donlan RM, Costerton JW. Biofilms: Survival Me- chanisms of Clinically Relevant Microorganisms. Clin Microbiol Rev. 2002; 15(2): 167–193.
12. Gander S. Bacterial biofilms: resistance to antimicro- bial agents. Antimicrobial chemother.1996; 37:1047-50
13. Davies D. Understanding biofilm resistance to anti- bacterial agents. Nat Rev Drug Discov.2003; 2:114-22
14. Hall-Stoodley L, Hu F, Gieseke A et al. Direct Detecion of Bacterial Biofilms on the Middle-Ear Mucosa of Children with Chronic Otitis Media. JAMA 2006;
296:202-211
16. McCaskill ML, Mason EO, Kaplan SL, Hammerman W, Lamberth LB, Hulten KG. Increase of the USA 300-clone among community acquired methicillin- susceptible staphylococcus aureus causing invasive infections. Pediat Infect Dis J. 2007; 26:1122-25
17. O`Connor JR, Johnson S, Gerding DN. Clostridium difficile infection caused by the epidemic BI/NAP 1/ O27 strain. Gastroenterology 2009; 136:1913-24
18. Yano H, Kuga A, Okamoto R, Kitasato H, Kobayashi T, Inoue M. Plasmid- encoded metallo-beta-lactamase (IMP 6) confering resistance to carbapenems, espe- cially meropenem. Antimicrob. Agents Chemotherapy
2001; 45:1343-8
19. Courvalin P. Vancomycin resistance in Gram positive cocci. Clin Infect.Dis. 2006; 42 (Suppl.1) S25-34
20. Rice LB. Antimicrobial resistance in Gram positive bacteria. Am J Med.2006; 119; S11-9
21. Tsiodras S, Gold HS, Sakoulas G, et al. Linezolid resistance in a clinical isolate of Staphylococcus aureus. Lancet 2001; 358:207-8
22. Alpuche-Aranda CM, Mazzotti LR. Uso de métodos de epidemiología molecular en el estudio de infec- ciones hospitalarias y resistencia antimicrobiana. En: Malagón-Londoño, Alvarez Moreno; Infecciones Hospitalarias. Editorial Médica Panamericana, Bo- gotá, Buenos Aires.2010
23. CDC NNIS System. National Nosocomial Infections Surveillance (NNIS) system report, data summary from January 1992 to June 2003, issued August
2003. Am J Infect Control 2003; 31: 481-98
24. Buitrago-Gutiérrez G, Castillo JS, Cortés JA. Vigi- lancia de la resistencia bacteriana y del consumo de antibióticos. En: Malagón-Londoño, Álvarez-Moreno, Infecciones Hospitalarias. Editorial Médica Paname- ricana, Bogotá, Buenos Aires. 2010.
25. Scott DR. The direct medical costs of health-care- associated infections in US hospitals and the benefits of prevention. Atlanta: Centers for Disease Control; 2009.
26. Gould IM. The epidemiology of antibiotic resistance.
Int J Antimicrob Agents.2008; 32 (Suppl. 1):S2-9.
27. OMS. La resistencia a los antimicrobianos: informe mundial sobre la vigilancia de 2014. http://www.who. int/mediacentre/news/releases/2014/amr-report/en/
28. González L, Cortés JA. [Systematic review of anti- microbial resistance in Enterobacteriaceae isolates from Colombian hospitals]. Biomedica. 2014 Jun; 34(2):180-97.
29. Balsalobre LC, Dropa M, Matté MH. An overview of antimicrobial resistance and its public health signi- ficance. Braz J Microbiol. 2014 Apr 18; 45(1):1-5. eCollection 2014.
30. Baharoglu Z, Mazel D. SOS, the formidable strategy of bacteria against aggressions. FEMS Microbiol Rev. 2014 Jun 13.
31. John JF Jr, Steed LL. Antibiotic resistance: a clinical danger beyond 2013. JSC Med. Assoc. 2013 Jun;
109(2):54-8.
32. Woappi Y, Gabani P, Singh A, Singh OV. Antibiotrophs: The complexity of antibiotic-subsisting and antibiotic- resistant microorganisms. Crit. Rev. Microbiol. 2014
Feb 4. [Epub ahead of print]. Correspondencia: HY- PERLINK "mailto:publicaciones@anmdecolombia. org.co" publicaciones@anmdecolombia.org.co
Recibido: Enero 14, 2014
Aceptado: Junio 2, 2014
Correspondencia: Gustavo Malagón Londoño gustavo.m@etb.net.co